El implante de asistencias ventriculares izquierdas de larga duración es una terapia que se utiliza en pacientes con insuficiencia cardiaca terminal y refractaria a otros tratamientos médicos, quirúrgicos o de resincronización cardiaca. Las indicaciones más habituales son como puente al trasplante cardiaco o como terapia de destino.
Estos sistemas mantienen un flujo de sangre continuo que tiene varias ventajas respecto al pulsátil, pero también tiene alguna desventaja como es la mayor incidencia de insuficiencia aórtica después del implante.
Con la asistencia HeartMate 3 teóricamente habría menos insuficiencia aórtica porque mantiene cierta pulsatilidad.
Presentamos el caso de un paciente con este tipo de asistencia como terapia de destino que presentó un shock cardiogénico cinco meses después del implante y que se trató con éxito mediante la colocación de una válvula aórtica transcatéter (TAVI) que es una de las opciones terapéuticas para este tipo de complicación, aunque aún existen pocos casos descritos, sobre todo con asistencias de última generación.
Long-term left ventricular assist implantation is a therapy used in patients with end-stage heart failure and refractory to other medical, surgical, or cardiac resynchronization treatments. The most common indications are as a bridge to heart transplantation or as destination therapy.
These systems maintain a continuous blood flow that has several advantages over the pulsatile one, but also has some disadvantages, such as the higher incidence of aortic insufficiency after implantation.
With HeartMate 3 assistance, theoretically there would be less aortic insufficiency because it maintains a certain pulsatility.
We present the case of a patient with this type of assistance as destination therapy who presented cardiogenic shock five months after implantation and who was successfully treated with the placement of a transcatheter aortic valve (TAVI), which is one of the therapeutic options for this type of complication, although there are still few cases described, especially with state-of-the-art assistance.
Presentamos el caso de un paciente que meses después del implante de una asistencia ventricular intracorpórea desarrolló una insuficiencia aórtica aguda con shock cardiogénico que se trató con éxito colocando una válvula aórtica transcatéter.
La insuficiencia aórtica en pacientes con dispositivos de asistencia ventricular es relativamente frecuente, pero concretamente con el HeartMate III debería ser más raro, porque se conserva cierta pulsatilidad que es una de las medidas que previene la alteración valvular.
Aún hay poca experiencia en el uso de TAVI para tratar esta complicación, pero cada vez se describen más casos con éxito.
Caso clínicoPaciente de 73 años de edad diagnosticado de miocardiopatía dilatada, con FE de 20% y un consumo máximo de oxígeno de 14ml/kg/min, motivo por lo que era portador de una asistencia ventricular intracorpórea de larga duración tipo HeartMate 3 como terapia de destino.
Entre sus antecedentes personales destacaba la colocación 15 años antes de una prótesis mitral mecánica por endocarditis, un implante de desfibrilador automático implantable y marcapasos tricameral (DAI-TCR) por miocardiopatía dilatada, fibrilación auricular, carcinoma prostático a tratamiento hormonal, dislipemia y colelitiasis.
Cinco meses después del implante de la asistencia ingresó por deterioro del estado general, acompañada de disminución del nivel de conciencia y disnea.
Presentaba semiología de fallo de ventrículo derecho y en la ecografía se observó dilatación de venas suprahepáticas. En la analítica destacaba aumento de lactatos (3,5 mmol/l) y un NT-pro BNP de 34000 pg/ml.
Se monitorizó con un catéter de arteria pulmonar que permitió objetivar aumento de presión venosa central (24mmHg) e hipertensión pulmonar severa, unos valores de NT-pro BNP de 34000 y una presión venosa de oxígeno de 21mmHg, indicando todo un bajo gasto importante, a pesar de que los parámetros de la asistencia eran correctos (gasto cardiaco de 5 l/min con 5300rpm, IP 2,9 energía 4). Se inició tratamiento con dobutamina a dosis crecientes hasta 10 mcg/kg/min y se realizó una ecografía transtorácica donde se objetivó un ventrículo izquierdo severamente dilatado con adelgazamiento global de paredes, una FE < 15%, la prótesis mitral mecánica era normofuncionante y lo más llamativo era una insuficiencia aórtica severa, con velos discretamente engrosados, sin verrugas y escaso movimiento de apertura. También se constató un ventrículo derecho dilatado e insuficiencia tricuspídea severa.
Con este diagnóstico se decidió la implantación urgente de una TAVI (Corevalve EVOLUT 34R®) a través de una arteria femoral.
El procedimiento se realizó con anestesia general, y se mantuvo la perfusión de inotropos. En el momento de desplegar la TAVI se redujo la velocidad de la asistencia a 4500rpm para disminuir la succión en el ventrículo derecho. El intercambio gaseoso fue normal.
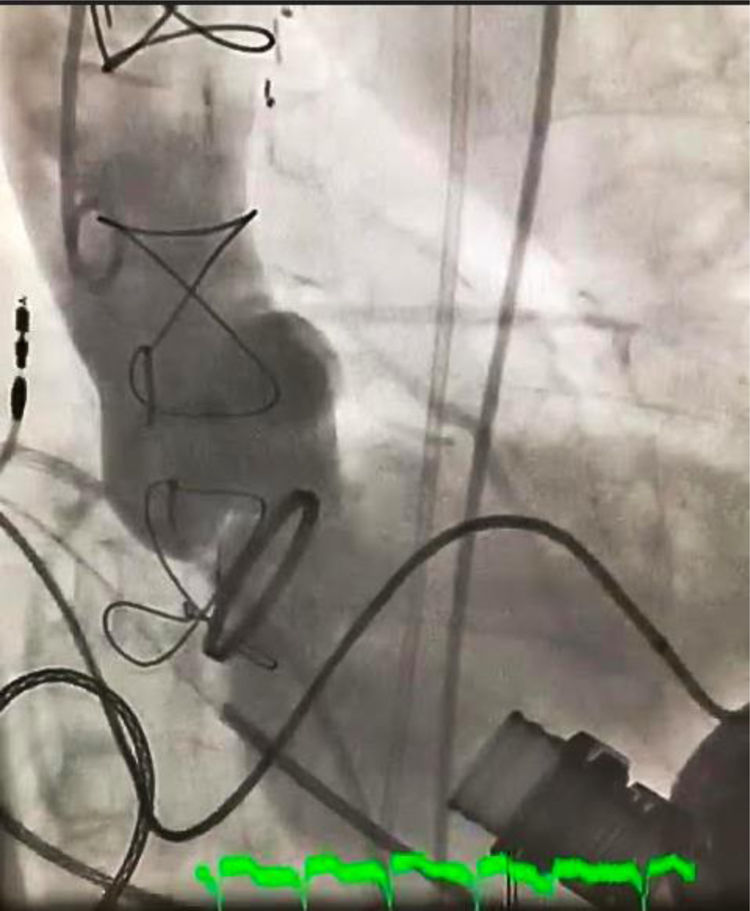
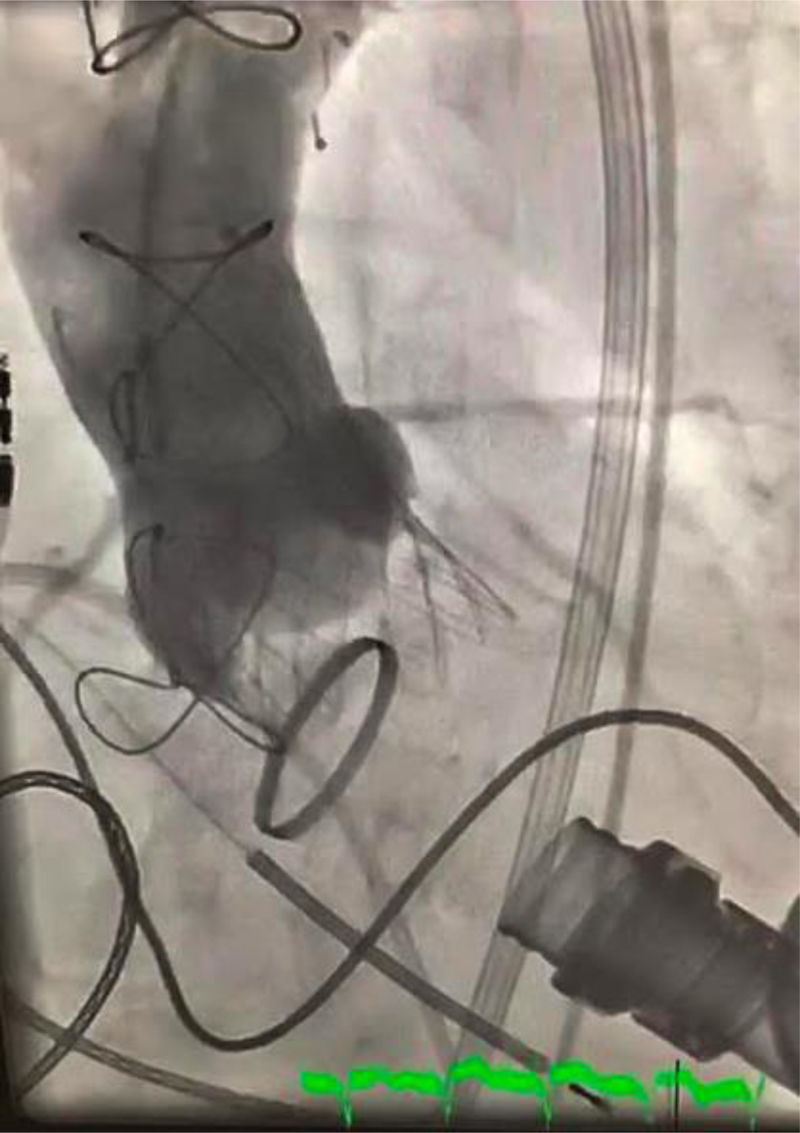
El implante fue un éxito, pasando de una IA severa (fig. 1) a una insuficiencia aórtica mínima (fig. 2) por aortografía y sin gradiente transvalvular.
El paciente fue trasladado a la Unidad de Cuidados Intensivos Cardiológicos intubado, aunque 4 h después y tras comprobar una clara mejoría de los parámetros hemodinámicos y con una gasometría normal se extuba sin incidencias.
La evolución posterior fue muy buena, pudiendo retirarse los inotropos a las 24 h y fue dado alta a la planta de hospitalización 3 días después y a su domicilio 9 días tras el implante de la TAVI.
Cuatro meses después se realizó una ecografía transtorácica donde no se pudo valorar bien la TAVI por interferencias con la asistencia y la insuficiencia tricuspídea era leve-moderada. Se realizó un cateterismo derecho donde no se objetivó hipertensión pulmonar.
Un año tras el implante de la TAVI, el paciente se encuentra bien con un grado funcional II/IV sin ortopnea ni disnea y a tratamiento con furosemida, acenocumarol, omeprazol, eplerenona y nebivolol/hidroclorotiazida.
DiscusiónLos dispositivos actuales de asistencia ventricular izquierda (DAVI) de larga duración son de flujo continuo ya que además de ser más simples y de menor tamaño han demostrado tener menos complicaciones y más durabilidad que los de flujo pulsátil.
Sin embargo, existen dos complicaciones relacionadas precisamente con la existencia de flujo continuo durante tiempo que son las angiodisplasias y el desarrollo de una insuficiencia aórtica (IA) de novo o empeoramiento de una previa.
La insuficiencia aórtica es la valvulopatía de mayor impacto en los pacientes portadores de DAVI y por eso debe ser evaluada cuidadosamente en el periodo preoperatorio y tras el implante del dispositivo.
Afecta entre el 25 y el 52% de pacientes durante el primer año1 ocurre con más frecuencia en aquellos pacientes en los que la válvula aórtica (VA) permanece cerrada, que en los que se abre.
Las causas de desarrollo de IA en estos casos son múltiples. En primer lugar, influyen las altas presiones que soporta la VA debidas al flujo de entrada desde la bomba en la aorta ascendente. Además, estas presiones producen fuerzas de cizallamiento en la raíz de aorta que favorecen la dilatación de la misma. Así, tras la implantación del Jarvik 2000 se objetivó una disminución del espesor aórtico, del contenido de elastina y del número de células musculares lisas que producía una dilatación aórtica y alteraba la coaptación de las valvas de la VA2.
Por otra parte, la frecuencia de apertura de la VA es menor y favorece el depósito de colágeno y la fusión de las valvas3.
Todos estos motivos explican la mayor incidencia de IA en los pacientes portadores de DAVI de larga duración.
La presencia de una IA significativa contribuye al establecimiento de un shunt entre la aorta y el VI que reduce el flujo anterógrado efectivo, distiende el VI, aumenta la sobrecarga de la asistencia y la poscarga del ventrículo derecho que puede conducir a un fallo del mismo y en definitiva a un shock cardiogénico.
Para prevenir o retrasar el desarrollo de una IA se recomienda un ajuste «a la baja» del flujo proporcionado por la asistencia, seleccionando una velocidad que produzca descarga del VI y a su vez permita una eyección ventricular (habitualmente cada 3 latidos) para intentar que la VA se abra el mayor número de veces posible.
El HeartMate 3TM (Abbott) es un DAVI intracorpóreo que proporciona un flujo continuo centrífugo mediante un rotor magnéticamente levitado, sin rozamientos mecánicos y un modo de pulso artificial que es una característica de la programación que permite realizar aceleraciones y desaceleraciones rítmicas del rotor cada 2 segundos de unas 2000 revoluciones4, produciendo cierta pulsatilidad lo que además de reducir el estasis de sangre y el estrés de rozamiento, también podría disminuir la incidencia de IA.
La presencia y severidad de una IA debe valorarse preoperatoriamente.
En el año 2013 la International Society of Heart Lung Transplantation recomendó la corrección de cualquier IA que fuese al menos moderada5, ya que tienen muchas posibilidades de progresar a severa.
Si la IA no es severa puede intentarse inicialmente un tratamiento médico consistente en evitar la hipertensión arterial para reducir el gradiente entre la aorta y el VI6 y en cambiar la velocidad de la bomba dependiendo de los síntomas predominantes. Si son de fallo cardiaco habría que reducir la velocidad de la bomba, en cambio si predominan síntomas de bajo gasto deberían aumentarse las revoluciones.
De todas formas, este manejo es temporal y sobre todo en IA severas o con un grado angiográfico > 2 habrá que actuar instrumentalmente sobre la VA.
Las formas de corrección quirúrgicas pueden ser la colocación de una prótesis biológica o unos puntos de coaptación de la VA que incluso algunos cirujanos recomiendan realizarlo durante el implante del DAVI7 aunque su eficacia no ha sido probada; así mismo puede realizarse un cierre completo de la VA mediante cirugía o percutáneo con dispositivos tipo Amplatzer, si bien el cierre completo de la VA deja al paciente totalmente dependiente de la asistencia.
Otro tratamiento que puede realizarse de forma percutánea sería el implante de una TAVI, que es una indicación off-label, pero cada vez se describen más casos con éxito.
La colocación de una TAVI es estos pacientes es más complejo, porque habitualmente no hay calcificaciones significativas en el anillo aórtico, dificultando el anclaje de la prótesis, y favoreciendo la migración de la misma tanto distalmente hacia la aorta, como proximalmente hacia el VI favorecido por la succión producida por la bomba del DAVI y en el caso de TAVI de nitinol por la dilatación del mismo. Por estas razones, con frecuencia se usan tamaños sobredimensionados (alrededor de un 15-20%), y sistemas autoexpandibles para favorecer la fijación y reducir la posibilidad de migración ventricular8.
En estos casos, durante el implante de la TAVI el uso de sobreestimulación con marcapasos es mucho menos efectivo, porque el VI contribuye muy poco al gasto cardiaco y el gradiente de presión transvalvular suele ser pequeño; lo que sí puede ser eficaz es la reducción de la velocidad de la bomba para disminuir el flujo de entrada y la presión de succión en el VI9.
Existen publicadas series de casos10 en los que se usó esta técnica con éxito, demostrando, al igual que en el paciente que describimos, la posibilidad real de tratar con el implante de una TAVI la IA de VA no calcificadas en pacientes con DAVI.
Consideraciones éticasLos autores declaran que se obtuvo el consentimiento informado del paciente, que la investigación fue aprobada por el comité de ética del Hospital Universitario Central de Asturias y que cumplieron con los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.