La endocarditis infecciosa sobre válvulas implantadas por vía transcatéter (TAVI) constituye un importante desafío clínico y quirúrgico debido principalmente a su complejidad diagnóstica, elevada morbimortalidad asociada y dificultad terapéutica. Presenta particularidades propias relacionadas con el diseño de la misma, el procedimiento de implante y las características clínicas de los pacientes candidatos a TAVI.
Aunque el tratamiento antibiótico puede ser eficaz, un número significativo de casos requiere de intervención quirúrgica. El explante de una prótesis transcatéter representa un procedimiento técnicamente complejo que exige una planificación quirúrgica meticulosa para reducir el riesgo de complicaciones intraoperatorias.
Dado el incremento en la incidencia de endocarditis sobre TAVI, consecuencia directa de la expansión en su indicación, resulta imprescindible establecer protocolos diagnósticos y terapéuticos claros que permitan una detección precoz y un manejo individualizado. En este contexto, el enfoque multidisciplinar mediante el «Endocarditis team», conformado por cardiólogos, cirujanos cardiacos y especialistas en enfermedades infecciosas, resulta fundamental para optimizar los resultados y mejorar el pronóstico de estos pacientes.
Infective endocarditis involving transcatheter aortic valve implantation (TAVI) prostheses represents a significant clinical and surgical challenge, primarily due to its diagnostic complexity, high associated morbidity and mortality, and therapeutic difficulty. This condition exhibits specific features related to the design, the implantation procedure technique, and the clinical characteristics of patients undergoing TAVI.
Although antibiotic therapy may be effective, a substantial proportion of cases require surgical intervention. The explantation of a transcatheter prosthesis is a technically demanding procedure that necessitates meticulous surgical planning to minimize the risk of intraoperative complications.
Given the increasing incidence of TAVI-associated endocarditis, directly linked to the expanding indications for TAVI, it is essential to establish clear diagnostic and therapeutic protocols that enable early detection and individualized management. In this context, a multidisciplinary approach through an “Endocarditis Team”, comprising cardiologists, cardiac surgeons, and infectious disease specialists, is crucial to optimizing outcomes and improving the prognosis of these patients.
La estenosis aórtica constituye la principal enfermedad valvular que requiere tratamiento quirúrgico en la Unión Europea y Norteamérica1. La indicación de intervención se basa tanto en la severidad de la enfermedad como de la aparición de sintomatología asociada. En este contexto, el implante transcatéter de la válvula aórtica (TAVI) ha emergido como alterativa menos invasiva a la sustitución valvular aórtica quirúrgica (SVAo). Inicialmente dirigida a pacientes de alto riesgo quirúrgico, en la última década su uso se ha extendiendo de forma exponencial, abarcando a pacientes más jóvenes y con riesgo quirúrgico intermedio o bajo1,2.
Incidencia de la endocarditis sobre TAVILa endocarditis infecciosa (EI) es una enfermedad clínico-quirúrgica compleja, que representa un desafío para la práctica clínica. Esto es debido a su presentación heterogénea, su dificultad diagnóstica y su elevada morbimortalidad, que requiere la necesidad de un abordaje terapéutico multidisciplinar3-5. La incidencia de EI protésica sobre TAVI se sitúa en torno al 1,3-2,7% durante el seguimiento, aunque algunos estudios han reportado incidencias más altas en torno al 5-8% en un seguimiento de 5 años6-9.
Podría esperarse que una técnica mínimamente invasiva como la TAVI se asociara a una menor tasa de complicaciones infecciosas en comparación con la SVAo. Sin embargo, estudios comparativos de EI sobre TAVI y SVAo convencional no han evidenciado diferencias significativas, aunque el aumento del uso de TAVI ha incrementado su prevalencia10,11. El riesgo de infección es particularmente elevado durante el primer año postimplante y con frecuencia se ha asociado a procedimientos invasivos que predisponen al desarrollo de bacteriemia tales como intervenciones ondotológicas o urológicas tras el implante6,10.
Dificultades en el diagnósticoEl diagnóstico definitivo de EI sobre TAVI se basa en los criterios de Duke modificados, aunque estos presentan limitaciones específicas en el contexto de la EIP3. Clínicamente, los pacientes con EIP sobre TAVI suelen presentar manifestaciones similares a los casos de endocarditis protésica quirúrgica como son fiebre, insuficiencia cardíaca aguda y eventos neurológicos. No obstante, debido a las particularidades de la EI sobre TAVI puede suponer un reto diagnóstico, dada la menor experiencia en este contexto, la edad avanzada de los pacientes con una manifestación más insidiosa de los signos y síntomas, y las dificultades en la interpretación de los hallazgos en las técnicas de imagen. Las técnicas complementarias como la PET-tomografía computarizada (TC), SPECT-TC y la TC sincronizado se han consolidado como herramientas útiles para mejorar la sensibilidad diagnóstica en casos de sospecha de EIP sobre TAVI. Las Guías ESC 2023 recomiendan su uso en pacientes con alta sospecha clínica y hallazgos inconcluyentes en la ecocardiografía, especialmente en presencia de dispositivos intracardíacos o prótesis transcatéter donde la imagen ecocardiográfica puede ser limitada3.
El diagnóstico precoz de esta enfermedad es fundamental para prevenir la progresión local de la infección y preservar la integridad de las estructuras cardíacas adyacentes.
Particularidades clínicas y anatómicasExisten diferentes factores que podrían contribuir al desarrollo de EIP post-TAVI entre los que destacan las particularidades propias relacionadas con el diseño, la técnica de implante, la preservación de los velos nativos de la válvula, el implante fuera de un quirófano que puede comprometer la esterilidad durante el procedimiento y las características clínicas de los pacientes candidatos a TAVI.
Desde un punto de vista anatómico el diseño de las prótesis transcatéter, con el marco del stent y una gran cantidad de struts de metal alrededor de la válvula, podría condicionar la formación de abscesos a nivel anular o en la porción de la aorta ascendente en contacto con el stent12.
La permanencia de los velos nativos, el proceso y manipulación de la prótesis durante el crimpado y la dilatación con balón del anillo pueden favorecer una mayor respuesta inflamatoria y la formación de microtraumatismos a nivel local que predisponen a la formación precoz de pannus, así como al desarrollo de infecciones más extensas con afectación subvalvular y que pueden comprometer otras estructuras como el anillo, la raíz aórtica, los ostia coronarios, la válvula mitral y la unión mitroaórtica.
Los pacientes tratados con TAVI presentan un perfil diferente al de la SVAo y la mayoría presentan más comorbilidades y fragilidad. Así mismo, la necesidad más frecuente de implante de marcapasoss permanente tras la TAVI podría facilitar infecciones asociadas a dispositivos, aumentando el riesgo de bacteriemias de origen nosocomial12. El Staphylococcus aureus es el microorganismo causal más prevalente13.
La experiencia en cirugía cardíaca tras el implante de una prótesis transcatéter sigue siendo limitada, lo que representa un desafío significativo en la toma de decisiones clínicas e indicación quirúrgica en estos pacientes. A medida que el uso de TAVI se extiende a pacientes más jóvenes y con menor riesgo quirúrgico, aumenta la probabilidad de requerir una reintervención. En este escenario, la participación de equipos multidisciplinarios especializados (Endocarditis team) ha sido incorporada en las guías de manejo como una estrategia clave para optimizar los resultados y debe considerarse sistemáticamente en la evaluación de estos casos debido al perfil clínico de estos pacientes, la forma de presentación, la dificultad diagnóstica y la propia técnica quirúrgica3. La integración sistemática de cardiólogos clínicos y expertos en imagen, cirujanos cardiacos, especialistas en enfermedad infecciosas, radiólogos e intensivistas permite una evaluación más precisa y oportuna, lo que se traduce en decisiones terapéuticas más ajustadas y pronósticos significativamente mejores. En pacientes con sospecha de EI post-TAVI, este enfoque colaborativo es clave para acortar el tiempo hasta el diagnóstico, y promover decisiones terapéuticas consensuadas y personalizadas14.
Indicación quirúrgicaLas guías de práctica clínica actuales, recomiendan una intervención quirúrgica precoz en pacientes con EIP que presentan insuficiencia cardíaca aguda, vegetaciones de gran tamaño, complicaciones locales como abscesos o fístulas, bloqueos auriculoventriculares o infecciones causadas por microorganismos altamente resistentes, como el Staphylococcus aureus1,11. No obstante, en el contexto específico de la EIP tras el implante de TAVI, hasta el 90% de los pacientes se manejaron de forma conservadora, incluso cuando cumplían criterios quirúrgicos establecidos, según algunas series publicadas5,6. Sin embargo, diversos estudios han demostrado que, en pacientes seleccionados valorando el riesgo – beneficio de manera individualizada, el tratamiento quirúrgico presenta un mejor pronóstico, incluso en aquellos con elevada complejidad clínica y técnica6. Consideraciones especiales, como la necesidad de intervenciones concomitantes sobres la raíz aórtica, válvula mitral, aorta ascendente o arterias coronarias deben contemplarse y abordarse durante la planificación preoperatoria.
Técnica quirúrgicaLa planificación preoperatoria basada en estudios de imagen multimodal es esencial para determinar la estrategia quirúrgica óptima: acceso, localización de la aortotomía, tipo de canulación y técnica de explante e implante valvular subsecuente. La TC es fundamental, y debe incluir entre otros parámetros la longitud de la aorta ascendente y la longitud del marco del stent de la TAVI13.
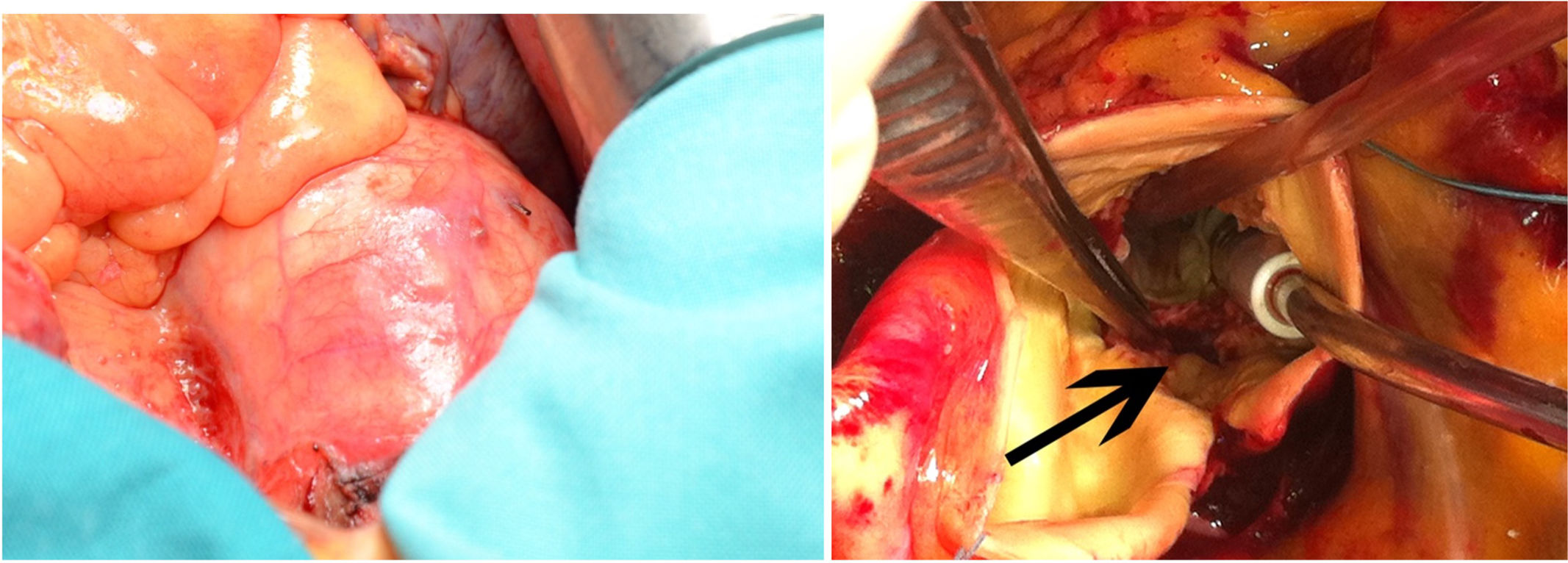
Una de las principales dificultades técnicas radica en la adherencia y epitelización progresiva del stent de la prótesis en la pared aórtica. Esta situación puede derivar en la necesidad de procedimientos complejos como la sustitución de raíz aórtica con reimplantación de coronarias (cirugía de Bentall), reemplazo de la aorta ascendente, reparación del tabique interventricular o reconstrucción de la unión mitroaórtica15. Además, los abscesos perianulares, afectación de la válvula mitral, disrupción de la unión mitroaórtica o la formación de fístulas y pseudoaneurismas están presentes en hasta un tercio de los casos de EIP post-TAVI (fig. 1A)16.
Los procedimientos concomitantes durante la intervención aumentan de forma exponencial la complejidad quirúrgica y tienen un impacto directo en los resultados postoperatorios. Se ha demostrado que estos procedimientos se asocian con una mayor mortalidad perioperatoria, una mayor incidencia de insuficiencia renal, accidente cerebrovascular y prolongan la estancia hospitalaria postoperatoria en comparación con el recambio valvular aórtico tras una SVAo convencional17,18.
El abordaje habitual es la esternotomía media, aunque en casos seleccionados puede optarse por técnicas mínimamente invasivas según las características anatómicas y quirúrgicas del paciente y la preferencia del cirujano19. Tras el establecimiento de la circulación extracorpórea, se recomienda realizar una palpación manual del stent para determinar la altura óptima de la aortotomía. Generalmente, esta se efectúa justo por encima del marco superior de la prótesis para facilitar la exposición del dispositivo y puede realizarse en orientación oblicua o transversa según la preferencia quirúrgica13.
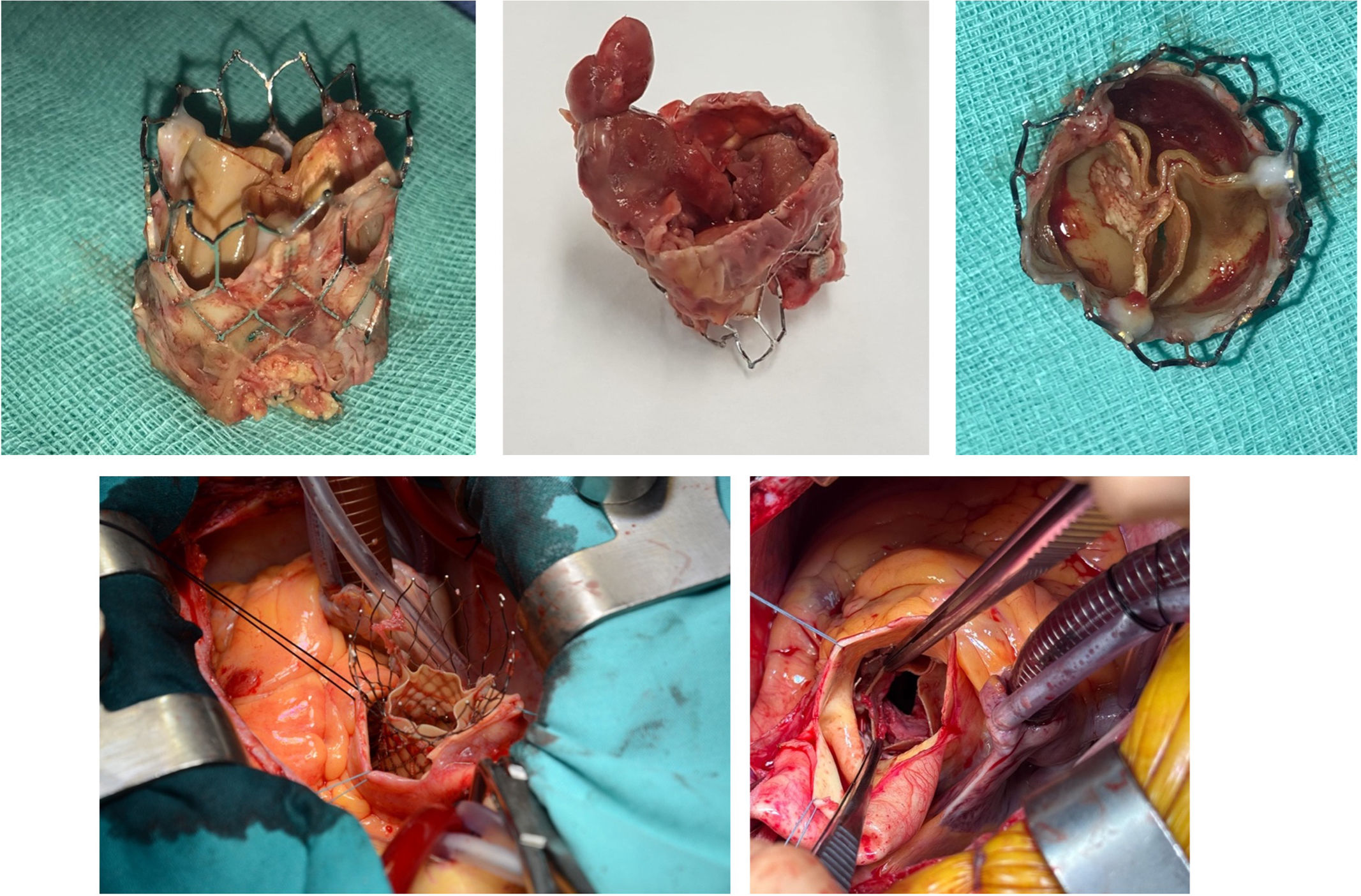
Para el explante pueden emplearse distintas técnicas que variarán en función del tipo de prótesis y las condiciones anatómicas del paciente. Se puede emplear una disección roma progresiva con una espátula combinada con tracción controlada mediante pinzas de Kocher20. Tras separar el marco del stent de la pared aórtica hasta al menos la mitad de su altura, puede sujetarse perpendicularmente con 2pinzas de Kocher largas para movilizar los bordes y deformar la protesis para su extracción. Este método permite aplastar parcialmente el marco del stent, facilitando su liberación mediante una fuerza radial controlada. Otra posibilidad, es enrollar el marco del stent hacia el centro, lo que reduce el diámetro de la prótesis y limita el daño a la pared aórtica. La técnica del torniquete está descrita principalmente para prótesis autoexpandibles. Con la ayuda de 2ligaduras introducidas a través de las celdas superiores del stent, se introduce un torniquete que recaptura parcialmente la prótesis, creando un perfil más pequeño de la misma lo que facilita su extracción. También se ha descrito la posibilidad de dividir transversalmente la prótesis con una tijera hasta la mitad para retirar la parte superior del stent y posteriormente se corta longitudinalmente y se pliegan los bordes. Una desventaja de esta técnica es que al cortar el marco superior se crean numerosos bordes afilados que pueden desgarrar estructuras adyacentes13,21. Las adherencias de la prótesis a la pared aórtica incrementan el riesgo de desgarros del endotelio durante la disección, especialmente a nivel de la unión sinotubular y del anillo aórtico, donde las adherencias son más firmes20. La presencia de neoendotelización avanzada agrava la dificultad del explante tardío, requiriendo disecciones más meticulosas.
Las prótesis balón-expandibles, suelen tener un perfil del stent más bajo y por tanto un menor riesgo de lesión en la aorta ascendente, pero un mayor riesgo de afectación del anillo, de alteraciones de la conducción y de afectación de la válvula mitral. Por otro lado, las prótesis autoexpandibles requieren de una aortotomía más alta, y durante el explante hay un mayor riesgo de lesión en la aorta ascendente22. La tabla 1 resume las principales diferencias.
Tipos de prótesis TAVI
| Tipo de prótesis | Técnica quirúrgica más empleada | Riesgos / complicaciones |
|---|---|---|
| Balón-expandible | Disección roma o pinzas de Kocher.Aortotomía más baja, menor perfil de stent | Mayor riesgo de daño del anillo y del sistema de conducción |
| Autoexpandible | Técnica de torniquete o enrollado. Disección roma o pinzas de KocherAortotomía más alta | Mayor riesgo de lesión en aorta ascendente |
Tras el explante, es esencial inspeccionar la raíz aórtica y las estructuras adyacentes, y desbridar todo el tejido infectado (fig. 1B). Posteriormente, es fundamental realizar una cuidadosa extracción de los velos residuales y una meticulosa decalcificación del anillo (fig. 2). A diferencia de las válvulas quirúrgicas convencionales, donde el plano de disección entre el anillo protésico y el tejido nativo suele estar bien definido, en el caso de la TAVI los velos nativos pueden estar profundamente adheridos al anillo o incluso a la estructura de la prótesis misma, dificultando la correcta identificación del plano anatómico. Esta situación puede incrementar el riesgo de perforación o desgarro del anillo durante la preparación del lecho para el nuevo implante valvular22. En pacientes con anillo aórtico pequeño o destrucción de los tejidos en esa zona, puede ser necesario la reconstrucción del anillo o la ampliación del mismo utilizando parche de pericardio. Dependiendo de la lesión en la pared aórtica, el reemplazo de la aorta ascendente puede incluso requerir de parada circulatoria con hipotermia profunda23.
Con respecto al tipo de prótesis, en la mayoría de los pacientes puede realizarse el implante de prótesis aórticas convencionales ya sean mecánicas o biológicas. En ciertos escenarios, como la presencia de una raíz aórtica pequeña o severamente calcificada, el uso de prótesis sin sutura son una alternativa útil. Estas prótesis reducen significativamente la manipulación del tejido aórtico y eliminan la necesidad de puntos de sutura en el anillo, minimizando así el riesgo de desgarros tisulares y facilitando la implantación en un entorno ya comprometido por la infección. Además, considerando que la cirugía de reintervención sobre TAVI es de alto riesgo, la reducción del tiempo de pinzamiento aórtico y de circulación extracorpórea es un objetivo prioritario en estos pacientes. Estudios recientes han confirmado que el uso de prótesis sin sutura en el contexto de la EI no se asocia con un mayor riesgo de migración de la válvula, fugas paravalvulares, bloqueos auriculoventriculares ni con una mayor necesidad de implante de marcapasoss, lo que refuerza su seguridad y eficacia en estos escenarios complejos24,25.
Aunque los homoinjertos pueden ser una alternativa en ciertos pacientes, la experiencia en este campo es limitada26,27.
ResultadosUn metaanálisis publicado por Tinica et al. que incluye 61 estudios diferentes evaluó la epidemiología, factores de riesgo y opciones terapéuticas en pacientes con EIP post-TAVI, encontrando una mortalidad significativamente menor en aquellos tratados con cirugía más antibioticoterapia (16,7%) en comparación con los que recibieron únicamente antibioticoterapia (37,4%) (p<0,05). Además, en el análisis multivariable, el tratamiento quirúrgico y el uso de prótesis autoexpandibles se asociaron con una menor mortalidad, con un OR de 0,15 (IC del 95%: 0,04-0,62; p <0,05) y un OR de 0,36 (IC 95%: 0,16-0,98; P <0,05), respectivamente28.
En una cohorte unicéntrica de 67 pacientes con EI post-TAVI, el 35,8% de los pacientes fueron tratados quirúrgicamente, frente al 64,2% que recibieron tratamiento médico conservador. Las tasas de mortalidad a 30 días y al año para los 3grupos de estudio (quirúrgico, médico sin indicación quirúrgica y médico con indicación quirúrgica) fueron del 0, el 4,2 y el 31,6% (p=0,002), y del 4,2, el 20,8 y el 73,7% (p <0,001), respectivamente13. En el grupo quirúrgico, el 58,3% fueron prótesis balón-expandible frente al 32.6% de prótesis balón-expandible en el grupo de tratamiento médico aislado.
El grupo de Saha et al. analizó a 41 pacientes tratados mediante cirugía cardíaca tras TAVI por diversas indicaciones en su centro entre 2012 y 2020, entre las cuales en 15 pacientes se trataba de una endocarditis protésica sobre TAVI. Todas las prótesis TAVI fueron explantadas sin complicaciones técnicas durante el procedimiento, lo que confirma que la cirugía cardiaca en este contexto es factible y segura en determinados grupos de pacientes. A pesar de que las prótesis fueron explantadas sin complicaciones técnicas, la mortalidad operatoria alcanzó el 10,3%, con una supervivencia global de la cohorte al año del 83%. En este caso no se aporta información sobre el tipo de prótesis transcatéter explantada29.
Pompeu et al. publicaron una revisión sistemática sobre el estado actual del explante de TAVI incluyendo 28 diferentes estudios. La incidencia de explante de TAVI por cualquier causa fue del 0,2 al 2,8% con una media de tiempo desde el implante de 17 a 674 días. Con respecto a la técnica quirúrgica, los procedimientos asociados que se realizaron fueron: sustitución de aorta ascendente (3,2-33,3%), reparación o sustitución valvular mitral (11,8-43,5%) y cirugía valvular tricúspide (2,8-25,0%). La mortalidad a los 30 días fue del 4,8 al 50%, con una tasa de mortalidad en la mayoría de los estudios mayor al 10%. Con respecto a la indicación de explante, la presencia de endocarditis variaba del 5,9 al 100% en los diferentes estudios. No se aporta información sobre el tipo de prótesis transcatéter explantada30.
Fukuhara et al. en un análisis retrospectivo de la base de datos de la Sociedad de Cirujanos Torácicos (STS) de Estados Unidos, identificaron a un total de 483 pacientes con TAVI explantada documentada (68% de pacientes con prótesis balón expandible y 32% de pacientes con prótesis transcatéter autoexpandibles). En el 17,7% la causa del explante fue EI. Durante el explante, el 63% de los pacientes requirieron procedimientos concomitantes incluyendo la reparación aórtica (27%), procedimientos mitrales (22%), cirugía coronaria (15%) y procedimientos tricúspides (7%). En este caso, la mortalidad a los 30 días fue del 18%31.
En el registro multicéntrico mundial EXPLANT-TAVR se reportaron un total de 372 explante de TAVI. En el 10% la causa fue por EI. La mortalidad a los 30 días fue del 15-17% y del 32-34% al año, similar a las causas no infecciosas. Se observó una mayor incidencia de complicaciones graves tras el explante por endocarditis como ictus (8,6% vs. 2,9%) o de necesidad de marcapasoss32.
A nivel nacional, la literatura publicada al respecto es limitada. Un estudio retrospectivo Español analizó 11 endocarditis post-TAVI entre 2009-2017 (incidencia 5,5%, 2,77 casos/año-paciente). La mediana de días desde el implante de TAVI hasta el diagnóstico de EI fue de 112 días (IQR 36 – 578). La mortalidad fue del 36% intrahospitalaria y del 54,5% a un año33.
Otro estudio multicéntrico Español del registro GAMES (Grupo de Apoyo al Manejo de la Endocarditis) que incluyó datos de 26 hospitales diferentes identificó 739 casos de EI, de los cuáles el 1,3% correspondían a EI post-TAVI. Estos 10 casos de endocarditis post-TAVI representaron el 1,1% del total de las TAVI implantadas. Todas se implantaron por vía femoral. Nueve pacientes tenían implantada una prótesis autoexpandible y un paciente una prótesis balón-expandible. Tras una evaluación multidisciplinaria, se indicó cirugía en 5pacientes, aunque finalmente solo se realizó en un paciente debido a dificultades técnicas o presencia de comorbilidades grave. El paciente sometido a intervención reingresó 117 días después del implante de TAVI debido al empeoramiento de la insuficiencia cardíaca, y se le diagnosticó EI durante el ingreso. El paciente se sometió con éxito a una cirugía reparadora de la raíz aórtica, pero ingresó 8días después del alta debido a un bloqueo auriculoventricular de alto grado sintomático e insuficiencia cardíaca refractaria. Finalmente, el paciente falleció 11 días después. La mortalidad de los pacientes diagnosticados de EI durante el seguimiento fue del 50%34.
ConclusionesLa EIP post-TAVI es una complicación grave con alta morbi-mortalidad, cuya incidencia sigue en aumento debido a la expansión del uso de esta técnica. Aunque las guías actuales recomiendan la cirugía en casos seleccionados, en la práctica clínica sigue predominando un manejo conservador basado exclusivamente en antibioticoterapia, pese a sus pobres resultados. La evidencia disponible indica que la cirugía, combinada con antibioticoterapia prolongada, es la estrategia terapéutica que ofrece la mayor supervivencia y mejor pronóstico, con una reducción significativa de la mortalidad en comparación con el tratamiento conservador en pacientes seleccionados tras evaluar minuciosamente el riesgo/beneficio de manera individual.
El explante de prótesis TAVI puede llevarse a cabo de manera segura, tendiendo en cuenta las posibles dificultades técnicas durante el procedimiento, lo que refuerza la viabilidad del enfoque quirúrgico en pacientes con indicación clara de intervención. En este contexto, el diagnóstico precoz y la actuación rápida son determinantes para mejorar el pronóstico. La implicación precoz y estructurada del equipo multidisciplinar especializado en endocarditis (Endocarditis team) resulta fundamental para identificar de manera oportuna a los candidatos a cirugía, valorar el riesgo y beneficio de manera individualizada y evitar retrasos injustificados en el tratamiento. Tanto la demora en el diagnóstico como en la toma de decisiones pueden impactar negativamente en la evolución del paciente.
A medida que la TAVI se indica en perfiles con menor riesgo quirúrgico, la opción quirúrgica debe mantenerse como pilar fundamental en el manejo de la EIP, y no considerarse una alternativa excepcional. Solo mediante una estrategia bien coordinada, centrada en la intervención temprana y el trabajo colaborativo de un equipo multidisciplinar, será posible mejorar los resultados clínicos y reducir la mortalidad en esta población en constante crecimiento.
Consideraciones éticasDada la naturaleza de este trabajo, el consentimiento informado de los pacientes no fue requerido.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno que declarar.