Es controversial el uso de ultrafiltración modificada en cirugía cardíaca pediátrica con bomba de circulación extracorpórea (CEC) para disminuir la respuesta inflamatoria sistémica, hemoconcentrar y remover el exceso de líquido. El objetivo de este estudio es demostrar en el período intraoperatorio la utilidad de este método para la remoción de sustancias proinflamatorias desencadenadas por la bomba en pacientes pediátricos no neonatales operados por cardiopatías congénitas simples. Adicionalmente, se pretende averiguar su efecto sobre la hemoconcentración y la remoción del exceso de líquido y lactato.
MétodosSe diseñó un ensayo clínico en pacientes pediátricos no neonatales con peso > 5kg con cardiopatías congénitas simples que se operaron con el uso de bomba en el período de un año. En forma aleatoria, se conformó un grupo problema (con ultrafiltración modificada) y un grupo control (sin ella), y se tomaron muestras para medir concentraciones de interleucinas (IL) (6 y 10) y de fracciones 3d y 4d del complemento, en los siguientes tiempos: basal, antes de bomba, después de bomba, después de la ultrafiltración y del ultrafiltrado, y al salir de quirófano. Los efectos finales se definieron en términos de morbimortalidad, remoción de sustancias proinflamatorias, lactato, balance hídrico y hemoconcentración.
ResultadosSe enroló a 13 pacientes al grupo problema y 15 al grupo control. Observamos una menor concentración sérica de IL-6, IL-10 y lactato post-CEC en el grupo problema, al igual que una mayor remoción de líquido, lactato y de C4d en el ultrafiltrado.
ConclusionesLa ultrafiltración modificada puede beneficiar a los pacientes pediátricos no neonatales con cardiopatía congénita operados con bomba porque es capaz de disminuir la concentración sérica de IL-6, IL-10 y lactato post-CEC. Adicionalmente, puede ayudar a filtrar C4d y a remover el exceso de líquido que promovería una mayor hemoconcentración, por lo que se recomienda su uso rutinario cuando las condiciones hemodinámicas lo permitan.
The use of modified ultrafiltration procedure in paediatric cardiac surgery with cardiopulmonary bypass in order to reduce the systemic inflammatory response is controversial. The aim of this study is to demonstrate the usefulness of this procedure for removing pro-inflammatory substances in non-neonatal paediatric patients with non-complex congenital heart disease. Additionally, we aimed to determine its effects on haemoconcentration and in lactate and fluid removal.
MethodsA clinical trial was designed that included non-neonatal paediatric patients weighing >5kg with non-complex congenital heart disease and underwent surgery with cardiopulmonary bypass over a period of one year. They were randomised into a problem group (with modified ultrafiltration) and a control group (without it), and blood samples were taken in order to measure concentrations of interleukins (6 and 10), C3d and C4d complement fractions at the following times: baseline, before cardiopulmonary bypass, after it, after modified ultrafiltration, from the ultrafiltration concentrate, and on discharge from the operating room. Endpoints were defined in terms of morbidity and mortality, pro-inflammatory substances, lactate removal, fluid balance, and haemoconcentration.
ResultsA total of 13 patients were included in the problem group and 15 in the control group. A significantly lower serum IL-6, IL-10, and lactate at the end of cardiopulmonary bypass, were observed in the problem group, as well as a greater fluid removal, lactate, and C4d concentration in the ultrafiltration product.
ConclusionsModified ultrafiltration may benefit non-neonatal paediatric patients with congenital heart disease operated on with cardiopulmonary bypass, as it is able to decrease serum concentration of IL-6, IL-10, and lactate. Additionally, it can help to filter C4d and remove excess fluid, thus a greater haemoconcentration. Therefore, its routine use is recommended when the haemodynamic conditions are favourable.
Desde su advenimiento, la circulación extracorpórea (CEC) ha permitido llevar a cabo cirugía cardíaca para la corrección de las malformaciones congénitas que involucran estructuras internas del corazón. Se sabe que su empleo no es inocuo, ya que es capaz de producir, entre otras alteraciones, una respuesta inflamatoria sistémica (RIS), que se caracteriza por la activación del complemento, de citocinas, de la coagulación y de fibrinólisis. Los factores que contribuyen a que se desencadene la RIS incluyen el contacto de los componentes del sistema humoral sanguíneo con la superficie sintética del circuito extracorpóreo, además de la activación de leucocitos y del endotelio después de la reperfusión o isquemia de los tejidos1-5. Si la respuesta inflamatoria desencadenada es severa, puede ocasionar un síndrome de disfunción orgánica múltiple elevando la morbimortalidad en las unidades de cuidados intensivos. Si bien no existe la forma de cuantificar la magnitud de la respuesta inflamatoria sistémica provocada por la CEC, se ha utilizado la medición de las concentraciones de citocinas (interleucina [IL] 6 y 10), productos de la activación del complemento (fracción 3d [C3d] y 4d [C4d] del complemento)6, e incluso algunos productos de activación de la coagulación (factor de von Willebrand, fibrinógeno y factor viii) con dicho objetivo.
Con el propósito de atenuar la respuesta inflamatoria y disminuir su repercusión clínica, se ha desarrollado una serie de estrategias intraoperatorias de manejo antiinflamatorio que incluyen el empleo de esteroides, el uso de superficie tubular modificada del circuito de CEC y la ultrafiltración intraoperatoria. Existen diversos protocolos que incorporan en forma individual alguna de estas medidas antiinflamatorias o las combinan entre sí7-12, pero probablemente la que en mayor proporción elimina los mediadores proinflamatorios a la par de remover el exceso de agua libre en el intraoperatorio es la ultrafiltración13. La ultrafiltración convencional (UFC), que se aplica en la fase de recalentamiento de la CEC, y la ultrafiltración modificada (UFM), que se realiza inmediatamente después de terminar la CEC, son las 2 modalidades de ultrafiltración intraoperatoria ampliamente usadas en cirugía cardíaca pediátrica.
Los objetivos finales de la UFM están encaminados a eliminar el exceso de líquido, mantener una hemoconcentración con un hematocrito post-CEC entre el 25 y el 30%, y remover las sustancias proinflamatorias y los metabolitos tóxicos. A pesar de que en la literatura existen evidencias favorables en relación a los beneficios de la UFM14-16, los estudios realizados no muestran resultados fehacientes, e incluso existen datos controversiales al respecto17-22. Por otro lado, a pesar de haberse reportado beneficios en la población neonatal, no se ha demostrado la utilidad de la UFM en pacientes pediátricos no neonatales y se desconoce el impacto real que pueda causar en la remoción de los factores proinflamatorios desencadenados por la CEC.
ObjetivosEl objetivo de este estudio es demostrar la utilidad de la UFM en la remoción de sustancias proinflamatorias desencadenadas por la CEC en los pacientes pediátricos no neonatales con peso > 15kg, operados por cardiopatías congénitas simples en el período intraoperatorio. Además, se pretende demostrar la utilidad de la UFM en remover el exceso de líquido, hemoconcentrar y remover el exceso de lactato en quirófano.
MétodosDiseño del estudioSe diseñó un ensayo clínico controlado, prospectivo, aleatorizado, analítico y experimental de todos los pacientes operados en el Departamento de Cirugía Cardíaca Pediátrica y de Malformaciones Congénitas en el período de un año. Los criterios de inclusión fueron: edad mayor a un mes y ≤ 18 años, peso > 5kg, portador de una cardiopatía congénita, que fueron llevados en forma electiva a cirugía con el uso de CEC por un período mayor a 30 min, y con ausencia de métodos invasivos en el preoperatorio. Los criterios de exclusión fueron: insuficiencia renal preoperatoria, choque cardiogénico con necesidad de inotrópicos en el período preoperatorio, sepsis preoperatoria, ventilación mecánica preoperatoria por un tiempo mayor o igual a 48 h, lactato ≥ 3mmol/l, intervencionismo preoperatorio y reoperación cardíaca. Los pacientes incluidos fueron asignados en forma aleatorizada a uno de los 2 grupos de estudio: grupo problema (con UFM) o grupo control (sin UFM). Para la asignación se usó un software (URNA) basado en una tabla de números aleatorios sobre la base de los cuales una persona ajena al área quirúrgica llevó a cabo la asignación, informando a la perfusionista sobre el grupo al que era asignado el paciente. Todos los pacientes incluidos en el estudio se operaron con consentimiento informado firmado por los padres y/o tutores del paciente para la cirugía y para el protocolo, y el mismo fue autorizado por el comité de bioética institucional.
Técnica de ultrafiltración modificadaEn los pacientes aleatorizados al grupo problema (con UFM), la perfusionista armó la máquina de CEC con los aditamentos necesarios en el sistema para realizar la UFM. Una vez parada la CEC y con estabilidad hemodinámica del paciente, se solicitó al cirujano no realizar la decanulación venosa y se procedió a pinzar la línea venosa en el extremo de la entrada del reservorio a la llave de 3 vías. Posteriormente, se abrió la llave de 3 vías tanto de la línea de salida de la bomba arterial, como de la línea venosa. Finalmente, se inició la UFM a un flujo de 10 a 20ml/kg/min con las cánulas in situ y de acuerdo con la presión arterial. Se continuó con flujo constante, retransfundiendo el volumen residual del reservorio venoso con la bomba arterial. En caso necesario, se aplicó vacío de 150 a 200mmHg. La UFM se mantuvo por un período de 10 a 20min o hasta obtener el hematocrito deseado, cuidando además el adecuado balance hidroelectrolítico. Se suspendió el procedimiento en caso de inestabilidad hemodinámica. Una vez terminada la UFM, se retransfundió el volumen de la línea venosa y hemofiltro, para finalmente permitir la decanulación por parte del cirujano.
Análisis bioquímico y clínico intraoperatorioSe compararon resultados bioquímicos y clínicos de ambos grupos de estudio. Los resultados bioquímicos estaban referidos a la medición de la concentración de citocinas (IL 6 y 10) y productos de la activación del complemento (C3d y C4d). Estas concentraciones se midieron a partir de una muestra de sangre de los pacientes en los siguientes tiempos: T0 (basal, al inicio de la fase de inducción anestésica), T1 (antes de entrar en CEC), T2 (inmediatamente después de salir de CEC), T3 (inmediatamente después de la UFM en los pacientes que se eligió aplicar el procedimiento) y T5 (al salir del quirófano). Además, se midieron los mismos factores en el producto de ultrafiltración modificada de los pacientes del grupo problema (con UFM) al término de este procedimiento (T4). Los resultados clínicos intraoperatorios fueron evaluados en términos de inestabilidad hemodinámica (indicada por variaciones post-CEC mayores del 20% del valor previo a la CEC de al menos 3 de las siguientes 5 variables hemodinámicas: frecuencia cardíaca, presión arterial sistólica, diastólica y media, y presión venosa central), mortalidad y/o complicaciones intraoperatorias.
Análisis laboratorial de las muestras. Las muestras de todos los pacientes incluidos en el presente estudio se obtuvieron de sangre periférica o central. En tubos de colección sin heparina (Vacutainer®, Beckton Dickinson) se tomaron 3ml de sangre para cada uno de los tiempos (T0, 1, 2, 3, 4 y 5). Los sueros obtenidos mediante centrifugación a 3.000rpm durante 15 min a 4°C fueron almacenados en congelación a –75°C en alícuotas de 0,5ml hasta su uso. La determinación de citocinas (IL-6, IL-10), se realizó mediante la técnica ELISA-Sandwich con el uso de anticuerpos monoclonales (Peprotech, New Jersey, EE. UU.). La detección de los productos de la activación del complemento (C3d y C4d) se elaboró con la misma técnica mediante el uso de kits comerciales (Bachem, San Carlos, EE. UU.), siguiendo las instrucciones del fabricante. La densidad óptica se determinó a 450nm en lector de ELISA. La concentración de IL-6, IL-10 (pg/ml) y de C3d y C4d (ng/ml) se calculó mediante el uso del GraphPad Software versión 4.2. Los niveles séricos de proteína C reactiva (mg/l) se realizó mediante nefelometría (Immage 800, Beckman Coulter, Krefeld, Alemania).
Análisis estadísticoLa información fue registrada en unas hojas de evaluación diseñadas para tal efecto. Los datos así compilados fueron vaciados en una planilla electrónica Excel y procesados con un software estadístico Prisma Graphics v3.1. Las variables continuas se expusieron como media ± desviación estándar, con rangos de variabilidad mínimo y máximo, y las variables categóricas como el número y su porcentaje en relación con la población de riesgo. Se estableció la comparabilidad de los 2 grupos de estudio mediante la determinación de las variables continuas y categóricas anteriormente descritas a través de la prueba de la t de Student y χ2, respectivamente, considerando un intervalo de confianza del 95%. Un valor de p < 0,05 fue indicativo de significación estadística.
ResultadosSe enroló a 28 pacientes en el estudio: 15 fueron aleatorizados al grupo problema (con UFM) y 13 al grupo control (sin UFM).
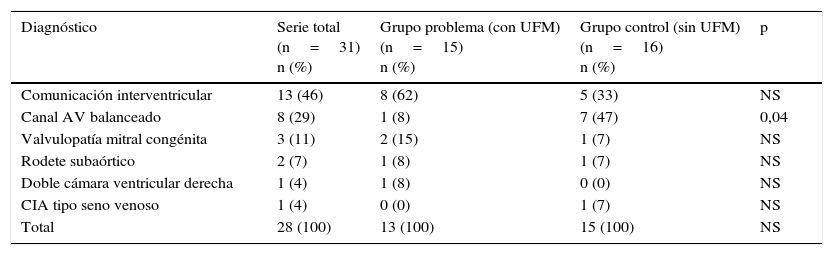
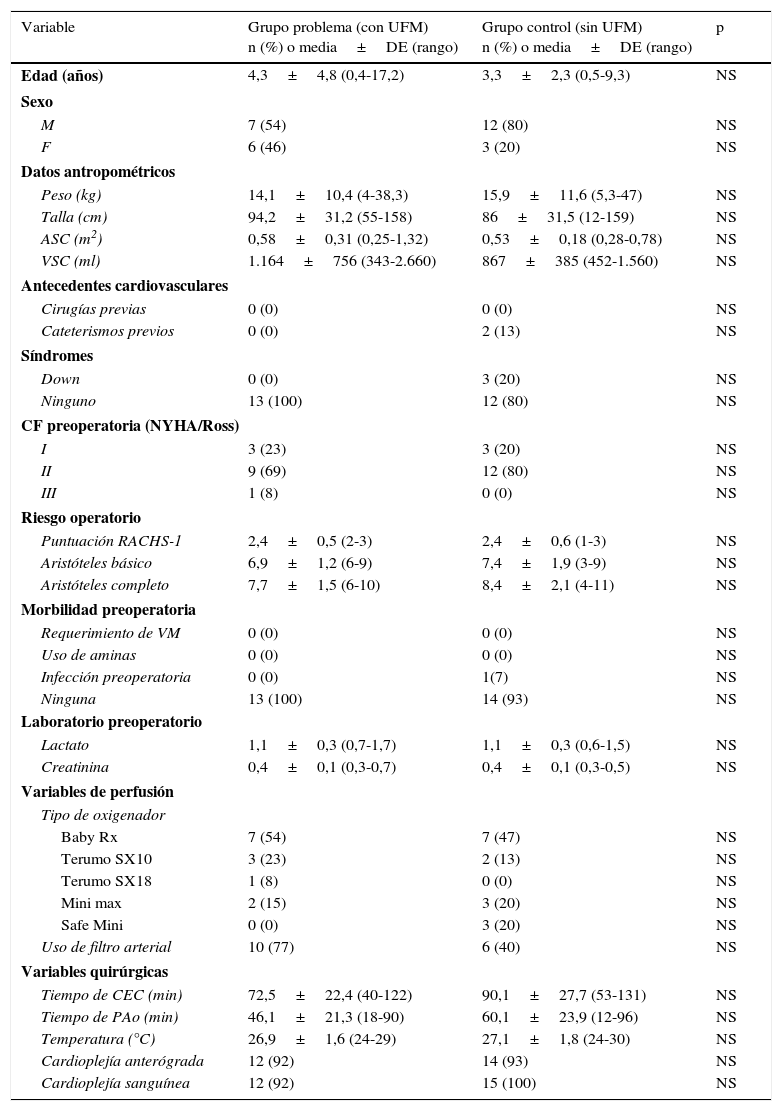
Características preoperatoriasEn la tabla 1 se resumen los diagnósticos de base en ambos grupos de estudio. Se puede ver que, a pesar de no existir diferencias en el número total de cardiopatías entre ambos grupos, el grupo control (sin UFM) tuvo significativamente mayor número de pacientes con diagnóstico de canal AV en relación con el grupo problema (con UFM). En la tabla 2 se exponen las demás características preoperatorias de los grupos de estudio. Nótese que no existen diferencias estadísticamente significativas entre los 2 grupos en ninguna de las variables estudiadas. A pesar de la mayor incidencia de canal AV en el grupo control (sin UFM) que pudo haberse debido al azar, el resto de los resultados nos indican que los 2 grupos de estudio son completamente comparables entre sí.
Diagnósticos de las cardiopatías de base en los grupos de estudio
| Diagnóstico | Serie total (n=31) n (%) | Grupo problema (con UFM) (n=15) n (%) | Grupo control (sin UFM) (n=16) n (%) | p |
|---|---|---|---|---|
| Comunicación interventricular | 13 (46) | 8 (62) | 5 (33) | NS |
| Canal AV balanceado | 8 (29) | 1 (8) | 7 (47) | 0,04 |
| Valvulopatía mitral congénita | 3 (11) | 2 (15) | 1 (7) | NS |
| Rodete subaórtico | 2 (7) | 1 (8) | 1 (7) | NS |
| Doble cámara ventricular derecha | 1 (4) | 1 (8) | 0 (0) | NS |
| CIA tipo seno venoso | 1 (4) | 0 (0) | 1 (7) | NS |
| Total | 28 (100) | 13 (100) | 15 (100) | NS |
Características preoperatorias de los grupos de estudio
| Variable | Grupo problema (con UFM) n (%) o media±DE (rango) | Grupo control (sin UFM) n (%) o media±DE (rango) | p |
|---|---|---|---|
| Edad (años) | 4,3±4,8 (0,4-17,2) | 3,3±2,3 (0,5-9,3) | NS |
| Sexo | |||
| M | 7 (54) | 12 (80) | NS |
| F | 6 (46) | 3 (20) | NS |
| Datos antropométricos | |||
| Peso (kg) | 14,1±10,4 (4-38,3) | 15,9±11,6 (5,3-47) | NS |
| Talla (cm) | 94,2±31,2 (55-158) | 86±31,5 (12-159) | NS |
| ASC (m2) | 0,58±0,31 (0,25-1,32) | 0,53±0,18 (0,28-0,78) | NS |
| VSC (ml) | 1.164±756 (343-2.660) | 867±385 (452-1.560) | NS |
| Antecedentes cardiovasculares | |||
| Cirugías previas | 0 (0) | 0 (0) | NS |
| Cateterismos previos | 0 (0) | 2 (13) | NS |
| Síndromes | |||
| Down | 0 (0) | 3 (20) | NS |
| Ninguno | 13 (100) | 12 (80) | NS |
| CF preoperatoria (NYHA/Ross) | |||
| I | 3 (23) | 3 (20) | NS |
| II | 9 (69) | 12 (80) | NS |
| III | 1 (8) | 0 (0) | NS |
| Riesgo operatorio | |||
| Puntuación RACHS-1 | 2,4±0,5 (2-3) | 2,4±0,6 (1-3) | NS |
| Aristóteles básico | 6,9±1,2 (6-9) | 7,4±1,9 (3-9) | NS |
| Aristóteles completo | 7,7±1,5 (6-10) | 8,4±2,1 (4-11) | NS |
| Morbilidad preoperatoria | |||
| Requerimiento de VM | 0 (0) | 0 (0) | NS |
| Uso de aminas | 0 (0) | 0 (0) | NS |
| Infección preoperatoria | 0 (0) | 1(7) | NS |
| Ninguna | 13 (100) | 14 (93) | NS |
| Laboratorio preoperatorio | |||
| Lactato | 1,1±0,3 (0,7-1,7) | 1,1±0,3 (0,6-1,5) | NS |
| Creatinina | 0,4±0,1 (0,3-0,7) | 0,4±0,1 (0,3-0,5) | NS |
| Variables de perfusión | |||
| Tipo de oxigenador | |||
| Baby Rx | 7 (54) | 7 (47) | NS |
| Terumo SX10 | 3 (23) | 2 (13) | NS |
| Terumo SX18 | 1 (8) | 0 (0) | NS |
| Mini max | 2 (15) | 3 (20) | NS |
| Safe Mini | 0 (0) | 3 (20) | NS |
| Uso de filtro arterial | 10 (77) | 6 (40) | NS |
| Variables quirúrgicas | |||
| Tiempo de CEC (min) | 72,5±22,4 (40-122) | 90,1±27,7 (53-131) | NS |
| Tiempo de PAo (min) | 46,1±21,3 (18-90) | 60,1±23,9 (12-96) | NS |
| Temperatura (°C) | 26,9±1,6 (24-29) | 27,1±1,8 (24-30) | NS |
| Cardioplejía anterógrada | 12 (92) | 14 (93) | NS |
| Cardioplejía sanguínea | 12 (92) | 15 (100) | NS |
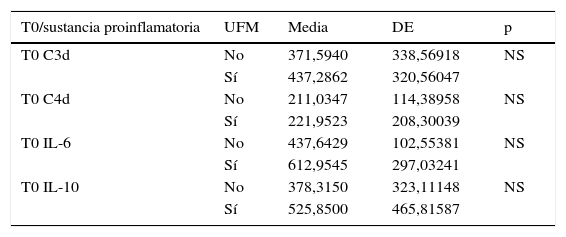
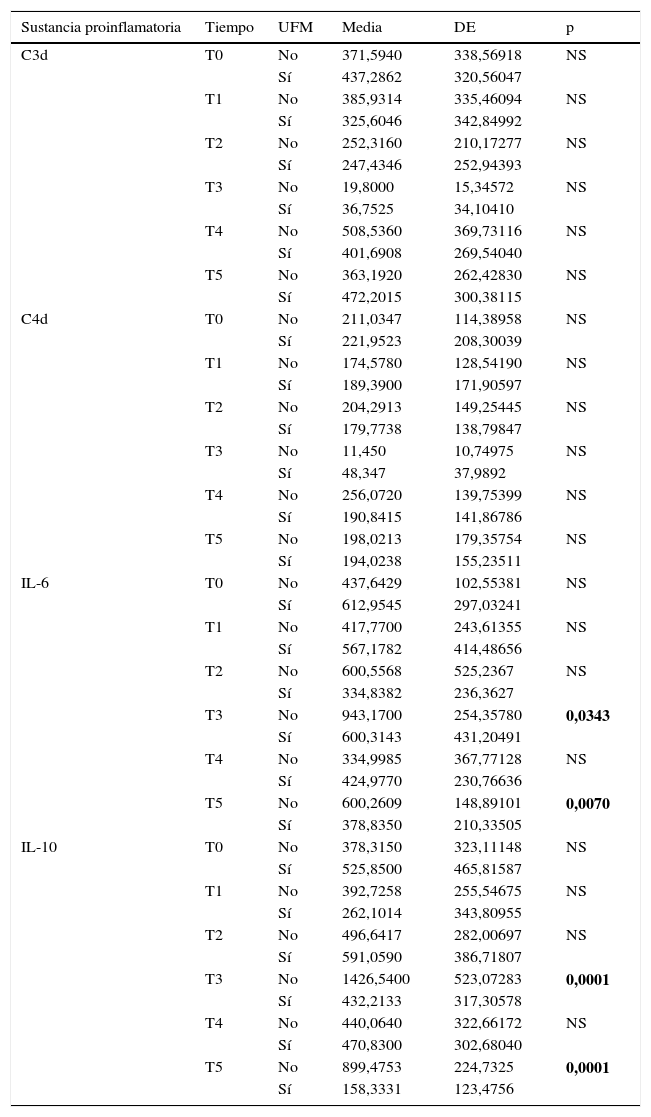
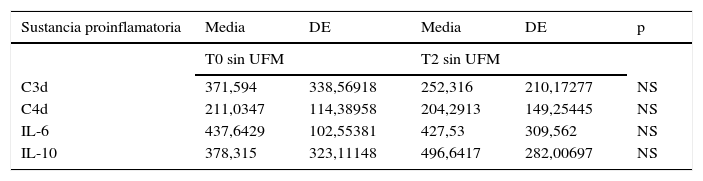
En la tabla 3 se hace la comparación de las concentraciones de sustancias proinflamatorias en ambos grupos de estudio (con y sin UFM) antes de la cirugía (T0). Se puede observar que no existen diferencias en la concentración basal de las sustancias proinflamatorias medidas (IL-6, IL-10, C3d y C4d) en el grupo con UFM al compararlo con el grupo sin UFM. Por otro lado, en la tabla 4 se comparan las concentraciones de las sustancias proinflamatorias en el grupo control (sin UFM) en los diferentes tiempos (T0, 1, 2, 3, 4 y 5), observándose que no existen diferencias en la concentración de las sustancias proinflamatorias, excepto las de IL-6 e IL-10, que son menores después de la UFM (T3) y al salir de quirófano (T5) en el grupo problema en relación con el grupo control. Finalmente, en la tabla 5 se hace una comparación las concentraciones de las sustancias proinflamatorias en los tiempos más representativos de los grupos de estudio. Se observa que, en relación con el valor basal (T0), hay una menor concentración en la sangre de los pacientes del grupo con UFM de C4d en T3 (después de la UFM). También se puede ver que, a pesar de existir una menor concentración de IL-10 en el producto del ultrafiltrado en relación con el basal del paciente, la concentración en sangre de esta sustancia proinflamatoria es menor en los pacientes al salir de quirófano en el grupo en el que se usó UFM. De la misma forma, la concentración de IL-6 al salir de quirófano es menor en relación con la basal en el grupo con UFM.
Comparación de las concentraciones basales de las sustancias proinflamatorias en los grupos de estudio en el tiempo cero (T0)
| T0/sustancia proinflamatoria | UFM | Media | DE | p |
|---|---|---|---|---|
| T0 C3d | No | 371,5940 | 338,56918 | NS |
| Sí | 437,2862 | 320,56047 | ||
| T0 C4d | No | 211,0347 | 114,38958 | NS |
| Sí | 221,9523 | 208,30039 | ||
| T0 IL-6 | No | 437,6429 | 102,55381 | NS |
| Sí | 612,9545 | 297,03241 | ||
| T0 IL-10 | No | 378,3150 | 323,11148 | NS |
| Sí | 525,8500 | 465,81587 |
Comparación de la concentración de sustancias inflamatorias en los diferentes tiempos en los grupos de estudio
| Sustancia proinflamatoria | Tiempo | UFM | Media | DE | p |
|---|---|---|---|---|---|
| C3d | T0 | No | 371,5940 | 338,56918 | NS |
| Sí | 437,2862 | 320,56047 | |||
| T1 | No | 385,9314 | 335,46094 | NS | |
| Sí | 325,6046 | 342,84992 | |||
| T2 | No | 252,3160 | 210,17277 | NS | |
| Sí | 247,4346 | 252,94393 | |||
| T3 | No | 19,8000 | 15,34572 | NS | |
| Sí | 36,7525 | 34,10410 | |||
| T4 | No | 508,5360 | 369,73116 | NS | |
| Sí | 401,6908 | 269,54040 | |||
| T5 | No | 363,1920 | 262,42830 | NS | |
| Sí | 472,2015 | 300,38115 | |||
| C4d | T0 | No | 211,0347 | 114,38958 | NS |
| Sí | 221,9523 | 208,30039 | |||
| T1 | No | 174,5780 | 128,54190 | NS | |
| Sí | 189,3900 | 171,90597 | |||
| T2 | No | 204,2913 | 149,25445 | NS | |
| Sí | 179,7738 | 138,79847 | |||
| T3 | No | 11,450 | 10,74975 | NS | |
| Sí | 48,347 | 37,9892 | |||
| T4 | No | 256,0720 | 139,75399 | NS | |
| Sí | 190,8415 | 141,86786 | |||
| T5 | No | 198,0213 | 179,35754 | NS | |
| Sí | 194,0238 | 155,23511 | |||
| IL-6 | T0 | No | 437,6429 | 102,55381 | NS |
| Sí | 612,9545 | 297,03241 | |||
| T1 | No | 417,7700 | 243,61355 | NS | |
| Sí | 567,1782 | 414,48656 | |||
| T2 | No | 600,5568 | 525,2367 | NS | |
| Sí | 334,8382 | 236,3627 | |||
| T3 | No | 943,1700 | 254,35780 | 0,0343 | |
| Sí | 600,3143 | 431,20491 | |||
| T4 | No | 334,9985 | 367,77128 | NS | |
| Sí | 424,9770 | 230,76636 | |||
| T5 | No | 600,2609 | 148,89101 | 0,0070 | |
| Sí | 378,8350 | 210,33505 | |||
| IL-10 | T0 | No | 378,3150 | 323,11148 | NS |
| Sí | 525,8500 | 465,81587 | |||
| T1 | No | 392,7258 | 255,54675 | NS | |
| Sí | 262,1014 | 343,80955 | |||
| T2 | No | 496,6417 | 282,00697 | NS | |
| Sí | 591,0590 | 386,71807 | |||
| T3 | No | 1426,5400 | 523,07283 | 0,0001 | |
| Sí | 432,2133 | 317,30578 | |||
| T4 | No | 440,0640 | 322,66172 | NS | |
| Sí | 470,8300 | 302,68040 | |||
| T5 | No | 899,4753 | 224,7325 | 0,0001 | |
| Sí | 158,3331 | 123,4756 |
Los valores en negrita indican significancia estadística (p < 0,05).
Comparación entre las concentraciones de las sustancias proinflamatorias en los tiempos más representativos de los grupos de estudio
| Sustancia proinflamatoria | Media | DE | Media | DE | p |
|---|---|---|---|---|---|
| T0 sin UFM | T2 sin UFM | ||||
| C3d | 371,594 | 338,56918 | 252,316 | 210,17277 | NS |
| C4d | 211,0347 | 114,38958 | 204,2913 | 149,25445 | NS |
| IL-6 | 437,6429 | 102,55381 | 427,53 | 309,562 | NS |
| IL-10 | 378,315 | 323,11148 | 496,6417 | 282,00697 | NS |
| T0 con UFM | T3 con UFM | ||||
|---|---|---|---|---|---|
| C3d | 437,2862 | 320,56047 | 36,7525 | 34,1041 | NS |
| C4d | 221,9523 | 208,30039 | 48,347 | 37,9892 | 0,019 |
| IL-6 | 612,9545 | 297,03241 | 600,3143 | 431,20491 | NS |
| IL-10 | 525,85 | 465,81587 | 432,2133 | 317,30578 | NS |
| T0 con UFM | T4 con UFM | ||||
|---|---|---|---|---|---|
| C3d | 437,2862 | 320,56047 | 401,6908 | 269,5404 | NS |
| C4d | 221,9523 | 208,30039 | 190,8415 | 141,86786 | NS |
| IL-6 | 612,9545 | 297,03241 | 424,977 | 230,76636 | NS |
| IL-10 | 525,85 | 465,81587 | 470,83 | 302,6804 | 0,001 |
| T0 sin UFM | T5 sin UFM | ||||
|---|---|---|---|---|---|
| C3d | 371,594 | 338,56918 | 363,192 | 262,4283 | NS |
| C4d | 211,0347 | 114,38958 | 198,0213 | 179,35754 | NS |
| IL-6 | 437,6429 | 102,55381 | 500,2609 | 448,89101 | NS |
| IL-10 | 378,315 | 323,11148 | 446,39 | 159,60207 | NS |
| T0 con UFM | T5 con UFM | ||||
|---|---|---|---|---|---|
| C3d | 437,2862 | 320,56047 | 472,2015 | 300,38115 | NS |
| C4d | 221,9523 | 208,30039 | 194,0238 | 155,23511 | NS |
| IL-6 | 612,9545 | 297,03241 | 378,835 | 210,33505 | 0,0364 |
| IL-10 | 525,85 | 465,81587 | 158,3331 | 123,4756 | 0,0149 |
Los valores en negrita indican significancia estadística (p < 0,05).
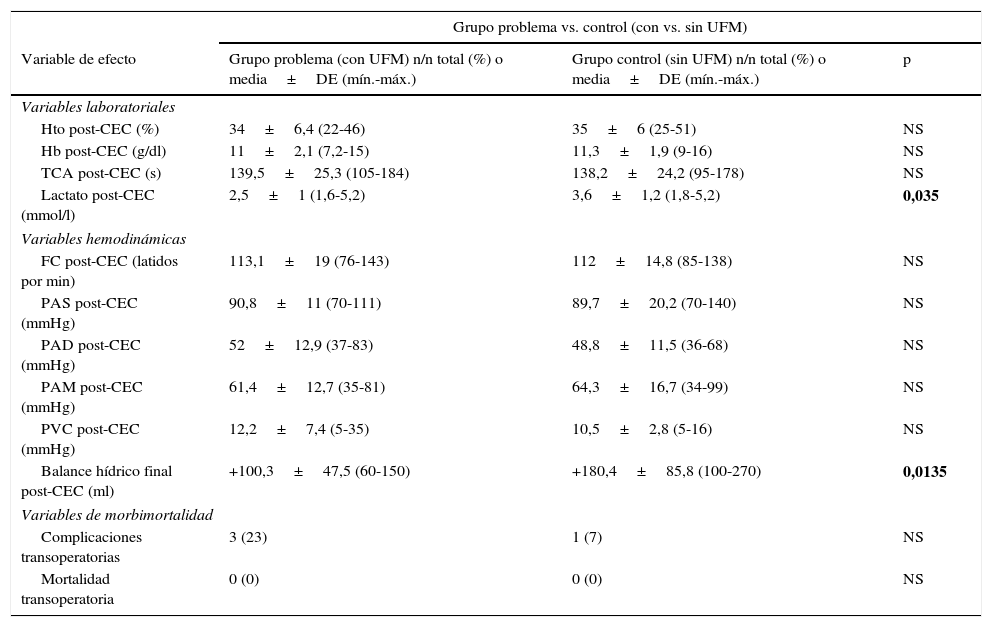
En la tabla 6 se resume la comparación de las variables de efecto en ambos grupos de estudio (con y sin UFM) post-CEC. Se puede observar que se detectó una disminución estadísticamente significativa en la concentración de lactato post-CEC en el grupo con UFM en relación con el que no la recibió. También se observa una disminución significativa del volumen del balance hídrico total en el grupo con UFM en relación con el que no la recibió. Sin embargo, no se detectaron diferencias estadísticamente significativas en el hematocrito, hemoglobina y TCA en el período intraoperatorio. Tampoco las variables hemodinámicas (presión arterial sistólica, diastólica y media, frecuencia cardíaca y presión venosa central) presentaron diferencias significativas post-CEC. Finalmente, no se evidenciaron diferencias en la morbimortalidad en ambos grupos de estudio (con y sin UFM).
Comparación entre los efectos finales de evaluación en ambos grupos de estudio (con y sin UFM)
| Grupo problema vs. control (con vs. sin UFM) | |||
|---|---|---|---|
| Variable de efecto | Grupo problema (con UFM) n/n total (%) o media±DE (mín.-máx.) | Grupo control (sin UFM) n/n total (%) o media±DE (mín.-máx.) | p |
| Variables laboratoriales | |||
| Hto post-CEC (%) | 34±6,4 (22-46) | 35±6 (25-51) | NS |
| Hb post-CEC (g/dl) | 11±2,1 (7,2-15) | 11,3±1,9 (9-16) | NS |
| TCA post-CEC (s) | 139,5±25,3 (105-184) | 138,2±24,2 (95-178) | NS |
| Lactato post-CEC (mmol/l) | 2,5±1 (1,6-5,2) | 3,6±1,2 (1,8-5,2) | 0,035 |
| Variables hemodinámicas | |||
| FC post-CEC (latidos por min) | 113,1±19 (76-143) | 112±14,8 (85-138) | NS |
| PAS post-CEC (mmHg) | 90,8±11 (70-111) | 89,7±20,2 (70-140) | NS |
| PAD post-CEC (mmHg) | 52±12,9 (37-83) | 48,8±11,5 (36-68) | NS |
| PAM post-CEC (mmHg) | 61,4±12,7 (35-81) | 64,3±16,7 (34-99) | NS |
| PVC post-CEC (mmHg) | 12,2±7,4 (5-35) | 10,5±2,8 (5-16) | NS |
| Balance hídrico final post-CEC (ml) | +100,3±47,5 (60-150) | +180,4±85,8 (100-270) | 0,0135 |
| Variables de morbimortalidad | |||
| Complicaciones transoperatorias | 3 (23) | 1 (7) | NS |
| Mortalidad transoperatoria | 0 (0) | 0 (0) | NS |
CEC: circulación extracorpórea; FC: frecuencia cardíaca; Hb: hemoglobina; Hto: hematocrito; NS: no significativo en lo estadístico; PAD: presión arterial diastólica; PAM: presión arterial media; PAS. presión arterial sistólica; PVC: presión venosa central; TCA: tiempo de coagulación activado.
En negrita, se destaca el valor de la significancia estadística alcanzada (p) para las variables comparadas mediante la prueba t de Student.
La CEC es capaz de desencadenar una respuesta inflamatoria sistémica secundaria a varios factores, entre los que destacan los siguientes: 1) activación celular por el contacto con superficies extrañas del circuito de la CEC; 2) estrés mecánico; 3) isquemia y reperfusión tisular; 4) hipotensión; 5) perfusión con flujo no pulsátil; 6) hemodilución con anemia relativa; 7) transfusión de sangre y hemoderivados; 8) administración de heparina y protamina, y 9) efectos de la hipotermia. La CEC ocasiona activación del endotelio vascular y la estimulación por mediadores de la inflamación, tales como el factor de necrosis tumoral-alfa, IL y endotoxinas, lo que a su vez ocasiona activación del factor de transcripción intracelular, incrementa las citocinas proinflamatorias endoteliales y la expresión molecular de adhesión leucocitaria.
También es un hecho conocido que cuanto menor es la edad del individuo, mayor es la susceptibilidad que tiene a la respuesta inflamatoria sistémica desencadenada por la CEC por múltiples razones. Entre ellas destacan la mayor demanda metabólica de estos pacientes, la hiperactividad de su vasculatura pulmonar, la inmadurez de sus órganos y la alteración en los sistemas de homeostasis. El riesgo es particularmente más elevado en neonatos y lactantes menores por la gran desproporción entre el circuito de CEC y el tamaño del paciente, con volúmenes de la derivación cardiopulmonar frecuentemente entre un 200 y un 300% mayores al volumen circulatorio del individuo. Adicionalmente, la mayor demanda metabólica que poseen requiere de un flujo de bomba mayor que alcanza en los neonatos hasta una tasa de perfusión de 200ml/kg−1/min−1. Esta combinación entre un tamaño relativamente mayor del circuito de CEC y tasa de perfusión más elevada trae como consecuencia una mayor exposición de la sangre a la superficie extraña del circuito23. En nuestra serie no hubo diferencias de edad entre ambos grupos, y cabe resaltar que en ninguno de ellos se incluyó a pacientes neonatales por las razones ya expuestas.
Las citocinas más involucradas en el desencadenamiento de la respuesta inflamatoria sistémica inducida por la CEC son precisamente la IL 6 e IL-10. Se han detectado niveles elevados de IL-6 en pacientes con complicaciones postoperatorias y se correlaciona con anormalidades en el movimiento de la pared miocárdica posterior a la CEC determinado por ecocardiograma transesofágico. Además, la IL-6 es un pirógeno endógeno y activador de la síntesis de proteínas de fase aguda. El incremento de los niveles de IL-6 es independiente del uso de oxigenador de membrana o burbuja, hipotermia o normotermia y de circuitos heparinizados o no24,25. Por otro lado, la IL-10 es una citocina que ha sido probada en diferentes ensayos clínicos basados en su capacidad para regular la disminución de las respuestas de los linfocitos T helper, es decir, la secreción de interferón gamma y la activación de monocitos y macrófagos. La capacidad de la IL-10 para inducir la diferenciación de un subconjunto de CD4 reguladora (+), las células T (Tr1) y su importancia para la función in vivo de células T reguladoras, tiende a apoyar la opinión de que la IL- 10 es una citocina crucial en el control de las respuestas inmunitarias26. En nuestro estudio, a pesar de que estos factores presentan concentraciones séricas sin diferencias significativas en el tiempo basal (T0) en ambos grupos de estudio, se puede ver que se remueven significativamente en el grupo problema en relación al grupo control, después de la UFM. Este probablemente es el hecho más relevante del estudio, ya que demuestra que la UFM en cardiopatías congénitas tiene un beneficio importante al disminuir la concentración circulante de estas sustancias proinflamatorias en estos pacientes en los que la inflamación es particularmente potenciada por la inmadurez de su sistema inmunológico. Otro efecto que cabe destacar al respecto es que si el beneficio de la UFM se refleja en las cardiopatías poco complejas como las de los pacientes de este estudio en las que habitualmente la morbimortalidad intraoperatoria es baja, con mayor razón lo será en aquellas cardiopatías complejas en las que la remoción de la IL-6 por UFM puede significar una diferencia muy importante en la evolución intraoperatoria de estos pacientes27. Este solo hecho justifica el uso rutinario de UFM en todos los pacientes con cardiopatías congénitas sometidos a cirugía con CEC.
Con el propósito de atenuar la respuesta inflamatoria y disminuir su repercusión sobre la evolución postoperatoria de los niños con cardiopatías congénitas, se ha empleado una serie de estrategias adicionales a la UFM en el manejo antiinflamatorio en el perioperatorio de la cirugía cardíaca con CEC, que incluyen el empleo de esteroides (dexametasona 10 a 30mg/kg, 12 y 6 h antes de la cirugía), el uso de superficie tubular modificada del circuito de derivación cardiopulmonar y la ultrafiltración intraoperatoria. Sin embargo, ninguno de ellos tiene un impacto tan importante como la UFM que se realiza inmediatamente después de terminar la CEC y antes de decanular al paciente28. Desde 1973, se han usado diferentes tipos de hemofiltros, particularmente de policarbonato, para eliminar el exceso de agua del volumen del cebado de acuerdo con el principio del gradiente de presión. Estos filtros han ido mejorando en el transcurso del tiempo, siendo reemplazados por los de poliariletersulfonato en 1986 y más tarde por la última generación de filtros que son los de poliamida. Estos últimos son más prácticos y tienen mayor biocompatibilidad, superficie reducida y efectividad de ultrafiltración a una presión menor a la fisiológica. Por otro lado, la capacidad de estos filtros en eliminar los factores proinflamatorios de la CEC dependerá de la combinación entre el tipo de filtro y la modalidad de ultrafiltración empleada. Al respecto, Berdat et al. estudiaron la efectividad de los filtros de poliariletersulfonato versus los de poliamida en relación con la modalidad de ultrafiltración empleada para la eliminación de las sustancias proinflamatorias más importantes, como la IL-6, el factor de necrosis tumoral y la IL-10. En este trabajo se demostró que la IL-6 se eliminó más eficientemente por la UFC con filtro de poliariletersulfonato, mientras que el factor de necrosis tumoral se removió mejor con UFM con filtro de poliariletersulfonato. Las demás sustancias proinflamatorias no se modificaron por la modalidad de ultrafiltración ni por el tipo de filtro. Por lo tanto, pareciera ser que la estrategia más efectiva para eliminar los factores proinflamatorios en cirugía cardíaca pediátrica es la UFM con el filtro de poliariletersulfonato. Nuestros resultados se basan en la modalidad de ultrafiltración más que en el tipo de filtro, aunque la variabilidad del material de estos últimos fue mínima.
Se ha reportado que la UFM es capaz no solo de filtrar el exceso de líquido extracelular, sino también citocinas y otros productos inflamatorios desencadenados por la CEC y el traumatismo quirúrgico. Existe cierta controversia en la literatura en relación con la eficacia de los filtros en la remoción de citocinas, al igual que en las diferencias entre las 2 modalidades de ultrafiltración29. Adicionalmente, los resultados comparativos entre ambas modalidades de ultrafiltración son de difícil interpretación por las variaciones en la técnica de ultrafiltrado, equipo, definiciones y objetivos, y mediciones de las citocinas. Finalmente, todavía no se sabe si los beneficios clínicos de la UFM se deben a la remoción de citocinas y otros productos de la inflamación, o a la reducción aislada del edema tisular30-34. En nuestro estudio, se puede ver un beneficio adicional de la UFM, que es la eliminación del exceso de líquido que se muestra mediante un balance hídrico de menor cantidad en el grupo problema en relación con el grupo control. Contrariamente a lo esperado, no se demostró una reducción significativa del hematocrito post-CEC en el grupo sometido a UFM. Este fenómeno se puede explicar por el hecho de que para conseguir una reducción efectiva del hematocrito reflejada por el estudio de laboratorio se requiere de un tiempo mínimo de 24 h.
Finalmente, a pesar de que se mostró en este estudio que en relación con el valor basal, hay una menor concentración de C4d en la sangre de los pacientes del grupo con UFM después de salir de CEC. Sin embargo, la disminución sérica de esta sustancia (C4d) no pareciera mantenerse en el resto del período intraoperatorio. A diferencia de este hallazgo, se pudo observar una disminución de los valores séricos de lactato post-CEC en los pacientes del grupo sometido a UFM. La medición del lactato ha demostrado ser útil para valorar la oxigenación tisular, ya que es un buen indicador de hipoperfusión tisular. Se acepta, en general, que concentraciones de lactato elevadas implican un mal pronóstico en pacientes graves, como aquellos portadores de una cardiopatía35. Se ha demostrado que un nivel elevado de lactato en el contexto de una cirugía cardíaca con CEC es un signo de mal pronóstico que indica la necesidad de medidas terapéuticas inmediatas e intensivas. Si la UFM consigue reducir el lactato en 24 a 48 h, las posibilidades de supervivencia se incrementan notablemente36.
ConclusionesA la luz de los resultados de este estudio, podemos decir que la concentración de las sustancias proinflamatorias como IL-6 e IL-10 en la sangre de los pacientes del grupo problema fueron menores en relación con los del grupo control, al igual que las concentraciones del lactato, y se asocian a un balance hídrico menor por acción de la UFM, en cuyo producto también existe mayor concentración de C4d. Esto nos indica que la UFM es un método que puede beneficiar a los pacientes pediátricos con cardiopatía congénita sometidos a CEC porque es capaz de disminuir la concentración sérica de IL-6, IL-10 y lactato post-CEC. Adicionalmente, puede ayudar a filtrar C4d y a remover el exceso de líquido que promovería una mayor hemoconcentración. Es por ello que recomendamos el uso de UFM en pacientes pediátricos no neonatales en forma rutinaria, siempre y cuando las condiciones hemodinámicas del paciente lo permitan.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.