La oclusión de los injertos coronarios utilizados durante la cirugía de revascularización miocárdica es un hecho relativamente frecuente. Se ha descrito que entre el 7–15% se afectan antes de las 24 horas, y hasta un 30% al año relacionándose principalmente con errores técnicos. El Doppler pulsado ofrece los requerimientos necesarios para una adecuada evaluación intraoperatoria de los injertos. El objetivo principal de este estudio es demostrarlo utilizando el prototipo Fluxvisum.
Material y métodoEstudio longitudinal realizado entre marzo de 2012 y junio del 2016 en pacientes revascularizados quirúrgicamente en los que los injertos coronarios elaborados fueron evaluados intraoperatoriamente utilizando Doppler pulsado.
ResultadosSe estudiaron 110 enfermos predominantemente hombres mayores de 60 años, con una alta prevalencia de hipertensión arterial (HTA), diabetes mellitus (DM) e infarto agudo de miocardio (IMA) previo, y diagnóstico al ingreso de SCASEST. Las mediciones promedio fueron: Qmed:31,7 mL/min, IP:3,2, DFI:70,2. El Qmed fue la variable flujométrica que más se asoció estadísticamente con la aparición de eventos cardiacos mayores. En la regresión logística, la calidad de la revascularización de la arteria descendente anterior (DA) destacó como el principal factor predictor de eventos adversos cardiovasculares mayores (MACE) (p = 0,050, OR: 2,599, IC 95%:0,972-6,947), muerte (p = 0,004, OR: 13,947, IC 95%:2,311-84,163), IMA (p = 0,000, OR: 11,331, IC 95%:2,995-42,867) e isquemia aguda perioperatoria (p = 0,049, OR: 2,864, IC 95%:0,997-8,222).
ConclusionesLa flujometría con Doppler pulsado demostró ser una herramienta que tiene un alto poder pronóstico como predictor de comorbilidad posoperatoria y eventos cardiacos mayores en pacientes revascularizados quirúrgicamente.
The occlusion of coronary grafts used during myocardial revascularization surgery is a relatively frequent event. It has been described that between 7%–15% are affected in under 24 hours, and up to 30% per year, mainly related to technical errors. Pulsed Doppler offers the necessary requirements for adequate intraoperative evaluation of grafts. The main objective of this study is to demonstrate this using the Fluxvisum prototype.
Material and methodLongitudinal study carried out between March 2012 and June 2016 in surgically revascularized patients in whom the constructed coronary grafts were evaluated intraoperatively using pulsed Doppler.
Results110 patients were studied, predominantly men older than 60 years, with a high prevalence of HT, DM, and previous AMI, and diagnosed on admission to NSTEMI. The average measurements were: Qmed:31.7 ml/min, PI:3.2, DFI:70.2. Qmed was the flowmeter variable that was most statistically associated with the appearance of major cardiac events. In the logistic regression, the quality of LAD revascularization stood out as the main predictor of MACE (p = .050, OR:2.599, 95%CI:0.972-6.947), death (p = .004, OR:13.947, 95%CI:2,311-84,163), AMI (p = .000, OR:11.331, 95%CI:2.995-42.867), and perioperative acute ischaemia (p = .049, OR:2.864, 95%CI:.997-8.222).
ConclusionsPulsed Doppler flowmetry proved to be a tool with high prognostic power as a predictor of postoperative comorbidity and major cardiac events in surgically revascularized patients.
El incremento sostenido en la sobrevida general ha consolidado a la cardiopatía isquémica como la primera causa de muerte a nivel mundial1,2, existiendo evidencia de la presencia de lesiones coronarias hasta en el 24% de los hombres entre 15 y 19 años3. La amplia evidencia acumulada ha ratificado a la cirugía de revascularización miocárdica (CRM) como tratamiento adecuado para todas las lesiones del árbol coronario4,5. En el estudio Project of Ex-vivo Vein Graft Engineering via Transfection IV (PREVENT IV)6 se identificaron lesiones significativas en el 25% de los puentes de la vena safena y el 8% de los hemoductos de mamaria interna, relacionándose su presencia con una mayor incidencia de IMA y/o muerte (13.9% vs 0.9%). Múltiples autores han encontrado que entre 7 a 15% de los injertos se ocluyen antes de las 24 horas y hasta un 30% al año7–10, relacionándose mayormente con errores técnicos en las anastomosis distales o proximales8-10, por lo que es prioritario encontrar un método de evaluación intraoperatoria que permita su identificación y corrección inmediata11–15. Se ha descrito en revisiones previas16 que el instrumento a utilizar además de veraz debe ser fácil de utilizar e interpretar, inocuo para el paciente y a un costo que lo haga sustentable.
El Servicio de Cirugía Cardiovascular del Hospital Clínico Quirúrgico «Hermanos Ameijeiras» cuenta con un Sistema Doppler Pulsado bidireccional de flujo sanguíneo, el cual ha sido desarrollado en colaboración con el Departamento de Ingeniería en Sistemas Computacionales y Automatización de la Universidad Nacional Autónoma de México (UNAM). Durante más de 15 años de colaboración se han llevado a cabo innovaciones al desarrollo tecnológico de sistemas Doppler Ultrasónicos17–22, hasta llegar a la versión del Sistema Doppler FLUXVISUM, que integra y opera con dos desarrollos de software: 1. FLUXVISUM-TR23: encargado del procesamiento y análisis de señales Doppler ultrasónicas en tiempo real que permiten la medición de flujo sanguíneo a través de una interfaz gráfica de usuario con la cual se extrae la información (magnitud y fase) de los ecos de las estructuras en movimiento en la sangre y consigo se obtiene la señal del flujo monitoreado. La interfaz permite relacionar y sincronizar los tiempos de duración del ciclo cardiaco (sístole y diástole) con el espectrograma utilizando la señal del electrocardiograma con lo que se logra el cálculo de los parámetros numéricos de interés en la cirugía, como son: índice de pulsatilidad (IP), índice de resistividad (IR), llenado diastólico (DFI), gasto medio (Qmed), gasto máximo (Qmax), gasto mínimo (Qmin) y frecuencia cardiaca (FC). El análisis de la señal, el cálculo de los índices, la curva media y el despliegue del espectrograma se llevan a cabo en tiempo real, y 2. FLUXVISUM-SERVIDOR24 que permite el registro de toda la información concerniente con el paciente facilitando su correlación con cada una de las variables descritas.
El sistema adquiere las señales de flujo sanguíneo por medio de un detector Doppler ultrasónico que opera a 8 MHz, utilizando un módulo de adquisición de datos que se comunica con una computadora por medio de un puerto USB. Es calibrado con un phantom emulador de flujo sanguíneo, integrado por una bomba dosificadora con capacidad de suministrar hasta 200 ml/min de un fluido mimetizador de sangre, un transductor ultrasónico a 8 MHz esterilizable y un aditamento para fijar el ángulo de incidencia del transductor a 60 grados19.
El sistema FLUXVISUM se ha utilizado en la institución desde marzo de 2012 a la fecha, no habiendo sido validado por ningún estudio dentro o fuera de Cuba, por lo que el fin de esta investigación es valorar su efectividad como método de medición funcional de los injertos y predictor pronóstico de eventos cardiacos mayores en la CRM facilitando la toma de decisiones de los cirujanos cardiovasculares durante el proceso transoperatorio.
Material y métodoDiseño del estudio, fuente de la información y pacientesEstudio observacional, longitudinal y descriptivo, con carácter mayoritariamente prospectivo realizado en el servicio de cirugía cardiovascular del Hospital Clínico Quirúrgico «Hermanos Ameijeiras», durante el periodo de marzo de 2012 a junio del 2016, en pacientes con diagnóstico de cardiopatía isquémica que fueron intervenidos con CRM. Inicialmente se tuvieron en consideración 483 pacientes revascularizados durante este el lapso de tiempo descrito, de los cuales se excluyeron 143 por la imposibilidad de realizar el seguimiento requerido debido a inasistencia a las consultas, la dificultad de localización telefónica o porque previo a la intervención quirúrgica manifestaran el deseo de no cooperar con el estudio. De los 340 restantes solo se mantuvieron 110 por contar con toda la información requerida completa particularmente cada una de las mediciones del flujo intraoperatorio de los injertos coronarios utilizando Doppler pulsado. No se tuvieron en consideración en ningún momento aquellos con cirugía combinada (cirugía coronaria y valvular, cirugía coronaria y vascular, cirugía coronaria y de reparación de defectos congénitos y cirugía coronaria y resección de aneurismas ventriculares o reparación de complicación mecánica en el infarto agudo de miocardio). La recolección de la información se realizó a partir de las historias clínicas presentes en el departamento de archivo y estadística del Hospital, además de la base datos del servicio de Cirugía Cardiovascular, así como del seguimiento en consulta externa y por vía telefónica.
Se evaluaron las variables: sexo, edad, índice de masa corporal, hábito de fumar, antecedentes patológicos familiares y personales, diagnóstico prequirúrgico, número de vasos afectados, puntaje SINTAX (Synergy between PCI with Taxus and Cardiac Surgery study), fracción de eyección del ventrículo izquierdo, clase funcional al ingreso, hemoglobina, colesterol, triglicéridos y creatinina, urgencia de la operación, apoyo circulatorio, tiempos operatorios, presencia de accidentes quirúrgicos, vasos revascularizados, variables flujométricas, calidad de la revascularización, tiempo de intubación y de estancia en la Unidad de Cuidados Intensivos (UCI) y morbilidad posoperatoria y eventos cardiacos mayores. Dentro de estos últimos se incluyó a la muerte, la angina, la necesidad de revascularización, el infarto agudo miocardio y el accidente cerebrovascular (grupo MACE). Para precisar el IMA perioperatorio se utilizaron los criterios de la cuarta definición universal del infarto.
FlujometríaPara la evaluación intraoperatoria con Doppler pulsado del flujo en los injertos realizados se utilizó el prototipo Fluxvisum. Se registró por paciente los datos correspondientes a las mediciones de cada una de los injertos coronarios realizados, definiendo: flujo medio (Qmed) como el volumen de sangre que fluye en el injerto en un minuto, expresado en mL/min, índice de pulsatibilidad (IP) como la relación entre la resta del flujo máximo y mínimo, dividido entre el flujo medio, indicada en un número entero sin unidades e índice diastólico (DFI) dado por la proporción de sangre que fluye a través del injerto durante la fase diastólica del ciclo cardiaco, expresado en porcentaje. Tanto off–pump como en on-pump las mediciones se realizaron posterior a la corrección de la anticoagulación con protamina manteniendo siempre una presión arterial sistólica mayor a 100 mmHg. Este último hecho se fundamenta en que valoraciones como el Qmed dependen en gran medida de la estabilidad hemodinámica por lo que hacerlo con presiones sistólicas inferiores puede subvalorar el índice.
Cuidados posoperatoriosLuego de pasadas seis horas, cada uno de los pacientes intervenidos recibió tratamiento antiagregante con 325 mg de ácido acetilsalicílico y en aquellos con intolerancia a este medicamento, se valoró el tratamiento antitrombótico con heparina de bajo peso molecular.
Técnicas de procesamiento y análisis estadísticoLa información obtenida se registró en una base de datos elaborada en la aplicación Microsoft Excel 2016 y fue procesada con el programa estadístico SPSS versión 20. Para resumir la información cualitativa se utilizó números absolutos y porcentajes, y en las cuantitativas, la media y la desviación estándar. Para evaluar la existencia de relación entre variables cualitativas fue usada la prueba χ2, cuando existió 25,0% o más de frecuencias esperadas menores que 5, se utilizó además la prueba exacta de Fisher. Para la comparación de medias en muestras independientes según variables cuantitativas se usó la prueba t de Student o la U de Mann-Whitney según se cumpliera o no el supuesto de normalidad, y cuando eran más de dos medias se usó el análisis de varianza de un factor (ANOVA) y el análisis post hoc con el test HSD de Tukey. Se calculó el riesgo relativo (RR) con un intervalo de confianza del 95%. Para determinar el valor pronóstico de la flujometría para la ocurrencia de eventos cardiacos mayores se utilizarán varios modelos de regresión logística multivariada con respuesta dicotómica. La variable dependiente fue cada uno de los eventos cardiacos mayores y las variables independientes: la flujometría y otras que influyeron en la ocurrencia de esos eventos o fueran variables confusoras, las cuales se determinaron según el análisis univariado, la literatura y la experiencia de los investigadores. Se estimó los odds ratio (OR) con sus respectivos intervalos de confianza. En todas las pruebas de hipótesis se fijó un nivel de significación de 0,05.
Consideraciones bioéticasPosterior a la discusión del protocolo ante el comité científico del Hospital Clínico-Quirúrgico «Hermanos Ameijeiras» y previa autorización del paciente, reflejado al llenar el consentimiento médico, se procedió a la recolección de la información necesaria para el estudio a través de las historias clínicas y durante el seguimiento periódico por consulta externa y llamadas telefónicas. Se guardó la confidencialidad de los datos y su uso fue estrictamente para los fines de la investigación, siendo custodiados por el investigador principal.
ResultadosCaracterísticas de la muestraSe estudiaron 110 pacientes preponderando el género masculino (74,5%), la edad media fue de 63,4 años, siendo el grupo etario de entre 60 y 80 el más numeroso (tabla 1). El seguimiento promedio fue por 713 días, durante este periodo fallecieron 14 pacientes para una mortalidad del 12,7%. La presencia de un síndrome coronario agudo sin elevación del segmento ST como motivo de ingreso (56,4%) caracterizó la muestra. El SINTAX promedio fue de 32,5 y la presencia de enfermedad de tres o más vasos estuvo presente en el 89,1% de los enfermos, siendo las arterias: descendente anterior (93.6%), coronaria derecha (86,4%), y circunfleja (78,2%) las más afectadas; 91enfermos (82,7%) se encontraban en clase funcional III-IV. Como antecedentes patológicos personales imperaron la HTA y el IMA previo (87,3% y 60,9%, respectivamente). En los estudios paraclínicos realizados no se observó predominancia de valores fuera de lo normal. El 95,5% de los casos fueron electivos, predominando la cirugía sin bomba (51,8%) y la revascularización completa (54,5%).
Características clínicas de los pacientes al ingreso y transoperatorio
| Variable | Global (n = 110) | |
|---|---|---|
| n o media (DS) | % | |
| Edad | 63,4 (8,8) | |
| Menor de 60 años | 28 | 25,5% |
| Entre 60 y 80 años | 82 | 74,5% |
| Mayores de 80 años | 0 | 0% |
| Sexo masculino | 82 | 74,5% |
| Sexo femenino | 28 | 25,5% |
| Índice de masa corporal (kg/m2) | 27,1 (3,7) | |
| IMC menor de 25 kg/m2 | 33 | 30% |
| IMC entre 25 y 29.9 kg/m2 | 52 | 47,3% |
| IMC Igual o mayor de 30 kg/m2 | 25 | 21,7% |
| Antecedentes patológicos personales | ||
| Infarto agudo de miocardio | 67 | 60,9% |
| Hipertensión arterial | 96 | 87,3% |
| Diabetes mellitus | 41 | 37,3% |
| Trastornos del ritmo | 13 | 11,8% |
| Enfermedad pulmonar obstructiva crónica | 18 | 16,4% |
| Arteriopatía periférica | 22 | 20% |
| Accidente vascular encefálico | 6 | 5,5% |
| Insuficiencia renal crónica | 9 | 8,2% |
| Cirugía cardiaca previa | 0 | 0% |
| Intervencionismo coronario percutáneo | 10 | 9,1% |
| Hábito de fumar | ||
| Fumador | 26 | 23,6% |
| Exfumador | 52 | 47,3% |
| No fumador | 32 | 29,1% |
| Clase funcional CCSa | ||
| I | 1 | 0,9% |
| II | 18 | 16,4% |
| III | 31 | 28,2% |
| IV | 60 | 54,5% |
| Diagnóstico | ||
| SCASESTb | 62 | 56,4% |
| SCACESTc | 6 | 5,5% |
| Angina estable crónica | 42 | 38,1% |
| FEVId(%) | 58,9 (10,9) | |
| Menor de 30% | 1 | 0,9% |
| Entre 30% y 50% | 26 | 20,9% |
| Mayor de 50% | 83 | 78,2% |
| Puntaje SINTAX | 32,5 (9,7) | |
| Menor de 23 | 15 | 13,6% |
| Entre 23 y 32 | 40 | 36,4% |
| Mayor de 32 | 55 | 50% |
| Vasos afectados | ||
| Tronco coronario izquierdo | 63 | 57,8% |
| Descendente anterior | 103 | 93,6% |
| Diagonales | 39 | 35,5% |
| Circunfleja | 86 | 78,2% |
| Obtusas | 42 | 38,2% |
| Coronaria derecha | 95 | 86,4% |
| IVP y posterolaterales | 19 | 17,3% |
| Otras | 8 | 7,3% |
| Número de vasos | 4,05 (1,2) | |
| Lesión de 1 vaso | 1 | 0,9% |
| Lesión de 2 vasos | 11 | 10% |
| Lesión de 3 vasos | 28 | 25,5% |
| Lesión de 4 o más vasos | 70 | 63.6% |
| Transoperatorio | ||
| Operación urgente | 5 | 4,5% |
| Operación electiva | 105 | 95,5% |
| Con circulación extracorpórea (CEC) | 51 | 46,4% |
| Sin circulación extracorpórea | 57 | 51,8% |
| Con apoyo circulatorio | 2 | 1,8% |
| Tiempo quirúrgico (horas) | 5,6 (1,1) | |
| Tiempo de CEC (min) | 121,7 (40,6) | |
| Tiempo de clampeo aórtico (min) | 78,6 (25,4) | |
| Anastomosis arteriales | 1,4 (0,7) | |
| Dos o más puentes arteriales | 37 | 33,6% |
| Anastomosis totales | 2,8 (0,7) | |
| Revascularización completa | 60 | 54,5% |
| Revascularización incompleta | 50 | 45,5% |
Se implantaron en total 316 injertos, 157 arteriales y 159 venosos, en promedio 2,8 por paciente. En 37 pacientes se emplearon dos o más injertos arteriales. La DA fue revascularizada en todos los casos, usándose la arteria mamaria izquierda (LIMA) como injerto en el 97,3% (tabla 2). Se utilizaron mayoritariamente hemoductos de vena safena magna en las demás arterias coronarias. Los valores flujométricos promedio fueron Qmed: 31,7 mL/min, IP: 3.2 y DFI: 70,2%, todos por encima de los valores de corte tradicionalmente descritos (Qmed igual o mayor a 20 mL/min, IP menor de 5 y DFI mayor a 60%).
Injertos vasculares y medición de flujos. Distribución arterial o venosa. Promedio de indicadores
| Variable | Injertos vasculares | Flujometría | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Total | Arterial | % | Venosoa | % | Qmede | IPf | DFIg | ||
| Descendente anterior | 110 | 107 (MIb) | 97,3 | 3 | 2,7 | 39,6 | 2,8 | 76 | |
| Diagonal | 37 | 9 (MDc) | 24,3 | 28 | 75,7 | 30 | 3,2 | 76,3 | |
| Obtusa | 81 | 22 | 16 (MD)6 (ARd) | 27,2 | 59 | 72,8 | 32,8 | 3,5 | 66,9 |
| Arteria intermedia | 10 | 4 (MD) | 40 | 6 | 60 | 23,4 | 3,3 | 72,1 | |
| Interventricular posterior | 48 | 9 | 4 (MD)5 (AR) | 18,8 | 39 | 81,2 | 26,5 | 4,2 | 61,4 |
| Coronaria derecha | 26 | 5 | 2 (MD)3 (AR) | 19,2 | 21 | 80,8 | 35,5 | 2,5 | 67,2 |
| Otros | 4 | 1 (MD) | 25 | 3 | 75 | 17,1 | 4,5 | 54,4 | |
| Total/promedio | 316 | 157 | 49,6 | 159 | 50,4 | 31,7 | 3,2 | 70,2 | |
Predominaron la isquemia aguda perioperatoria (IAP) y las infecciones (23,6% y 20%, respectivamente). No hubo grandes diferencias en cuanto a los valores de flujo medio, IP y DFI entre los que padecieron alguna comorbilidad posoperatoria y los que no. En los enfermos que sufrieron de IAP destaca el predominio de valores de Qmed menores de 30 mL/min e IP mayores a 3, sin grandes cambios en el DFI. Las arritmias malignas se asociaron con alteraciones en la arteria interventricular posterior (IVP): Qmed bajo (13,7 mL/min, p = 323), IP alto (8,9 p = 0,007) y DFI bajo (31,1%, p = 0,018). La fibrilación auricular se asoció con alteraciones en las obtusas marginales que, aunque numéricamente fueron más evidentes en el Qmed (5,7 mL/min), no tuvieron significación estadística. Los enfermos que durante su posoperatorio aquejaron hipertensión severa tuvieron de manera general peores indicadores.
Eventos cardiovasculares mayoresSe constataron eventos cardiovasculares mayores en 49 pacientes, con recurrencia en un 10% de ellos. Predominaron el IMA (22,7%) en particular el no mortal, y la angina (17,3%). La mortalidad se presentó en promedio a los 192 días, no obstante, el 57,1% se produjo en los primeros 30 días. De forma general las mediciones obtenidas en los injertos en los pacientes que sufrieron algún tipo de evento cardiaco mayor difieren respecto a los que no, siendo este hecho más evidente en la DA tanto para el grupo MACE (Qmed: 34,1 mL/min vs. 44,2 mL/min [p = 0,024], IP: 3,3 vs. 2,4 [p = 0,013], y DFI:73 vs. 78,6 [p = 0,089]), y en la mortalidad general (Qmed: 25,6 mL/min vs. 41,7 mL/min [p = 0,014], IP: 3,3 vs. 2,8 [p = 0280], y DFI: 71,6 vs. 76,8 [p = 0,302]), como en la necesidad de revascularización (Qmed: 12,2 mL/min vs. 39,9 mL/min [p = 0,238], IP: 1,1 vs. 2,8 [p = 0,342], DFI: 68,1 vs. 76,1 [p = 0,645]); y el IMA (Qmed: 29,5 mL/min vs. 42,6 mL/min [p = 0,012], IP: 3,6 vs. 2,6 [p = 0,019], y DFI: 73,9 vs. 76,7 [p = 0,477]). El valor promedio de las mediciones realizadas solo fue relevante en el IMA asociándose el Qmed a una p = 0,003.
Mortalidad por periodosAl dividir la mortalidad general en sus diferentes periodos, se puede evidenciar como los decesos ocurridos en los primeros 30 días (inmediata y mediata) se asociaron a un flujo medio menor en DA (22,6 mL/min) e IVP (2,1 mL/min). En la mortalidad tardía, aquellos que fallecieron pasado un año tuvieron flujos mucho menores en todas las arterias. No existió significación estadística en ninguna de las variables ante el estudio de la varianza por medio del factor ANOVA inter o intragrupos ni en el análisis post hoc con el test HSD de Tukey.
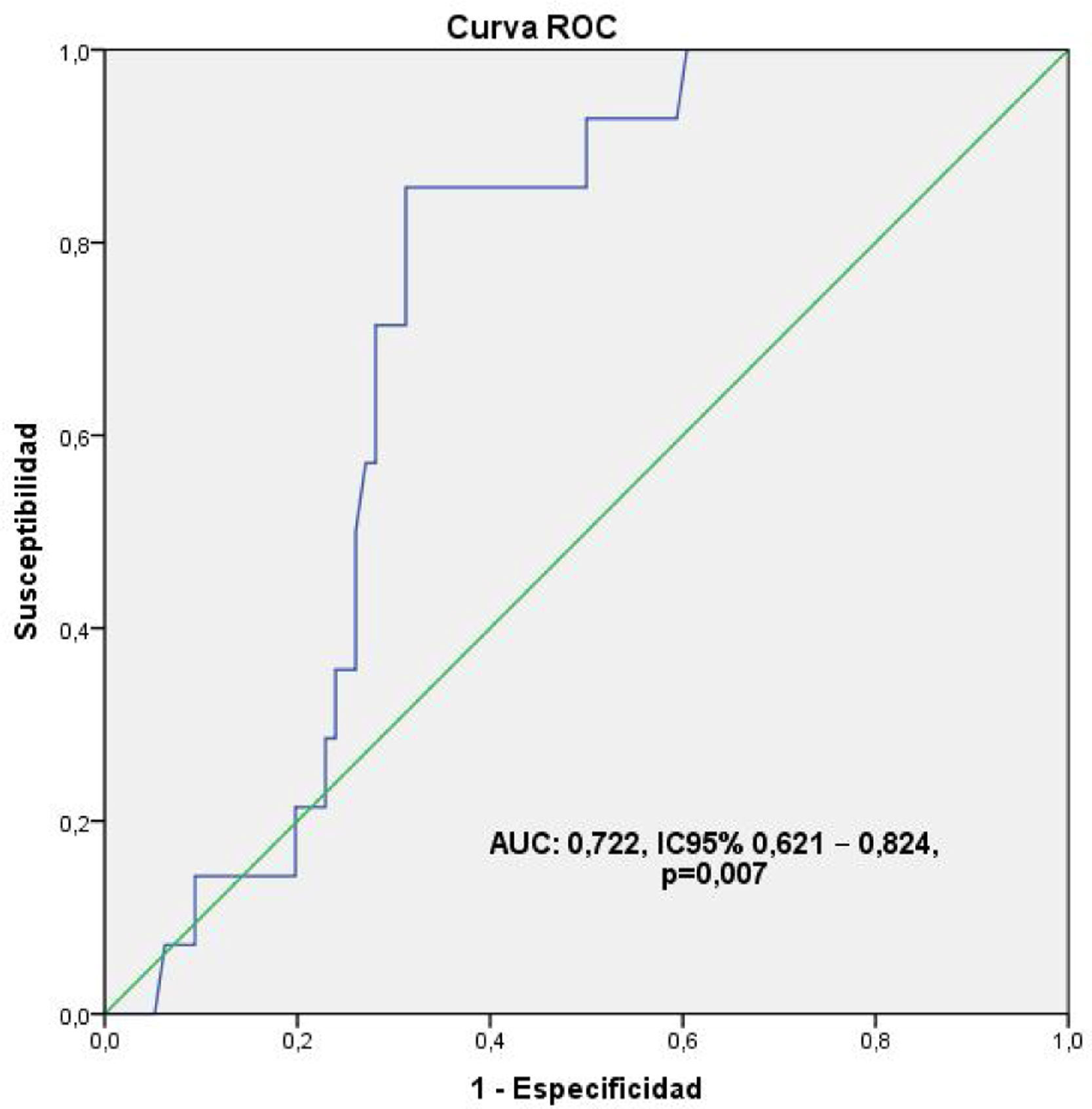
Valoración de calidad de la revascularizaciónDefinición de puntos de corteUsando los estándares referidos en la literatura (Qmed mayor o igual a 20 mL/min, IP menor a 5, con un DFI mayor de 50%), los cuales llamaremos «clásicos» de ahora en adelante, las mediciones realizadas se clasificaron en dos grupos: bueno y malo, encontrándose, de forma general, una pobre relación estadística con la presencia de eventos cardiacos mayores y comorbilidades usando el χ2, incluso en las mediciones de la arteria DA en donde solo destaca MACE (p = 0,030; RR:1,758; IC 95%:1,167–2,650), aun a pesar de los hallazgos descritos previamente. Ante esta contradicción, se decidió, tomando como referencia un punto en la dispersión de coordenadas de la sensibilidad mayor de 0,700 en un área bajo la curva (AUC) ROC, definir unos nuevos puntos de corte. Se seleccionaron para tal fin, por un lado, las valoraciones flujométricas de la descendente anterior por el hecho de que esta arteria fue revascularizada en la totalidad de los pacientes, además de ser el aspecto técnico decisor frente a la conducta de revascularización en la enfermedad arterial coronaria multivaso, y por el otro lado, la mortalidad al ser el evento más definitivo de todos lográndose un AUC para el Qmed:0,722, IC 95%0,621-0,824, p = 0,007 reflejado en la figura 1, y los valores: Qmed ≥ 30 mL/min, IP < 3, y un DFI > 60% los cuales se decidió identificar como «corregidos». Se evidenció además que los valores usados inicialmente no sobrepasaban el punto correspondiente al 0,300.
Significación estadística por χ2 y estimación de riesgo relativo, usando valores «corregidos»Basados en los nuevos puntos de corte, se obtuvo significación estadística en la DA no solo en la variable MACE (p = 0,041, RR: 1,505; IC 95%:0,997-2,270) como ya había sido descrito con los valores «clásicos», sino además en la recurrencia (p = 0,044, RR: 3,370; IC 95%:0,920–12, 342), la mortalidad (p = 0,002; RR: 5,296; IC 95: 1,566–17,916), y el IMA (p = 0,000; RR: 4,574; IC 95%: 1,984–10,574); en este último aspecto destaca también la IVP (p = 0,024, RR: 6,032; IC 95%: 0,850–42,816), quien registra el mayor RR patentado; así como el promedio de las mediciones (p = 0,014; RR: 2,639; IC 95%: 1,142–6,098). La morbilidad posoperatoria no tuvo grandes diferencias entre los distintos valores de corte propuestos, destacando solamente la isquemia aguda perioperatoria en relación con la DA (valores «clásicos»: p = 0,032; RR: 2,526; IC 95%:1,305–4,891, «corregidos»: p = 0,026; RR: 2,311; IC 95%: 1,156–4,620).
Regresión logísticaFundamentado en los resultados expuestos, se puede definir que la variable flujométrica con mayor asociación estadística ante la ocurrencia de eventos cardiacos mayores en los pacientes llevados a cirugía de revascularización miocárdica es la valoración de la calidad de la revascularización de la arteria descendente anterior basada en los valores «corregidos». Para determinar su valor pronóstico real fueron usados varios modelos de regresión logística binaria. La variable dependiente fue cada uno de los eventos cardiacos mayores y las morbilidades posoperatorias y dentro de las independientes, además de la valoración de la calidad de la revascularización de la DA, se incluyeron las variables que basados en la significación estadística tuvieron una mayor correlación con los diferentes MACE y con la morbilidad posoperatoria, así como aquellas que históricamente han sido consideradas más influentes, dividiéndolas en dos grupos: 1) preoperatorios: el diagnóstico clínico que motivó la intervención, el índice de masa corporal, el antecedente personal de diabetes mellitus e hipertensión arterial, y la FEVI preoperatoria, y 2) transoperatorios: la urgencia de la intervención, el tipo de revascularización, el apoyo circulatorio utilizado. La calidad de la revascularización de la DA se mantuvo como el principal factor predictor de eventos con directa relación con la isquemia miocárdica aguda como la muerte ([tabla 3] p = 0,004, OR: 13,947; IC 95%: 2,311–84,163), el IMA ([tabla 4] p = 0,000; OR: 11,331; IC 95%: 2,995–42,867) y la isquemia aguda perioperatoria ([tabla 5] p = 0,049; OR: 2,864; IC 95%: 0,997–8,222). Destacó además en el grupo MACE y en las infecciones (tabla 6) en donde a pesar tener una asociación significativa (p = 0,050; OR: 2,599; IC 95%: 0,972–6,947 y p = 0,035; OR: 3,713; IC 95%: 1,099–12,538, respectivamente) hubo variables con una p más cercana a 0 y un OR mayor.
Regresión logística. Muerte, MACE y recurrencia
| n = 110 | Muerte | MACE1 | Recurrencia | ||||||
|---|---|---|---|---|---|---|---|---|---|
| P | OR | IC 95% | p | OR | IC 95% | p | OR | IC 95% | |
| PREOPERATORIO | |||||||||
| Diagnóstico | |||||||||
| Angina de esfuerzo estable crónicaa | 0,857 | 0,502 | 0,139 | ||||||
| SCACEST2 | 0,590 | 2.087 | 0,144 – 30.220 | 0,312 | 3.272 | 0,328 – 32.603 | 0,062 | 28.339 | 0,850 – 944.397 |
| SCASEST3 | 0,983 | 1.018 | 0,201 – 5.142 | 0,402 | 1.579 | 0,542 – 4.598 | 0,119 | 7.331 | 0,598 – 89.833 |
| Antecedentes patológicos personales | |||||||||
| Hipertensión arterial | 0,807 | 0,702 | 0,041 – 11.915 | 0,075 | 4.597 | 0,858 – 24.634 | 0,234 | 8.409 | 0,253 – 279.776 |
| Diabetes mellitus | 0,018 | 11.663 | 1.513 – 89.915 | 0,029 | 3.257 | 1.132 – 9.373 | 0,921 | 0,911 | 0,144 – 5.745 |
| FEVI4 < 50% | 0,025 | 6.510 | 1.272 – 33.324 | 0,638 | 0,761 | 0,244 – 2.376 | 0,943 | 0,936 | 0,152 – 5.756 |
| Índice de masa corporal | |||||||||
| Normopesoa | 0,370 | 0,001 | 0,059 | ||||||
| Sobrepeso | 0,175 | 0,265 | 0,039 – 1.082 | 0,000 | 0,087 | 0,024 – 0,313 | 0,017 | 0,080 | 0,010 – 0,641 |
| Obeso | 0,654 | 0,640 | 0,091 – 4.509 | 0,011 | 0,138 | 0,030 – 0,629 | 0,514 | 0,448 | 0,040 – 5.017 |
| TRANSOPERATORIO | |||||||||
| Operación urgente | 0,581 | 2.333 | 0,115 – 47.202 | 0,081 | 9.845 | 0,753 – 128.701 | 0,317 | 5.054 | 0,211 – 120.862 |
| Mala calidad de revascularización de DA5 | 0,004 | 13.947 | 2.311 – 84.163 | 0,050 | 2.599 | 0,972 – 6.947 | 0,074 | 4.364 | 0,867 – 21.961 |
| Revascularización incompleta | 0,148 | 3.062 | 0,672 – 13.954 | 0,120 | 2.187 | 0,816 – 5.860 | 0,183 | 0,296 | 0,050 – 1.773 |
| Soporte cardiovascular | |||||||||
| On pumpa | 0,960 | 0,029 | 0,415 | ||||||
| Off pump | 0,776 | 0,789 | 0,155 – 4.030 | 0,008 | 3.787 | 1.422 – 10.082 | 0,185 | 3.449 | 0,553 – 21.500 |
| Cirugía con apoyo | 0,999 | 0,000 | 0,000 | 0,999 | 0,000 | 0,000 | 0,999 | 0,000 | 0,000 |
Variable de referencia.
1 Variable conjunta de eventos cardiovasculares mayores (muerte, necesidad de nueva revascularización del vaso diana, angina, infarto agudo de miocardio, insuficiencia cardiaca y enfermedad cerebrovascular); 2 síndrome coronario agudo con elevación del ST; 3 síndrome coronario agudo sin elevación del ST; 4 fracción de eyección del ventrículo izquierdo; 5 arteria descendente anterior.
Fuente: historias clínicas.
Regresión logística. Eventos cardiacos mayores con excepción de la mortalidad y la necesidad de revascularización
| n = 110 | Infarto agudo de miocardio | Angina | Insuficiencia cardiaca | Accidente vascular encefálico | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| p | OR | IC 95% | p | OR | IC 95% | P | OR | IC 95% | p | OR | IC 95% | |
| PREOPERATORIO | ||||||||||||
| Diagnóstico | ||||||||||||
| Angina de esfuerzo estable crónicaa | 0,168 | 0,428 | 0,260 | 0,163 | ||||||||
| SCACEST1 | 0,160 | 6.189 | 0,486 – 78.838 | 0,593 | 2.109 | 0,136 – 32.646 | 0,213 | 8.283 | 0,298 – 230.254 | 0,058 | 36.161 | 0,881 – 1.483.472 |
| SCASEST2 | 0,385 | 0,562 | 0,153 – 2.065 | 0,193 | 2.609 | 0,615 – 11.064 | 0,108 | 7.884 | 0,635 – 97.909 | 0,501 | 2.371 | 0,192 – 29.231 |
| Antecedentes patológicos | ||||||||||||
| Hipertensión arterial | 0,998 | 0,000 | 0,000 | 0,884 | 1.154 | 0,167 – 7.995 | 0,170 | 0,178 | 0,015 – 2.091 | 0,999 | 0,000 | 0,000 |
| Diabetes mellitus | 0,795 | 1.193 | 0,315 – 4.527 | 0,066 | 3.440 | 0,924 – 12.812 | 0,185 | 2.950 | 0,597 – 14.578 | 0,689 | 1.532 | 0,190 – 12.383 |
| FEVI3 < 50% | 0,228 | 0,371 | 0,074 – 1.858 | 0,929 | 1.064 | 0,271 – 4.179 | 0,294 | 2.252 | 0,494 – 10.270 | 0,327 | 0,278 | 0,022 – 3.600 |
| Índice de masa corporal | ||||||||||||
| Normopesoa | 0,019 | 0,024 | 0,702 | 0,077 | ||||||||
| Sobrepeso | 0,005 | 0,093 | 0,018 – 0,488 | 0,006 | 0,123 | 0,027 – 0,552 | 0,759 | 0,761 | 0,133 – 4.362 | 0,034 | 0,053 | 0,003 – 0,800 |
| Obeso | 0,077 | 0,202 | 0,034 – 1.189 | 0,200 | 0,308 | 0,051 – 1.865 | 0,404 | 0,320 | 0,022 – 4.648 | 0,121 | 0,088 | 0,004 – 1.908 |
| TRANSOPERATORIO | ||||||||||||
| Operación urgente | 0,009 | 58.101 | 2.783 – 1.213.170 | 0,429 | 3.060 | 0,191 – 49.035 | 0,887 | 1.210 | 0,087 – 16.828 | 0,999 | 0,000 | 0,000 |
| Mala calidad de revascularización de DA4 | 0,000 | 11.331 | 2.995 – 42.867 | 0,071 | 0,299 | 0,080 – 1.110 | 0,430 | 1.830 | 0,407 – 8.219 | 0,538 | 1.834 | 0,266 – 12.668 |
| Revascularización incompleta | 0,965 | 1.027 | 0,313 – 3.367 | 0,513 | 0,647 | 0,176 – 2.381 | 0,658 | 1.423 | 0,299 – 6.775 | 0,676 | 1.524 | 0,211 – 11.012 |
| Soporte cardiovascular | ||||||||||||
| On pumpa | 0,210 | 0,083 | 0,938 | 1.000 | ||||||||
| Off pump | 0,077 | 3.135 | 0,883 – 11.229 | 0,026 | 4.516 | 1.201 – 16.970 | 0,721 | 1.337 | 0,272 – 6.582 | 0,990 | 0,987 | 0,136 – 7.169 |
| Cirugía con apoyo | 0,998 | 0,000 | 0,000 | 0,999 | 0,000 | 0,000 | 0,999 | 0,000 | 0,000 | 0,999 | 0,000 | 0,000 |
Regresión logística. Morbilidad posoperatoria renal y cardiovascular (con excepción de la FA)
| n = 110 | Bajo gasto cardiaco | Isquemia aguda perioperatoria | Arritmias malignas | Hipertensión arterial posoperatoria | Insuficiencia renal | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| p | OR | IC 95% | p | OR | IC 95% | p | OR | IC 95% | p | OR | IC 95% | p | OR | IC 95% | |
| PREOPERATORIO | |||||||||||||||
| Diagnóstico | |||||||||||||||
| Angina de esfuerzo estable crónicaa | 0,247 | 0,810 | 0,322 | 0,986 | 0,987 | ||||||||||
| SCACEST1 | 0,154 | 4.844 | 0,553 – 42.438 | 0,581 | 1.829 | 0,214 – 15.638 | 0,373 | 4.129 | 0,183 – 93.257 | 0,931 | 1.119 | 0,089 – 14.139 | 0,915 | 0,864 | 0,060 – 12.406 |
| SCASEST2 | 0,727 | 0,799 | 0,226 – 2.823 | 0,849 | 0,894 | 0,280 – 2.848 | 0,669 | 0,557 | 0,038 – 8.194 | 0,903 | 0,919 | 0,240 – 3.527 | 0,937 | 1.054 | 0,288 – 3.853 |
| Antecedentes patológicos | |||||||||||||||
| Hipertensión arterial | 0,221 | 4.391 | 0,411 – 46.932 | 0,793 | 1.276 | 0,207 – 7.880 | 0,999 | 0,000 | 0,000 | 0,219 | 0,328 | 0,056 – 1.938 | 0,999 | 0,000 | 0,000 |
| Diabetes mellitus | 0,635 | 0,742 | 0,216 – 2.545 | 0,881 | 1.096 | 0,333 – 3.606 | 0,173 | 7.903 | 0,404 – 154.543 | 0,787 | 1.207 | 0,308 – 4.721 | 0,715 | 1.254 | 0,373 – 4.218 |
| FEVI3 < 50% | 0,651 | 1.335 | 0,382 – 4.669 | 0,750 | 1.220 | 0,359 – 4.143 | 0,686 | 0,583 | 0,043 – 7.982 | 0,398 | 0,480 | 0,087 – 2.634 | 0,116 | 2.688 | 0,784 – 9.219 |
| Índice de masa corporal | |||||||||||||||
| Normopesoa | 0,928 | 0,802 | 0,823 | 0,860 | 0,207 | ||||||||||
| Sobrepeso | 0,704 | 0,773 | 0,204 – 2.924 | 0,980 | 1.017 | 0,268 – 3.858 | 0,999 | 0,000 | 0,000 | 0,584 | 1.552 | 0,322 – 7.485 | 0,084 | 0,294 | 0,073 – 1.178 |
| Obeso | 0,792 | 0,801 | 0,154 – 4.172 | 0,586 | 1.531 | 0,331 – 7.085 | 0,999 | 0,000 | 0,000 | 0,713 | 1.406 | 0,229 – 8.641 | 0,683 | 0,729 | 0,160 – 3.323 |
| TRANSOPERATORIO | |||||||||||||||
| Operación urgente | 0,050 | 9.487 | 1.004 – 89.610 | 0,999 | 0,000 | 0,000 | 0,098 | 32.853 | 0,524 – 2.058.308 | 0,999 | 0,000 | 0,000 | 0,652 | 1.814 | 0.136 – 24.197 |
| Mala calidad de revascularización de DA4 | 0,961 | 1.028 | 0,335 – 3.157 | 0,049 | 2.864 | 0,997 – 8.222 | 0,709 | 1.541 | 0,159 – 14.981 | 0,155 | 2.520 | 0,705 – 9.008 | 0,371 | 0,575 | 0,172 – 1.929 |
| Revascularización incompleta | 0,475 | 1.513 | 0,485 – 4.718 | 0,182 | 2.065 | 0,713 – 5.985 | 0,267 | 4.457 | 0,319 – 62.337 | 0,143 | 2.549 | 0,729 – 8.908 | 0,117 | 2.613 | 0,788 – 8.670 |
| Soporte cardiovascular | |||||||||||||||
| On pumpa | 0,371 | 0,570 | 0,422 | 0,910 | 0,211 | ||||||||||
| Off pump | 0,666 | 1.284 | 0,413 – 3.991 | 0,289 | 1.811 | 0,605 – 5.423 | 0,189 | 10.939 | 0,307 – 389.249 | 0,665 | 0,759 | 0,219 – 2.634 | 0,193 | 0,445 | 0,132 – 1.504 |
| Cirugía con apoyo | 0,163 | 8.812 | 0,415 – 187.057 | 0,999 | 0,000 | 0,000 | 1.000 | 0,000 | 0,000 | 0,999 | 0,000 | 0,000 | 0,281 | 5.780 | 0,238 – 140.504 |
Regresión logística. Morbilidad posoperatoria: insuficiencia pulmonar, infecciones, trastornos hematológicos, sangrado anormal y otras
| n=110 | Insuficiencia pulmonar | Infecciones | Trastornos hematológicos | Sangrado anormal | Gastrointestinales | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| p | OR | IC 95% | p | OR | IC 95% | p | OR | IC 95% | p | OR | IC de 95% | p | OR | IC 95% | |
| PREOPERATORIO | |||||||||||||||
| Diagnóstico | |||||||||||||||
| Angina de esfuerzo estable crónicaa | 0,964 | 0,022 | 0,309 | 0,940 | 0,264 | ||||||||||
| SCACEST1 | 0,801 | 0,700 | 0,044 – 11.146 | 0,912 | 1.167 | 0,077 – 17.778 | 0,128 | 18.757 | 0,429 – 820.935 | 0,726 | 1.774 | 0,072 – 43.607 | 0,770 | 2.648 | 0,004 – 1.823.667 |
| SCASEST2 | 0,851 | 0,878 | 0,226 – 3.412 | 0,006 | 7.836 | 1.796 – 34.182 | 0,552 | 1.788 | 0,263 – 12.144 | 0,873 | 1.190 | 0,140 – 10.098 | 0,299 | 0,023 | 0,000 – 28.082 |
| Antecedentes patológicos | |||||||||||||||
| Hipertensión arterial | 0,998 | 0,000 | 0,000 | 0,505 | 0,502 | 0,066 – 3.810 | 0,160 | 0,221 | 0,027 – 1.815 | 0,201 | 0,198 | 0,016 – 2.373 | 0,999 | 0,000 | 0,000 |
| Diabetes mellitus | 0,642 | 0,731 | 0,195 – 2.735 | 0,901 | 0,926 | 0,280 – 3.070 | 0,249 | 0,227 | 0,018 – 2.826 | 0,279 | 2,780 | 0,437 – 17.688 | 0,600 | 4.856 | 0,013 – 1.791.111 |
| FEVI3< 50% | 0,760 | 1.233 | 0,322 – 4.729 | 0,186 | 0,345 | 0,071 – 1.674 | 0,734 | 1.386 | 0,211 – 9.113 | 0,928 | 0,887 | 0,065 – 12.088 | 0,176 | 21.219 | 0,254 – 1.773.111 |
| Índice de masa corporal | |||||||||||||||
| Normopesoa | 0,933 | 0,030 | 0,502 | 0,249 | 0,883 | ||||||||||
| Sobrepeso | 0,756 | 0,788 | 0,174 – 3.560 | 0,383 | 1.936 | 0,439 – 8.547 | 0,612 | 0,628 | 0,104 – 3.784 | 0,145 | 0,190 | 0,020 – 1.774 | 0,618 | 0,338 | 0,005 – 24.108 |
| Obeso | 0,736 | 0,732 | 0,119 – 4.488 | 0,013 | 10.118 | 1.624 – 63.047 | 0,246 | 0,127 | 0,004 – 4.133 | 0,167 | 0,123 | 0,006 – 2.397 | 0,999 | 0,000 | 0,000 |
| TRANSOPERATORIO | |||||||||||||||
| Operación urgente | 0,146 | 5.877 | 0,541 – 63.871 | 0,999 | 0,000 | 0,000 | 0,999 | 0,000 | 0.,000 | 0,224 | 6.661 | 0,314 – 141.539 | 0,214 | 111.762 | 0,066 - … |
| Mala calidad de revascularización de DA4 | 0,378 | 1.714 | 0,517 – 5.683 | 0,035 | 3.713 | 1.099 – 12.538 | 0,977 | 1.025 | 0,182 – 5.773 | 0,185 | 0,188 | 0,016 – 2.230 | 0,498 | 0,242 | 0,004 – 14.635 |
| Revascularización incompleta | 0,065 | 3.337 | 0,928 – 11.994 | 0,072 | 2.814 | 0,912 – 8,685 | 0,645 | 1.519 | 0,256 – 9.001 | 0,085 | 8.756 | 0,743 – 102.126 | 0,456 | 0,180 | 0,002 – 16.309 |
| Soporte cardiovascular | |||||||||||||||
| On pumpa | 0,741 | 0,103 | 0,474 | 0,177 | 0,755 | ||||||||||
| Off pump | 0,439 | 1.647 | 0,465 – 5.834 | 0,334 | 0,568 | 0,180 – 1.789 | 0,222 | 0,332 | 0,057 – 1.945 | 0,372 | 0,389 | 0,049 – 3.089 | 0,454 | 4.312 | 0,094 – 197.406 |
| Cirugía con apoyo | 0,999 | 0,000 | 0,000 | 0,073 | 19.728 | 0,760 – 512.267 | 0,999 | 0,000 | 0,000 | 0,118 | 28.143 | 0,427 – 1.855.647 | 1,000 | 0,000 | 0,000 |
La muestra evaluada presentó peores indicadores clínicos que los descritos en publicaciones nacionales25,26 e internacionales13,27,28 sobre CRM, existiendo una proporción mayor de pacientes con diagnóstico de síndrome coronario agudo, así como una prevalencia más alta de IMA, diabetes mellitus, hipertensión arterial, enfermedad arterial periférica y lesión de 3 o más vasos, todas indicadoras de un gran daño en el árbol coronario preoperatorio, por lo que comparativamente tiene una relación más estrecha con las series de alto riesgo en donde la mortalidad general y los MACE son muchos más frecuentes29-32. En cuanto a las variables transoperatorias hubo un predominio de la cirugía electiva y tiempos quirúrgicos que tuvieron un comportamiento similar a lo publicado en la literatura internacional consultada33–36. La revascularización off –pump predominó como técnica de elección en más de la mitad de los enfermos, con una alta proporción de pacientes con revascularización incompleta. Esta asociación se ha descrito por autores como Afilalo et al.37 quienes evidenciaron un menor número de arterias coronarias intervenidas en aquellos que eran operados sin bomba. El promedio de injertos realizados es similar al rango en que oscilan los diferentes estudios revisados27,33,38, resaltando que, aunque a largo plazo la mortalidad es similar (12,7%), hubo una marcada prevalencia de angina (17,3%) e IMA no mortal (14,5%)39–42.
Flujometría transoperatoria con Doppler pulsadoLas cifras promedio obtenidas con Doppler pulsado se asemejaron a las descritas por otros grupos43–45, siendo necesario aclarar que ellos usaron un método diferente: la flujometría por tiempo de tránsito (TTFM), lo que permite inferir que al ser valoraciones funcionales las mediciones son comparables e incluso equiparables. La importancia de la DA como factor pronóstico ha sido descrita históricamente. En las valoraciones realizadas esta arteria fue la única con relación estadística con eventos conexos con isquemia miocárdica, tanto en la comorbilidad posoperatoria (IAP) como en los eventos cardiovasculares mayores (MACE, IMA y muerte), con especial relevancia en los valores de flujo medio e IP, haciéndose evidente que los injertos de pacientes que tuvieron algún evento cardiovascular mayor registraron las peores cifras. El DFI individualmente no se relacionó con ningún evento. Jaramillo et al.13 consideran que un flujo medio mayor de 27 mL/min, es suficiente para calificar las anastomosis como adecuadas sin necesidad de tener presente las demás variables, y aunque este hecho pudiera estar en relación con lo evidenciado en la muestra de estudio, autores como Jokinen et al.46 sustentan que valores en el IP por encima de 3 predicen con más probabilidad fallos en el injerto en los primeros seis meses de la revascularización que el Qmed y el DFI, por lo que la interpretación de los valores obtenidos durante de la flujometría debe hacerse como un todo, al no tener ninguno por sí solo el peso suficiente como predictor fidedigno de la permeabilidad del conducto.
Di Giammarco et al.47 hace referencia a la disyuntiva existente a la hora de definir unos puntos de corte universales, argumento muy usado por los detractores de la evaluación intraoperatoria con métodos funcionales como la TTFM, quienes afirman que este hecho impide la fácil interpretación de los resultados lo que provoca amplias variaciones en los valores predictivos positivos y negativos calculados al comparar la flujometría con la angiografía convencional, algo que se evidenció en estudio al usar los puntos de corte «clásicos» y obtener una pobre correlación estadística con los eventos estudiados, por lo que se ha llevado a plantear que la mezcla entre un método funcional y otro anatómico, como el ultrasonido epicárdico de alta definición, podría vencer este obstáculo al permitir una mejor discriminación de las posibles causas de un flujo inadecuado.
Es de especial interés que los diferentes estudios realizados sobre el tema, se enfocan principalmente en la relación entre los valores funcionales intraoperatorios y la permeabilidad de la anastomosis evaluada por medios anatómicos como la angiografía intra y/o posoperatoria, dejando atrás la relación entre la calidad del hemoducto y la evolución clínica del paciente a mediano y largo plazo, siendo necesaria la exploración de este campo para poder concluir si lo valores «clásicos» al mismo tiempo de ser capaces de predecir el fallo precoz también pueden prever la respuesta de los injertos en la calidad de vida de los pacientes o, si por otro lado, es necesario realizar una «calibración» al ser este aspecto clave a la hora comparar los resultados de la CRM contra el intervencionismo coronario percutáneo (ICP).
La calidad de la revascularización de la DA usando los valores «corregidos» tuvo la mayor asociación estadística con la aparición de eventos relacionados con isquemia miocárdica aguda, muerte, IMA e IAP, hecho ratificado a su vez por las regresiones logísticas realizadas, revalidando que en presencia de lesión proximal de la DA la cirugía es considerada apropiada4,5.
ConclusiónLa valoración intraoperatoria de injertos con Doppler pulsado durante la CRM demostró tener un alto poder pronóstico como predictor de comorbilidad posoperatoria y eventos cardiacos mayores relacionados con isquemia miocárdica, es además un método sencillo y reproducible, veraz, inocuo y a un costo aceptable por lo que se puede reconocer como una alternativa que debe ser tomada en consideración y sacada de aquel «baúl de los recuerdos» al que ha sido condenada desde hace ya varios años.
FinanciaciónLos costos económicos fueron asumidos por los investigadores no existiendo en consonancia ningún conflicto de intereses.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a P. Acevedo Contla, M. Fuentes Cruz, A. J. Duran por su ayuda en la preparación del documento.