Para asegurar unos buenos resultados en cirugía coronaria es fundamental, además de una adecuada técnica quirúrgica, un cuidadoso manejo perioperatorio.
De esta manera, se deben optimizar todos los factores relacionados con la intervención, desde el inicio del proceso a la hora de la selección de los pacientes candidatos a revascularización miocárdica hasta el tratamiento farmacológico y las recomendaciones pautadas al alta hospitalaria. Son muchos los factores sobre los que podemos influir para mejorar resultados quirúrgicos, tanto a corto como a largo plazo.
En este artículo nos centraremos en algunos de ellos, como la estimación del riesgo preoperatorio teniendo en cuenta el concepto de fragilidad, el precondicionamiento isquémico, la transfusión de concentrados de hematíes, el manejo inicial en la Unidad de Cuidados Intensivos y una pequeña aproximación a las vías de corta estancia.
An exquisite perioperative management, besides an adequate surgical technique, is mandatory to obtain good outcomes in coronary artery bypass grafting surgery (CABG).
So, all the steps related to the surgical procedure should be optimized, from the beginning of the process, when surgical candidates are selected for CABG, to the recommendations and medications prescribed at Hospital discharge. There are several steps that can be modified to improve the early and late surgical results.
In this review we will deal with some of this factors, such as preoperative risk estimation taking into account the frailty of the patient, ischemic preconditioning, blood transfusions, intensive care unit management and fast track protocols.
Existen muchos factores perioperatorios cuya optimización es fundamental para conseguir los excelentes resultados que son requeridos a la cirugía de revascularización coronaria.
Para empezar, a la hora de la selección de los pacientes, además de apoyarnos en las escalas clásicas de estimación del riesgo quirúrgico como el EuroSCORE, y otras escalas que tratan de cuantificar la complejidad anatómica de las lesiones coronarias, como el SYNTAX score, también deberíamos tener en cuenta otros conceptos menos extendidos, como la fragilidad, la capacidad funcional y la calidad de vida preoperatoria.
En el preoperatorio, debemos optimizar los factores que puedan influir en la evolución. Por ejemplo, desde el punto de vista farmacológico, se ha estudiado el beneficio del tratamiento preoperatorio con betabloqueantes o fármacos como la amiodarona para la profilaxis de la fibrilación auricular postoperatoria. Otras intervenciones preoperatorias que se pueden tener en cuenta son la optimización del nivel de hemoglobina mediante el tratamiento con hierro o transfusiones sanguíneas y otro tipo de maniobras como el precondicionamiento isquémico remoto (PIR).
Durante la intervención y en el postoperatorio inmediato, uno de los puntos a tener en cuenta son el umbral transfusional de concentrados de hematíes y el beneficio del uso del recuperador o «cell saber» intraoperatorio. Además, es fundamental un adecuado manejo en la Unidad de Cuidados Intensivos (UCI), con un cuidadoso control de la monitorización y de los fármacos vasoactivos.
De cara al alta hospitalaria, el tratamiento farmacológico pautado, las recomendaciones dietéticas y un estilo de vida adecuado desempeñarán un papel fundamental en los resultados a medio y largo plazo.
Por otro lado, aunque todavía su aplicación en la práctica diaria no está muy extendida, en los últimos años se han puesto en marcha vías de corta estancia que buscan disminuir las complicaciones y los costes de la intervención a través una reducción de la estancia hospitalaria.
En este artículo nos centraremos en algunos de estos aspectos, como son la estimación del riesgo preoperatorio teniendo en cuenta el concepto de fragilidad, el precondicionamiento isquémico, la transfusión de concentrados de hematíes, el manejo inicial en la UCI y una pequeña aproximación a las vías de corta estancia.
Estimación del riesgo quirúrgico. EuroSCORE. FragilidadLa utilidad de la estimación preoperatoria del riesgo quirúrgico resulta evidente durante el proceso de decisión terapéutica y para ofrecer una información lo más completa posible al paciente y familiares. Objetivar este riesgo matemáticamente, es decir, ofreciendo un porcentaje aproximado de éxito o fracaso también tiene utilidad desde otros puntos de vista:
- –
Es útil como herramienta de monitorización y comparación de la calidad, pudiendo analizar los resultados de cualquier institución de forma estandarizada (mortalidad observada versus mortalidad esperada).
- –
Puede utilizarse como medidor objetivo de la complejidad de la población que atendemos.
En este sentido, las escalas de estimación del riesgo preoperatorio, como el EuroSCORE o el STS score, buscan hacer un cálculo objetivo del riesgo quirúrgico y son útiles desde la perspectiva de los puntos anteriores.
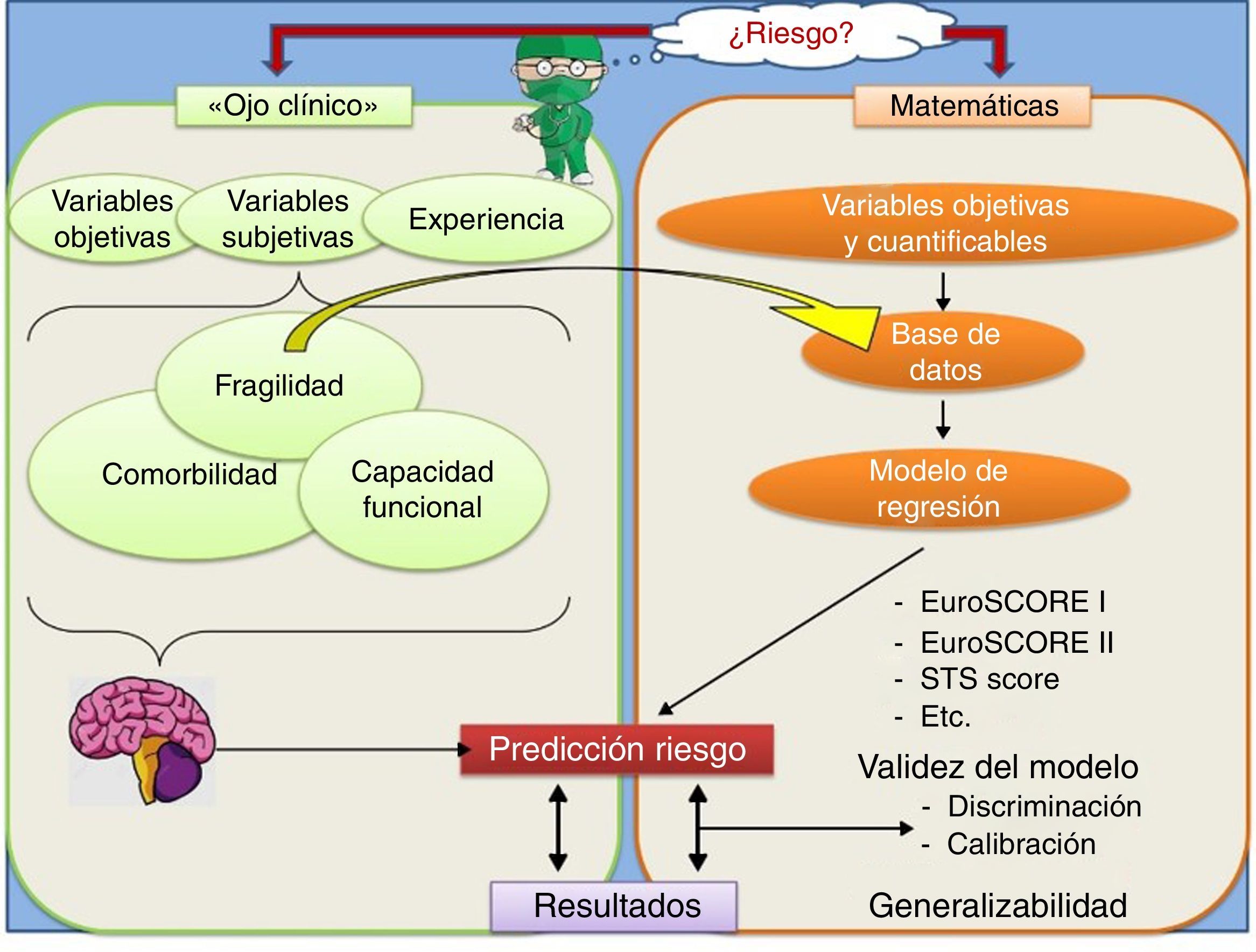
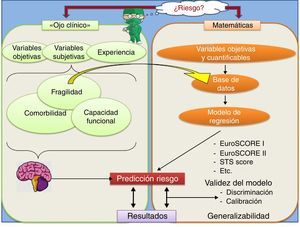
Por otro lado, además de las anteriores escalas, a la hora de evaluar el riesgo de un paciente, el cirujano, basándose en su experiencia y teniendo en cuenta factores como la edad, las comorbilidades y otras variables menos cuantificables como la fragilidad percibida, la capacidad funcional y la calidad de vida del paciente, inicialmente hace una estimación subjetiva del riesgo individual de ese paciente en concreto.
En muchas ocasiones, la estimación realizada subjetivamente no es acorde con la objetivización del riesgo calculado con las escalas clásicas. Esta falta de concordancia pone de manifiesto la existencia de variables distintas de las valoradas por sistemas como el EuroSCORE que probablemente puedan influir en los resultados de la cirugía y que no sean tan fácilmente medibles o cuantificables. En este sentido, conceptos como la fragilidad, la capacidad funcional y la calidad de vida preoperatorias están progresivamente perfilándose como importantes factores a tener en cuenta a la hora de una valoración más exacta del riesgo quirúrgico.
Para ejemplificar esta situación, podemos pensar en una paciente mujer de 80 años con estenosis aórtica severa, hipertensión arterial, fracción de eyección del ventrículo izquierdo del 50%, hipertensión pulmonar moderada, función renal normal y clase funcional ii-iii de la New York Heart Association. La estimación del riesgo es diferente según el sistema que empleemos. El EuroSCORE I le atribuye una mortalidad del 11,6%, mientras que el EuroSCORE II y el STS score del 2,7 y el 2,0%, respectivamente. En la práctica clínica diaria, el cirujano corrige subjetivamente estas puntuaciones de riesgo en función de factores no cuantificados, por ejemplo, si la paciente es una persona activa, independiente para las actividades básicas e instrumentales de la vida diaria, le gusta viajar y hace natación, probablemente la estimación del riesgo que se le atribuya sea más cercana al 2% que al 11,6%. Sin embargo, si la paciente no sale a caminar casi nunca, precisa ayuda domiciliaria y está diagnosticada de depresión con deterioro cognitivo incipiente, la estimación de riesgo que le atribuimos se acercará más a la del EuroSCORE I.
El proceso de estimación «objetiva» del riesgo quirúrgico. EuroSCORELa mayoría de los sistemas de estimación preoperatoria del riesgo quirúrgico como el EuroSCORE están basados en modelos de regresión. La regresión permite relacionar una variable dependiente (resultado) con una o varias variables independientes. El tipo de regresión utilizado dependerá del «outcome» o resultado que estemos midiendo:
- –
Para respuestas binarias, que solo pueden adquirir valores «sí» o «no», como la mortalidad en los primeros 30 días postoperatorios, se emplea la regresión logística.
- –
Para respuestas cuantitativas, como puede ser el número total de días postoperatorios o las horas de intubación, se emplea la regresión lineal.
Para la construcción de un modelo de regresión, es necesario disponer previamente de una base de datos, que deberá contener un número de casos mayor conforme aumenta el número de variables registradas. Estas variables pueden ser binarias, categóricas o cuantitativas, pero tienen que ser perfectamente medibles y cuantificables.
A través del análisis de la base de datos mediante técnicas estadísticas, se pueden calcular diferentes modelos de regresión, es decir, distintas combinaciones de variables que estiman un determinado riesgo o una determinada predicción para el «outcome» que estamos explorando. De todos los posibles modelos de regresión calculados, se debe elegir el que realice las predicciones más ajustadas y que, a su vez, sea lo más parsimonioso posible, es decir, que no contenga un número excesivo de variables.
Una vez estimado el modelo de regresión más adecuado, se debe evaluar si sus predicciones son fiables, es decir, si el modelo predice satisfactoriamente los datos obtenidos en otras muestras extraídas de la población de interés. Para ello, en el caso de los modelos de regresión logística como el EuroSCORE, se utilizan 2 conceptos que conviene conocer y distinguir: La calibración y la discriminación.
- –
La calibración valora la concordancia entre las probabilidades observadas en la muestra y las predichas por el modelo, es decir, evalúa el acuerdo entre los «outcomes» observados y los «outcomes» predichos por el modelo. La prueba estadística que evalúa la calibración es la de Hosmer-Lemeshow.
- –
La discriminación evalúa el grado en que el modelo distingue entre individuos que presentan o no la variable resultado. Como medida de discriminación se utiliza el área bajo la curva ROC, que representa, para todos los posibles pares formados por un individuo en el que ocurrió el evento y otro en el que no, la proporción de los que el modelo predice una mayor probabilidad para el que tuvo el evento. A partir de un área de 0,7 la discriminación del modelo se considera aceptable.
El modelo más utilizado en nuestro medio para la estimación del riesgo quirúrgico ha sido el EuroSCORE. La base de datos sobre la que se estimó el EuroSCORE I se concluyó en 1995, por lo que este modelo sería representativo de una «foto»’ de la práctica de la cirugía cardiaca de la década de los 90. De hecho, en su base de datos hay una baja prevalencia de octogenarios (< 2%), una baja prevalencia de cirugía valvular (< 30%) y un elevado número de pacientes coronarios1. Después de muchos años, el EuroSCORE I ha perdido capacidad de calibración, lo que se traduce generalmente en una sobreestimación del riesgo quirúrgico.
Para la estimación del modelo del EuroSCORE II se utilizó una base de datos en la que participaron 154 grupos de 43 países en el ámbito mundial. En total 22.381 pacientes. La recogida de datos se llevó a cabo entre mayo y julio del 2010 y el modelo se publicó en 2012. Se ha estudiado la validez del EuroSCORE II en nuestro medio1 y, aunque tiene un valor predictivo adecuado en términos de capacidad discriminatoria, su calibración no es óptima.
Actualmente, las guías europeas de revascularización desaconsejan el uso del EuroSCORE I como estimador del riesgo en cirugía coronaria (grado de recomendación iiiB), siendo los sistemas más adecuados para estimar el riesgo a corto plazo, el STS score y el EuroSCORE III, con un grado de recomendación i y iia, respectivamente, según estas mismas guías.
Estimación «subjetiva»’ del riesgo. FragilidadComo se ha mencionado anteriormente, independientemente de la estimación «objetiva» del riesgo mediante las anteriores escalas, el cirujano realiza una valoración más subjetiva del riesgo quirúrgico basándose principalmente en su experiencia previa y teniendo en consideración, además de las variables utilizadas por el EuroSCORE, otros factores menos cuantificables, como la fragilidad y la capacidad funcional del paciente (fig. 1).
En general, puede considerarse la fragilidad como una medida de la discordancia de mayor o menor grado entre la edad biológica y cronológica en los pacientes añosos y se reconoce como un estado fisiopatológico resultado de un deterioro general de la reserva funcional del organismo, reduciendo su capacidad para afrontar los factores estresantes y aumentando la vulnerabilidad a la aparición de complicaciones. Bajo este concepto subyace la impresión subjetiva de que una parte de la población de edad avanzada se encuentra mucho mejor de manera general y demuestra menos edad de la que realmente tiene y que, por el contrario, también existe gente con la misma edad que los anteriores que son más vulnerables y previsiblemente con más facilidad para presentar complicaciones.
El hecho de que los pacientes frágiles presentan una vulnerabilidad individual aumentada a los diferentes factores estresantes y de que son más susceptibles a varios resultados de salud adversos, incluyendo la muerte, discapacidad y hospitalización2,3, ha despertado el interés en la posibilidad de mejorar la estimación del riesgo quirúrgico teniendo en cuenta la fragilidad de los pacientes.
En este sentido, y en el campo de la cirugía cardiaca, Lee et al.4 realizaron un análisis prospectivo sobre 3.826 pacientes intervenidos de cirugía cardiaca con un rango de edad de entre 15 y 91 años de edad. Se dividieron en las categorías de pacientes frágiles (n=157) y no frágiles (n=3669) en función de la presencia de cualquier deterioro. La fragilidad fue un factor de riesgo independiente para la mortalidad hospitalaria (OR 1,8; IC del 95%: 1,1-3), la reducción a la mitad del periodo de supervivencia (RR 1,5; IC del 95%: 1,1-2,2) y el principal factor de riesgo para la atención institucional prolongada (OR 6,3; IC del 95%: 4,2 a 9,4). Los autores, que no incluyeron sistemas de estimación de riesgo como el EuroSCORE en su análisis, concluyen que la fragilidad, independientemente de la edad, es predictiva de la mortalidad y la estancia hospitalaria prolongada.
Usando un enfoque ligeramente diferente, Sünderman et al.5 estudiaron a 400 pacientes con una edad media de 80,2 años sometidos a cirugía cardiaca. En el análisis se incluyeron también procedimientos transcatéter en 59 casos. Se calculó la puntuación STS y EuroSCORE, y se realizó una evaluación exhaustiva de la fragilidad utilizando una escala que incorpora la percepción de pérdida involuntaria de peso, sensación de cansancio y de baja actividad, evaluación de la fuerza de agarre, el equilibrio, la velocidad de la marcha, coordinación y pruebas de laboratorio, incluyendo la espirometría y una batería de parámetros bioquímicos. El EuroSCORE logístico medio de esta cohorte de pacientes fue del 8,5%, y la puntuación STS mediana fue del 3,3%. Aunque la correlación entre estos resultados y la medida fragilidad fue baja a moderada, la fragilidad predijo la mortalidad a los 30 días, con precisión cercana a la de las escalas habituales de cálculo de riesgo quirúrgico utilizadas en cirugía cardiaca. Los autores concluyen que la combinación de las escalas de fragilidad con las puntuaciones obtenidas con los sistemas de cálculo de riesgo en cirugía cardiaca puede aumentar la precisión de la predicción del riesgo.
Otro ejemplo es la revisión sistemática que Sepehri et al. publicaron en 2014. Se incluyó a 4.756 pacientes intervenidos de cirugía cardiaca mayor6 y concluye que los pacientes frágiles tienen mayor probabilidad de mortalidad, morbilidad, deterioro de su capacidad funcional y aparición de eventos cardiovasculares adversos tras la cirugía.
Todo parece indicar que la fragilidad desempeña un papel importante a la hora de predecir el riesgo quirúrgico, pero, sin embargo, no está aclarado cuál es el mejor criterio para definir un paciente como frágil. De hecho, cada uno de los anteriores estudios utiliza diferentes criterios para la clasificación de los pacientes como frágiles o robustos.
ConclusionesComo hemos visto, una de las posibles vías para mejorar la predicción del riesgo quirúrgico puede ser la valoración objetiva de la fragilidad preoperatoria de los pacientes para poder incluirla en modelos de regresión junto con el resto de variables de riesgo. Mientras tanto, en la práctica clínica diaria, deberemos seguir utilizando el STS Score y el EuroSCORE II como principales herramientas de cálculo del riesgo quirúrgico.
Precondicionamiento isquémico remotoEl miocardio puede tolerar periodos de isquemia de hasta 15 min de duración sin que se produzca muerte celular. Periodos mayores de isquemia lo lesionan, a lo que se suma el daño provocado por la reperfusión posterior. La combinación de ambos procesos es lo que se conoce como lesión de isquemia-reperfusión.
La idea de aplicar breves periodos de isquemia-reperfusión con el fin de proteger al miocardio frente a posteriores periodos de isquemia más prolongados fue presentada por primera vez en 1986 por Murry et al.7. Demostraron que el área de infarto después de 40 min de isquemia era menor si se aplicaban en la zona ciclos de 5 min de isquemia-reperfusión previos. Este procedimiento se dio a conocer como PIR.
Hoy en día se define PIR como el fenómeno por el cual breves periodos de isquemia y reperfusión en un territorio vascular alejado del órgano diana que sufrirá el periodo prolongado de isquemia, protegen a este de los efectos adversos de la misma. Estos ciclos protegerían de la isquemia tanto si se realizan antes (precondicionamiento), durante (pericondiconamiento) como después (postcondicionamiento) del periodo isquémico principal.
Mecanismos del condicionamiento isquémicoNo está definido el mecanismo por el cual se produce la protección ante la isquemia, pero existen 2 teorías al respecto:
- –
Hipótesis humoral: mantiene que ciclos de isquemia-reperfusión remotos provocan la acumulación y la liberación a la circulación de mediadores humorales que alcanzan finalmente el corazón8.
- –
Cardioprotección mediada neuralmente: postula que ciclos de isquemia-reperfusión en lugares periféricos alejados activan reflejos neuronales que proporcionan protección del miocardio ante un daño isquémico posterior más prolongado9. Algunos estudios en humanos han mostrado la implicación del sistema nervioso autónomo como el mecanismo que explicaría el efecto protector ante la isquemia10.
Después de varios años de publicaciones sobre el PIR en enfermos sometidos a angioplastia percutánea, varios metaanálisis recientes parecían demostrar la utilidad del PIR en la sala de hemodinamia11. Varios trabajos mostraban disminución de eventos adversos cardiacos y cerebrales mayores a corto y largo plazo cuando se aplicaba PIR antes de la angioplastia, aunque en otros casos no se podía demostrar un aumento de la supervivencia en los grupos tratados. La heterogeniciddad en el tipo y la duración de los ciclos de isquemia-reperfusión, así como en los objetivos primarios de los estudios, son probablemente la causa de las diferencias encontradas. Aunque el empleo de PIR está en auge en procedimientos electivos, su eficacia parece mayor en casos de angioplastia primaria de urgencia.
Pero, aunque el PIR parece tener efectos beneficiosos en la salas de hemodinamia, ¿qué papel desempeña en el caso de la revascularización miocárdica quirúrgica? En un estudio en cirugia de revascularización miocárdica del año 2007, 57 pacientes fueron aleatorizados a recibir o no ciclos de isquemia-reperfusión remota después de la inducción anestésica. Los resultados mostraron una reducción de los niveles de troponina a las 72 h en el grupo tratado respecto al grupo control12. Otros ensayos han confirmado el efecto cardioprotector reflejado en reducciones de los valores postoperatorios de troponina T, I o CKMB. Sin embargo, no todos los ensayos han sido positivos al respecto y no confirman estos resultados. Es muy probable que el empleo rutinario de anestésicos inhalatorios o los betabloqueantes, que han demostrado su efecto cardioprotector en varios ensayos clínicos, enmascaren los efectos beneficiosos del PIR. En cualquier caso, en un metaanálisis posterior llevado a cabo por d’Ascenzo et al. se observó una disminución de los valores de troponina en el postoperatorio una vez controlados los posibles factores confundidores, tales como el empleo de dichos anestésicos volátiles durante la cirugía13.
Parece claro que no existe una comprensión exacta del mecanismo por el cual el PIR ofrece protección frente a episodios de isquemia posteriores más prolongados. La comprensión de estos mecanismos sería crucial para determinar el tipo y la duración de los ciclos de isquemia-reperfusión, el mejor lugar y momento de aplicación, el tipo de cirugía y aquellos pacientes que se podrían beneficiar en mayor medida. En cualquier caso, por lo expuesto hasta el momento, parece que el PIR podría ser beneficioso en algunos enfermos, resultando un procedimiento de bajo coste y fácil realización, con mínimos o nulos efectos secundarios8.
En el año 2015 varios estudios sobre el tema adquieren una relevancia especial, dando lugar a un acalorado debate y siendo motivo de varias editoriales en revistas internacionales de prestigio. En JAMA aparece publicado un ensayo clínico que demuestra una reducción de la incidencia de fracaso renal postoperatorio en enfermos que reciben PIR respecto al grupo control (37,5 frente a 52,5%) y una disminución de la necesidad de terapia renal sustitutiva. No obstante, no se encontraron diferencias en cuanto a mortalidad y eventos adversos cerebrales y cardiovasculares (aunque no constituían el objetivo primario del ensayo)14. También en 2015 se publican 2 ensayos clínicos clave, ambos en el New England Journal of Medicine. Se tratan del ensayo ERICCA15 y el ensayo RIPHeart16. El ensayo ERICCA, multicéntrico sobre más de 1.000 pacientes, no demostró diferencias en el objetivo primario (muerte, ictus, fracaso renal agudo o infarto agudo de miocardio). Tampoco se encontraron diferencias en los análisis de subgrupos ni en los objetivos secundarios (valores de troponina, tiempos de estancia en la UCI y de ventilación mecánica, incidencia de delirio y fibrilación auricular de nueva aparición). No se observaron efectos adversos en el grupo de intervención15. En el ensayo RIPHeart, multicéntrico sobre más de 1.600 pacientes, tampoco se encontraron diferencias en el objetivo primario (muerte, infarto agudo de miocardio, necesidad de revascularización o ictus), ni tampoco en los objetivos secundarios (elevación de troponina, fracaso renal agudo, necesidad de inotropos, duración de estancia en la UCI y calidad de vida posterior al procedimiento).
ConclusionesLos estudios sobre PIR, de diferente calidad y con distintos objetivos, parecen ofrecer al final conclusiones similares en cirugía cardiaca: el PIR parece ofrecer beneficios en cuanto a la disminución de los valores de marcadores de lesión miocárdica y de incidencia de daño renal en el postoperatorio inmediato, pero no parece mejorar los resultados a corto y medio plazo cuando se analizan la supervivencia y los efectos adversos cardiovasculares y cerebrales. Quizás los fármacos cardioprotectores empleados de forma rutinaria (anestésicos inhalatorios, cardioplejía, betabloqueantes, etc.) vienen siendo suficientes, sin que la isquemia remota aporte beneficios adicionales.
Tampoco queda suficientemente aclarado qué grupo de enfermos sería el más beneficiado con la técnica, cuál es el método más apropiado para realizarla e incluso si carece o no de efectos adversos.
Uso de hemoderivadosUmbral transfusional¿Cuál es la mejor estrategia transfusional en pacientes sometidos a cirugía cardiaca? Esta pregunta permanece sin contestar hasta la fecha actual.
Las estrategias para disminuir la transfusión de hemoderivados en cirugía se pueden agrupar en 3: optimizar los niveles de hemoglobina preoperatoria, disminuir las pérdidas intraoperatorias y, por último, ser tolerantes con la anemia.
Entre el 14 y el 20% de la sangre que se consume en los centros hospitalarios lo hacen los pacientes sometidos a cirugía cardiaca. La transfusión de hemoderivados puede aumentar la morbilidad postoperatoria, disminuir la supervivencia y aumentar el coste del procedimiento. Nunca está exenta de efectos secundarios y siempre está sujeta a disponibilidad. Por otro lado, la anemia puede aumentar la incidencia de infarto agudo de miocardio, la incidencia de ictus y de fracaso renal, y finalmente disminuir la supervivencia de los pacientes.
Por lo tanto, ¿dónde se encuentra el valor óptimo de hemoglobina en el que tenemos que transfundir a nuestros pacientes sometidos a cirugía cardiaca? Esta pregunta carece de respuesta en el escenario en el que nos encontramos. Mientras que parece claro que las estrategias restrictivas en pacientes críticos son más beneficiosas que las estrategias liberales, en pacientes sometidos a cirugía cardiaca no resulta tan evidente.
El papel del recuperador de sangre intraoperatorioEl empleo de recuperadores intraoperatorios de sangre no cuenta en la literatura con la suficiente evidencia para su empleo rutinario en cirugía cardiaca. Según la última revisión de la Cochrane del año 2012, el uso de recuperadores de sangre intraoperatorios disminuye las necesidades de transfusión de sangre alogénica sin aumentar los efectos adversos, aunque no existen ensayos de calidad suficiente17.
Sin embargo, ¿es útil para todos los casos? ¿El coste derivado de su empleo está justificado por el beneficio obtenido? Y, por último, ¿tiene o no tiene efectos adversos? Parece que el empleo de recuperadores no debería hacerse de forma rutinaria en todas las intervenciones y reservarse para pacientes con alto riesgo de sangrado:
- –
Edad avanzada.
- –
Reintervención quirúrgica.
- –
Enfermedad de pericardio, aorta o endocarditis, cirugía combinada o multivalvular.
- –
Pacientes con puntuaciones mayores de 10 en el EuroSCORE.
- –
Insuficiencia renal o hepática asociadas.
- –
Anemia preoperatoria, trombocitopenia o terapia con antiagregantes.
El empleo de recuperadores no es coste efectivo en pacientes de bajo riesgo y no disminuye la necesidad de transfusión18.
No obstante, algunos autores han encontrado una disminución de las complicaciones respiratorias en el postoperatorio inmediato con el empleo de recuperadores intraoperatorios. Postulan que eliminaría sustancias proinflamatorias causantes de daño pulmonar agudo después de la cirugía19.
Queda por determinar si el empleo del recuperador de sangre intraoperatorio es útil y coste-efectivo en todos los pacientes o solamente en enfermos de alto riesgo. No olvidemos además que la sangre recuperada, aunque con un elevado hematocrito, no posee ningún factor de coagulación ni plaquetas, pudiendo contribuir al sangrado postoperatorio.
Optimización del postoperatorio inmediatoPara monitorizar al paciente coronario en las UCI se suele utilizar lo que consideramos monitorización básica que consta de: electrocardiograma, pulsioximetría, presión arterial invasiva continua, presión venosa central, balance hídrico, temperatura y gasometría arterial.
En aquellos pacientes en los que se considere necesario, se podrán utilizar además otros monitores más avanzados, como son: la ecocardiografía, el catéter de arteria pulmonar o algunos sistemas que miden el gasto cardiaco a través del análisis del contorno de la onda de pulso o de la termodilución.
La terapia guiada por objetivos que se basa en estos últimos monitores no invasivos del gasto cardiaco parece reducir las complicaciones postoperatorias, según algunos metaanálisis20.
En cuanto al manejo de algunos fármacos de uso habitual en estos enfermos, se deben tener en cuenta las recomendaciones de las últimas guías clínicas:
- –
El uso de los betabloqueantes debe limitarse a aquellos pacientes con un riesgo de mortalidad elevado que se vean sometidos a un procedimiento quirúrgico de alta complejidad21. Sí que se deben mantener en aquellos pacientes que los tomen de manera crónica, aunque su reintroducción no debe hacerse el mismo día de la intervención.
- –
La introducción precoz de las estatinas en el postoperatorio inmediato parece tener un efecto beneficioso claro sobre los pacientes.
- –
Los inhibidores de la enzima conversiva de angiotensina y los inhibidores de la angiotensina ii deberían mantenerse durante el periodo perioperatorio y, en caso de ser retirados por su asociación con la hipotensión quirúrgica, deben ser introducidos lo antes posible, según la clínica de los pacientes.
Las complicaciones más frecuentes observadas en el paciente coronario durante su estancia en las UCI son:
- –
Sangrado postoperatorio: la incidencia varía en función de la definición del mismo, entre un 5 y un 25%. En general, consideraremos un sangrado excesivo aquel superior a 200-300ml a la hora.
- –
Síndrome de bajo gasto: cuya definición incluye un índice cardiaco menor de 2 l/min/m2 y presión arterial sistólica inferior a 90mmHg, unidos a signos de hipoperfusión, en pacientes normovolémicos.
- –
Hipertensión pulmonar y disfunción del ventrículo derecho.
- –
Síndrome de respuesta inflamatoria sistémica (8-10%).
- –
Taponamiento cardiaco (0,5-8%).
- –
Infarto agudo de miocardio perioperatorio (2-4%), quedando definido según las últimas guías, como22:
- ∘
Valores de troponina 10 veces superiores al percentil 99 del límite superior de referencia durante las primeras 48 h tras la cirugía, partiendo de un valor basal normal de la misma.
- ∘
Aparición de nuevas ondas Q patológicas o un nuevo bloqueo completo de rama izquierda del haz de His.
- ∘
Reoclusión de una arteria coronaria nativa o del injerto, documentada angiográficamente.
- ∘
Evidencia por imagen de nueva pérdida de miocardio viable o aparición de nuevas alteraciones de la contractilidad.
- ∘
- –
Arritmias, siendo la fibrilación auricular la más frecuente y pudiéndose presentar en un 20-40% de los pacientes intervenidos.
- –
Déficits neurológicos: se estima la incidencia de accidente cerebrovascular agudo entre el 2 y el 5%.
Una vía de corta estancia es un proceso de planificación del periodo perioperatorio de los pacientes intervenidos de cirugía cardiaca, que tiene entre sus objetivos optimizar los tiempos de realización de las pruebas y el ingreso preoperatorio, retirar la ventilación mecánica de manera precoz y acelerar las medidas de recuperación, favoreciendo el alta hospitalaria precoz, sin poner en riesgo la seguridad de dicho proceso.
Desde mediados de la década de los 90, una rehabilitación postoperatoria intensiva se ha establecido como el camino a seguir para conseguir una rápida y adecuada recuperación de los pacientes intervenidos de cirugía cardiaca. En este sentido, los protocolos de «fast-track» o protocolos de corta estancia se han ido popularizando, hasta actualmente considerarse un estándar de actuación23.
Estos protocolos buscan la reducción de los tiempos de ingreso tanto en el preoperatorio como en el postoperatorio, reduciendo significativamente de los costes del ingreso.
Uno de los puntos clave en el desarrollo de estos protocolos es la adecuada selección de pacientes candidatos a entrar en la vía clínica, ya que se ha visto que los errores en la selección son uno de los indicadores de fracaso de estas vías24. Un ejemplo de los criterios de inclusión para entrar en esa vía podrían ser los pacientes independientes para las actividades básicas de la vida diaria, programados para procedimientos de baja complejidad, con bajo riesgo de mortalidad según el EuroSCORE y con la posibilidad de apoyo social y familiar.
Una vez realizada la selección de los pacientes en la consulta prequirúrgica, se debe gestionar la realización de las pruebas preoperatorias de manera ambulatoria para así poder ingresar el paciente el día previo a la intervención, optimizando así el uso de las camas de hospitalización.
En el postoperatorio, la anestesia estará dirigida hacia un despertar rápido con una extubación precoz. También se buscará lo antes posible el alta de la UCI, el inicio de la tolerancia oral y la movilización.
La técnica de «fast-track» o de recuperación precoz es muy eficaz cuando la selección de los pacientes es correcta, la técnica anestésica se adapta para conseguir una recuperación rápida de las funciones vitales, la cirugía es resolutiva, y cuando el postoperatorio inmediato se realiza en unidades de reanimación postanestésica situadas dentro del área quirúrgica con personal de enfermería especializado en este tipo de pacientes.
Por último, y como no podría ser de otra manera, para asegurar el éxito en la implantación y la aplicación de estos protocolos, es fundamental el consenso y el trabajo en equipo entre los diferentes estamentos que intervienen en el proceso.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.