La asistencia ventricular (AV) como tratamiento del fallo cardíaco refractario a las medidas farmacológicas convencionales permite realizar el bombeo sanguíneo supliendo al corazón mientras que se recupera de la injuria recibida y revierte las lesiones causadas en los órganos secundarios por la mala perfusión. En los casos en que el corazón no se recupera, permite al paciente ganar más tiempo de espera si está incluido en lista de trasplante cardíaco, o mejorar su calidad y cantidad de vida en los casos implantados como terapia de destino.
En los últimos años cada vez es más frecuente el uso de la AV en adultos, e igualmente ocurre en la población pediátrica. Revisamos en este apartado las particularidades de la AV en pediatría y en pacientes con cardiopatías congénitas. En primer lugar revisamos sus indicaciones, y la manera de elegir la AV más adecuada para cada paciente. Seguidamente, analizaremos la AV de corta duración, que en niños habitualmente precisa sustituir al pulmón junto con el corazón, asociando un oxigenador en el circuito, denominándola en estos casos circulación extracorpórea con oxigenador de membrana intercalado. En tercer lugar, nos dedicaremos a la AV de larga duración, que en pediatría se reduce casi exclusivamente al Berlin Heart implantado como puente al trasplante. Por último, exponemos la experiencia de nuestro hospital con la AV tanto de corta como de larga duración en pacientes pediátricos, objetivando que esta ha contribuido directamente a mejorar la supervivencia de nuestros pacientes.
Mechanical circulatory support (MCS) is the treatment of heart failure refractory to conventional pharmacological measures. MCS enables the blood to be pumped to the whole body while the heart recovers from the injury received, as well as the recovery of the secondary organs damaged by poor perfusion. In cases where the heart does not recover, it can give the patient to have more time on the waiting list for heart transplant, or can improve their quality and quantity of life in cases implanted as a final therapy.
The use of MCS has become increasingly frequent in adults, as well as in the paediatric population, in recent years. In this section, a review is presented on the characteristics of MCS in paediatric patients with or without congenital heart disease. Firstly, a review of the indications is presented, as well as how to choose the most appropriate MCS for each patient. This is followed by an analysis of the short-term MCS in children, usually requiring lung support along with the heart, with an oxygenator in the circuit, which is given the name, extracorporeal circulation with membrane oxygenator. Thirdly, a look at the long-term MCS in paediatrics, which is almost exclusively reduced to the Berlin Heart implanted as a bridge to transplant. Finally, we present our experience with MCS, including both short and long-term follow up in paediatric patients, with the aim of contributing directly to improve the survival of our children.
La indicación de colocar una asistencia ventricular (AV) se establece en el fallo cardíaco resistente al tratamiento médico convencional que requiere más de 2 inotrópicos, mantiene cifras de saturación venosa mixta inferiores al 60% y presenta disfunción de órganos secundaria a la mala perfusión periférica objetivada generalmente con acidosis láctica y oligoanuria1.
La AV implantada realiza las funciones de bombeo sanguíneo supliendo al corazón mientras este se recupera de la injuria recibida y revierte las lesiones causadas en los órganos secundarios por la mala perfusión. Puede también temporalmente sustituir al pulmón si se asocia un oxigenador en el circuito, denominándola en estos casos circulación extracorpórea (CEC) con oxigenador de membrana intercalado (ECMO). En los casos en que el corazón no se recupera, permite al paciente ganar más tiempo de espera si está incluido en lista de trasplante cardíaco, o mejorar su calidad y cantidad de vida en los casos implantados como terapia de destino. Como desventajas, la AV requiere anticoagulantes a dosis elevada, que con frecuencia asocian problemas tromboembólicos, y supone un elevado consumo de recursos tanto humanos como materiales, prolongando los tiempos de hospitalización.
La incidencia de las cardiopatías congénitas (CC) es de 8 por cada 1.000 recién nacidos vivos y la de miocardiopatías es de 0,58 por cada 100.000 niños, y de estas solo un pequeño porcentaje requerirán AV a lo largo de su vida2. Aunque dentro del total de las AV implantadas los pacientes pediátricos y/o con CC son una minoría, merece la pena comentar en apartado independiente de este monográfico las peculiaridades de este grupo de enfermos. Estas particularidades requieren que los dispositivos de AV puedan implantarse en distintos tamaños de pacientes (desde el neonato hasta el adulto), adaptarse a los cambios circulatorios del crecimiento, y también a las anomalías estructurales y fisiológicas de las CC, para obtener buenos resultados con máxima optimización de recursos.
El desarrollo de la AV en niños históricamente ha ido detrás de la de adultos, teniendo la ECMO buenos resultados a corto plazo. Respecto a la AV de larga duración, se implantaron primeramente los dispositivos de adultos en adolescentes con buenos resultados, y estos fueron peores al usarlos con niños más pequeños3. Con el tiempo han ido apareciendo en el mercado dispositivos especialmente diseñados para la población pediátrica, que han mejorado las expectativas de tratamiento de estos niños con insuficiencia cardíaca terminal. En los últimos años cada vez es más frecuente el uso de la AV en población pediátrica tanto de corta como de larga duración, y esto ha contribuido directamente a mejorar su supervivencia, permitiendo unas veces la recuperación cardíaca y que lleguen en buen estado al trasplante los que no se recuperan4.
Indicación y elección de la asistencia ventricularLos avances médico-quirúrgicos en el tratamiento de las CC a lo largo de las últimas décadas han permitido ir disminuyendo la mortalidad hospitalaria y prolongando la supervivencia de estos pacientes. En algún momento de su vida requerirán hospitalización por insuficiencia cardíaca secundaria a una miocardiopatía o a su CC en fase terminal y esta será refractaria al tratamiento médico convencional y se planteará entonces la necesidad de implantar una AV. En los niños y en los pacientes con CC utilizamos la estratificación del fallo cardíaco INTERMACS5, al igual que en adultos: al principio se indicaba la AV en la categoría i de INTERMACS, y ahora se tiende a ser más precoz haciéndolo en la categoría ii.
Los objetivos buscados con la AV son lograr la supervivencia del paciente hasta su recuperación o el trasplante mediante la mejora del gasto cardíaco. En consecuencia, pretende también que revierta la disfunción moderada de los órganos causada por el bajo gasto. Es primordial conseguir una rehabilitación física que permita extubar y movilizar al paciente (deambulación incluida), el restablecimiento de la nutrición enteral y una evaluación neurológica y psicológica que finalmente permita mejorar su calidad de vida.
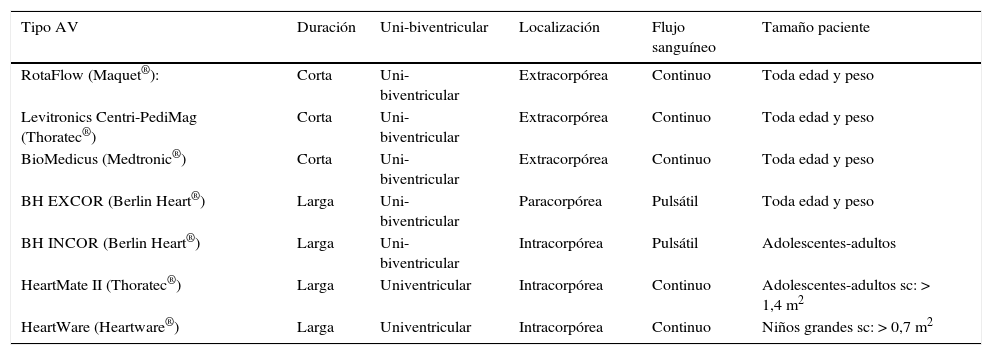
Antes de elegir el modelo de AV a implantar se deben responder una serie de preguntas6: la primera de ellas es si se va a poner como puente a la recuperación (p. ej., cuando un paciente no se puede desconectar de CEC después de reparar su CC y pensamos que existe un daño cardíaco transitorio susceptible de mejorar en unos días), como puente al trasplante (por ej., una miocardiopatía dilatada en fase terminal), o como terapia de destino que actualmente es excepcional en niños. La segunda pregunta va de la mano con la primera, ya que se refiere al tiempo que se prevea que vaya a estar puesta la AV7: si este tiempo es menor de 14 días pensaremos en una AV de corta duración (asociada o no a un oxigenador, según sea necesario), y si es mayor de 14 días elegiremos una AV de larga duración. La tercera pregunta se refiere a si es necesario asistir uno o los 2 ventrículos. Según sean respondidas las preguntas anteriores, el dispositivo de AV escogido tendrá una localización extra, para o intracorpórea con flujo sanguíneo continuo o pulsátil (tabla 1).
Tipos de asistencia ventricular más usadas en pacientes pediátricos y con cardiopatías congénitas
| Tipo AV | Duración | Uni-biventricular | Localización | Flujo sanguíneo | Tamaño paciente |
|---|---|---|---|---|---|
| RotaFlow (Maquet®): | Corta | Uni-biventricular | Extracorpórea | Continuo | Toda edad y peso |
| Levitronics Centri-PediMag (Thoratec®) | Corta | Uni-biventricular | Extracorpórea | Continuo | Toda edad y peso |
| BioMedicus (Medtronic®) | Corta | Uni-biventricular | Extracorpórea | Continuo | Toda edad y peso |
| BH EXCOR (Berlin Heart®) | Larga | Uni-biventricular | Paracorpórea | Pulsátil | Toda edad y peso |
| BH INCOR (Berlin Heart®) | Larga | Uni-biventricular | Intracorpórea | Pulsátil | Adolescentes-adultos |
| HeartMate II (Thoratec®) | Larga | Univentricular | Intracorpórea | Continuo | Adolescentes-adultos sc: > 1,4 m2 |
| HeartWare (Heartware®) | Larga | Univentricular | Intracorpórea | Continuo | Niños grandes sc: > 0,7 m2 |
AV: asistencia ventricular; BH: Berlin Heart; sc: superficie corporal.
También habrá que considerar factores locales, como la disponibilidad de equipos de AV existentes en cada centro de trabajo y con los que el personal sanitario está familiarizado, tanto en el implante como en el manejo postoperatorio. Los buenos resultados con la AV implican la existencia de un equipo multidisciplinar entrenado, con experiencia de tratamiento de estos pacientes, así como en el delicado control de anticoagulación que precisan.
Como se ha comentado anteriormente, tanto el tamaño del paciente, como su patología específica (CC vs. miocardiopatía) y las cirugías previas realizadas nos llevarán a considerar variaciones anatómicas que dificulten la canulación y/o el funcionamiento de la AV.
Mención especial merece la AV como puente al trasplante en edad pediátrica ya que es responsable de mejorar los resultados del mismo8. Actualmente se observa un aumento de los pacientes listados para trasplante ya sea por miocardiopatía o por CC en fase terminal, y los donantes son escasos, por tanto, la tasa de trasplante pediátrico anual permanece constante y el tiempo de espera en lista cada vez es mayor. El trasplante cardíaco pediátrico presenta una complejidad técnica asociada a las anomalías estructurales asociadas a la CC y a sus cirugías previas que aumentan el tiempo de disección y la realización de las anastomosis vasculares en el momento del trasplante. En los últimos 20 años ha aumentado el uso de AV (sobre todo AV de larga duración), favoreciendo que disminuya la mortalidad en lista de espera y que más pacientes lleguen al trasplante. Se evitará poner ECMO en la medida de lo posible porque los resultados son peores en estos pacientes si llegan al trasplante respecto a otras AV de larga duración o si no necesitan ningún tipo de asistencia previa9.
Asistencia ventricular de corta duraciónLlamamos AV de corta duración al dispositivo que se coloca para un período inferior a 14 días. En pacientes pediátricos la disfunción ventricular izquierda es rara, presentando con frecuencia un fallo cardíaco biventricular con hipoxemia e hipertensión pulmonar, necesitando estos casos asociar un oxigenador a la AV (ECMO)10. Estos dispositivos son bombas centrífugas de flujo continuo, localización extracorpórea, se pueden usar en pacientes de cualquier edad o peso y pueden dar asistencia uni o biventricular. La AV de corta duración permite trasladar al paciente (a sala de cateterismo, centro de trasplante, etc.) y prolonga la supervivencia del paciente, ya que los órganos lesionados por el bajo gasto cardíaco van mejorando hasta la recuperación cardíaca o la colocación de una AV de larga duración. Como desventajas, los pacientes permanecen sedados y conectados a ventilación mecánica, la anticoagulación es obligada con heparina intravenosa (la ECMO requiere mayor anticoagulación y activa más la respuesta inmunitaria), y al cabo de 2 semanas se observa un aumento exponencial de las complicaciones tromboembólicas y hemorrágicas.
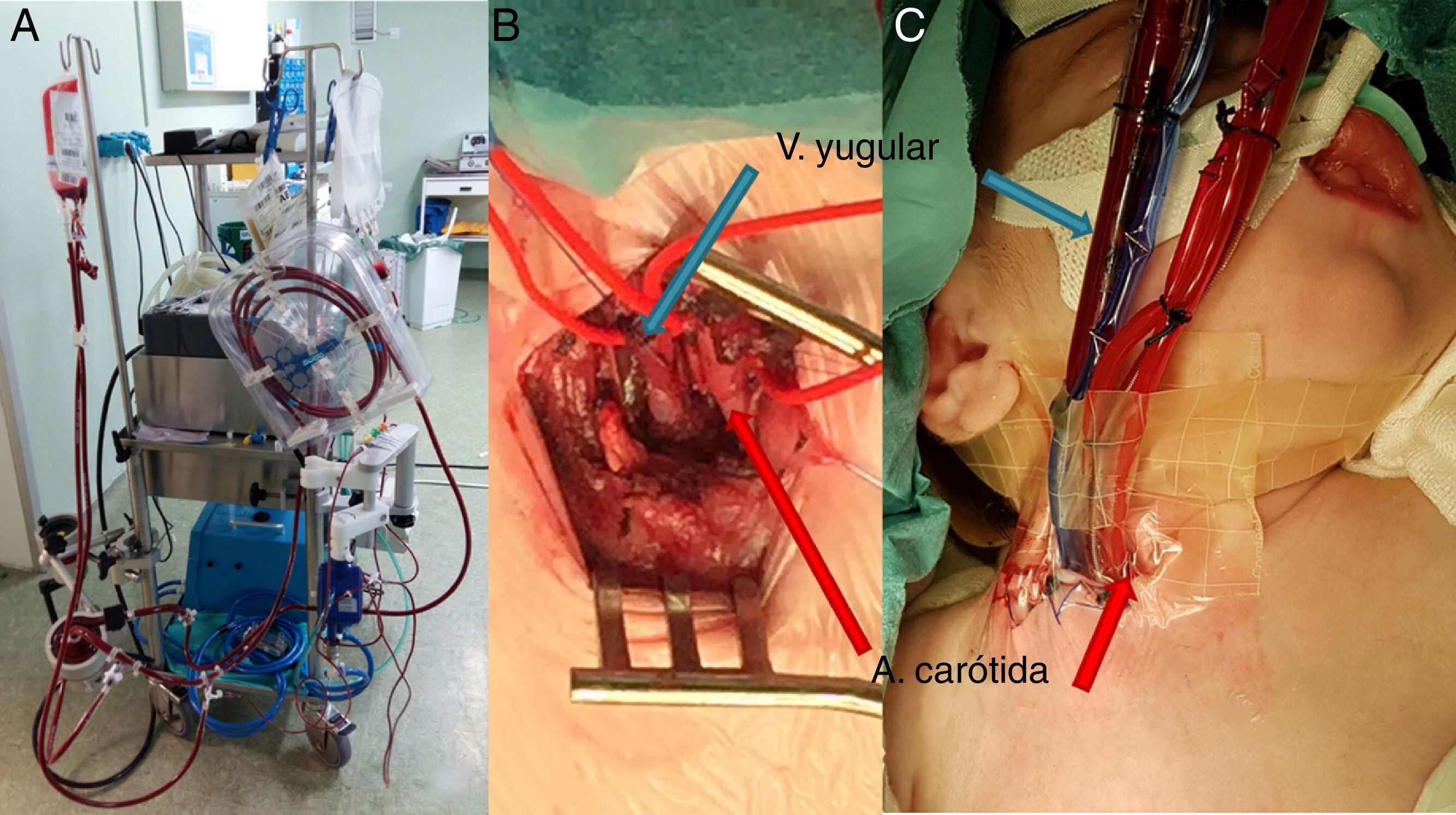
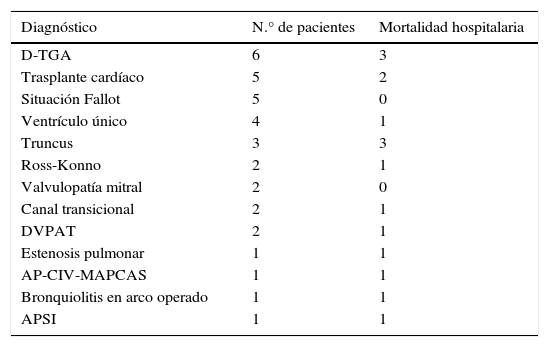
Su implante está indicado en procesos agudos como una disfunción ventricular tras una reparación de CC que no puede desconectarse de CEC (ECMO poscardiotomía), una miocarditis aguda, un fallo primario del trasplante cardíaco o una parada cardíaca que no responde a las medidas de resucitación cardiopulmonar estándar, y también en casos dudosos como, por ejemplo, una alteración neurológica no bien definida o si el paciente no tiene clara indicación de trasplante, como puente a colocar una AV de larga duración. Este implante de AV se hace como puente a la recuperación o puente a la decisión (para incluir al paciente en lista de trasplante, o para un posterior implante de una AV de larga duración). La indicación habitualmente será urgente o emergente, eligiendo según sea cada caso una técnica de canulación de los vasos central (aorta, aurícula derecha±aurícula izquierda) o periférica (arteria carótida y vena yugular en neonatos y lactantes, y vasos femorales para niños grandes) (fig. 1).
ECMO en paciente neonatal: purgado de la bomba centrífuga (A), acceso cervical derecho con disección de arteria carótida y vena yugular interna derechas (B), y con la canulación realizada en los vasos (C). Las flechas azules señalan la vena yugular y la cánula de retorno venoso y las flechas rojas señalan la arteria carótida y la cánula de salida arterial, respectivamente.
La ECMO poscardiotomía se indica ante un fallo cardíaco y/o pulmonar potencialmente reversible tras una reparación completa o paliación quirúrgica de una CC11. Tiene como complicación principal la hemorragia, que suele requerir revisión del lecho quirúrgico. Mientras que el paciente está en ECMO, si se detectan lesiones residuales, estas se han de solucionar para favorecer el destete precoz de la ECMO. Su supervivencia hospitalaria está entre el 38 y 55%, y de estos supervivientes un 10% requiere posteriormente un trasplante cardíaco. La duración prolongada de la ECMO, los valores elevados de láctico previo a la ECMO, el fallo renal y la cirugía paliativa respecto a la de reparación completa son factores predictivos de mortalidad en estos pacientes12.
La ECMO puesta en una miocarditis aguda es la que tiene mejor pronóstico, con supervivencia hospitalaria del 61% y tasas de recuperación en los supervivientes de hasta el 96%.
Durante los 14 días postimplante pueden aparecer 4 escenarios: recuperación cardíaca y retirada de la AV/ECMO en los casos más favorables (puente a la recuperación), y retirada por no recuperación con fallo multiorgánico seguida del fallecimiento del paciente en los casos más desafortunados. El tercer escenario contemplaría la no recuperación cardíaca, siendo el paciente incluible en lista de trasplante (puente al trasplante), y por último tendríamos un escenario (puente a la trasplantabilidad) de no recuperación cardíaca en un paciente con dudas sobre su inclusión en lista de trasplante. En estos 2 últimos escenarios, pasados estos 14 días habría que plantear su sustitución por una AV de larga duración.
Asistencia ventricular de larga duraciónLlamamos AV de larga duración al dispositivo que se implanta para un período superior a 14 días. El Berlin Heart (BH) EXCOR® es el dispositivo de larga duración más usado en niños (el único disponible en neonatos y lactantes) y en algún centro llega a suponer hasta un tercio de los pacientes pediátricos listados para trasplante13. Usado por vez primera en Alemania en un niño (1990), se aprobó su uso en Europa en 1996. En Estados Unidos desde el año 2000 se usa como modo compasivo y fue aprobado por la Food and Drug Administration en el 2011. Es una bomba neumática de localización paracorpórea, de flujo pulsátil, puede dar asistencia uni o biventricular, y tan solo ocasionalmente y de manera transitoria permite intercalar un oxigenador14. El implante de una AV de larga duración siempre es una cirugía programada, a diferencia de la AV de corta duración. Es importante elegir bien el paciente y el momento de implantarlo, de manera que no sea muy tarde para evitar disfunción hepática-renal o del ventrículo derecho (que son factores de riesgo de mortalidad), ni muy pronto para así evitar la morbilidad neurológica asociada al BH.
Actualmente en los pacientes pediátricos estos dispositivos se indican como puente al trasplante y solo excepcionalmente en pacientes mayores (niños grandes, adolescentes) como terapia de destino. La AV de larga duración permite disminuir o retirar inotrópicos, la extubación del niño, iniciar la alimentación oral, movilización progresiva, mayor colaboración de los padres en los cuidados de su hijo y poder trasladarlo a la planta de hospitalización. El BH EXCOR® tiene una tasa de éxito como puente al trasplante o a la recuperación al año superiores al 75%15 y están descritos casos que felizmente se trasplantan tras prolongados tiempos de asistencia16. Como inconvenientes, precisa anticoagulación y doble antiagregación que inevitablemente asocian importantes complicaciones tromboembólicas17, la morbilidad neurológica en series llega hasta el 29% y es la principal causa de mortalidad hospitalaria, y habitualmente asocian una estancia hospitalaria prolongada porque solo excepcionalmente son dados de alta a su domicilio. El bajo peso (inferior a 5kg), la presencia de fallo renal o hepático y el implante de BH biventricular se asocian a una mayor mortalidad18. Otros estudios también han encontrado mayor mortalidad en pacientes con una CC de base respecto a las miocardiopatías19. Conseguir una óptima pauta de anticoagulación y antiagregación es más complicado en niños que en adultos, aun a pesar de hacer controles exhaustivos de la agregación plaquetaria y tener el tromboelastograma a pie de cama. La trombogénesis está aumentada en los niños ya que la relación entre la superficie de la AV por la que se impulsa la sangre y la volemia del paciente siempre es mayor que en adultos y también porque requieren flujos más bajos que en adultos. Las cánulas de menor diámetro usadas en pediatría también aumentan la hemólisis. Probablemente por estos factores la AV pulsátil es preferida en niños frente a la continua.
Existen 5 tamaños de bomba BH que permiten eyectar diferentes volúmenes de sangre (10, 25, 30, 50 y 60ml), que se ajustan, respectivamente, a unas cánulas de silicona específicas de entrada y salida, lo cual permite que este dispositivo se pueda colocar en pacientes de cualquier peso y edad (desde el neonato hasta la edad adulta). Las válvulas de entrada y salida de sangre por la bomba BH son de poliuretano en los modelos pequeños (10, 25 y 30ml) y mecánicas en los de 50 y 60ml.
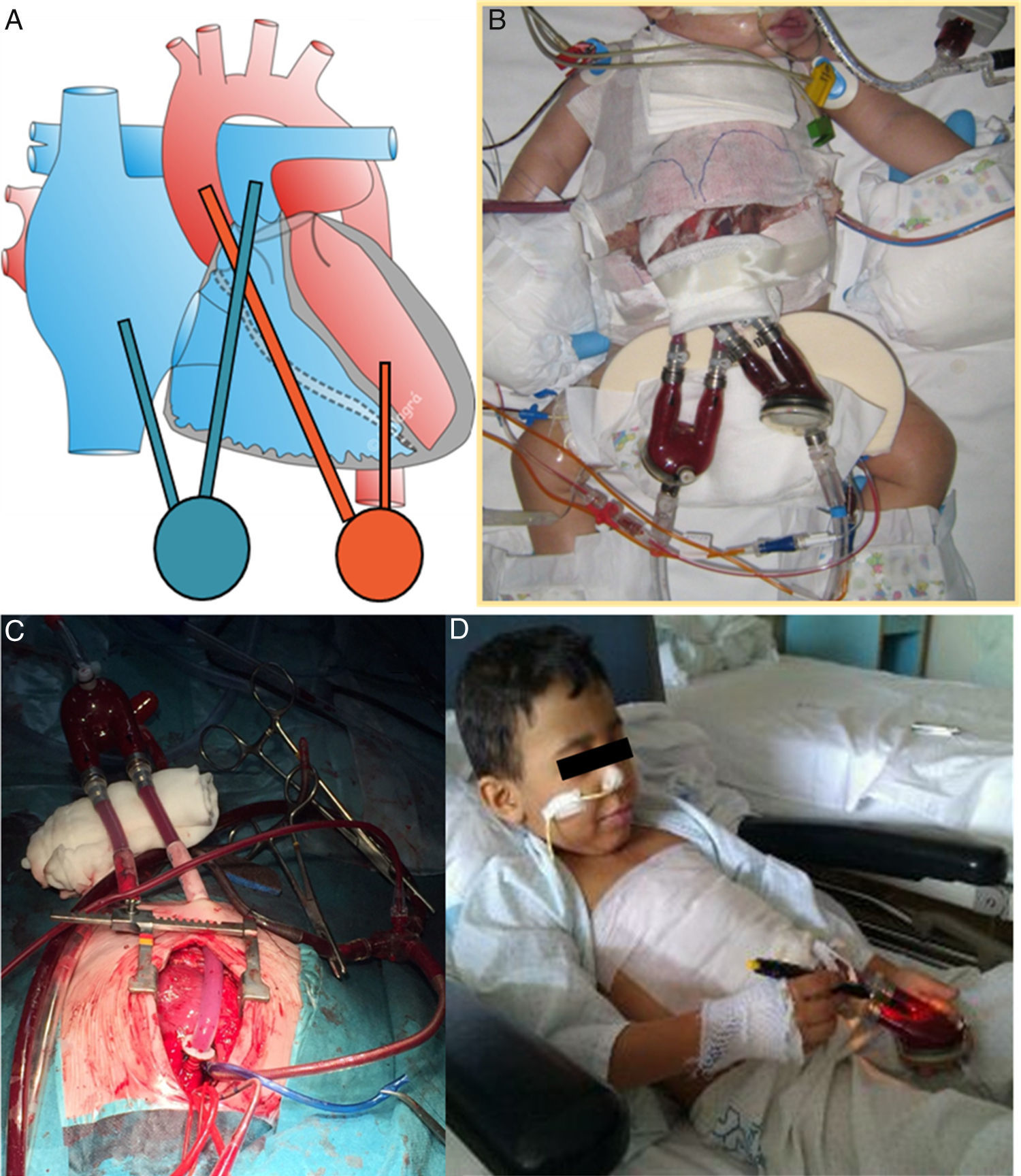
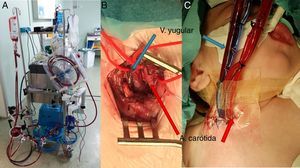
Se describe a continuación nuestra técnica de implante, que es similar a la empleada en la mayoría de los centros20. La cirugía se realiza en quirófano, bajo anestesia general y con control de ecocardiografía transesofágica. Después de la esternotomía media recomendamos hacer toda la disección posible antes de heparinizar para minimizar el sangrado. Tras heparinización sistémica completa se establece una CEC con canulación de aorta y bicava e hipotermia leve, y hacemos los canales por donde van a salir las cánulas en la pared abdominal anterior (evitando entrar en peritoneo) dejando a ese nivel una cinta de algodón como referencia. Habitualmente, evitamos el pinzado aórtico y el procedimiento se realiza con el corazón latiendo o fibrilando, opcionalmente se puede colocar un drenaje de cavidades izquierdas. El tamaño de la bomba y el calibre de sus cánulas los habremos elegido previamente, según el peso y la superficie corporal. Completamos la disección hasta movilizar completamente el corazón para colocar la cánula en ápex del ventrículo izquierdo, apoyada en una corona de puntos con pledget de polipropileno transmurales en U. Tras anudar los puntos y comprobar la hemostasia, pasamos la cánula por el túnel subcutáneo previamente labrado hasta su salida cutánea en el hipocondrio izquierdo. Seguidamente, pasamos la cánula aórtica por el túnel subcutáneo hasta la pared abdominal y la colocamos en la aorta ascendente con pinzado parcial de la misma. Las cánulas grandes se suturan directamente a la aorta y en los pacientes más pequeños (con cánulas n.° 5 y 6) interponemos un conducto de dacrón entre la cánula y la aorta para que el extremo distal de la cánula no protruya y cause obstrucción a la salida de la aorta. Una vez colocadas las 2 cánulas, se reinicia la ventilación mecánica y se llena el ventrículo izquierdo para conectar las cánulas a la bomba del BH previamente purgada con suero. Es crucial eliminar todo el aire que quede en el circuito para que no embolice antes de poner en marcha la asistencia. Se dan unos latidos de prueba y si todo es correcto se comienza la asistencia con el BH, la ventilación se optimiza y la CEC se va retirando progresivamente. Valoramos visualmente observando el movimiento del diafragma y con el ecocardiograma si la bomba se llena y vacía bien, para ajustar los parámetros de la consola de manejo (frecuencia, presiones y tiempo de llenado y vaciado de la bomba BH). Si esta no se llena bien, puede ser por falta de llenado (mejoraría con volumen) o por fallo del ventrículo derecho que no manda sangre hacia el izquierdo (valorar inotrópicos, óxido nítrico o BH para el ventrículo derecho).
Si también hubiera que poner BH para asistir al ventrículo derecho, colocamos primero la cánula de salida en el tronco pulmonar distal (similar a la cánula aórtica). Después, con 2 bolsas de tabaco se coloca la cánula de entrada del BH en el cuerpo de la aurícula derecha pasándola primero por otro túnel subcutáneo. Se llena el corazón para purgar el aire y las cánulas se conectan a la segunda bomba como en el lado izquierdo. Tras comprobar que el BH funciona bien, se administra protamina, se retiran cánulas de CEC, hacemos hemostasia cuidadosa y colocamos una membrana retroesternal de politetrafluoroetileno expandido que facilita la disección posterior en el momento del explante.
En pacientes pediátricos y/o con CC es importante resaltar alguna peculiaridad. Al colocar la cánula del ápex ventricular izquierdo tenemos que asegurar un correcto llenado de la misma sin obstrucciones, puede ser necesario hacer una amplia resección muscular en casos de hipertrofia severa del ventrículo izquierdo y en lactantes pequeños extirpar parcialmente el aparato subvalvular y algún músculo papilar mitral, o incluso extirpar la válvula mitral completamente. Tenemos que comprobar que el corazón esté septado para evitar shunt derecha-izquierda al asistir el ventrículo izquierdo, por ejemplo, si existieran comunicaciones interauriculares o interventriculares, habría que cerrarlas previamente. Las válvulas semilunares han de ser competentes para que se vacíe bien el corazón: si existiera insuficiencia aórtica o pulmonar severas, habría que cerrar dicha válvula o sustituirla por una prótesis antes de colocar respectivamente un BH izquierdo o derecho.
Las contraindicaciones absolutas para implantar una AV de larga duración21 son: que el paciente presente un fallo multiorgánico terminal, presente una alteración neurológica o una cromosomopatía de mal pronóstico, tenga una infección activa y, por último, la prematuridad y/o el bajo peso extremos.
Las complicaciones más frecuentes son las neurológicas, que representan también la principal causa de mortalidad: el infarto tromboembólico se ve con doble incidencia que el hemorrágico y parece asociarse más con las AV pulsátiles respecto a las de flujo continuo. El riesgo sangrado es máximo en las primeras 2 semanas postimplante y el riesgo trombótico se mantiene constante durante todo el período de asistencia; además en los pacientes pediátricos es complicado encontrar un rango óptimo de anticoagulación. Otras complicaciones, además de las tromboembólicas, son las infecciosas, la disfunción hepática y la pancreatitis (sobre todo en dispositivos paracorpóreos), la insuficiencia aórtica y el sangrado digestivo (sobre todo en dispositivos de flujo continuo).
La AV en pacientes con ventrículo único merece una mención aparte ya que es la CC que con más frecuencia precisa trasplante cardíaco y al mismo tiempo son los pacientes más complejos22. En la situación pre-Fontan, se canularán el ápex ventricular y la aorta manteniendo el flujo pulmonar por la fístula o el Glenn. En los pacientes que presenten fallo de Fontan y disfunción ventricular con resistencias pulmonares normales, se asistirá el ventrículo con cánulas en el ápex y la aorta manteniendo el flujo pulmonar por el Fontan. Por último, en los pacientes que presenten fallo de Fontan y fracción de eyección conservada con resistencias pulmonares elevadas (fallo de circulación Fontan), se hará una AV derecha fabricando un reservorio venoso que reciba la sangre de las cavas como entrada de la AV y como salida se aprovecha el conducto del Fontan previamente desmontado para llevar sangre hacia las ramas pulmonares23. Actualmente, solo hay reportada escasa experiencia, con mortalidad hospitalaria elevada, alrededor del 40%.
Dentro de los dispositivos intracorpóreos que serían de elección en los casos aislados de AV como terapia de destino, actualmente solo están disponibles para niños mayores-adolescentes; en la literatura solo hay reportados casos sueltos24 y en nuestro país aún no se ha implantado ninguno en edad pediátrica. Se podría optar por el BH INCOR®, que es pulsátil, el HeartMate-II®, que es una bomba axial de flujo continuo, y el HeartWare®, que es una bomba centrífuga de flujo continuo (estos 2 últimos sólo pueden proporcionar AV izquierda, no biventricular).
PedimacsEs el mayor registro de pacientes pediátricos con AV. Este primer reporte25 revisa a 130 pacientes de edad inferior a 18 años con 153 AV implantadas entre septiembre del 2012 y marzo del 2014. La mayoría de los pacientes (45%) tenían una edad entre 10 y 18 años, y el 25% eran menores de 5 años. La etiología más frecuente fue miocardiopatía en el 67% y CC en el 20%. Como antecedentes destacan que el 24% de los pacientes tenían alguna cirugía cardíaca previa y el 19% ECMO previa. La mayoría de los pacientes (55%) se encontraban en una categoría ii de INTERMACS. Los dispositivos de corta duración fueron el 17% y de los de larga duración los pulsátiles constituyen un 43% frente a los de flujo continuo (40%), a diferencia de los usados en adultos, que tienen claro predominio de los de flujo continuo. La AV fue izquierda en el 76% y biventricular en el 18%. Los resultados fueron excelentes ya que a los 6 meses el 54% fue trasplantado, el 37% seguía vivo con la AV, el 8% falleció y el 1% se recuperó. Los efectos adversos más frecuentes fueron infección (27%), sangrado (26%), malfunción del dispositivo (24%) y alteración neurológica (21%).
Nuestra experienciaEn el Hospital Universitario La Paz usamos como AV Rotaflow® con o sin oxigenador para corta duración y BH EXCOR® para larga duración. La ECMO siempre es un procedimiento urgente que indicamos como puente a la recuperación en el paciente que no logramos desconectar de CEC tras cardiotomía y en las miocarditis agudas, y como puente al trasplante en los pacientes candidatos a trasplante que presentan un deterioro clínico brusco. El BH lo hemos implantado siempre de forma programada y generalmente como puente al trasplante. A continuación, referimos nuestra experiencia en los últimos 10 años.
Durante el tiempo comprendido entre 2006 y 2016, implantamos 73 AV en pacientes pediátricos (edad inferior a 18 años), que supone un 2,9% del total de nuestras cirugías realizadas durante ese período en pacientes de esa edad. Del total de AV, 54 (74%) fueron de corta duración (53 ECMO y 1 AV izquierda sin oxigenador), y 19 (26%) de larga duración tipo BH EXCOR®.
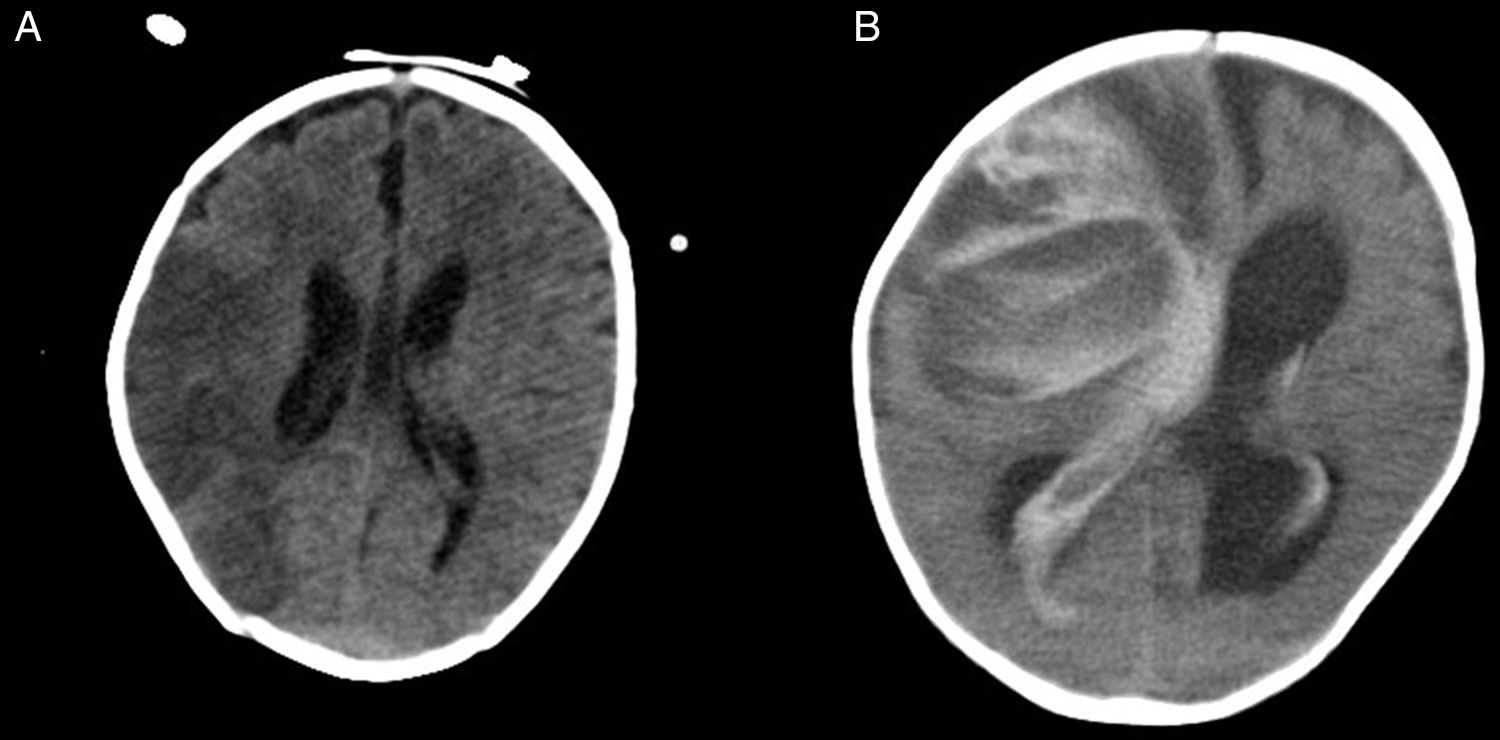
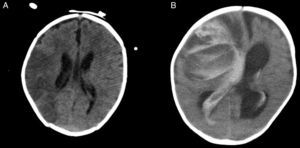
Pacientes con asistencia ventricular de larga duración tipo BH EXCOR®Nuestros 19 pacientes tenían una edad media de 50±58 meses (rango: 1-180) y peso medio de 18±17kg (rango: 3-65). Su cardiopatía de base fue miocardiopatía en el 84% (dilatada en 13 casos, restrictiva en 3) y CC en 3 pacientes (Fontan con miocarditis por gripe A, Ebstein severo con disfunción biventricular y doble discordancia con disfunción ventricular severa). Precisaron ECMO previo 5 pacientes (28%). El BH fue biventricular en 6 pacientes (31%) y univentricular en 13 (69%) pacientes, aunque uno posteriormente pasó a ser biventricular (fig. 2). Utilizamos como anticoagulante heparina sódica, que posteriormente se sustituyó por acenocumarol o heparina de bajo peso molecular, y como doble antiagregación aspirina y dipiridamol, sustituyendo posteriormente este último por clopidogrel. Las complicaciones más frecuentes fueron las relacionadas con la anticoagulación consistentes en trombosis y hemorragia, siendo las ocurridas a nivel cerebral la principal causa de mortalidad (fig. 3), seguidas de las infecciones.
El tiempo de asistencia medio ha sido de 83±64 días (rango: 8-210), con 7 (37%) pacientes fallecidos (3 de 6 biventriculares y 4 de 13 univentriculares), 11 (58%) trasplantados y un paciente (5%) que continúa con el BH. Todos los pacientes trasplantados se fueron de alta hospitalaria, uno presentó un rechazo hiperagudo que precisó ECMO postoperatoria y otra paciente falleció súbitamente al año del trasplante; el resto de los niños actualmente están vivos y en grado funcional i.
Pacientes con asistencia ventricular de corta duraciónDividimos estos 54 pacientes según su indicación de ECMO: pretrasplante (12), en procesos agudos (7) y poscardiotomía (35)
Los 12 pacientes que estaban en lista de trasplante y precisaron ECMO tras deterioro brusco, evolucionaron de la siguiente manera: 4 fallecieron y 5 pasaron a BH tras 14 días de ECMO. Finalmente, 6 pacientes fallecieron en lista (4 con ECMO y 2 con BH tras ECMO) y otros 6 (50%) llegaron a trasplantarse con éxito.
De los 7 pacientes que presentaron procesos agudos que cursaron con shock cardiogénico refractario al tratamiento médico convencional y precisaron ECMO, se recuperaron 4 (57%) pacientes (2 miocarditis no requirieron cirugía y otros 2 pacientes requirieron plastia valvular tras la desconexión de ECMO) y fallecieron 3 (43%).
El implante de ECMO poscardiotomía lo indicamos cuando no podemos desconectar de CEC al paciente tras cirugía reparadora o paliativa de su CC, o porque presenta fallo cardíaco refractario en los primeros días del postoperatorio inmediato. Se usó con más frecuencia en neonatos (11) y lactantes (15), respecto a los niños entre 1-18 años (9). La patología de base fue diversa (tabla 2), destacando principalmente la D-trasposición de grandes arterias, la situación Fallot y el estado postrasplante cardíaco. Reoperamos por sangrado al 60% de los pacientes. Logramos retirar la ECMO en 22 pacientes (63%) y finalmente se dieron de alta hospitalaria 19 (54%). Con el paso del tiempo, hemos ido ganando experiencia que parece favorecer la supervivencia de nuestros pacientes, ya que en la primera parte de nuestra experiencia (años 2006-2011) falleció el 58% y en los últimos años (2012-2016) esta cifra ha descendido al 39%.
Indicaciones de ECMO poscardiotomía en pacientes pediátricos del Hospital Universitario La Paz durante el período 2006-2016
| Diagnóstico | N.° de pacientes | Mortalidad hospitalaria |
|---|---|---|
| D-TGA | 6 | 3 |
| Trasplante cardíaco | 5 | 2 |
| Situación Fallot | 5 | 0 |
| Ventrículo único | 4 | 1 |
| Truncus | 3 | 3 |
| Ross-Konno | 2 | 1 |
| Valvulopatía mitral | 2 | 0 |
| Canal transicional | 2 | 1 |
| DVPAT | 2 | 1 |
| Estenosis pulmonar | 1 | 1 |
| AP-CIV-MAPCAS | 1 | 1 |
| Bronquiolitis en arco operado | 1 | 1 |
| APSI | 1 | 1 |
Las columnas de izquierda a derecha refieren el diagnóstico basal de los pacientes, el número de ellos que precisaron ECMO y el número de ellos que fallecieron hospitalariamente.
AP-CIV-MAPCAS: atresia pulmonar con comunicación interventricular y grandes colaterales aorto pulmonares; APSI: atresia pulmonar con septo intacto; D-TGA: D-trasposición de grandes arterias; DVPAT: drenaje venoso pulmonar anómalo total, N.°: número.
La AV es fundamental en el fallo cardíaco que no responde al tratamiento médico convencional y su uso en pediatría ha crecido exponencialmente en la última década. Los niños y pacientes con CC manejados por un grupo multidisciplinar con experiencia en AV logran disminuir las cifras de mortalidad hospitalaria y mejorar la supervivencia posterior. La AV de corta duración puede funcionar como puente a la recuperación, la decisión o el trasplante. La AV de larga duración en la población pediátrica prácticamente solo se usa como puente al trasplante. Persiste un problema aún no resuelto que es el manejo de la anticoagulación, con sus complicaciones hemorrágicas y tromboembólicas que causan importante morbimortalidad en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro sincero agradecimiento a todo el personal implicado en el cuidado de estos pacientes y en especial a los DUES de perfusión (Sr.J. Segura y Sr. M. A. Villar), que con su experiencia, ilusión y buen hacer son el alma de la AV en nuestro centro.