El estrés oxidante ocasiona un aumento en las especies reactivas de oxígeno. Durante el estrés oxidante se produce la pérdida del balance entre oxidantes y antioxidantes a favor de los primeros, los cuales se han asociado a diversas enfermedades como la fluorosis dental y la gingivitis. Este artículo presenta información sobre los sistemas antioxidantes y particularmente sobre la familia glutatión y su papel en enfermedades bucales. Este sistema enzimático lo conforma la glutatión oxidasa, glutatión reductasa, glutatión peroxidasa y glutatión S-transferasa. Estas enzimas neutralizan radicales libres, reducen las especies reactivas de oxígeno y participan en la defensa del organismo ante numerosas alteraciones como algunos tipos de cáncer, infecciones, diabetes mellitus, artritis reumatoide, fibrosis quística, sida, retinopatías, cirrosis, y malnutrición proteica, entre otras. En el caso de las enfermedades bucales como la fluorosis dental y la gingivitis, las alteraciones en el sistema enzimático glutatión producen una modificación en la respuesta de la glutatión S-transferasa debido a niveles elevados de fluoruros en el caso de la fluorosis dental y la disminución en la capacidad de neutralizar las especies reactivas de oxígeno durante los procesos inflamatorios en el caso de la gingivitis. Por ello, es importante caracterizar los procesos que modifican la función del sistema enzimático glutatión, de tal forma que se identifiquen vías para mejorar su funcionamiento durante procesos que generan estrés oxidante.
Oxidative stress (OS) can cause an increase in reactive oxygen species (ROS) levels and disruptions of the oxidant/antioxidant balance. This article provides information about antioxidant systems, particularly the glutathione family, and the role of OS in dental fluorosis and gingivitis. OS leads to increased levels of various oxidizing agents that have been associated with several diseases. These oxidizing species can inhibit protective enzyme systems in the body. The glutathione family of enzymes, including glutathione oxidase, glutathione reductase, glutathione peroxidase and glutathione S-transferase (GST) participate in defense processes against oxidation by neutralizing free radicals. This system has been implicated in defending the body against free radicals in many disorders, including various types of cancer and infections, diabetes mellitus, rheumatoid arthritis, cystic fibrosis, AIDS, retinopathy, cirrhosis, and protein malnutrition, among others. Oral health is also affected by changes in the glutathione system, as dysregulation of this system has being associated with periodontal disease, dental fluorosis and gingivitis. The effects on the glutathione system produce changes in the response of the GST due to high levels of fluoride in the dental fluorosis. In gingivitis, a decreased has been found in the ability of GST to reduce ROS during inflammatory process. The glutathione system plays a key role in the reduction of ROS, thereby preventing the cell damage that these compounds produce in the human body. It is therefore important to characterize the processes that modify the function of glutathione enzyme system, so that pathways are identified to improve its performance during the processes generating oxidative stress.
El estrés oxidante (EO) consiste en la pérdida del balance entre oxidantes y antioxidantes a favor de los primeros1. El daño oxidante puede ocurrir por aumento en la producción de especies reactivas de oxígeno (ROS en inglés reactive oxygen species), debido a que se encuentran en una concentración elevada y no alcanzan el último eslabón de la reducción de oxígeno, el agua, y se produce la oxidación de moléculas biológicas, tales como proteínas, carbohidratos, ADN, lípidos, enzimas de transporte y mecanismos celulares de transcripción1–3. Se asocia al EO con diferentes enfermedades, tales como las cardiovasculares, neurodegenerativas, diabetes, procesos inflamatorios mediados por citocinas, isquemia, metástasis y enfermedades bucales como fluorosis dental y la gingivitis, y en esta última ocurre daño en el ámbito local dentro de los tejidos periodontales3,4. Se considera al EO como parte de la fisiopatología de muchas enfermedades, y se sugiere que los agentes que lo disminuyen pueden desempeñar un papel importante en su tratamiento3.
Especies reactivas de oxígenoLas ROS y los xenobióticos se asocian a diversos padecimientos o alteraciones en el organismo, que pueden ir desde efectos tóxicos leves hasta carcinogénicos. Los radicales libres son especies provenientes de grupos hidroxilo, superóxido y alcóxido; sin embargo, otras especies que no son radicales libres como el peróxido de hidrógeno, el ácido hipocloroso y el oxígeno singlete también pueden causar EO. Estas especies producen daño en los tejidos a través de diferentes mecanismos, entre los que se encuentran el deterioro proteico, la peroxidación lipídica, la estimulación de citocinas proinflamatorias, liberadas por monocitos y macrófagos, daño en el ADN y la oxidación de enzimas importantes en el organismo. Por tal motivo, su estudio es de suma importancia en diferentes enfermedades5.
Sistemas antioxidantesExisten diversos sistemas antioxidantes, algunos de los cuales están presentes en la dieta y contribuyen a la protección del organismo ante agentes o elementos extraños que ocasionan daños a nivel celular6,7. De acuerdo con Battino et al., los sistemas antioxidantes pueden clasificarse en 3 grupos: el primero, de antioxidantes preventivos que suprimen la formación de radicales libres, incluye la superóxido dismutasa (SOD), catalasa (CAT), carotenoides, transferrina, albúmina, glutatión peroxidasa y glutatión S-transferasa6–9. El segundo, que se encarga de secuestrar radicales libres y eliminarlos, está conformado por el ácido úrico, bilirrubina, vitaminas A, C y E. El tercer grupo, que repara el daño ocasionado por los radicales libres en el entorno de la membrana celular, lo conforman enzimas de reparación del ADN, lipasa, proteasas y transferasas6.
GlutatiónEl glutatión (GSH) es un antioxidante que participa en la inhibición enzimática, reducción de ROS e inactivación de xenobióticos, controla la permeabilidad de la membrana y el transporte de aminoácidos, funciona como coenzima, interviene en el proceso de apoptosis y síntesis de proteínas, ADN y ARN, además de regular la formación y el mantenimiento de la forma activa de ciertas enzimas3,10.
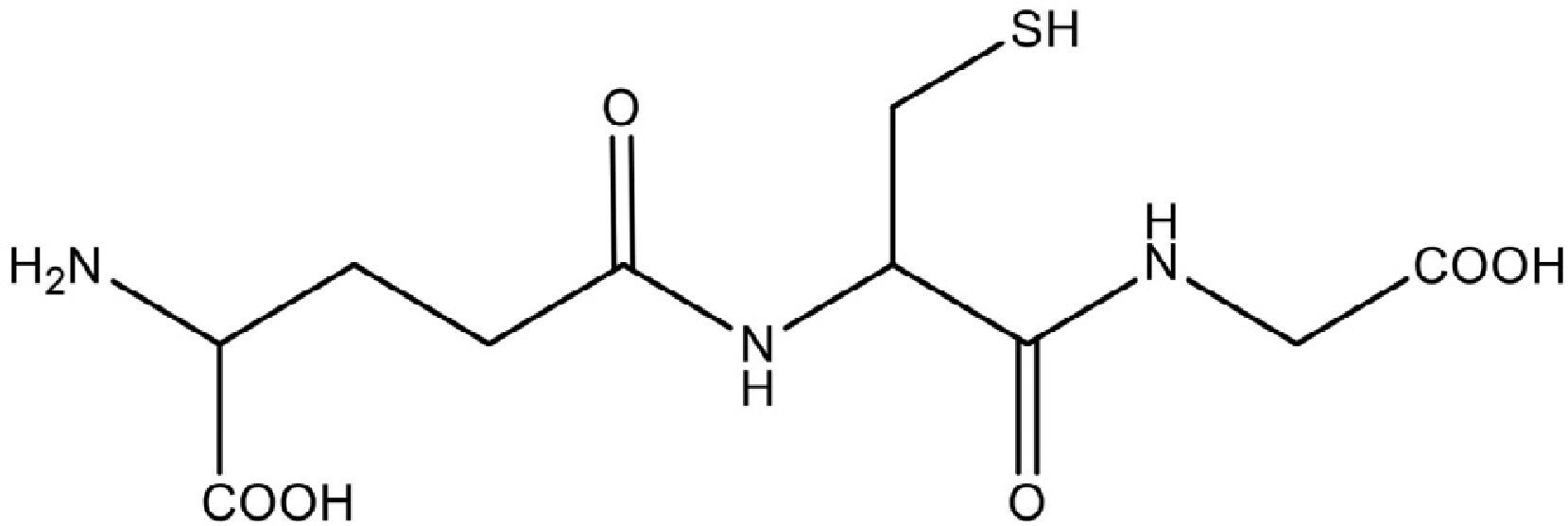
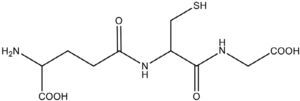
El GSH es un tripéptido de bajo peso molecular formado por los aminoácidos: ácido glutámico (glutamato), glicina y cisteína (Glu-Gly-Cys), y se conoce químicamente al GSH reducido como N-(N-L-gamma-glutamil-L-cisteinil) glicina, con formula molecular de C10H17N3O6S y peso molecular de 307.33g.mol–1 (fig. 1)3,11.
Estructura química del glutatión reducido (Sarra-sague, 2006)3.
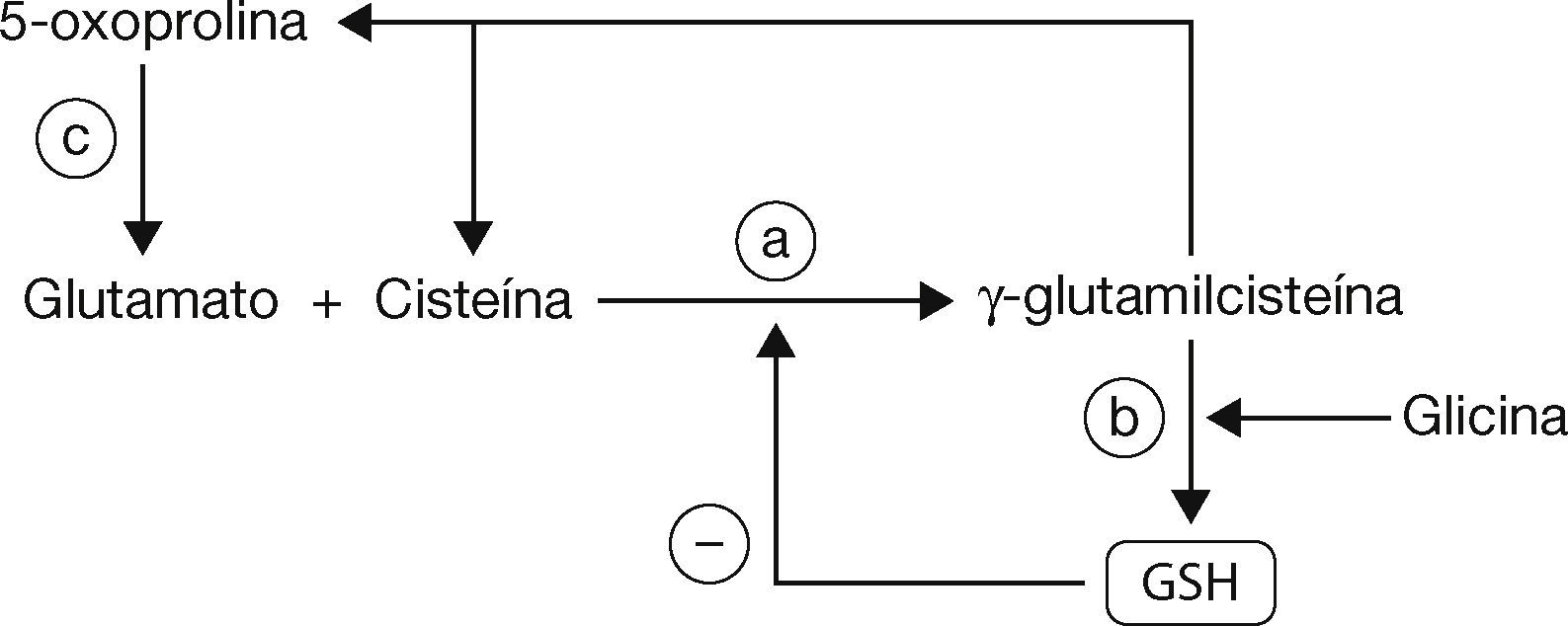
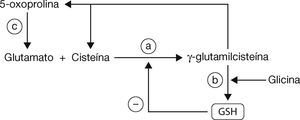
En la síntesis del GSH, inicialmente se unen el glutamato y la cisteína, para que al final se adicione la glicina mediante la intervención de la enzima gamma-glutamil-cisteína sintetasa (gamma-GCS) (fig. 2, paso a) y la GSH sintetasa (fig. 2, paso b). Por otra parte, la gamma-glutamil-cisteína no convertida en GSH sigue una ruta alternativa, produciendo cisteína y 5-oxoprolina; esta última será convertida en glutamato vía la enzima 5-oxoprolinasa (fig. 2, paso c) para evitar la pérdida de los aminoácidos3,11.
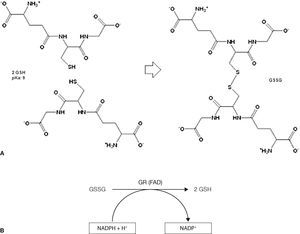
Síntesis/metabolismo del GSH (modificado de Sarra-sague, 2006)3.
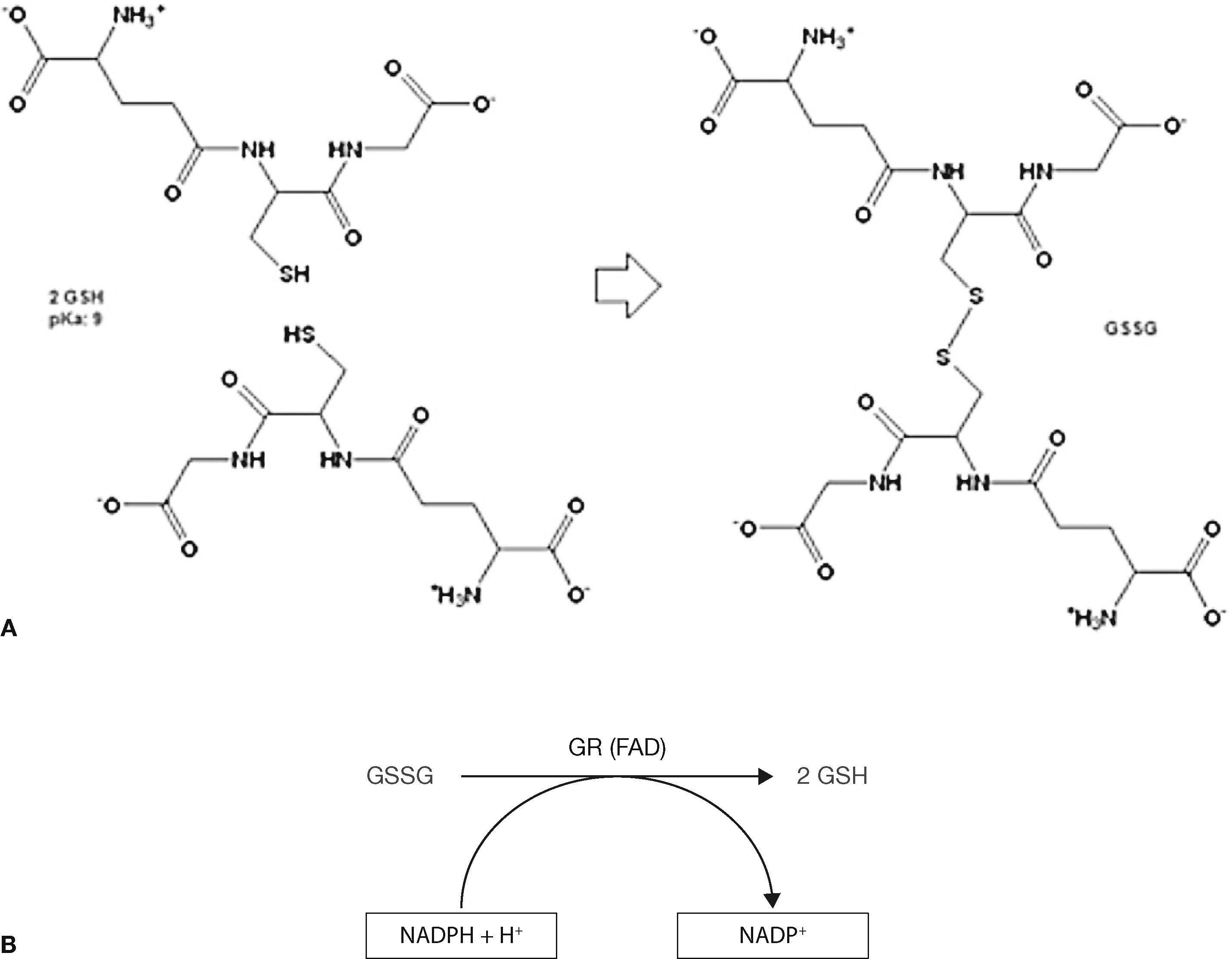
El GSH puede encontrarse como GSH en su forma reducida (tiol libre) o como glutatión disulfuro (L-gamma-glutamil-L-cisteinil-glicina disulfuro) con fórmula molecular C20H32N6O12S2 en su forma oxidada o GSSG (formando puentes disulfuro). El GSSG es reducido nuevamente a través de la glutatión reductasa, lo que ocasiona que el GSH sea la especie predominante en la célula (fig. 3), de tal forma que entre el 80 al 85% se localiza en el citosol, del 10 al 15% en la mitocondria, y una pequeña parte en el retículo endoplásmico11.
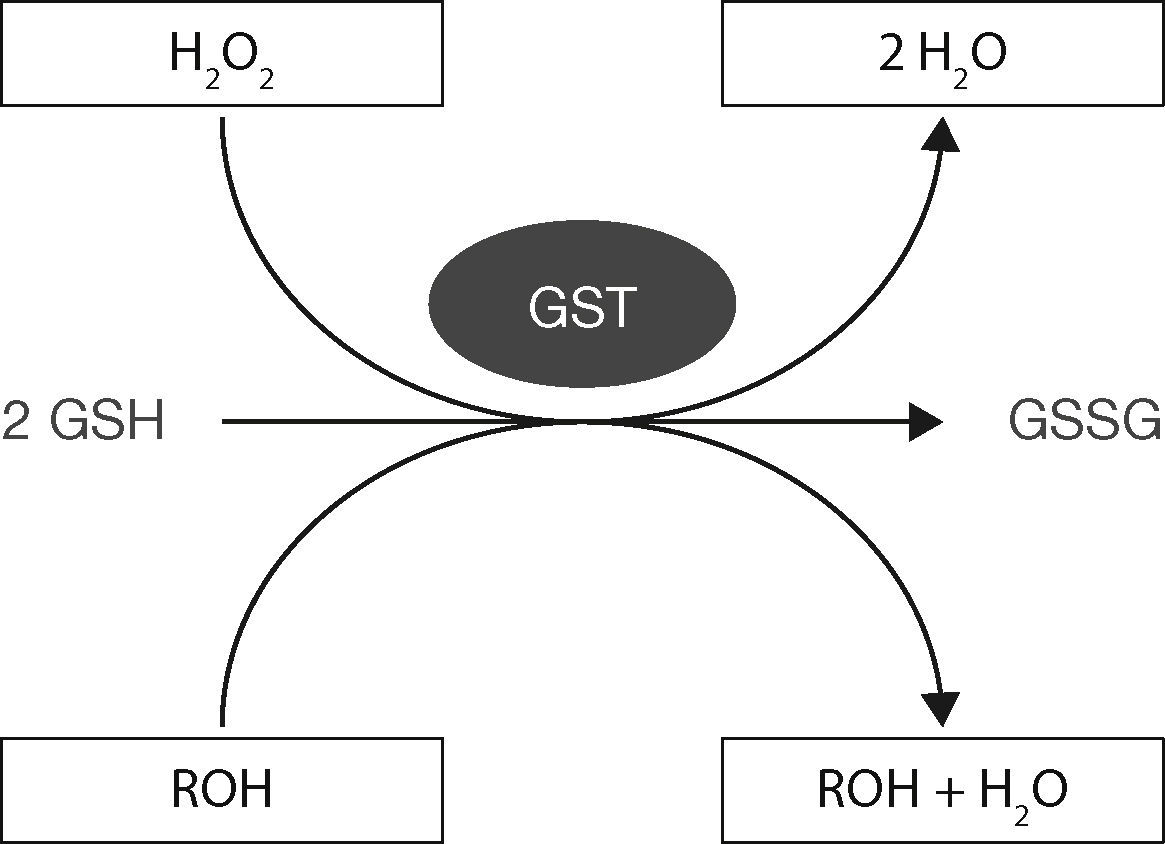
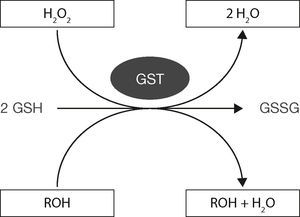
Mecanismo de acción del glutatiónLas características nucleofílicas del GSH aportadas por su grupo tiol libre le permiten reducir diversos compuestos con características electrofílicas como pueden ser los peróxidos y disulfuros al donar un protón y lograr la ruptura de diversos enlaces (fig. 4), proteínas, factores de transcripción y moléculas previamente oxidadas8,11–13.
Esquema del funcionamiento GST-GSH para eliminar compuestos tóxicos (oxidados). Modificado de Shelly, 201311.
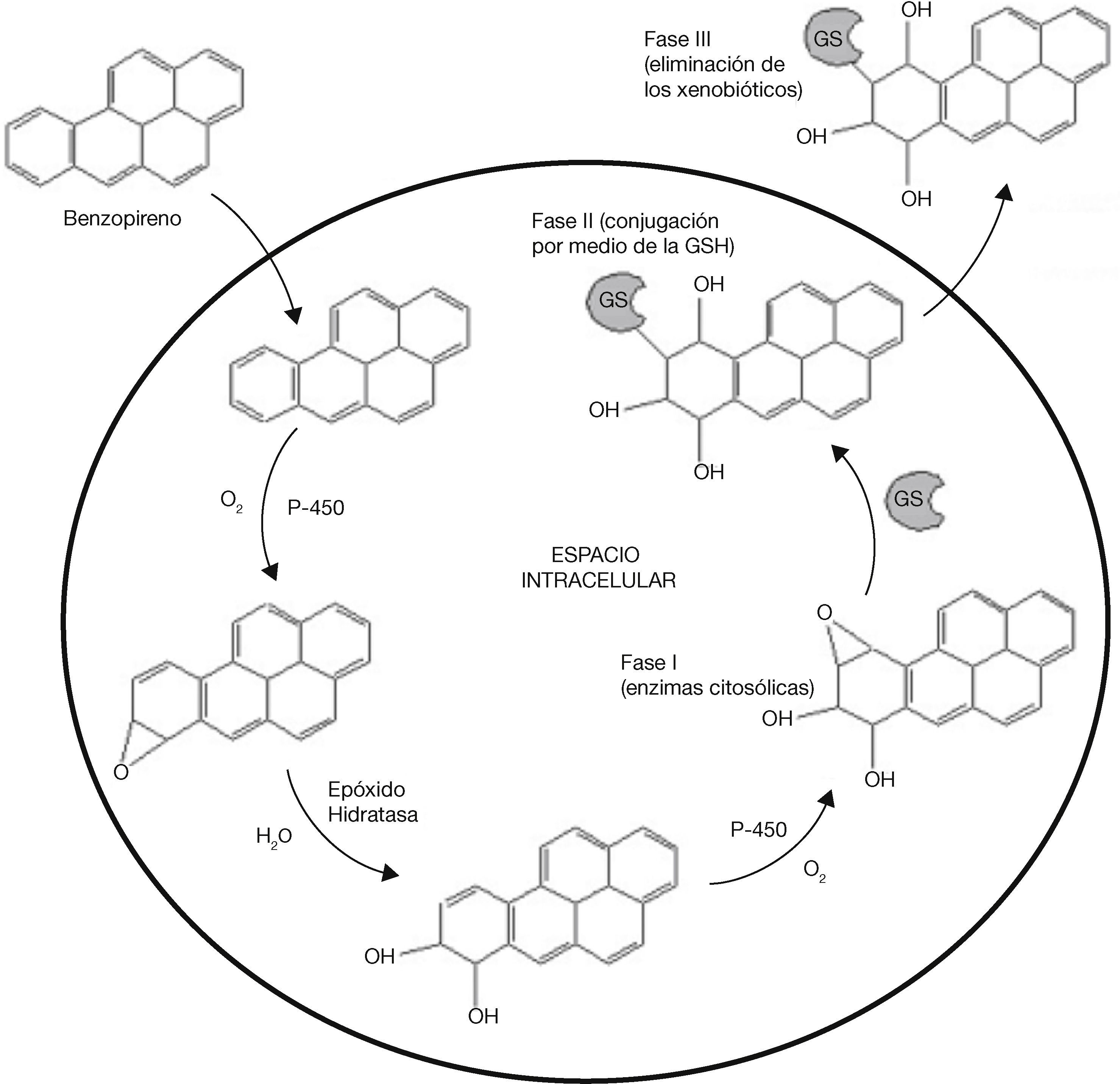
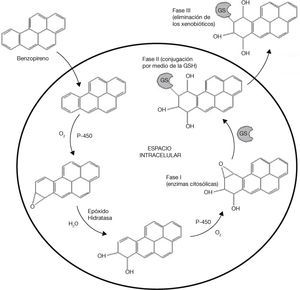
Además, en los procesos de detoxificación como se ejemplifica en el caso del benzopireno, el GSH no es el único elemento que interviene en dicho proceso. Las enzimas citosólicas de la fase I comienzan la detoxificación y, posteriormente, la GSH (enzima de fase II) realiza una conjugación y origina un xenobiótico que puede difundirse a través de la célula para su excreción mediante una bomba transmembranal activada por la ATPasa. La excreción es unidireccional, ya que el resto del GSH hidrófilo impide que se vuelva a difundir nuevamente el conjugado a través de la membrana plasmática, excretando estos compuestos como ácidos mercaptoúricos (fase III) que aparecen en la orina (fig. 5)3,8.
Mecanismo de acción del GSH en la eliminación del benzopireno (modificado de Sheehan, 2001)8.
La glutatión S-transferasa (GST; EC 2.5.1.18) es una enzima dimérica responsable de la biotransformación fase II de distintos compuestos electrofílicos mediante procesos de conjugación2,8,14,15. Además de estas reacciones, la GST efectúa reacciones de reducción e isomerización, interviene en la biosíntesis de prostaglandinas y esteroides, catabolismo de tirosina y la apoptosis celular, entre otras funciones16.
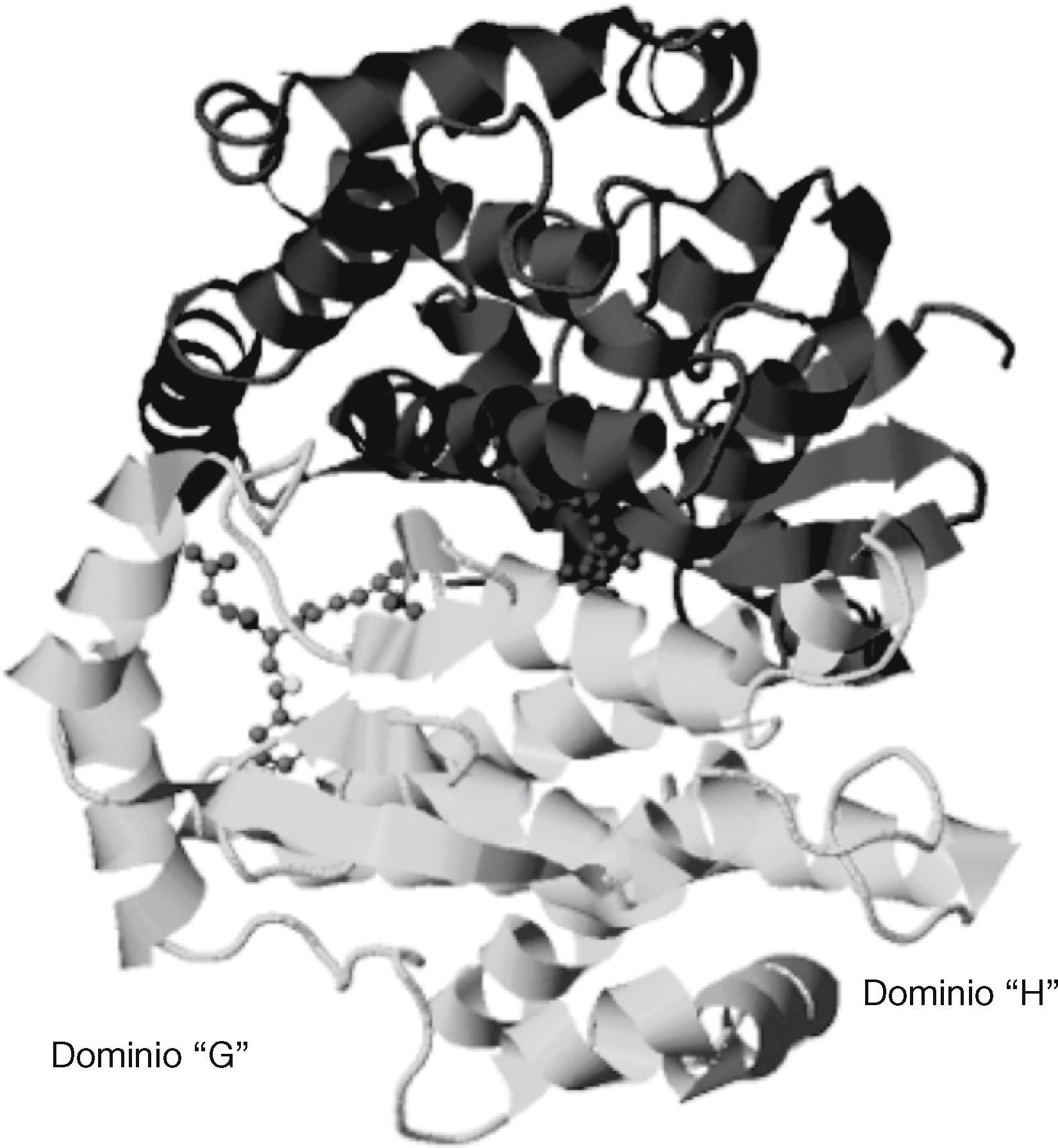
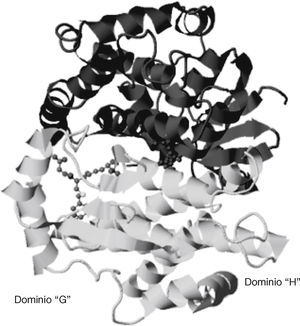
Las GST humanas tienen 3 familias: citosólicas, mitocondriales y membranales asociadas a proteínas de los eicosanoides y al metabolismo del GSH. Una unidad de GST del extremo N-terminal consiste en un dominio alfa/beta (o dominio G para la unión con GSH) y un dominio formado por estructuras en hélice alfa (o dominio H para la unión con sustratos hidrofóbicos). La unión del GSH con la GST en el dominio G ocurre en el extremo de la hoja beta1 con el resto de la proteína del gamma-glutamil, anclado mediante puentes de hidrógeno en la unidad beta3-beta4-alfa3. El GSH corre antiparalelo al asa que proviene de la hebra beta3 que origina uniones entre los hidrógenos de los residuos de cisteína del GSH y de la cadena principal de la proteína. En el caso de la unión de los sustratos en el dominio H en el GST, este se encuentra adyacente al sitio G donde se une el GSH y está conformado por 3 regiones: el asa entre la hebra beta1 y la hélice alfa1, la hélice alfa4, y/o el extremo C-terminal16. De esta forma, el dominio G es el sitio en el cual se une el GSH para su interacción con diversos compuestos y el dominio H, el responsable de la unión a moléculas hidrofóbicas (fig. 6)17.
Estructura dimérica de la GST A1-1 (Protein Data Bank) indicando los dominios G y H, respectivamente17.
Actualmente, la Organización Mundial de la Salud indica que existen diversas enfermedades bucales que afectan a gran parte de la población, como la caries dental que se presenta entre el 60 y el 90% de los escolares de todo el mundo, mientras que entre el 5 al 15% de la población presenta periodontitis grave18,19.
En México, los datos del Sistema de Vigilancia Epidemiológica de Patologías Bucales 2011 indican que el 95.5% de la población examinada presentó caries dental, en donde el grupo de 20 a 24 años mostraron el 88.6% de prevalencia de caries y en los grupos de 45 a 79 años se detectaron cifras superiores al 98%20. Por otra parte, aproximadamente tres cuartas partes de los niños y adolescentes manifiestan sangrado gingival (74.2%), el 21.6% de los examinados en el grupo de edad de 20 a 49 años presentó hemorragia gingival, mientras que en aquellos en edades comprendidas entre 50 a 79 años y adultos con más de 80 años el 12.9 y 16.1%, respectivamente, presentaron bolsas periodontales con más de 4 mm de profundidad20. Según la OMS, la caries dental y las parodontopatías son las principales causas de pérdida dentaria. El edentulismo afecta entre el 5 y 20% de los adultos18. Por otra parte, una enfermedad bucodental cuya prevalencia ha aumentado en años recientes es la fluorosis dental, la cual se ha observado en diversas zonas endémicas de México21.
Fluorosis dentalEl flúor es un elemento clave en la prevención y el control de la caries dental. Su principal mecanismo de acción se relaciona con su capacidad para remineralizar el esmalte que ha sido dañado por los ácidos bacterianos durante el proceso de caries dental22–24. La fluorosis dental se produce por el exceso en la ingesta de fluoruros durante etapas de formación dentaria23–26. Este elemento puede ser adquirido por diversas fuentes, tales como el agua y la sal fluorada, los alimentos, el uso de complementos, productos tópicos fluorados e incluso las pastas dentales, cuando estas son ingeridas durante los primeros años de vida22. En población infantil, los niveles recomendados de ingesta diaria de fluoruros se encuentran entre 0.05 a 0.07mg/kg/día para infantes entre los 20 y 30 meses de edad22. La Academia de Nutrición y Dietética de los Estados Unidos sugiere las siguientes dosis: de 0.01mg/día para infantes en los primeros 6 meses de vida, 0.5mg/día para 6 a 12 meses, 0.7mg/día en niños de 1 a 3 años de edad, 1mg/día en niños de 4 a 8 años, 2mg/día para niños de 9 a 13 años de edad, 3mg/día en adolescentes varones y mujeres de 14 a 18 años, 4mg/día en varones de más de 19 años, y 3mg/día en mujeres con más de 19 años27. Asimismo, es importante tomar en cuenta que la sobreexposición a los fluoruros entre 1 a 4 años y quizás hasta los 8 años de edad, se asocia al desarrollo de fluorosis dental en la dentición permanente22.
Entre las características clínicas que se presentan en la fluorosis dental se encuentra el aumento de la porosidad del esmalte, con opacidad o manchas que van de un color blanquecino, amarillo a café obscuro, incluso con zonas de pérdida de estructura dentaria que ocasiona en el esmalte un puntilleo o foseta, en donde estos puntos pueden confluir para formar islas donde el esmalte se ha perdido22. Este último proceso ocurre en etapas posteruptivas, donde las fuerzas oclusales pueden favorecer la pérdida de estructura dentaria23.
Investigaciones realizadas por Aoba et al. sugieren que la presencia de fluoruros influye en la cantidad de iones de calcio que se incorporan a la estructura del diente, causando con ello una hipomineralización y afectando directamente a la maduración del esmalte durante la etapa de la formación dentaria24. De esta forma, los iones de flúor libres contribuyen a la hidrólisis de los precursores ácidos como el fosfato octacálcico y la precipitación de cristales de apatita fluorada que intervienen en la mineralización del esmalte24.
Por otra parte, Fejerskov et al. mencionan que el flúor afecta al esmalte, principalmente en la fase de maduración preeruptiva, en donde el esmalte fluorótico presenta zonas de hipomineralización, mientras que el resto del esmalte se encuentra en proceso de maduración24,28.
Los iones flúor afectan a la precipitación de la hidroxiapatita, existe alteración en la función de los ameloblastos, así como de células de la lámina dental. De esta forma, los fluoruros afectan a la fase de secreción en los ameloblastos, ocasionando una reducción en la producción de proteínas, secreción y concentración de las mismas ocasionada por la respuesta al EO, lo que origina un daño en el proceso de mineralización22,23,29,30.
Debido a que el flúor puede actuar como modulador intracelular en la homeostasis del sistema redox, incrementa la producción de aniones como el superóxido y óxido nítrico, capaces de generar ROS y por consecuencia daño oxidativo. El flúor se asocia a la disminución de la actividad antioxidante de diversos componentes del organismo. Este proceso sugiere una modificación en la cantidad de GSH debido al exceso de las ROS30. Diversos estudios in vitro e in vivo en células, tejidos, animales y en personas que viven en zonas endémicas con fluorosis dental indican que los fluoruros inhiben la actividad de enzimas antioxidantes como la SOD, CAT y GSH debido al elevado número de ROS que se encuentran en el ámbito mitocondrial, lo que origina en la mayoría de los casos un aumento en la oxidación de lípidos y proteínas. Sin embargo, no se observó este fenómeno en todos los casos debido a que los niveles de GSH en la sangre, tejidos o incluso la saliva difieren debido a la presencia de otros sistemas antioxidantes que actúan en presencia de ROS30.
Estudios realizados en el cerebro de ratas que fueron sometidas a una elevada ingesta de fluoruro de sodio (20mg/kg de peso/día durante 14 días) mostraron una disminución en la actividad de enzimas como la SOD, CAT y GST9. Por otra parte, Reddy et al. observaron un incremento en los niveles de EO en niños de 3 a 10 años de zonas endémicas con fluorosis esquelética debido al aumento de malonildialdehído que origina la disminución de los niveles de GSH9.
La cantidad de GSH y GST se modifica como respuesta a niveles elevados de fluoruros durante la fase de maduración preeruptiva o en procesos donde ocurre estrés oxidante31.
GingivitisLa gingivitis es un proceso inflamatorio originado por la biopelícula microbiana que se encuentra en la superficie dental adyacente al tejido gingival e induce una respuesta inmune, la cual afecta al huésped en diferentes niveles. Al no eliminarse por completo la placa dentobacteriana (biopelícula), los productos microbianos producen un daño continuo en el periodonto, en donde bacterias como Porphyromonas gingivalis, Actinobacillus actinomycetemcomitans y Bacteroides forsythus son las responsables del daño en el tejido32,33. De esta forma, las bacterias patógenas y otros componentes inflamatorios pueden originar una respuesta inmune que ocasiona un aumento en las citocinas y la actividad inmunológica en los tejidos gingivales, incluyendo el número de leucocitos polimorfonucleares, en donde las metaloproteinasas de la matriz e interleucinas que son mediadoras de la respuesta inflamatoria se modifican, debido al daño en el tejido1,34.
Durante este proceso, se altera la cantidad de fluido crevicular gingival, lo que ocasiona una modificación en la composición de la saliva al producir sustancias que responden al proceso de inflamación, el cual desempeña un papel importante en el control y/o modulación de los daños oxidativos de la cavidad bucal6,35,36.
Se han realizado estudios para identificar los componentes que intervienen en los procesos inflamatorios gingivales a través del análisis del fluido crevicular gingival, en los que se han detectado cambios en los niveles de la GST. Se observó que la migración de los neutrófilos a través del surco gingival promueve la formación de las ROS, las cuales modifican su concentración durante el proceso inflamatorio, así como la concentración del GSH dentro del fluido crevicular gingival36.
Se determinó que muchas de las ROS localizadas en la cavidad bucal se originan por procesos en los que intervienen fagocitos, en donde el GSH reducido y enzimas antioxidantes como la CAT, la SOD y diversas vitaminas actúan previniendo el daño en los procesos inflamatorios ocasionados por hidroperóxidos. La literatura sugiere que los pacientes con enfermedades bucales relacionadas con procesos inflamatorios muestran un nivel más bajo de GSH en el fluido crevicular gingival. Esto se ha observado una vez determinados los componentes que originan el proceso oxidativo y aquellos que se derivan del mismo, incluyendo la oxidación de lípidos. Con esta información se concluyó que la menor cantidad de GSH detectada en el fluido crevicular se debe a la interacción de este elemento con los componentes que generan el daño oxidativo en enfermedades inflamatorias como la gingivitis37.
La GST actúa durante los procesos inflamatorios y la presencia de ROS o de elementos como el malonildialdehído que son producidos durante la destrucción celular y la cantidad de GST resulta insuficiente para detener el daño ocasionado por las ROS38.
El fluido crevicular posee una capacidad antioxidante local diferente a la del plasma, lo que ha derivado en estudios que buscan identificar la función de los diversos sistemas antioxidantes en la cavidad bucal y su papel en el desarrollo de enfermedades como la gingivitis, tratando de aclarar los procesos por los cuales disminuye la cantidad de enzimas como la GST y los mecanismos en los que interactúa con las ROS para inactivarlas35.
ConclusionesLa literatura muestra evidencias que sugieren una relación entre diversas enfermedades bucales, como la fluorosis dental y la gingivitis, con el grado de EO. En el caso de la fluorosis dental, las ROS durante la fase secretoria de los ameloblastos posiblemente reducen la producción de proteínas, lo que afecta al proceso de formación del esmalte y se traduce en zonas hipomineralizadas y aumento en la porosidad del diente, características de la fluorosis dental.
Durante la gingivitis se observa un aumento en las ROS que se asocia al grado de inflamación y avance de esta enfermedad. En este proceso, la cantidad de GST disminuye y por lo tanto la capacidad para eliminar las ROS, lo cual es producto de daños en el entorno celular que impiden el correcto funcionamiento de los mecanismos que se requieren para la producción de esta enzima.
En años recientes se ha fortalecido la investigación relacionada con la capacidad antioxidante del organismo, así como de los mecanismos de protección en los diferentes sitios en donde ocurre la lesión, de tal forma que se han estudiado enzimas antioxidantes como la SOD, CAT y GST, en donde la GST en conjunto con el GSH son componentes esenciales de la respuesta antioxidante en enfermedades como la fluorosis dental y la gingivitis4,6,31. Sin embargo, es necesario realizar más estudios que profundicen en la relación del EO y las enfermedades bucodentales e identifiquen los mecanismos específicos en los que interviene el sistema GSH.