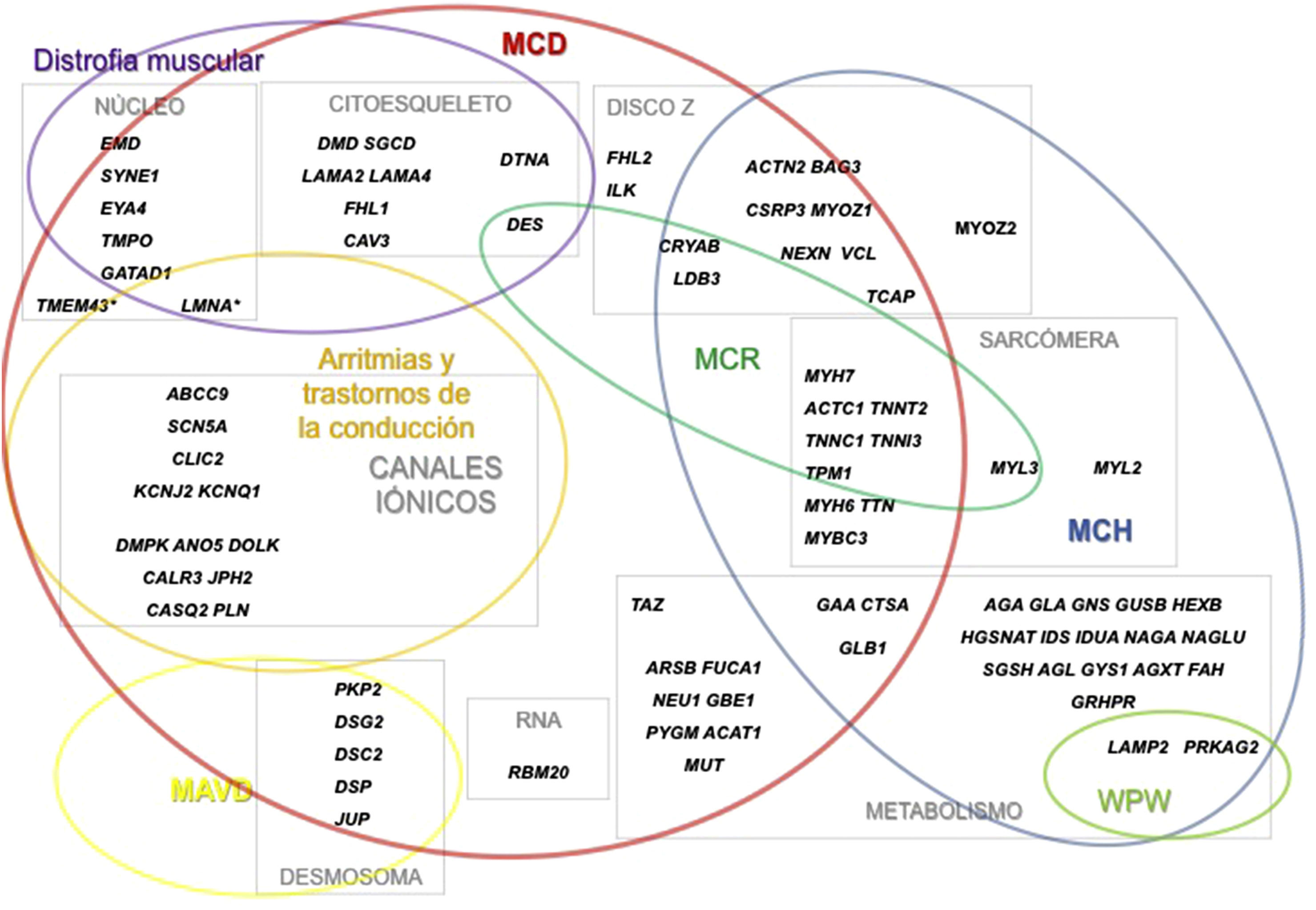
Se denomina miocardiopatías a las enfermedades cardiacas que cursan con una alteración estructural y funcional del miocardio en ausencia de hipertensión arterial, cardiopatía isquémica, valvulopatía o cardiopatía congénita que las justifique1.
La definición y clasificación de las miocardiopatías ha sido motivo de controversia entre las distintas sociedades científicas. La Asociación Americana de Cardiología clasifica las miocardiopatías en función de si no presentan afectación extracardiaca (miocardiopatías primarias), o sí (miocardiopatías secundarias). Dentro de las primarias distingue si tienen una base genética, mixta o no.
Con el propósito de facilitar y simplificar el manejo de los pacientes, la actual clasificación de las miocardiopatías de la Sociedad Europea de Cardiología diferencia los diversos subtipos según sus características morfológicas y las subclasifica posteriormente según exista o no agregación familiar y/o causa genética1.
Las principales miocardiopatías de causa genética son la miocardiopatía hipertrófica (MCH) (engrosamiento de las paredes ventriculares), la miocardiopatía dilatada (MCD) (dilatación de la cavidad ventricular con disfunción sistólica), la miocardiopatía restrictiva (MCR) (disfunción diastólica con patrón restrictivo sin alteraciones importantes en el grosor, la cavidad ni la función sistólica) y la miocardiopatía arritmogénica del ventrículo derecho (MAVD) (disfunción global/regional del ventrículo derecho). Existe otro tipo de miocardiopatías no clasificables en las anteriores entre las que se incluye la miocardiopatía no compactada (aumento de la trabeculación ventricular izquierda asociada o no a adelgazamiento de la pared y disfunción sistólica). Los 5 tipos de miocardiopatías presentan una base genética en mayor o menor grado1–3.
¿Qué genes están implicados en las distintas miocardiopatías?Aunque, como comentaremos a continuación, determinados genes están más frecuentemente implicados en la patogenia de algunas miocardiopatías concretas, existe un gran solapamiento en el espectro genético de las miocardiopatías (fig. 1). De esta forma, la alteración de un determinado gen puede dar lugar a varias miocardiopatías.
Miocardiopatía hipertróficaLa MCH se puede clasificar en MCH sarcomérica y MCH no sarcomérica según estén implicados o no genes que codifican por proteínas estructurales/reguladoras del sarcómero1. Las mutaciones en genes sarcoméricos aparecen en el 60-65% de los pacientes con diagnóstico clínico de MCH y son las mutaciones más frecuentes en la MCH (>90% de las mutaciones detectadas). Dentro de las mutaciones que afectan a los genes sarcoméricos, un 70-80% ocurren en 2 genes, MYH7 (cadena pesada de beta miosina) y MYBPC3 (proteína C de unión a miosina).
Existe otro grupo de genes que no codifican proteínas contráctiles y que están implicados en enfermedades metabólicas y por depósito que afectan al miocardio, causando hipertrofia ventricular izquierda. Son las llamadas fenocopias de MCH (MCH no sarcomérica) y es conveniente su identificación ya que se pueden beneficiar de tratamientos específicos que cambien su historia natural.
Miocardiopatía dilatadaHasta en el 50% de las MCD idiopáticas el origen es familiar. Más de 40 genes se han relacionado con el desarrollo de la enfermedad4. La mayoría de estos genes codifican para proteínas sarcoméricas, del citoesqueleto, la membrana nuclear, o las proteínas desmosómicas. Los mecanismos implicados son varios y complejos, resultando en alteraciones estructurales y funcionales que afectan a la generación de la fuerza contráctil en el sarcómero, la transmisión de la fuerza contráctil o a la integridad celular (tabla 1). Las mutaciones más frecuentes en pacientes con MCD son aquellas que afectan a los genes TTN (hasta en el 15-25% de los casos), LMNA (4-8%), MYH7 (4-8%) y TNNT2 (3-6%).
Correlaciones genotipo-fenotipo en las miocardiopatías
| Genotipo | Fenotipo |
| Miocardiopatía hipertrófica | |
| Genes sarcoméricos | Coexistencia de MCD, MCR o MNC en la misma familia. Algunas mutaciones específicas en determinados genes (ACTC1) ligadas a CIA |
| No sarcoméricosAlteraciones metabolismo | |
| PRKAG2 | Preexcitación. Taquicardia supraventricular. Marcapasos. Adultos jóvenes |
| Enfermedad de Danon (LAMP2) | Preexcitación. Ligado cromosoma X. Hipertrofia biventricular. Retinosis pigmentosa. Retardo mental. Elevación transaminasas y CPK. HVI masiva. Evolución a IC terminal y fase dilatada. Comienzo en infancia-juventud en varones, más tarde mujeres |
| Enfermedad de Fabry (GLA) | Ligado a cromosoma X. Acroparestesias. Insuficiencia renal, córnea verticillata, angioqueratomas, disautonomía, accidentes cerebrovasculares y trastornos gastrointestinales |
| Enfermedad de Pompe (GAA) | Autosómica recesiva. Alteraciones musculares y hepatomegalia |
| LEOPARD (PTPN11) | Lentiginosis, hipertelorismo ocular, estenosis pulmonar, anormalidades genitales en varones, sordera, retraso del crecimiento |
| Noonan (PTPN11, RAF1, SOS1, KRAS, NRAS, BRAF) | Estenosis pulmonar, estatura baja, retraso cognitivo, pectum excavatum, cuello corto, anomalía puente nasal, CIA |
| Amiloidosis | |
| Transtirretina (TTR)Apolipoproteína A1 (APOA1) | Familiar: Variable grado de afectación cardiaca. Bajo voltaje ECG. Engrosamiento septo interauricular, hipertrofia biventricular, engrosamiento valvas. Derrame pericárdico. Neuropatía y disfunción autonómica, depósitos vítreos, STCSenil: STC |
| Fibrinógeno A (FGA) | Variable grado de afectación cardiaca. Bajo voltaje ECG. NefropatíaRara afectación cardiaca. Nefropatía |
| Miocardiopatía dilatada | |
| Sarcoméricos | |
| Titina (TTN) | Alta penetrancia elevada dependiente de edad. Peor pronóstico en varones |
| Disco Z | |
| BAG-3 | Posible miopatía |
| LDB3 | Miopatía miofibrilar (con miocardiopatía restrictiva o MCH). Inicio en la infancia |
| Citoesqueleto | Ligado a X, CPK elevada, bajo riesgo arritmogénico. Alto porcentaje de IC y necesidad de trasplante |
| Distrofina (DMD) | |
| Distrofia muscular de Duchenne (DMD) | Ligada al cromosoma X (recesiva). Taquicardia sinusal y variabilidad frecuencia cardiaca. Ondas Q y anomalías de la contractilidad en cara inferoposterolateral del VI. MCD en adolescencia y muerte prematura |
| Distrofia muscular de Becker (DMD) | Taquicardia sinusal. Ondas Q y anomalías de la contractilidad en cara inferoposterolateral y de VD. Un tercio desarrolla MCD |
| Desmina (DES) | 74% afectación cardiaca: 60% enfermedad del tejido de conducción, arritmias o MS. 70%: miopatía. Un tercio con CPK normal |
| Desmosoma | |
| PKP2, DSP, DSC2, DSG2, JUP | MCD con o sin criterios de MAVD |
| Manejo del calcio | |
| Fosfolamban (PLN) | Fenotipo variable. MCD con presentación agresiva precoz o MCD tardía |
| Estructura nuclear | |
| Lamina (LMNA) | Afectación del sistema de conducción y muerte súbita. Dilatación y disfunción leve del VI inicialmente. Posible afectación muscular variable |
| Emerina (EMD) | Herencia ligada al cromosoma X. Puede asociarse a la distrofia muscular de Emery-Dreifuss (contracturas precoces, agotamiento muscular con distribución humeroperoneal, defectos de la conducción) |
| TMEM43 | Mayor afectación varones. Alta tasa de arritmias ventriculares y MS. Algunos cumplen criterios de MAVD |
| Mitocondrial | |
| Tafazina (TAZ) | Miocardiopatía en niños (MCD, MCH, fibroelastosis endocárdica, miocardio no compactado). Retraso en el crecimiento, neutropenia y aumento de excreción urinaria de ácido 3 metilglutacónico |
| Regulación iónica | |
| SC5NA | Arritmias supraventriculares, defectos de conducción, taquicardia ventricular |
| Miocardiopatía arritmogénica del ventrículo derecho | |
| DesmosomaJUP, DSPEstructura nuclearTMEM43LMNA | Queratodermia palmoplantar. Pelo rizadoMayor afectación varones. Alta tasa de arritmias ventriculares y MS.Afectación biventricular. Afectación del sistema de conducción |
| Miocardiopatía restrictiva | |
| SarcoméricosTroponina (TNNI3) | Algunas mutaciones se han asociado a alto riesgo arritmogénico |
| CitoesqueletoDesmina (DES) | BAV. MS. Miopatía |
BAV: bloqueo auriculoventricular; CIA: comunicación interauricular; CPK: creatinfosfocinasa; ECG: electrocardiograma; HVI: hipertrofia ventricular izquierda; IC: insuficiencia cardiaca; MAVD: miocardiopatía arritmogénica del ventrículo derecho; MCD: miocardiopatía dilatada; MCH: miocardiopatía hipertrófica; MNC: miocardiopatía no compactada; MCR: miocardiopatía restrictiva; MS: muerte súbita; STC: síndrome del túnel carpiano; VD: ventrículo derecho; VI: ventrículo izquierdo.
La MCR es la menos frecuente de las miocardiopatías hereditarias y su prevalencia real se desconoce. En su etiopatogenia se han implicado mutaciones en algunos genes sarcoméricos (especialmente TNNI3) y en DES codificante de desmina, proteína del citoesqueleto.
Otras enfermedades hereditarias que pueden manifestarse con fisiología restrictiva son la amiloidosis (habitualmente por mutaciones en el gen TTR) o la hemocromatosis (HFE).
Miocardiopatía arritmogénica de ventrículo derechoEn esta entidad se han descrito mutaciones en 8 genes (PKP2, DSP, DSC2, DSG2, JUP, LMNA, TMEM43 y TGFB3). Los genes más frecuentemente afectados son aquellos que codifican para proteínas del desmosoma (PKP2, DSP, DSC2, DSG2 y JUP). La mutación de estos genes provoca la disrupción de los puentes intercelulares que conectan las células cardiacas.
¿Cuál es su patrón de herencia?Conocer el patrón de herencia permite estimar el riesgo de trasmisión del defecto genético a los descendientes. Lo más común son los patrones de herencia mendelianos (autosómicos vs. ligados al cromosoma X; dominante vs. recesivo) aunque en ocasiones la alteración se encuentra en el ADN mitocondrial y la herencia será matrilineal (solo trasmitido por las mujeres).
Miocardiopatía hipertróficaEn la MCH, el patrón de herencia predominante en las formas sarcoméricas es el autosómico dominante (AD). En el caso de los genes no sarcoméricos, los patrones de herencia son más variados. La MCH asociada a PRKAG2 tiene patrón AD, mientras que la enfermedad de Fabry o la enfermedad de Danon tienen herencia ligada al cromosoma X y el síndrome de Pompe un patrón autosómico recesivo (AR). También existen formas asociadas a mutaciones en el ADN mitocondrial.
Miocardiopatía dilatadaLa MCD es generalmente un desorden monogénico en el que una sola mutación es suficiente para producir la enfermedad, aunque otros factores o modificadores genéticos, así como factores ambientales, pueden contribuir al desarrollo de esta. En la mayoría de los casos el patrón de herencia es AD, aunque se han descrito patrones de herencia AR en mutaciones en TNNI3, DES y DSP; herencia ligada al cromosoma X en las distrofinopatías (DYS), en el síndrome de Barth (TAZ) y mutaciones en el gen de la emerina (EMD).
Miocardiopatía restrictivaEn la MCR, el patrón de herencia en las troponinopatías suele ser AD, mientras que en las desminopatías se han descrito tanto AD como AR (25%).
Miocardiopatía arritmogénica de ventrículo derechoEl patrón de herencia es habitualmente AD. Hay que resaltar que en esta enfermedad es habitual hallar sujetos con mutaciones en 2 o más genes.
¿Cuál es la eficacia de realizar un test genético?Miocardiopatía hipertróficaLa efectividad de realizar un test genético en la MCH es alta. En el 40-70% de los pacientes que cumplen criterios clínicos de MCH se encuentra el defecto genético causal de la enfermedad. Con vistas a la rentabilidad diagnóstica, y si no hay signos particulares que orienten a una entidad concreta, lo más habitual es analizar en primer lugar los genes sarcoméricos: MYBPC3, MYH7, TNNT2, TNNI3, TPM1, TNNC2, MYL2, MYL3 y ACTC.
Miocardiopatía dilatadaDada la complejidad y heterogeneidad de la base genética de la MCD, hasta recientemente no ha sido posible realizar estudios genético sistemáticos de múltiples genes en estos pacientes. La aplicación de las nuevas técnicas de secuenciación y el avance de la investigación en la genética de la MCD ha aumentado la eficacia del test genético en estos pacientes. Datos de nuestra práctica empleando paneles de análisis de múltiples genes muestran que es posible identificar el defecto genético causal de MCD en el 30-40% de los casos esporádicos y hasta en el 60-80% de los casos familiares (datos no publicados).
Miocardiopatía restrictivaEn la MCR se desconoce cuál es el es espectro genético causal. Se considera que las mutaciones en genes sarcoméricos solo representan un 5-10% de los casos por lo que la efectividad del estudio genético es baja. No se recomienda estudio genético de rutina salvo que exista una agregación familiar o se sospeche una entidad concreta por rasgos fenotípicos particulares.
Miocardiopatía arritmogénica de ventrículo derechoHasta el 20-30% de los pacientes con MAVD tienen antecedentes familiares de la enfermedad o de muerte súbita. Según las series publicadas es posible documentar el defecto genético causal en el 26-58% de los pacientes.
¿Cuál es la penetrancia en las distintas miocardiopatías?La penetrancia de una mutación se define como el porcentaje de portadores que desarrollarán rasgos de la enfermedad a lo largo de su vida. Este concepto es diferente del de expresividad, que se refiere a la severidad de las manifestaciones clínicas (edad de inicio, intensidad de los síntomas y riesgo de complicaciones).
Miocardiopatía hipertróficaEn la MCH las formas sarcoméricas tienen una penetrancia incompleta, dependiente de la edad (casi completa a los 50-60 años) mientras que las formas raras (AR y no sarcoméricas) tienen con más frecuencia penetrancia completa incluso antes de la edad adulta; es decir, que prácticamente el 100% de los individuos portadores del defecto genético tendrán manifestaciones cardiacas precoces.
Miocardiopatía dilatadaDada la heterogeneidad de la MCD, la penetrancia y expresividad son muy variables y dependen del defecto genético subyacente (tabla 1).
Miocardiopatía restrictivaLas 2 formas genéticas predominantes de MCR (troponinopatías y desminopatías) tienen una penetrancia muy elevada, con evidencia de enfermedad en la tercera década en la mayoría de los portadores.
Miocardiopatía arritmogénica de ventrículo derechoLa penetrancia y expresividad en la MAVD también es variable, desde ausencia completa de síntomas hasta el desarrollo de arritmias malignas o insuficiencia cardiaca. El desarrollo de la enfermedad y formas más severas se ha relacionado con la exposición a ciertos virus, la práctica de actividad física y con la presencia de más de una mutación. La penetrancia es casi completa en la enfermedad de Naxos y Carvajal (formas cardiocutáneas).
¿Cuáles son los principales genotipos-fenotipos?Las principales correlaciones genotipo-fenotipo de las diversas miocardiopatías se recogen en la tabla 1.
Miocardiopatía hipertróficaNo se han logrado establecer relaciones genotipo-fenotipo entre las mutaciones sarcoméricas y el grado de hipertrofia, o lo que sería más importante, el riesgo de eventos adversos (muerte súbita o evolución a insuficiencia cardiaca). Se ha sugerido que únicamente las MCH secundarias a mutaciones múltiples (lo que ocurre en un 5-10% de los casos) se relacionan con una expresividad más severa de la enfermedad.
En las MCH no sarcoméricas hay datos clínicos que sirven de alerta («red flags») para sospechar determinadas etiologías (tabla 1).
Miocardiopatía dilatadaEn función del defecto genético subyacente la MCD puede cursar con características específicas asociadas (tabla 1).
Miocardiopatía restrictivaLa MCR por mutaciones del gen DES tiene una mayor incidencia de bloqueo auriculoventricular y se asocia con miopatía (CK elevada).
Miocardiopatía arritmogénica de ventrículo derechoLa MAVD se caracteriza por la afectación del ventrículo derecho, aunque en ocasiones existe afectación biventricular e incluso única del ventrículo izquierdo (más frecuente en mutaciones en la DSP y DSC2). Los pacientes portadores de 2 mutaciones tienen una mayor expresión de la enfermedad y una peor evolución.
¿Cuál es la utilidad del análisis genético para el paciente con miocardiopatía?Conocer el defecto genético una vez el fenotipo está ya presente no suele implicar cambios en el manejo clínico en la mayoría de las miocardiopatías. Una excepción puede ser la instauración de tratamientos específicos en algunas MCH no sarcoméricas (enfermedad de Fabry y amiloidosis TTR) o la implantación precoz de desfibrilador en pacientes con MCD que presentan afectación en LMNA o TMEM43, dado el elevado riesgo de arritmias malignas en estas entidades.
En ocasiones realizar el estudio genético permite establecer el diagnóstico de una miocardiopatía cuando la expresión es incompleta o existen dudas diagnósticas con otras entidades. La MAVD y el diagnóstico diferencial entre MCH y corazón de atleta constituyen un buen ejemplo de la utilidad de la genética en el diagnóstico de la cardiopatía del probando. Así, los hallazgos genéticos constituyen un criterio mayor en los criterios diagnósticos revisados vigentes de MAVD y en ocasiones los hallazgos genéticos pueden ayudar para establecer el diagnóstico de MCH en sujetos deportistas con hipertrofia ventricular izquierda entre 13 y 15mm.
Por otro lado, conocer el defecto genético causal en el paciente permite siempre otorgarle asesoramiento reproductivo en cuanto patrón de herencia de la mutación, riesgo de trasmitir el defecto genético a sus descendientes y posibilidad de realizar técnicas de diagnóstico genético preconcepcional y prenatal.
¿Cuál es la utilidad del análisis genético para los familiares de pacientes con miocardiopatías?Tras identificar la mutación causal en el paciente índice hay que ofrecer el test a sus familiares, ya que es en estos donde la realización del test genético es más útil. El estudio genético de familiares nos permite identificar a aquellos con riesgo de desarrollar la enfermedad y así poder realizar un seguimiento más estrecho y un tratamiento precoz. Por otro lado, el no hallar la mutación nos permite en la mayoría de los casos cesar el seguimiento, con el consiguiente beneficio económico y psicológico. La realización de estudios genéticos en los familiares permite también otorgarles asesoramiento a nivel reproductivo y a nivel profesional y deportivo.
La experiencia reciente de nuestro grupo relativa a la utilidad del estudio genético en la MCH ha sido publicada recientemente5. Constatamos que aproximadamente el 50% de los familiares estudiados genéticamente recibieron asesoramiento reproductivo (al estar todavía en edad reproductiva) y cerca del 30% recibieron asesoramiento para su actividad profesional y deportiva5.
Sin embargo, la realización de estudios genéticos también puede acarrear consecuencias negativas que han de tenerse presente y discutir con anterioridad con el paciente (tabla 2).
Consecuencias de la realización de estudios genéticos en familiares
| Portador de la mutación familiar | No portador de la mutación familiar | |
| Consecuencias positivas | • Alivio de la incertidumbre• Beneficios médicos• Planificación vital | • Alivio de la incertidumbre• Fin del seguimiento• Planificación vital |
| Consecuencias negativas | • Ansiedad• Culpabilidad por trasmisión• Anticipación de empeoramiento | • Culpabilidad del superviviente |
| Otras consecuencias | • Cambio del estilo de vida (deporte)• Posibles problemas de coberturas (seguros)• Implicaciones laborales |
El diagnóstico genético plantea problemas de tipo logístico, éticos y legales tanto en su ejecución como en la interpretación y comunicación de los resultados. El lugar idóneo donde realizarlos son las unidades de cardiopatías familiares que cuentan con experiencia contrastada.
En estos centros se garantiza un abordaje multidisciplinar, con una alta especialización y dotación tecnológica. Es necesario que la unidad de cardiopatías familiares atienda un número significativo de casos de forma anual y que realice de frecuentemente estudios genéticos en el propio centro y en colaboración con laboratorios acreditados.
El personal de la unidad debe estar familiarizado con el proceso de asesoramiento genético que incluye el asesoramiento profesional, deportivo y reproductivo. La unidad debe contar con procesos estandarizados para el manejo de la información genética y su aplicación en situaciones especiales (menores de edad, incapacitados, etc.).
FinanciaciónEste trabajo se ha realizado parcialmente gracias a financiación del ISCIII (PI11/0699 y RD12/0042/0066).
AutoríaMarta Cobo-Marcos y Maria Gallego-Delgado han contribuido por igual.
Conflicto de interesesEl Dr García-Pavía ha recibido remuneración como ponente en actividades científicas patrocinadas por Ferrer in Code.
El resto de los autores declaran no tener ningún conflicto de intereses.