Analizar la relación del control glucémico materno con el peso final del recién nacido (RN) en pacientes con diabetes gestacional (DG).
MétodosEstudio retrospectivo de 214gestaciones únicas con DG. Se analizaron las características maternas, los resultados del RN y el control glucémico durante el embarazo. Este se evaluó por las hemoglobinas glucosiladas (HbA1c) medidas en diferentes momentos del tercer trimestre (3T), glucemias basales, glucemias capilares preprandiales, posprandiales a la hora (PP1h) y a las 2h (PP2h).
ResultadosEl porcentaje de RN grandes para la edad gestacional (GEG) fue del 9,9% (macrosomía 5,4%), sin diferencias entre sexos. Las madres con RN GEG tenían mayor peso y porcentaje de grasa corporal antes de la gestación (p<0,05), mayor ganancia de peso durante el embarazo (p<0,01) y mayor tasa de insulinización. En los embarazos con RN GEG la HbA1c media en el 3T y la HbA1c media (p<0,01) fueron más elevadas, así como las glucemias PP1h (p<0,05), PP2h (p<0,01) y la glucemia media capilar (p<0,05). La HbA1c del 3T y la glucemia PP2h se correlacionaron con el índice ponderal fetal (r=0,22, p<0,01, y r=0,17, p<0,05, respectivamente).
ConclusionesLas madres con RN GEG tienen peor control glucémico, a pesar de recibir un tratamiento más intensivo, por lo que las estrategias de tratamiento deben implementarse de forma precoz, sin olvidarse del tratamiento del sobrepeso materno. La HbA1c y la glucemia PP2h son los únicos parámetros de control glucémico que se correlacionan con el peso del RN en nuestro grupo.
To assess the relationship between maternal glycaemic control and final newborn (NB) birth weight in patients with gestational diabetes (GD).
MethodsA retrospective study was conducted on 214singleton pregnancies with GD. Maternal characteristics, newborn outcomes and glycaemic control during pregnancy were analysed. GD was assessed by measurements of glycated haemoglobin (HbA1c) at different times during the third trimester (3T), fasting, pre-prandial, and 1 and 2hour post-prandial capillary blood glucose (1hPP-2hPP).
ResultsThe percentage of NB large for gestational age (LGA) was 9.9% (macrosomia 5.4%), with no differences between genders. Mothers with LGA NB had a higher weight and percentage of body fat before pregnancy (P<.05), more weight gain during pregnancy (P<.01), and required more insulin. In pregnancies with LGA NB, the mean third trimester HbA1c and mean HbA1c (P<.01), were higher, as well as 1hPP (P<.05), 2hPP (P<.01) blood glucose and mean capillary blood glucose (P<.05). The mean third trimester HbA1c and 2hPP blood glucoses were correlated with the fetal weight index (r=0.22, P<.01, and r=0.17, P<.05, respectively).
ConclusionsMothers with LGA NB have worse glycaemic control, despite having received a more intensive treatment. Treatment strategies should be implemented early during pregnancy, not forgetting maternal overweight treatment. HbA1c and 2hPP blood glucose are the only control parameters that correlated with NB weight in our group.
Existe una evidencia creciente de que la obesidad, la diabetes y las enfermedades cardiovasculares en la edad adulta podrían tener antecedentes prenatales. Los determinantes del ambiente intrauterino y del crecimiento fetal se han convertido en una importante área de investigación1,2. El principal episodio adverso de la diabetes gestacional (DG) es el excesivo peso fetal que da como resultado un alto riesgo de ser un recién nacido (RN) grande para la edad gestacional (GEG)1. Los niños GEG se han asociado a síndrome metabólico y obesidad en la edad adulta. Por otro lado, RN pequeños para la edad gestacional (PEG) se han asociado a enfermedad cardiovascular, diabetes y enfermedades inflamatorias3.
Los determinantes de riesgo de mayor peso fetal en DG vienen condicionados en parte por las características maternas (peso pregestacional, ambiente glucémico, ganancia de peso durante el embarazo, paridad, antecedentes previos de macrosomía, etc.), por las características fetales (sexo del RN) y por los factores relacionados con la propia gestación (duración de la gestación)4. De todos estos factores, casi siempre se ha prestado atención prioritaria al control glucémico. Las madres diabéticas con mal control glucémico durante la gestación son más propensas a dar a luz a RN macrosómicos; sin embargo, un control glucémico estricto falla algunas veces en prevenir la macrosomía4. Esto sugiere que la diabetes durante la gestación puede estar además asociada a otras anormalidades metabólicas (metabolismo proteico y lipídico) que podrían justificar alteraciones en el peso fetal5,6. El metabolismo lipídico está marcadamente alterado incluso en una gestación normal. Los niveles de lípidos de la madre se incrementan desde la décima semana de gestación, como consecuencia de una hipertrigliceridemia fisiológica que se exacerba con la diabetes y se ha asociado significativamente con el peso fetal, si bien es cierto no se conoce bien el mecanismo5.
Con todo lo previamente descrito, no hay duda de que la glucemia materna en la mujer con DG está relacionada con el peso al nacimiento, pero hoy en día en los datos aportados en la literatura continúa sin estar claro cuáles son los mejores indicadores del control glucémico que nos permitan predecir los resultados finales del peso del RN. Tampoco se sabe exactamente en qué momento de la gestación estos indicadores producen un mayor efecto. En este trabajo nos proponemos analizar qué indicadores del control glucémico materno se relacionan mejor con el peso final del RN en gestaciones con DG en nuestro centro hospitalario.
Material y métodosSe ha realizado un estudio retrospectivo analizando los resultados de 214gestaciones diagnosticadas de DG a lo largo de 12meses. Se excluyeron las gestaciones múltiples. Todas las gestantes fueron atendidas en la consulta conjunta de diabetes y embarazo de alto riesgo del Hospital Virgen de la Salud, que atiende a un área de 400.000habitantes.
El diagnóstico de DG se realizó siguiendo las recomendaciones del Grupo Español de Diabetes y Embarazo de la Sociedad Española de Diabetes7, con cribado selectivo en el primer trimestre si hay factores de riesgo y universal con el test de O'Sullivan entre la 24-28semanas, seguido del test diagnóstico con 100g de glucosa, utilizando los criterios diagnósticos del III Workshop de Diabetes Gestacional del National Diabetes Data Group8. En las gestantes con valoración previa normal, si en el control ecográfico entre las 32-34semanas se detectaba macrosomía o hidramnios se realizó de nuevo el test diagnóstico. A las mujeres con un valor alterado de glucemia en el test diagnóstico se indicaron medidas dietéticas generales y se repitió de nuevo si se detectaba macrosomía en el tercer trimestre (3T).
En cada gestación se han recogido los datos sobre las características maternas, los resultados del RN y el control glucémico.
Características maternasSe han registrado la edad materna, datos antropométricos de la madre (peso previo al embarazo, talla, índice de masa corporal [IMC] y porcentaje de grasa corporal de la madre [utilizando la fórmula de la Clínica Universitaria de Navarra9]), paridad y presencia de factores de riesgo (antecedentes familiares de diabetes tipo2, obesidad [IMC≥30], edad >35años, existencia de DG previa, existencia de macrosomía en embarazos previos o existencia de malformaciones en gestaciones previas).
También se ha recogido la fecha de la primera visita a la consulta de diabetes y embarazo, así como las fechas de realización del test de cribado con 50g de glucosa y de la sobrecarga diagnóstica con 100g. Los resultados de glucemia basal, a la hora, a los 120 y a los 180min de la sobrecarga diagnóstica se han utilizado como predictores del peso del RN.
Se ha registrado el tipo de tratamiento utilizado: dieta, necesidad o no de insulina, pauta y dosis diaria de insulina al final del embarazo.
La ganancia de peso durante el embarazo se ha calculado a partir de peso previo manifestado por la mujer y el peso materno registrado en la última visita antes del parto. También se ha registrado la edad gestacional en el momento del parto, la existencia de prematuridad o no y el modo y la vía de terminación del embarazo. Se consideró parto prematuro si la terminación del embarazo era antes de la semana37, y parto inmaduro si se producía entre las semanas 22 y 28.
Características de los recién nacidosSe han analizado el sexo, el peso del RN, la existencia de macrosomía absoluta, la valoración del peso en relación con la edad gestacional y el sexo del RN, y se ha calculado el índice ponderal fetal. Los RN se identificaron como GEG si el peso al nacimiento era superior al percentil 90, y como PEG si era inferior al percentil 10 para la edad gestacional, utilizando las tablas españolas separadas por sexo del grupo de Segovia10. Se consideró macrosomía absoluta cuando el peso al nacimiento era superior a 4kg. Se ha registrado la presencia de complicaciones metabólicas y traumáticas tras el parto.
Control glucémico y lipídicoEl grado de control glucémico y lipídico durante el embarazo se ha valorado utilizando los siguientes parámetros:
- 1.
Mediante las cifras de hemoglobina glucosilada (HbA1c) y glucemias basales plasmáticas medidas cada 3 a 4semanas en el 3T. En las pacientes en las que el diagnóstico de DG se realizó antes de la semana24 también se consideraron los valores de HbA1c y glucemias antes del inicio del 3T. Se consideró «HbA1c media» a la media de todas las hemoglobinas realizadas a la gestante (2T y 3T); en el caso de que el diagnóstico se hubiera realizado después de la semana 24, esta cifra coincidiría con la «HbA1c media del 3T».
- 2.
Mediante la realización de automedición de glucemias capilares preprandiales, posprandiales a la hora (PP1h) y a las 2h (PP2h). Las pacientes realizaban 2perfiles de glucemia capilar a la semana, o 3 si el control era inadecuado, de 6puntos cada uno. En uno de los perfiles se medían las glucemias capilares PP1h y en el otro perfil semanal se medían las PP2h. En todos los registros se recogían las glucemias preprandiales. Se han valorado los valores de la glucemia capilar en cada punto por separado y se ha calculado la glucemia capilar media en semanas alternas.
- 3.
Para la medición de la glucemia capilar se han utilizado diferentes glucómetros (Optium exceed® y Glucocard G+ Meter®), que en un estudio realizado en nuestra área (resultados no publicados) presentan muy buena correlación con la glucemia medida por laboratorio, con una correlación del 0,97 y 0,98, respectivamente, estando el 96 y el 100% de las determinaciones de glucemia dentro del intervalo del valor de referencia de acuerdo con la normativa ISO11.
- 4.
Adicionalmente, en 72mujeres se midieron niveles lipídicos (triglicéridos y colesterol total) entre las semans 24 y 32.
Las determinaciones analíticas se han realizado con los siguientes métodos:
- 1.
Glucosa plasmática mediante test enzimático, método de la hexoquinasa (Roche Diagnostics, Manheim).
- 2.
HbA1c mediante HPLC de intercambio iónico (BIO-RAD laboratorios, California, EE.UU.).
- 3.
Colesterol total mediante test enzimático colorimétrico, ésteres de colesterol (Roche Diagnostics, Manheim).
- 4.
Triglicéridos mediante test enzimático lipoprotein-lipasa (Roche Diagnostics, Manheim).
Una vez realizado el diagnóstico de DG, las gestantes fueron educadas en seguir una dieta adecuada a su estado ponderal y fraccionada en 6-7tomas diarias. Fueron instruidas para la realización de 2perfiles de glucemia semanales o en días alternos si el test diagnóstico estaba muy alterado. Tras la visita inicial, las mujeres fueron seguidas en la consulta conjunta de diabetes y embarazo cada 1 a 3semanas según necesidades de la gestante, hasta finalizar la gestación. La gestante podía consultar telefónicamente con el personal educador para dudas del tratamiento y se adelantaba la cita si el control se consideraba inadecuado.
Se insulinizó por criterios de control cuando por los perfiles la glucemia basal o preprandial fue ≥95mg/dl, PP1h≥140mg/dl o a las 2h≥120mg/dl de forma persistente, en 2 o más valores en una a 2semanas, a pesar de una buena adherencia al tratamiento dietético. En algunas gestantes se indicó tratamiento con insulina, con un valor en los perfiles de glucemia igual o mayor a los niveles referidos, si se detectaba por ecografía una circunferencia abdominal ≥2 semanas a la edad gestacional o peso fetal estimado ≥p75. Se comenzó por 0,2UI/kg de insulina prandial habitualmente repartida en 2 a 3dosis, ajustando la dosis y la combinación con NPH cada 1 a 2semanas si era necesario, hasta alcanzar los objetivos de control.
Análisis estadísticoPara el estudio estadístico hemos utilizado el paquete SPSS v. 15.0. Los datos numéricos se han expresado como media y desviación estándar. Las diferencias entre los grupos se han analizado mediante el test de la t de Student. Las variables cualitativas se expresan como frecuencias y porcentajes. Para los porcentajes hemos calculado el intervalo de confianza del 95% (IC95%). Utilizamos el test de la chi cuadrado para analizar las diferencias entre proporciones. Para analizar las correlaciones de los parámetros bioquímicos con el peso fetal final se ha utilizado la correlación de Pearson. Se consideró un valor de p<0,05 como estadísticamente significativo.
ResultadosEl porcentaje de RN GEG fue del 9,9% (IC95%, 5,8-14,0%) sin diferencias entre sexos. De estos, el 5,4% tuvieron macrosomía absoluta. El 86% de los RN en el grupo estudiado tuvieron un peso adecuado para la edad gestacional. El 4,1% de los RN tuvieron bajo peso para la edad gestacional.
En la tabla 1 aparecen reflejadas las características maternas asociadas a la presencia de RN GEG. Las madres con RN GEG tenían más paridad (p<0,05), más antecedentes de macrosomía en gestaciones previas (p<0,01), mayor peso y mayor porcentaje de grasa corporal antes de la gestación (p<0,05) y mayor ganancia de peso durante el embarazo (p<0,01). El porcentaje de gestantes que precisó insulinización durante el embarazo fue significativamente superior en las madres con niños GEG. No encontramos diferencias en la edad gestacional al diagnóstico, ni en el momento de inicio del tratamiento con insulina ni en la dosis final de insulina entre los 2grupos de madres.
Características maternas asociadas con recién nacidos grandes para la edad gestacional y resultados perinatales
| Madre sin RN GEG | Madre con RN GEG | p | |
| Edad (años) | 33,1±4,7 | 34,5±4,7 | 0,265 |
| Primíparas (%) | 45,9 | 20,0 | < 0,05 |
| Macrosomía previa (%) | 4,9 | 30,0 | < 0,001 |
| Peso pregestacional (kg) | 66,3±12,9 | 73,2±12,9 | < 0,05 |
| IMC pregestacional (kg/m2) | 26,1±5,1 | 28,4±5,4 | 0,066 |
| Obesidad (%) | 20,3 | 30,0 | 0,316 |
| % de grasa corporal maternaa | 35,6±6,7 | 38,7±6,6 | < 0,05 |
| Ganancia de peso (kg) | 9,4±5,3 | 12,7±4,5 | < 0,01 |
| Edad gestacional al diagnóstico (semanas) | 26,6±6,5 | 28,5±5,1 | 0,139 |
| Edad gestacional en la primera visita (semanas) | 28,7±6,3 | 29,2±7,7 | 0,743 |
| Número de visitas durante el seguimiento | 3,7±1,5 | 3,6±1,7 | 0,296 |
| Insulinización (%) | 41,0 | 80,0 | < 0,001 |
| Dosis final (U/kg/día) | 0,43±0,2 | 0,45±0,2 | 0,687 |
| Edad gestacional a la insulinización (semanas) | 30,3±5,7 | 32,6±4,3 | 0,149 |
| Edad gestacional al parto (semanas) | 38,6±1,6 | 39,1±1,2 | 0,257 |
| Prematuridad (%) | 8,2 | 0 | 0,183 |
| Cesáreas (%) | 27,5 | 47,1 | 0,09 |
| RN varones (%) | 56,3 | 70,0 | 0,239 |
| Hipoglucemia (%) | 20,2 | 40,0 | < 0,05 |
| Traumatismo obstétrico (%) | 3,3 | 10,0 | 0,142 |
GEG: grande para la edad gestacional; IMC: índice de masa corporal; RN: recién nacido.
Las variables cuantitativas se expresan como media±DE.
Los RN GEG tuvieron más hipoglucemia (p<0,05) y más traumatismos obstétricos que los RN con peso adecuado. El porcentaje de cesáreas fue también superior en el grupo de GEG, aunque no pudimos encontrar diferencias significativas.
En las gestaciones diagnosticadas de DG antes de la semana 26 (n=59, 28%) el porcentaje de RN GEG fue inferior (8,9%) al que tuvieron las gestantes diagnosticadas después de la semana26 (10,3%), aunque sin encontrar significatividad estadística. Este grupo de pacientes tenían más factores de riesgo para DG: más obesidad (45,8% vs 11,9%; p<0,001), mayor porcentaje de mujeres >35años (44,1% vs 26,3%; p<0,01), más antecedentes familiares de diabetes (59,3% vs 36,8%; p<0,05) y mayor porcentaje de DG previa (30,5% vs 13,2%; p<0,01). El porcentaje de insulinización en las gestantes diagnosticadas antes de la semana26 fue estadísticamente superior (59,3% vs. 38,2%; p<0,01).
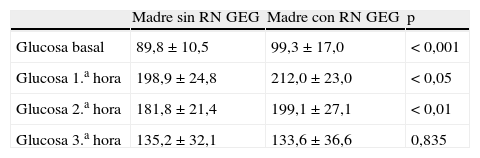
En la sobrecarga oral diagnóstica con 100g, los valores de glucemia basal, a los 60min y a los 120min fueron más elevados en las madres con RN GEG (p<0,01) (tabla 2).
Resultados de la sobrecarga oral de glucosa diagnóstica (100 g) para los 2 grupos de madres
| Madre sin RN GEG | Madre con RN GEG | p | |
| Glucosa basal | 89,8±10,5 | 99,3±17,0 | < 0,001 |
| Glucosa 1.a hora | 198,9±24,8 | 212,0±23,0 | < 0,05 |
| Glucosa 2.a hora | 181,8±21,4 | 199,1±27,1 | < 0,01 |
| Glucosa 3.a hora | 135,2±32,1 | 133,6±36,6 | 0,835 |
GEG: grande para la edad gestacional; RN: recién nacido.
Los datos se expresan como media ± DS.
Los resultados del control glucémico por los datos obtenidos en laboratorio y por las glucemias capilares, así como los datos de lípidos, aparecen reflejados en la tabla 3. La HbA1c media en el 3T y la HbA1c media fueron más elevadas en los embarazos con RN GEG (p<0,01). No encontramos diferencias en las glucemias venosas. La HbA1c media en el 3T se correlacionó con el índice ponderal fetal (r=0,22; p<0,01). El control glucémico valorado por los resultados de la auto-monitorización de la glucemia capilar fue peor en las madres con RN GEG, tanto en glucemias PP1h (p<0,05) y PP2h (p<0,01), como en la glucemia media capilar (p<0,05). No encontramos diferencias en las glucemias preprandiales. La glucemia PP2h se correlacionó con el índice ponderal fetal (r=0,17; p<0,05).
Control glucémico y lipídico para madres con recién nacidos grandes para la edad gestacional
| Madre sin RN GEG | Madre con RN GEG | p | |
| HbA1c media (%) | 5,2±0,4 | 5,5±0,3 | < 0,01 |
| HbA1c 3T media (%) | 5,2±0,4 | 5,6±0,4 | < 0,01 |
| Glucemia basal 3T (mg/dl) | 75,8±10,8 | 81,5±18,1 | 0,06 |
| Glucemia media capilar total 3T | 103,3±15,3 | 113,4±16,1 | < 0,05 |
| Glucemia media capilar preprandial 3T | 81,9±14,5 | 86,2±16,7 | 0,275 |
| Glucemia media capilar posprandial 1h 3T | 125,2±18,8 | 135,5±21,1 | < 0,05 |
| Glucemia media capilar posprandial 2h 3T | 104,6±17,9 | 121,1±28,0 | < 0,001 |
| Colesterol (mg/dl)a | 212,8±94,3 | 236,6±18,0 | 0,665 |
| Triglicéridos (mg/dl)a | 157,3±93,6 | 190,0±45,9 | 0,730 |
GEG: grande para la edad gestacional; RN: recién nacido; 3T: tercer trimestre.
Los niveles de colesterol total y triglicéridos fueron superiores en las madres con RN GEG, aunque sin significatividad estadística.
DiscusiónNuestros resultados confirman la hipótesis inicial de que las madres con DG que tienen peor control glucémico tienen peores resultados en el peso final de sus hijos. Casi todos los parámetros utilizados para valorar el control glucémico que hemos analizado en el segundo y tercer trimestre son peores en las madres que dan a luz niños GEG.
El porcentaje de RN GEG y macrosómicos en esta serie no es muy diferente del obtenido en otras series de nuestro país3. De forma similar a lo encontrado en la literatura3,4, en nuestro grupo de DG hemos podido demostrar la contribución, en el peso de los RN, de otros factores no relacionados directamente con el ambiente glucémico; encontramos como factores predictores de GEG el antecedente de macrosomía en gestaciones previas y la paridad.
En relación con el peso materno, no pudimos encontrar diferencias en cuanto al IMC pregestacional, como en otros trabajos12-15, pero sí pudimos comprobar desigualdades en otros parámetros relacionados como el peso materno pregestacional y el porcentaje de grasa corporal antes del embarazo. Las mujeres con mayor peso y mayor porcentaje de grasa corporal tienen RN más grandes.
También hemos podido comprobar que una mayor ganancia de peso durante el embarazo se asocia con mayores pesos en los RN. Datos recientes de Black et al.16 en mujeres con y sin DG muestran un incremento de riesgo de RN GEG, mayor en mujeres con obesidad y sobrepeso, y que la mayor ganancia de peso durante la gestación se asoció con mayor prevalencia de GEG en todos los grupos estudiados (mujeres con normopeso, sobrepeso y obesidad con o sin DG). Posiblemente, acciones terapéuticas preventivas orientadas a la reducción ponderal previa a la gestación y un mayor control de la ganancia de peso durante la misma conseguirían resultados beneficiosos en la reducción de la macrosomía y sus complicaciones.
Las madres con RN GEG tienen peor control glucémico desde el diagnóstico. Hemos comprobado que los resultados glucémicos en casi todos los puntos de la sobrecarga oral diagnóstica son significativamente mayores en las gestantes con RN más grandes. Este peor control se mantiene hasta el final del embarazo, a pesar de recibir un tratamiento más intensivo, reflejado por el mayor porcentaje de insulinización en este grupo de pacientes, sin precisar necesariamente una mayor dosis de insulina. Además, los resultados de las mujeres diagnosticadas en el primer y segundo trimestre (antes de la semana 26), a pesar de tener más factores de riesgo, consiguen resultados similares o mejores a las diagnosticadas después de la semana 26. Todos estos datos vendrían a incidir en la importancia de instaurar estrategias diagnósticas y de tratamiento lo más precozmente posible durante el embarazo. En este sentido, el estudio Hyperglycemia and Pregnancy Outcome (HAPO)17 consiguió demostrar la existencia de una relación lineal entre los niveles glucémicos maternos con las alteraciones perinatales del RN y las complicaciones maternas. Como consecuencia de estos resultados, la International Association of Diabetes and Pregnancy Study Groups (IADPSG) ha formulado nuevas guías18 para el diagnóstico de DG con unos puntos de corte glucémicos más estrictos que los utilizados en nuestro trabajo. Serían necesarios nuevos estudios a nivel nacional que permitieran comprobar en nuestro medio la reproducibilidad de los resultados del estudio HAPO y los beneficios obtenidos sobre la morbilidad materno-fetal al aplicar criterios de diagnóstico menos laxos.
Muchos estudios previos relacionados con la macrosomía fetal y con el pobre control glucémico han usado mediciones combinadas de glucemia pre y posprandial o mediciones indirectas del control glucémico utilizando la HbA1c o la fructosamina15.
En nuestro trabajo, la HbA1c media del tercer trimestre y la glucemia capilar posprandial a las 2h fueron los predictores más potentes de RN GEG. Son los únicos parámetros que se correlacionaron con el índice ponderal fetal. Se ha documentado previamente que los niveles de HbA1c se correlacionan mejor con el pico de glucosa en el plasma o el área bajo la curva en el test de tolerancia a la glucosa, que los niveles de glucemia en ayunas19. En contraste con otros estudios12,13, nosotros encontramos que la glucemia posprandial de las 2h durante el tercer trimestre, pero no la glucemia en ayunas o preprandial, es un predictor de GEG. No pudimos dilucidar exactamente, como en otros estudios, en qué momento de la gestación estos indicadores suponen un rol más importante, puesto que la mayoría de los datos fueron obtenidos en el tercer trimestre, salvo en los casos en los que el diagnóstico de DG se hizo antes de la semana 24.
Nuestros datos también indican que monitorizando solo la glucemia en ayunas y preprandial, que reflejan los niveles más bajos de glucemia durante el día, no se provee una adecuada valoración del riesgo de macrosomía. Estos datos preprandiales son relevantes a la hora de comprobar el cumplimiento terapéutico y la necesidad o no de inicio de insulina, así como la distribución de la dieta y el ajuste de las dosis, pero no parece que aporten información sobre el resultado final del peso del RN. En nuestro trabajo son las glucemias capilares posprandiales las que con mayor precisión indican la posibilidad de exceso de peso en el RN, como también se ha visto en otros estudios15,20.
Con respecto al papel de los lípidos sobre el peso del RN, no obtuvimos resultados concluyentes como en otros trabajos, ya que solo se pudieron analizar los datos en un número muy reducido de gestantes, por lo que se necesitan estudios posteriores con una muestra mayor para investigar este posible indicador.
Nuestro trabajo presenta algunas limitaciones que hay que considerar. En primer lugar, los datos analizados de forma retrospectiva son solo de un tiempo limitado (12meses). En segundo lugar, el análisis de las glucemias capilares se ha obtenido de los registros apuntados manualmente por las gestantes y que fueron comprobados en la memoria de los glucómetros. El cálculo de medias se hizo cada 2semanas; si hubiéramos utilizado un sistema de descarga automática habríamos obtenido mayor número de registros en todos los puntos y podríamos disponer de más información de control. Pero este sistema de registro manual es el que utilizamos de forma habitual y refleja nuestra práctica clínica.
Si las mujeres con DG que estén en riesgo de dar a luz RN macrosómicos se identificaran en forma temprana y se las tratara precozmente para mejorar el control metabólico, una vigilancia óptima debería incluir la HbA1c y la glucemia posprandial (sobre todo a las 2h). Quizá sería necesario introducir cambios en los protocolos de DG, incluyendo más puntos complementarios de control en estas mujeres de alto riesgo (más obesas, con ganancia exagerada de peso, glucemia más alta al diagnóstico) durante la última parte de la gestación, y aumentando la frecuencia de autoanálisis para poder predecir de forma más exacta, junto con las ecografías fetales, la posibilidad de exceso ponderal fetal.
El tratamiento precoz del sobrepeso materno, conseguir una ganancia de peso que no supere las recomendaciones durante el embarazo y un buen control glucémico, utilizando los parámetros más exactos, conseguirá que los resultados de peso en los embarazos con DG sean similares a los embarazos sin diabetes y con una menor morbilidad perinatal. Con las limitaciones de nuestro trabajo no podemos, sin embargo, contestar a las cuestiones que están en plena polémica: la necesidad o no del cambio de los criterios diagnósticos de DG, establecer protocolos de actuación orientados a los factores de riesgo de la mujer con DG e implementar una actuación multifactorial antes y durante la gestación, etc. Como hemos sugerido previamente, estudios prospectivos a nivel nacional posiblemente puedan dar respuesta a estas preguntas.
Conflicto de interesesLos autores declaran no tener conflicto de intereses con respecto al tema tratado.