Evaluar las características de las enfermedades autoinmunes (EA) asociadas a la diabetes mellitus tipo 1 (DM1).
Pacientes y métodos Estudio transversal, multicéntrico, que incluyó a pacientes adultos con DM1 valorados en consultas externas de endocrinología durante 12meses. Se analizaron variables sociodemográficas, clínicas y la presencia de EA (enfermedad tiroidea autoinmune [ETA], gastritis crónica, enfermedad celiaca [EC], vitíligo, insuficiencia suprarrenal primaria [ISR] y otras EA registradas en esta cohorte).
ResultadosDe un total de 1.465 pacientes, el 51,5% varones, con una mediana de edad de 38,2años (rango intercuartílico, 28,5-48,3) y una mediana de tiempo de evolución de la DM1 de 17,3años (11,1-25,6), el 29,2% presentaron alguna EA, siendo la más frecuente la ETA (22% con normofunción o hipofunción y 3,4% con hiperfunción tiroidea). La ETA fue más frecuente en el sexo femenino (70,5% [p<0,001]) y aumentó con la edad (41,7±14,5 vs 38,6±13,1 años en sujetos con y sin ETA, respectivamente [p<0,001]). La ETA con normofunción o hipofunción tiroidea aumentó también con el tiempo de evolución de la DM1 (17,1% en <10 años de evolución, 21% en 10-20 años, 24,6% en 20-30 años y 26,3% en >30años [p<0,05]). Otras EA que se asociaron fueron la gastritis crónica (3,6%), el vitíligo (1,6%), la EC (1,1%), la ISR (0,3%) y otras (3,4%).
ConclusionesLa ETA es la EA más prevalente. La EC y la gastritis crónica probablemente se encuentren infradiagnosticadas en este estudio por la falta de consenso en cuanto a su cribado. Parece necesario realizar un cribado sistemático de EA en pacientes con DM1.
To assess the characteristics of autoimmune diseases (AD) in patients with type 1 diabetes mellitus (T1DM).
Patients and methodsA cross-sectional, multicentre study on adult patients with T1DM seen in outpatient endocrinology clinics over a 12 month period. Sociodemographic and clinical variables and the presence of AD [autoimmune thyroid disease (ATD), chronic gastritis, coeliac disease (CD), vitiligo, primary adrenal insufficiency, and other AD in this cohort] were investigated.
ResultsThe study included a total of 1,465 patients (51.5% male) with a median age of 38.2years (interquartile range 28,5-48,3) and a median diabetes duration of 17.3years (11.1-25.6). Just under one-third (29.2%) had AD, with ATD being the most frequent (22% with normal thyroid function or hypothyroidism, and 3.4% with hyperthyroidism). ATD was most frequent in females [70.5% (P<.001)] and the prevalence increased with age [41.7±14.5 vs 38.6±13.1 years in patients with and without ATD respectively (P<.001)]. ATD with normal thyroid function or hypothyroidism increased also with longer duration of T1DM [17.1% with <10years, 21% with 10-20 years, 24.6% with 20-30 years and 26.3 with >30years (P<.05)]. Other AD were chronic gastritis (3.6%), vitiligo (1.6%), CD (1.1%), primary adrenal insufficiency (0.3%) and others (3.4%).
ConclusionsATD was the most prevalent AD. CD and chronic gastritis were probably underdiagnosed in our study as there is no consensus for screening. Screening for AD may be necessary in patients with T1DM.
La diabetes mellitus tipo1 (DM1) es una patología crónica que aparece como consecuencia de la destrucción selectiva de la célula beta del islote pancreático y se asocia con frecuencia a otras enfermedades autoinmunes (EA). La enfermedad tiroidea autoinmune (ETA) es la que presenta una mayor prevalencia, y la asociación de ambas aparece con más frecuencia en pacientes genéticamente predispuestos, como son los portadores del haplotipo HLA-DR31,2. Se ha descrito que el 3-50% de los pacientes con DM1 tienen anticuerpos antitiroideos, y que hasta en el 50% de los casos se progresa a una enfermedad tiroidea3, fundamentalmente a hipotiroidismo primario (2-5% de los pacientes con DM14,5), aunque también a hipertiroidismo primario en el 1-2% de los casos6.
La enfermedad celiaca (EC) es otra enfermedad de base autoinmunitaria que se da en pacientes genéticamente predispuestos y cuyo factor ambiental desencadenante es el gluten. Se estima que la prevalencia en la población general caucásica es de aproximadamente el 1%7, pero los pacientes con DM1 constituyen un grupo de riesgo para su desarrollo. Gran número de estudios han demostrado que, tanto en adultos como en niños, la prevalencia de EC es más alta en sujetos con DM1 (1,5-7%)8-12, y hasta en el 90% de los pacientes con ambas patologías, la DM1 fue diagnosticada en primer lugar13. Se han encontrado indicadores que sugieren una predisposición genética común en relación con los haplotipos A1, B8, DR3 y DQ28.
Por otro lado, la gastritis autoinmune se caracteriza por una atrofia del cuerpo y del fundus gástricos y por la presencia de anticuerpos anticélula parietal. Su prevalencia en la población general puede alcanzar el 2%, pero al igual que las anteriores EA, su prevalencia está aumentada en los pacientes con DM1 y puede alcanzar cifras del 20,9%14.
Existen otras EA que se asocian a la DM1 con menos frecuencia, como son el vitíligo o la insuficiencia suprarrenal primaria (ISR) (prevalencia de anticuerpos frente a las glándulas suprarrenales del 1,4%, con desarrollo de ISR en el 18-45% de los pacientes con anticuerpos positivos)15.
El estudio DIACAM1 (DIAbetes tipo1 en CAstilla-la Mancha) fue diseñado para intentar conocer la situación de control y complicaciones de los pacientes con DM1 en la Comunidad de Castilla-La Mancha. La situación de control glucémico y las pautas de tratamiento utilizadas se han publicado recientemente16. El objetivo del presente estudio es conocer la prevalencia y las características clínicas de las EA asociadas a la DM1 en la cohorte de pacientes del estudio.
Material y métodosEstudio transversal observacional de ámbito regional de una cohorte de 1.465 pacientes con DM1 mayores de 16años y con más de 5años de evolución, seguidos de forma regular en el último año en las consultas de endocrinología de las 8áreas sanitarias de Castilla-La Mancha (Albacete, Ciudad Real, Cuenca, Guadalajara, Mancha-Centro, Puertollano, Talavera de la Reina y Toledo). Los pacientes incluidos habían acudido a las consultas externas de endocrinología al menos en 2ocasiones durante los 12meses que duró la recogida de datos (septiembre 2009-agosto 2010). Se excluyeron del estudio las mujeres con DM1 embarazadas. Esta muestra de pacientes representaba una tercera parte de la población con DM1 mayor de 14años de la comunidad autónoma. Los datos fueron estimados a partir del registro de población diabética de los equipos de Atención Primaria de Castilla-La Mancha (Turriano, memoria de actividades del Servicio de Salud de Castilla-La Mancha 2008), considerando un 5% de DM1 y una prevalencia del 0,31% en mayores de 14años. Los datos detallados de cómo se hizo la selección de pacientes han sido descritos previamente16.
El estudio fue aprobado por el Comité de Ética e Investigación Clínica del Complejo Hospitalario de Toledo como centro investigador-coordinador, y los pacientes dieron su consentimiento informado para ser incluidos en el estudio.
Las variables que se analizaron en el estudio y que se describen a continuación se obtuvieron mediante la revisión de historias clínicas y la explotación de registros informatizados en cada centro sanitario16.
Variables sociodemográficas y clínicasEdad, sexo, área sanitaria de referencia, edad de diagnóstico de la DM1, tiempo de evolución de la enfermedad y grado de control metabólico. Para la valoración del grado de control metabólico se utilizó el valor medio de la hemoglobina glucosilada (HbA1c) de las 2 últimas determinaciones realizadas dentro del período de estudio. La medición de HbA1c se realizó en todos los centros por cromatografía de alta presión de intercambio iónico (BioRad Variant II o Menarini), métodos certificados por el National Glycohemoglobin Standarization Program (NGSP) y estandarizados al método de referencia del Diabetes Control and Complications Trial (DCCT) (valores de normalidad: 4-6%). La presencia de obesidad se definió por un índice de masa corporal (IMC) ≥30kg/m2. La presencia de hipertensión arterial (HTA) se definió como presión arterial sistólica medida en el momento de la visita ≥140mmHg y/o presión arterial diastólica ≥90mmHg (media de 2 determinaciones) o si los pacientes recibían tratamiento antihipertensivo. Se consideró que los pacientes tenían dislipidemia si presentaban valores de colesterol total >200mg/dl, colesterol asociado a lipoproteínas de baja densidad (cLDL) >130mg/dl o triglicéridos >150mg/dl, o bien si recibían tratamiento hipolipidemiante. La presencia de tabaquismo activo se definió por el consumo de al menos 1-2cigarrillos al día en el último mes.
Valoración de las enfermedades autoinmunes asociadasEnfermedad tiroidea autoinmuneSe consideraron 2grupos de pacientes según el grado de función tiroidea al diagnóstico:
Enfermedad tiroidea autoinmune con normo o hipofunción tiroideaSe definió por la presencia de anticuerpos antitiroperoxidasa (Ac antiTPO) y/o anticuerpos antitiroglobulina (Ac antiTg) con cifras de tirotropina (TSH) normales o elevadas dentro del rango de normalidad de cada área sanitaria. Así mismo, en este grupo se incluyó también a los pacientes con anticuerpos antitiroideos positivos que recibían tratamiento con levotiroxina.
Enfermedad tiroidea autoinmune con hiperfunción tiroideaSe definió por la presencia de Ac antiTPO y/o Ac antiTg y/o inmunoglobulina estimuladora del tiroides (TSI) con cifras de TSH por debajo del límite de la normalidad de cada área sanitaria en ausencia de tratamiento con levotiroxina.
Otras enfermedades autoinmunes asociadas: enfermedad celiaca, gastritis crónica atrófica, vitíligo e insuficiencia suprarrenal primariaSe definió su presencia por la constancia del diagnóstico en la historia clínica de los sujetos incluidos en el estudio. Así mismo se consideró la existencia de otras enfermedades de base inmunitaria no organoespecífica (lupus, artritis reumatoide, psoriasis, etc.) si así se había registrado en la historia clínica.
Hipoglucemia graveSe definió por la alteración del nivel de consciencia que había precisado administración de glucosa intravenosa o glucagón por personal sanitario o familiar durante el último año. Se registró su presencia si constaba en la historia clínica de los sujetos incluidos en el estudio.
Análisis estadísticoLas variables cualitativas se expresan como porcentaje con el intervalo de confianza del 95% (IC95%) y se compararon con la prueba de la Chi-cuadrado (χ2). Las variables cuantitativas se expresaron como media±desviación estándar o como mediana (rango intercuartílico) para las variables cuantitativas con distribución no normal, y se compararon con la prueba de la t de Student para muestras independientes (las variables no normales fueron trasformadas para utilizar este test). El umbral de significación que se adoptó para todas las pruebas fue p<0,05. Para llevar a cabo el análisis estadístico se utilizó el programa informático SPSS V15.
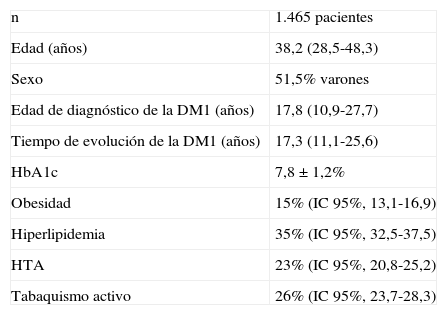
ResultadosLas características de la cohorte de pacientes incluidos en el estudio DIACAM1 se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas entre las áreas sanitarias en cuanto al sexo, a la edad de diagnóstico y al tiempo de evolución de la DM1 y cifra de HbA1c. Sin embargo, la edad media fue algo mayor en el área de Cuenca y menor en el área Mancha-Centro (41,9±13,7 vs 36,2±13,7 años [p<0,05]).
Características de los pacientes incluidos en el estudio DIACAM1
| n | 1.465 pacientes |
| Edad (años) | 38,2 (28,5-48,3) |
| Sexo | 51,5% varones |
| Edad de diagnóstico de la DM1 (años) | 17,8 (10,9-27,7) |
| Tiempo de evolución de la DM1 (años) | 17,3 (11,1-25,6) |
| HbA1c | 7,8±1,2% |
| Obesidad | 15% (IC95%, 13,1-16,9) |
| Hiperlipidemia | 35% (IC95%, 32,5-37,5) |
| HTA | 23% (IC95%, 20,8-25,2) |
| Tabaquismo activo | 26% (IC95%, 23,7-28,3) |
Las variables cuantitativas se expresan como mediana (rango intercuartílico), y las variables cualitativas como porcentaje con el intervalo de confianza del 95% (IC95%).
La prevalencia de cualquier EA asociada a la DM1 en el estudio DIACAM1 fue del 29,2% (IC95%, 26,8-31,6). La EA que se asoció con mayor frecuencia fue la ETA (prevalencia de ETA con normofunción o hipofunción del 22% [IC95%, 19,8-24,2) y de ETA con hiperfunción tiroidea del 3,4% [IC95%, 2,5-4,3]), seguida de la presencia de gastritis crónica atrófica, con una prevalencia de 3,6% (IC95%, 2,6-4,6). Otras EA que se asociaron con menor frecuencia fueron el vitíligo (1,6% [IC95% 0,9-2,3]), la EC (1,1% [IC95% 0,6-1,6]) y la ISR (0,3% [IC95% 0-0,6]). Por último, el 3,4% (IC95%, 2,5-4,3) de los sujetos presentaban algún otro tipo de EA asociada.
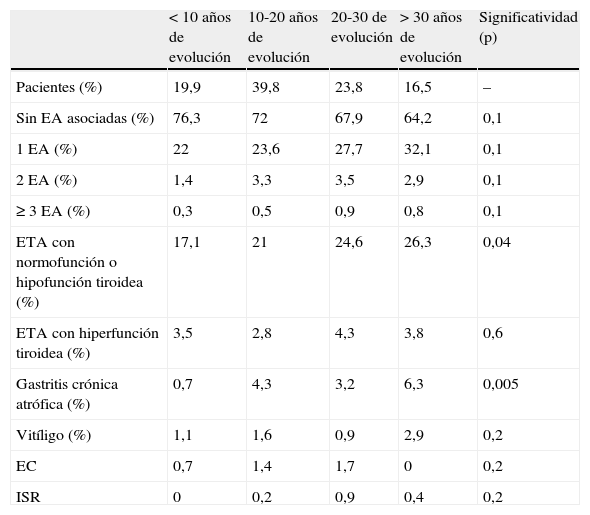
En la tabla 2 se describe la prevalencia de las EA (de forma general y específica para cada EA) en función de los años de evolución de la DM1. La HbA1c en los pacientes que no presentaban ninguna EA asociada fue de 7,9±1,2%. En los sujetos que presentaban una, 2 o ≥3 EA asociadas fue del 7,8±1,2%, del 7,6±0,9% y del 8,6±1,1%, respectivamente. No se encontraron diferencias estadísticamente significativas en cuanto al grado de control metabólico. Los sujetos sin EA asociadas presentaron 0,42±1,4 hipoglucemias graves/paciente/año, mientras que aquellos con alguna EA asociada presentaron 0,41±1,2 hipoglucemias graves/paciente/año. No se encontraron diferencias estadísticamente significativas.
Prevalencia de cualquier EA en relación con los años de evolución de la DM1 en el estudio DIACAM1. Prevalencia de ETA con normo o hipofunción tiroidea, ETA con hiperfunción tiroidea, gastritis crónica atrófica, vitíligo, EC e ISR en relación con los años de evolución de la DM1 en el estudio DIACAM1
| <10 años de evolución | 10-20 años de evolución | 20-30 de evolución | >30 años de evolución | Significatividad (p) | |
| Pacientes (%) | 19,9 | 39,8 | 23,8 | 16,5 | – |
| Sin EA asociadas (%) | 76,3 | 72 | 67,9 | 64,2 | 0,1 |
| 1 EA (%) | 22 | 23,6 | 27,7 | 32,1 | 0,1 |
| 2 EA (%) | 1,4 | 3,3 | 3,5 | 2,9 | 0,1 |
| ≥3 EA (%) | 0,3 | 0,5 | 0,9 | 0,8 | 0,1 |
| ETA con normofunción o hipofunción tiroidea (%) | 17,1 | 21 | 24,6 | 26,3 | 0,04 |
| ETA con hiperfunción tiroidea (%) | 3,5 | 2,8 | 4,3 | 3,8 | 0,6 |
| Gastritis crónica atrófica (%) | 0,7 | 4,3 | 3,2 | 6,3 | 0,005 |
| Vitíligo (%) | 1,1 | 1,6 | 0,9 | 2,9 | 0,2 |
| EC | 0,7 | 1,4 | 1,7 | 0 | 0,2 |
| ISR | 0 | 0,2 | 0,9 | 0,4 | 0,2 |
DM1: diabetes mellitus tipo 1; EA: enfermedad autoinmune; EC: enfermedad celiaca; ETA: enfermedad tiroidea autoinmune; IRS: insuficiencia suprarrenal primaria.
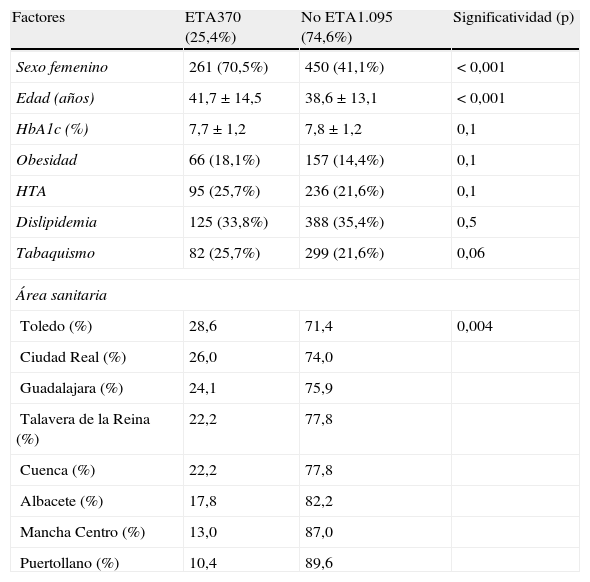
Como ya se ha dicho anteriormente, la ETA fue la EA asociada con mayor frecuencia. En la tabla 3 se muestran las características de los pacientes con ETA (con normofunción, hipofunción o hiperfunción tiroidea).
Características de los pacientes con ETA en el estudio DIACAM1
| Factores | ETA370 (25,4%) | No ETA1.095 (74,6%) | Significatividad (p) |
| Sexo femenino | 261 (70,5%) | 450 (41,1%) | <0,001 |
| Edad (años) | 41,7±14,5 | 38,6±13,1 | <0,001 |
| HbA1c (%) | 7,7±1,2 | 7,8±1,2 | 0,1 |
| Obesidad | 66 (18,1%) | 157 (14,4%) | 0,1 |
| HTA | 95 (25,7%) | 236 (21,6%) | 0,1 |
| Dislipidemia | 125 (33,8%) | 388 (35,4%) | 0,5 |
| Tabaquismo | 82 (25,7%) | 299 (21,6%) | 0,06 |
| Área sanitaria | |||
| Toledo (%) | 28,6 | 71,4 | 0,004 |
| Ciudad Real (%) | 26,0 | 74,0 | |
| Guadalajara (%) | 24,1 | 75,9 | |
| Talavera de la Reina (%) | 22,2 | 77,8 | |
| Cuenca (%) | 22,2 | 77,8 | |
| Albacete (%) | 17,8 | 82,2 | |
| Mancha Centro (%) | 13,0 | 87,0 | |
| Puertollano (%) | 10,4 | 89,6 | |
ETA: enfermedad tiroidea autoinmune; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial.
La gastritis crónica atrófica fue la segunda EA diagnosticada con mayor frecuencia. Al igual que en el caso de la ETA, no se obtuvo una diferencia estadísticamente significativa en cuanto al grado de control metabólico (HbA1c 7,9±1,1% vs 7,8±1,2% en el grupo con y sin gastritis crónica atrófica, respectivamente). No se analizaron en este grupo de pacientes otras variables como sexo, edad, obesidad, dislipidemia, HTA asociada o tabaquismo como en el caso de la ETA. Tampoco se analizaron estas variables en relación con otras EA.
En los sujetos con vitíligo no se encontraron diferencias estadísticamente significativas en cuanto al grado de control metabólico (HbA1c 7,7±0,9% vs 7,8±1,2% en el grupo con y sin vitíligo, respectivamente). Tampoco se encontraron diferencias en los sujetos con EC (HbA1c 8,3±1,1% vs 7,8±1,2% en el grupo con y sin EC) ni con ISR (HbA1c 7,9±0,9% vs 7,8±1,2% en el grupo con y sin ISR).
DiscusiónEn la cohorte del estudio DIACAM1, la presencia de EA asociadas a la DM1 afecta al 29% de los sujetos. La ETA fue la más frecuente (25,4%). Baena et al.17 encontraron una prevalencia de patología tiroidea en sujetos con DM1 del 17,8% (hipotiroidismo primario en el 9,9%, hipotiroidismo subclínico en el 7,1% y enfermedad de Graves en el 0,8% de los sujetos). Entre los pacientes con enfermedad tiroidea conocida, se detectaron Ac antiTPO en el 41,1% de los casos, mientras que los anticuerpos resultaron negativos en el 25,6% de los sujetos. En el 33,3% de los casos no se disponía de este dato. En nuestro estudio, la prevalencia de ETA es mayor, probablemente ya que por un lado este dato se estimó en función de la presencia de anticuerpos antitiroideos y además se incluyeron también los pacientes con normofunción tiroidea. En el estudio de Baena et al.17 la prevalencia de enfermedad tiroidea fue mayor en el sexo femenino, aunque no se encontraron diferencias estadísticamente significativas en función de la edad y del tiempo de evolución de la DM1. Sin embargo, existen otros estudios en los que el sexo femenino, la edad y la duración de la DM1 son factores asociados para el desarrollo de autoinmunidad tiroidea3,4,18. En nuestro caso, estas variables se asociaron con el desarrollo de ETA. También es más frecuente la autoinmunidad tiroidea positiva en los pacientes con DM1 con anticuerpos antiglutamato decarboxilasa positivos, en contraste con la presencia de anticuerpos antiinsulina. Esto se puede explicar por la presencia de receptores en el páncreas, el cerebro, el estómago y también a nivel tiroideo19, aunque este fenómeno no fue estudiado en la cohorte de pacientes de DIACAM1. Por otro lado, al igual que en otros estudios, no existe diferencia en relación con el grado de control metabólico en sujetos con y sin autoinmunidad tiroidea positiva4.
Es llamativa la diferencia en cuanto a la prevalencia de ETA en función del área sanitaria a la que pertenezca el paciente, lo que pone de manifiesto la diferencia que existe en el cribado de esta patología, ya que no encontramos diferencias estadísticamente significativas entre las 8 áreas de nuestra comunidad respecto al tiempo de evolución de la DM1, en el porcentaje de mujeres ni en la edad de los pacientes incluidos, excepto, tal y como se ha mencionado anteriormente, en el caso de las áreas sanitarias de Cuenca y de Mancha-Centro16. La American Diabetes Association (ADA) recomienda determinar Ac antiTPO y/o Ac antiTg en el momento del diagnóstico de la DM1 en niños. Así mismo, recomienda la determinación de TSH tras el diagnóstico y control de la DM1, y repetir dicha determinación cada 1-2años, o de forma más frecuente en caso de presentar síntomas sugestivos de disfunción tiroidea o bocio20. Otros autores recomiendan la determinación de anticuerpos antitiroideos de forma anual (sobre todo los Ac-antiTPO) en todos los niños y adolescentes con DM1 tras el diagnóstico, y la determinación de TSH en caso de autoinmunidad positiva4. Según la guía NICE, debe realizarse un cribado mediante la determinación de hormonas tiroideas en el momento del diagnóstico y posteriormente con periodicidad anual. En este caso no se menciona la necesidad de realizar determinación de anticuerpos antitiroideos21. Por tanto, no existe un consenso sobre cuándo y cómo se debe realizar el cribado de patología tiroidea en los sujetos con DM1, lo que explicaría probablemente las diferencias encontradas en este trabajo. Por otro lado, también podrían explicarse estas diferencias por un problema de infrarregistro de los datos dadas las características del estudio, lo que supone una limitación de este trabajo.
Como ya se ha mencionado anteriormente, la presencia de EC está aumentada en los sujetos con DM1. La detección es clínica y serológica, pero el diagnóstico definitivo es histológico. Las lesiones intestinales son graduales y reversibles con la retirada del gluten de la dieta, aunque se puede asociar con una serie de efectos secundarios indeseables como son la osteoporosis, los linfomas T asociados a enteropatía, la presencia de otro tipo de tumores u otras EA asociadas. Además, en los sujetos con DM1 se ha descrito un aumento del número de hipoglucemias asociadas en relación con la absorción errática de los nutrientes11,22, aunque este fenómeno no ha sido analizado en nuestra serie. En nuestro caso, la presencia de EC es claramente inferior a la descrita en otros estudios, probablemente porque esta patología esté infradiagnosticada. Este fenómeno se puede explicar porque el 50% de los pacientes con DM1 y EC no presentan síntomas gastrointestinales y el otro 50% únicamente refieren síntomas leves que difieren de la sintomatología clásica de diarrea, pérdida de peso y distensión y dolor abdominal9. Sin embargo, se debe tener en cuenta que la presencia o no de síntomas en el momento del diagnóstico es independiente del grado de lesión histológica. Al igual que en el caso de la ETA, no existe un consenso sobre cuándo realizar el cribado de la EC. La ADA20 recomienda realizar el cribado de EC (grado de recomendaciónE) en el momento del diagnóstico de la DM1 mediante la determinación de anticuerpos antitransglutaminasa de clase IgA o anticuerpos antiendomisio de clase IgA junto con la concentración de IgA total en suero. No especifica la periodicidad con la que deben realizarse estas determinaciones en caso de ser negativas. También recomienda (grado de recomendaciónE) la realización del cribado en niños en caso de alteraciones en el desarrollo pondero-estatural, pérdida de peso, diarrea, flatulencia, dolor abdominal o presencia de signos de malabsorción. En muchos trabajos se recomienda la determinación seriada de anticuerpos, aunque no se especifica cuál sería la periodicidad idónea para realizar estas determinaciones11,23. Sin embargo, existen otros autores24 que recomiendan realizar un cribado sistemático de forma anual en los 5 primeros años tras el diagnóstico de la DM1 y posteriormente espaciar estos controles y realizarlos cada 3 años. En nuestro caso, no existen diferencias estadísticamente significativas en cuanto al grado de control metabólico en los sujetos con y sin EC asociada a la DM1. Existen datos contradictorios sobre el beneficio obtenido con una dieta sin gluten sobre los requerimientos de insulina y el grado de control metabólico obtenido mediante la determinación de HbA1c, y lo que se ha descrito es una disminución en la frecuencia de hipoglucemias en pacientes con un buen cumplimiento terapéutico11,25.
La gastritis crónica atrófica fue la segunda EA encontrada en nuestro estudio por orden de frecuencia, con una prevalencia menor que la hallada en otros trabajos, probablemente porque también se encuentra infradiagnosticada al cursar en muchas ocasiones de forma asintomática. De Block et al.14 encontraron una prevalencia de anticuerpos contra las células parietales del 20,9%, que se asoció con anemia ferropénica en el 15,4% y con anemia perniciosa en el 10,5% de los casos. En el estudio de Warncke et al.26 la prevalencia de anticuerpos contra la célula parietal fue del 15,8%, y, al igual que en nuestro caso, dicha prevalencia aumentó de forma paralela al tiempo de evolución de la DM1. La ADA no realiza recomendaciones a cerca de su cribado de forma sistemática20.
En cuanto a la ISR, la prevalencia en países desarrollados es claramente inferior a la de otras EA, y se estima en 35-60casos por millón de habitantes, aunque hay estudios que indican prevalencias de 120casos por millón de habitantes27. No parece justificada la búsqueda sistemática de marcadores genéticos ni inmunológicos de ISR en los pacientes con DM1, ya que solo en torno al 1% desarrollarán la enfermedad, y es más razonable en casos de sintomatología compatible28.
Una limitación de nuestro trabajo es la forma en la que se seleccionaron los pacientes para el estudio. No se trata de un estudio de base poblacional, sino que se seleccionaron los pacientes que acudieron a consulta de endocrinología y que según los registros representan al 33% de todos los diabéticos mayores de 16años de la comunidad. Esto podría suponer que la prevalencia de EA esté todavía infradiagnosticada.
Por tanto, nuestro trabajo confirma que la DM1 es una patología que se asocia con frecuencia a otro tipo de EA. Se debería realizar un cribado sistemático de estas para optimizar el seguimiento de los pacientes con DM1, fundamentalmente de la ETA debido a su elevada prevalencia y de la EC por la importancia que tiene esta patología en el control de la diabetes y por sus posibles efectos secundarios asociados. En el momento actual, no existe consenso sobre la forma de realizar dicho cribado.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Complejo Hospitalario Universitario de Albacete: J.J. Alfaro, S. Aznar, F. Botella, A. Hernández, C. Lamas, L. López, L. Louhibi, J.J. Lozano, P.J Pinés.
Hospital Virgen de la Luz (Cuenca): M. Alramadán, S. Aranda, D. Calderón, C. Gómez, D. Martín.
Hospital Universitario de Guadalajara: V. Álvarez, S. Herranz.
Hospital General de Ciudad Real: M. Aguirre, R. Chamorro, M. Delgado, P. Rozas.
Complejo Hospitalario Mancha Centro: A. García Manzanares, I. Gómez, M. López, J. Moreno, J. Silva.
Hospital Santa Bárbara (Puertollano): J.C. Padillo, C. Roa.
Hospital Nuestra Señora del Prado (Talavera de la Reina): B. Blanco, P. de Diego, I. Quiroga, M.A. Valero.
Complejo Hospitalario de Toledo: B. Cánovas, E. Castro, J. López, I. Luque, E. Maqueda, A. Marco, E. Martínez, V. Peña, R. Sanchón, J. Sastre, A. Vicente.