El síndrome metabólico (SM), es un término empleado en los últimos años para designar un grupo de factores de riesgo que incluyen obesidad visceral, hipertensión arterial, hiperglucemia y dislipidemia aterogénica, los cuales predisponen al individuo a desarrollar enfermedad cardiovascular (ECV) y diabetes mellitus tipo 2 (DM2). La actividad física ha sido parte fundamental para entender el SM y su etiología, ya que el sedentarismo se asocia con ganancia de peso y aumento de grasa visceral, lo cual predispone al individuo a una adipocitopatía proinflamatoria con resistencia insulínica y aparición del fenotipo característico del SM. Los efectos beneficiosos que el ejercicio ejerce sobre el cuerpo humano justifican la evaluación, planificación y aplicación de programas de intervención que disminuyan el riesgo de DM2 y ECV. La siguiente revisión analiza los conceptos, bases moleculares y evidencia clínica del ejercicio como abordaje primordial en los trastornos endocrino-metabólicos.
Metabolic syndrome (MS) is a term that has been used in the last decades to define a group of risk factors that include: visceral obesity, arterial hypertension, hyperglycemia and atherogenic dyslipidemia, which predispose the individual to cardiovascular disease (CVD) and type 2 diabetes mellitus (DM2). Physical activity has been a fundamental element to understand MS and its etiology, given the fact that sedentarism is associated with weight gain and increased abdominal fat, which then predisposes the individual to a pro-inflammatory adiposopathy with insulin resistance, and the manifestation of the MS phenotype. The beneficial effects of exercise on the human body are of sufficient merit to evaluate, plan and apply intervention programs that lower the risk for DM2 and CVD. The following review analyzes the concept, molecular basis, and clinical evidence for exercise as a primary tool in endocrine and metabolic disorders.
El lema de los juegos olímpicos «Citius, Altius, Fortius», creado por el sacerdote dominico Henri Didon en 1891, establece un concepto de estética del deporte en el cual solo aquellos que son más rápidos, altos y fuertes lograrán la victoria. Aquellos atletas que luchan por la obtención de una presea basan su entrenamiento en la búsqueda de una aptitud física que les permita retar su cuerpo hasta los límites, tanto para ganar, como para romper marcas olímpicas. Desde el punto de vista biológico, los atletas de alta competencia ofrecen un soporte invaluable para la evaluación de los beneficios del acondicionamiento físico. El advenimiento de avances en áreas de la salud, biomedicina y bioingeniería ha iniciado un marco de investigación que ha mejorado nuestra percepción sobre la inactividad física, fenómenos asociados a ella y la irreversibilidad de sus secuelas.
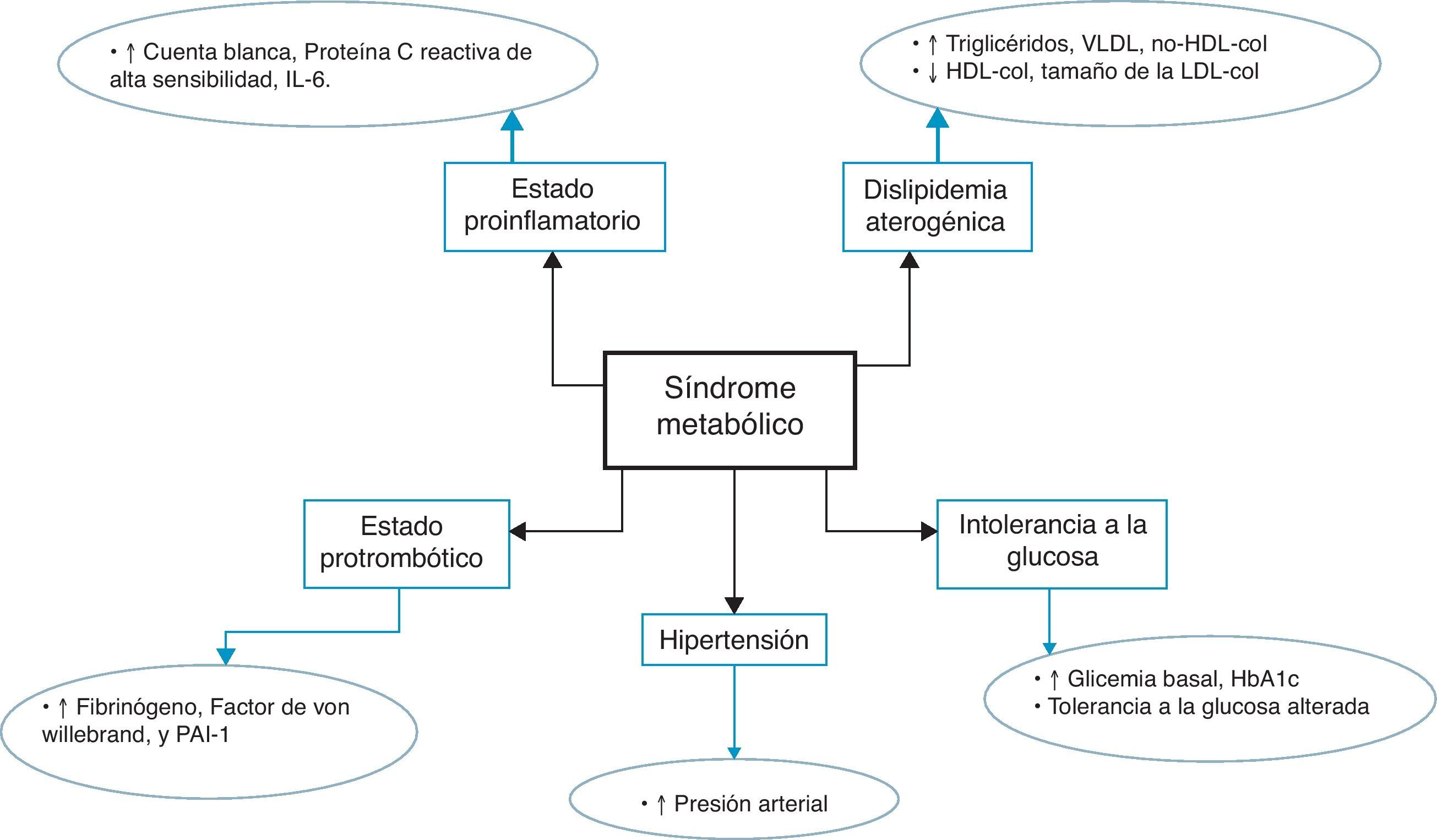
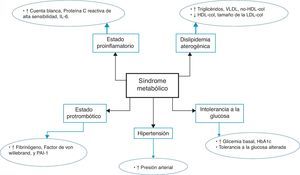
El sedentarismo constituye parte integral del síndrome metabólico (SM), término empleado en los últimos años para designar un grupo de factores de riesgo que incluyen obesidad visceral, hipertensión arterial, hiperglucemia y dislipidemia aterogénica, los cuales de forma independiente o en conjunto predisponen al individuo a desarrollar enfermedad arterial coronaria y diabetes mellitus tipo 2 (DM2)1; ver figura 1. A pesar de que la evidencia científica señala una íntima asociación entre un estilo de vida sedentario con la aparición de SM, no existe consenso con respecto al tipo, tiempo de duración e intensidad de la actividad física, lo cual dificulta la implementación de programas eficaces a gran escala, y particularmente en poblaciones de alto riesgo cardiometabólico2,3. Al respecto, se ha demostrado que 3h de ejercicio moderado o intenso a la semana disminuyen el riesgo de desarrollar SM, y que el beneficio es mayor cuando la actividad física es mantenida en el tiempo4. Más aún, el acondicionamiento cardiorrespiratorio se ha señalado como un predictor independiente de SM en hombres y mujeres, resultando especialmente útil como estrategia de prevención primaria en poblaciones vulnerables5.
El presente artículo de revisión se enfocará en las bases moleculares y clínicas que apoyan al ejercicio como herramienta fundamental en el abordaje y tratamiento de pacientes con SM. Para comenzar esta revisión, primero debemos establecer ciertos conceptos que son necesarios para la fluidez de la misma.
En primer lugar, se reconoce como actividad física cualquier movimiento producido por los músculos esqueléticos que resulta en consumo energético y puede ser medido en kilocalorías6. Una definición más amplia la define como la acumulación diaria de al menos 30min de actividades seleccionadas por el paciente, que incluyen labores ocupacionales, de ocio o relacionadas con oficios del hogar, pudiendo ser moderadas o vigorosas, planeadas o no planeadas, que se insertan en el «día a día» del individuo7. Por el contrario, inactividad física es por definición la ausencia de 30min diarios de actividad muscular con consumo calórico. Por su parte, sedentarismo hace referencia a aquel individuo que invierte menos del 10% de su gasto energético diario en la realización de actividades físicas que requieran al menos 4 MET (metabolic equivalent to task)8. Se define como MET la medida de intensidad basada en la tasa de gasto energético de una actividad y expresa el coste directo de la actividad física9. El concepto fisiológico lo define como el radio de la tasa de consumo energético durante una actividad física específica en referencia a la tasa metabólica en reposo (sentarse callado). Por convención, MET equivale 1kcal/kg/h (4,184J/kg/h)9. Ahora bien, ejercicio es cualquier movimiento producido por los músculos esqueléticos que consuma energía, y se relaciona positivamente con la condición física a medida que la intensidad, duración y frecuencia de los movimientos aumentan; sin embargo, este no es sinónimo de actividad física a pesar de que comparten varios elementos, más bien es una subcategoría de la misma6.
Si bien el concepto de actividad física se basa en consumo energético, la condición física es un concepto fisiológico y psicológico en el cual el individuo posee la habilidad de realizar actividades diarias con vigor y atención, sin llegar a fatigarse, y con suficiente energía como para disfrutar momentos de ocio y enfrentar emergencias impredecibles6. En otras palabras, estar en «buenas condiciones físicas» se relaciona con una serie de atributos que el individuo tiene u obtiene. Otra definición de condición física la sitúa como el estado de bienestar en el cual existe un bajo riesgo de problemas de salud prematuros y energía suficiente para participar en una variedad de actividades físicas9. El acondicionamiento cardiorrespiratorio es la capacidad del sistema circulatorio y respiratorio de proveer de oxígeno a los grandes grupos musculares esqueléticos durante una actividad física sostenida. La adaptación morfológica que ocurre durante un entrenamiento riguroso o planificado incluyen: aumento de la fracción de eyección, incremento del volumen sanguíneo, aumento de la densidad capilar y proliferación mitocondrial en los músculos entrenados6. Finalmente, el fitness metabólico es el radio entre la capacidad mitocondrial para la utilización de sustrato y la incorporación máxima de oxígeno hacia el músculo10. Este acondicionamiento celular incluye una inducción mediada por el ejercicio de enzimas involucradas en la glucogenogénesis, glucólisis y las proteínas relacionadas con el consumo de grasas como fuente de energía durante el ejercicio intenso y prolongado11.
Citius ∼ el más rápidoMetabolismo aeróbico y biocomplejidadLa diferencia entre un atleta rápido y otro no tan veloz es el uso de oxígeno por parte del músculo, la capacidad de almacenaje de energía de acceso inmediato y un sistema cardiorrespiratorio capaz de soportar la demanda exigida por tal actividad. Si bien el oxígeno es la molécula fundamental para el funcionamiento de la mitocondria y la consecuente síntesis de agua y ATP, no siempre fuimos seres oxígeno-tolerantes.
La historia de los organismos multicelulares complejos puede dividirse en 2 grandes fases: la fase reductora y la fase oxidativa12. Al principio, las formas celulares reducían el CO2 para incorporarlo en combustibles orgánicos; sin embargo, el oxígeno se comenzó a acumular en la atmósfera forzando a las células a evolucionar y realizar fotosíntesis oxigénica. Esta propiedad tiene como marcador evolutivo el desarrollo de organelas tipo mitocondrias o cloroplastos capaces de metabolizar el oxígeno característico de esta era llamada por muchos «El Gran Evento Oxidativo». Este enriquecimiento progresivo de la atmósfera con oxígeno derivó en otro fenómeno denominado «La Catástrofe Oxigénica», en la cual ocurrió una extinción en masa de aquellos organismos que no se adaptaron a la respiración aeróbica por déficit en la adquisición de organelas especializadas y ausencia de sistemas antioxidantes eficaces13. En vista de estos fenómenos, Koch y Britton14 postularon que la biocomplejidad evolutiva va de la mano con el desarrollo de un ambiente dominado por oxígeno, siendo por tanto el metabolismo aeróbico una maquinaria energética indispensable, donde todos aquellos defectos mitocondriales podrían constituir la base de muchas enfermedades crónicas de la actualidad.
El término SM ha evolucionado durante más de 20 años, manteniendo como eje central la obesidad visceral y la insulinorresistencia responsables de la hiperglucemia, hipertensión arterial, hipertrigliceridemia y los bajos niveles de colesterol HDL1. En este sentido, Haram et al.15 utilizando un modelo animal de SM demostraron que el ejercicio mejora varios de los defectos bioquímicos asociados con el estrés oxidativo y disfunción endotelial a través del incremento en la producción de óxido nítrico (ON) por parte del endotelio vascular. Además, el ejercicio aeróbico incrementa la sensibilidad a la insulina, mejorando el perfil de riesgo cardiovascular en ratas con SM. Con relación a lo anterior, Lee et al.16 evaluaron a 14.006 sujetos con el fin de estudiar la asociación entre el acondicionamiento cardiorrespiratorio, la obesidad y el riesgo de intolerancia a la glucosa y DM2, encontrando que el sedentarismo y la obesidad incrementan el riesgo de presentar alteraciones metabólicas, y que el acondicionamiento físico atenúa mas no elimina la influencia de la obesidad sobre el desarrollo de DM2.
En vista de la relación inversa que existe entre el SM y la condición física del paciente, parece lógico pensar que un bajo acondicionamiento cardiorrespiratorio forma parte de la fisiopatología de esta entidad. La relación entre ambos probablemente se deba a que el sedentarismo se asocia con ganancia de peso y aumento de grasa visceral, lo cual predispone al individuo a una «adipocitopatía proinflamatoria» con resistencia insulínica y aparición del fenotipo característico del SM17.
Altius ∼ el más altoBeneficios de la actividad física. Bases molecularesPoder obtener y mantener los beneficios de la actividad física permiten que el atleta llegue más alto, más lejos y en mejor condición. El ejercicio provoca un cambio en la utilización de combustible por parte del músculo esquelético activo, el cual proviene primariamente de la glucosa y el glucógeno muscular, así como de los ácidos grasos libres no esterificados. El glucógeno es la fuente de energía en el trabajo extenuante, mientras que en trabajos que requieren resistencia y larga duración la fuente de energía proviene de la glucosa circulante obtenida por medio de la gluconeogénesis y la glucogenólisis hepática18.
Al iniciarse la actividad física se produce un rápido incremento de la fosfocreatina, la oxidación de glucosa y de los ácidos grasos libres. Estos 3 sistemas constituyen las principales fuentes para reponer el ATP consumido. La fosfocreatina está conformada por la unión de la creatina al fósforo, y se caracteriza por ser la mayor reserva energética por unidad de tiempo. El sistema fosfocreatina-ATP es el que promueve la fosforilación del ATP con mayor rapidez debido a que la fosfocreatina es almacenada en el citosol muy próxima a los sitios de utilización de energía. Cuando la actividad física excede los 10min de duración, las reservas de fosfocreatina y ATP se agotan, siendo necesario activar el sistema glucolítico, el cual constituye el segundo sistema energético para reponer el ATP utilizado18,19.
En reposo, la tasa de producción de glucosa es de 150mg/min, del cual el 75% proviene de la glucogenólisis y el 15% restante de la gluconeogénesis a partir de aminoácidos. Cuando el individuo ingiere carbohidratos, estos se almacenan en el hígado (glucógeno hepático), donde las reservas pueden ser de 70 a 100g y en el músculo (glucógeno muscular), cuyas reservas varían entre 250 y 400g18. La producción de glucosa se incrementa cuando esta es utilizada por el músculo en actividad, siendo este aumento principalmente a expensas de la glucogenólisis hepática y muscular, la cual es inducida durante los primeros 10 a 15min de la actividad física. Subsecuentemente, si se prolonga el ejercicio, la producción de glucosa ocurre a expensas de la gluconeogénesis. El destino final de la glucosa producida por cualquiera de estas vías es ingresar en la vía glucolítica, dando como resultado 2 moléculas de ATP, 2 moléculas de ácido pirúvico y un ión hidruro que es captado por el NAD+. El ácido pirúvico y los hidrógenos entran a la mitocondria (en presencia de oxígeno) y de allí pasan al ciclo de Krebs para dirigirse hacia la cadena respiratoria, cuyo producto final será la fabricación de 36 moléculas de ATP, que serán utilizadas como fuente de energía18,20.
A medida que progresa la actividad física ocurre una disminución en los depósitos de glucosa del organismo, por lo que la glucólisis es reemplazada progresivamente por la lipólisis, la cual incrementa la concentración de ácidos grasos libres en la circulación sanguínea. Estos ácidos grasos se unen a proteínas transportadoras como la albúmina, para ser transferidos a los músculos activos y luego de ingresar a la célula muscular entran en las mitocondrias para que tenga lugar la β-oxidación de ácidos grasos y la generación de acetil coenzima A (CoA) que posteriormente ingresará al ciclo de Krebs y a la cadena respiratoria para la formación de ATP18.
Como se mencionó previamente, el ejercicio es capaz de disminuir la resistencia insulínica mediante 2 vías: una mediada por ON y la otra por la cinasa dependiente de AMP (AMPK). En estudios llevados a cabo tanto in vivo como in vitro se ha demostrado que la contracción muscular incrementa la adenosina extracelular, formada por la enzima 5′ nucleotidasa a partir de la desfosforilación del AMPc. Parte de la adenosina que es producida intracelularmente es liberada hacia el espacio extracelular, donde interactúa con los receptores A1 regulando así varios procesos fisiológicos, entre ellos el transporte de glucosa estimulado por insulina en el músculo esquelético y el tejido adiposo. Por otra parte, la bradicinina es otra de las sustancias liberadas durante la actividad física y en conjunto con la adenosina actúa en las células musculares a través de su unión a receptores específicos acoplados a proteína G, los cuales estimulan la activación de la óxido nítrico sintasa constitutiva cuya función es la síntesis de ON a partir de L-arginina. Posteriormente, el ON a través de su segundo mensajero el GMPc promueve la translocación del transportador GLUT 4 hacia la membrana celular posiblemente a través de la fosforilación del residuo de tirosina del sustrato del receptor de insulina tipo 1 (IRS1)18,21.
El otro mecanismo que explica el efecto beneficioso del ejercicio en personas con SM, es la vía del AMPK, la cual constituye una proteína heterotrimérica compuesta por 3 subunidades α, β, y λ, y de la que existen 2 isoformas: la AMPK α1 y α2, siendo esta última la más estimulada por el ejercicio. La actividad contráctil trae consigo el consumo de ATP, el cual es rápidamente hidrolizado en AMP, el cual a su vez determina la activación alostérica de la AMPK mediante su unión a la subunidad α y λ19. La AMPK estimulada durante el ejercicio aeróbico inhibe la enzima acetil CoA carboxilasa tipo 2 que se encarga de transformar el acetil CoA en malonil CoA, obteniendo por tanto una concentración reducida de malonil CoA que determina el cese de la inhibición sobre la enzima carnitina palmitoil transferasa. Como resultado de este proceso, se incrementa el paso de ácidos grasos libres hacia el interior de la mitocondria donde tiene lugar la β-oxidación de ácidos grasos, a partir de la cual se obtiene el ATP necesario para la contracción muscular y se reducen significativamente los ácidos grasos libres del plasma, los cuales se encuentran elevados en sujetos con SM. Además, la AMPK es capaz de suprimir la expresión génica de las enzimas involucradas en la lipogénesis y gluconeogénesis hepática, lo cual conduce a la reducción de los depósitos lipídicos en los hepatocitos, evitando así la generación de VLDL22.
Efecto antiinflamatorioDurante el siglo pasado se ha demostrado que la inflamación crónica es una característica clave en la obesidad y DM223. Este evento se denomina «metainflamación» y es estimulado por fenómenos metabólicos, nutrientes y metabolitos intermediarios que activan vías involucradas en la inflamación clásica. La metainflamación ocurre por la síntesis anormal de citocinas, reactantes de fase aguda y otros mediadores provenientes del adipocito y los macrófagos del tejido adiposo estromal24. Dentro de las adipocitocinas destaca el factor de necrosis tumoral α (TNF-α), el cual bloquea la señalización postreceptor de la insulina mediante varios mecanismos, entre ellos: inducción de serín/treonín cinasas que fosforilan e inhiben al IRS-1 y la activación de señales proinflamatorias como la cinasa del N-terminal de Jun (JNK)24.
Otra citocina implicada en el fenómeno metainflamatorio y que es capaz de interferir en la cascada de señalización de la insulina es la interleucina 6 (IL-6). Esta molécula ejerce varias funciones que abarcan desde el crecimiento celular hasta la regulación de aspectos humorales y celulares de la inflamación25. De igual forma, la interleucina 1β (IL-1β) se asocia a un mayor riesgo de presentar DM2, debido a que constituye el principal promotor de la destrucción inflamatoria de las células β, por lo cual se considera un potencial blanco terapéutico futuro para preservar la masa y función de la célula β pancreática26. Por su parte la leptina, sintetizada principalmente por los adipocitos, se encarga de la regulación de múltiples procesos como la homeostasis energética, la función sexual e incluso la interacción entre células del sistema inmunológico, por lo que está implicada en procesos patológicos como el SM, donde se observan niveles significativamente mayores de esta hormona, siendo considerada un predictor independiente de riesgo cardiovascular27,28.
Un cuerpo creciente de evidencia ha demostrado que el ejercicio es capaz de modificar la respuesta inflamatoria29,30. De hecho, durante el ejercicio no hay un incremento de TNF-α ni IL-1β, sino un aumento en las concentraciones de IL-10, que es una citocina antiinflamatoria debido a que ejerce un rol inmunomodulador en las células T reguladoras. Por tanto, se plantea que el ejercicio practicado de forma regular protege ante la inflamación crónica de bajo grado y mejora el pronóstico de enfermedades inflamatorias como la aterosclerosis30. En la tabla 1 se resumen los beneficios metabólicos que confiere la actividad física31.
Bases moleculares de los beneficios del ejercicio
| Parámetro | Modificación |
| Cambios estructurales del músculo esquelético | • Incremento del tamaño de la fibra• Incrementa el porcentaje de fibras tipo iia• Incrementa la densidad capilar y el flujo sanguíneo |
| Cambios bioquímicos en el músculo esquelético | • Aumenta la cinética de señalización insulínica• Activación de AMPK• Incrementa la maquinaria enzimática para el metabolismo de la glucosa (hexocinasa, glucógeno sintetasa, citrato sintetasa, aconitasa, entre otras)• Aumenta la síntesis de mioglobina |
| Influencia sistémica | • Aumenta la captación de oxígeno y la capacidad funcional de trabajo• Aumenta la síntesis de la lipoproteín lipasa• Disminuye la producción excesiva de glucosa hepática y VLDL• Mejora los niveles de hormonas contrarreguladoras• Mejoría de condiciones comórbidas: hipertensión, obesidad visceral, inflamación sistémica y dislipidemia |
En qué se basa la denominación de fortaleza: ¿en la cantidad de peso que se puede levantar?, ¿en la cantidad de veces que se repite un ejercicio?, ¿en el desarrollo de masa muscular?, ¿en aquel que es capaz de sobrevivir ante situaciones adversas? Cuando hablamos de seres humanos y cómo han evolucionado a través de los años, aquel que sobrevive es denominado el más apto, y bajo este concepto, el más fuerte. La actividad física ha sido pieza clave para la supervivencia de la raza humana, no solo por el advenimiento de la marcha erguida, sino por la aplicación de la misma para las actividades de caza y recolección. Estudios en biología evolutiva, kinesiología, medicina del deporte, biología de mitocondrias y otras ciencias básicas médicas han descubierto un abanico de beneficios del acondicionamiento físico que incluyen modificaciones genéticas y de almacén energético.
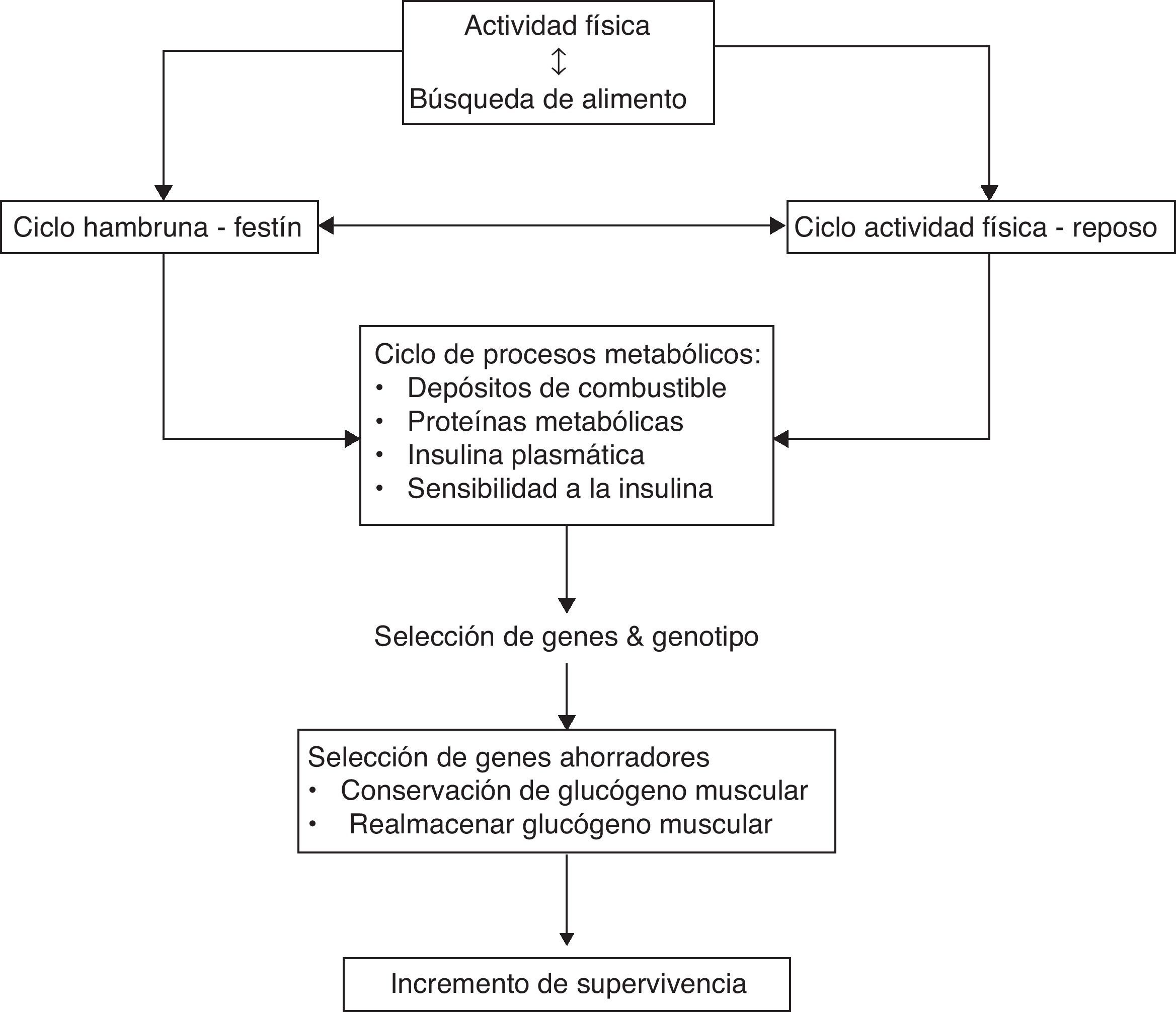
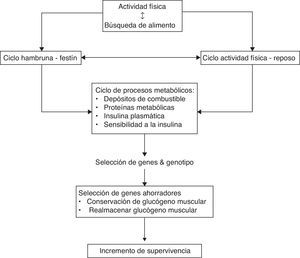
Inducción génicaNeel, en su publicación del año 1962, planteó que el perfil genometabólico del hombre moderno proviene de los cazadores-recolectores del final de la era Paleolítica, hace unos 50.000 - 10.000 años antes de Cristo (AC)32. Estos ancestros vivían entre ciclos de hambruna y festín, durante los cuales debieron adquirir propiedades específicas, como lo fue el almacenamiento de energía en el hígado, músculo esquelético y tejido adiposo durante los períodos de festín junto con gluconeogénesis hepática paralela («insulinorresistencia selectiva»), y utilización de dichos depósitos durante los ciclos de hambruna. La selección ventajosa se basó en mantener y heredar genes ahorradores los cuales permitían la incorporación y utilización eficiente de los alimentos32,33. La característica fundamental de los humanos del Paleolítico era su rutina de cacería y recolección de alimentos. Los hombres cazaban durante 1-4 días a la semana, mientras que las mujeres recolectaban hortalizas, frutas y tubérculos cada 2–3 días. Esta rutina semanal proporcionaba un plan de actividad física caracterizada por resistencia moderada e intensa alternada con periodos de descanso32,33 (ver figura 2). Este perfil de actividad física combinado con un metabolismo ahorrador tardó unos 2,5 millones de años en desarrollarse y ser selectivamente heredado, manteniéndose igual durante los últimos 10.000 años. Se puede concluir entonces que la discordancia entre los «genes de la era de piedra» y los «genes de la era espacial», precipitaron la pandemia del SM.
En la actualidad es posible evidenciar que las poblaciones de cazadores-recolectores que han sido sacados de su medio ambiente e introducidos en un «medio occidentalizado» han experimentado un incremento significativo en la incidencia de DM2 y enfermedades cardiovasculares; es decir, si bien es cierto que la predisposición genética es importante, también lo son todos aquellos factores ambientales que inciden sobre la expresión o supresión de esos genes (epigenética)34–36. Un ejemplo de este fenómeno es observado en los indios Pima de Arizona, los cuales descienden de los aborígenes mexicanos que migraron hacia Estados Unidos alrededor de 300 años AC. Los Pima de Arizona invierten menos de 5h a la semana en actividad física, en comparación con las casi 23h de trabajo semanal de los indios Pima de México, lo cual combinado con una dieta occidental ha sido la combinación perfecta para lograr una prevalencia 6 veces mayor de DM2 en comparación con los Pima Mexicanos34–37.
Intervenciones en estilos de vidaEstudios prospectivos en poblaciones de alto riesgo han concluido que la actividad física regular está asociada con un menor riesgo de DM2. El Programa de Prevención de Diabetes (DPP, por sus siglas en inglés Diabetes Prevention Program) estudió a 3.234 pacientes con prediabetes. En este estudio, el grupo de pacientes que siguió una dieta baja en grasa y 150min de ejercicio moderado a la semana durante 3 años, disminuyó en un 58% el riesgo de desarrollar DM2. La pérdida de peso, aunque modesta (7%), fue el principal predictor en la reducción del riesgo de DM2. Cabe destacar que en este estudio 495 sujetos no lograron la meta de reducción de peso, sin embargo, cumplieron la meta de ejercicio lo cual produjo una reducción del 44% en el riesgo de desarrollar DM238. De igual forma, el estudio finlandés de estilos de vida demostró en sujetos con intolerancia a la glucosa una reducción del 58% de riesgo de desarrollar DM2 en aquellos participantes que perdieron peso por una ingesta baja de grasa y mayor consumo de fibra en combinación con una caminata de 30min al día con entrenamiento de resistencia ocasional39. Más aún, aquellos individuos que realizaron caminata de al menos 2,5h semanales durante el seguimiento, tuvieron de un 63 a un 69% menos probabilidades de desarrollar DM2 con respecto a los que caminaron menos de 1h semanal, concluyendo que el riesgo de desarrollar DM2 estuvo más asociado al incremento de la actividad física total que a la intensidad del ejercicio39.
Más recientemente, el estudio chino de Prevención de Diabetes DaQuing demostró que los cambios en estilos de vida producen un beneficio a largo plazo en la incidencia de DM2. Para tal fin, se estudiaron 577 adultos con intolerancia a la glucosa, de los cuales un grupo recibió intervención con dieta y ejercicio (solo o en combinación) durante 6 años. Se encontró que el grupo que recibió intervención combinada en estilos de vida (dieta más ejercicio) logró una disminución del 51% en la incidencia de DM2 durante el período de intervención activa comparado con el grupo control, y del 43% luego de 14 años de iniciados dichos cambios40.
Por su parte, el estudio Look Ahead (Action for Health in Diabetes) diseñado para evaluar si la pérdida de peso a través de cambios intensivos en estilos de vida es capaz de mejorar el control glucémico y disminuir el riesgo de enfermedades cardiovasculares en sujetos diabéticos con sobrepeso y obesidad, demostró que al primer año de iniciada la intervención se alcanzó una pérdida ponderal del 8,6% frente al 0,7% del grupo control, con mejoría significativa de factores de riesgo como la HbA1c, la presión arterial, colesterol HDL, triglicéridos y microalbuminuria. Además, hubo una disminución en el número y/o dosis de fármacos utilizados para el tratamiento de la hipertensión arterial, DM2 o la dislipidemia, lo cual indica que los cambios en estilos de vida basados en dieta baja en grasas y actividad física moderada-intensa producen beneficios incluso en pacientes diabéticos de alto riesgo cardiovascular41. Inclusive, en este período de tiempo los sujetos con obesidad mórbida pertenecientes al grupo de intervención intensiva registraron un mayor beneficio en pérdida ponderal con respecto a los sujetos diabéticos con sobrepeso, evidenciando una buena adherencia al plan terapéutico en todos los grupos estudiados42.Por estos hallazgos, se recomienda realizar ejercicio aeróbico de moderada intensidad al menos 30min, 5 días a la semana o ejercicio aeróbico intenso al menos 20min, 3 días a la semana. Adherirse a este programa resulta beneficioso en cada grupo etario y es capaz de disminuir a la mitad el riesgo de padecer SM43–45.
Métodos de medición de la actividad físicaEn la actualidad existen métodos directos e indirectos para medir la actividad física. Los métodos directos son usualmente sensores de movimiento tipo acelerómetros que miden aceleración en el plano vertical, y podómetros los cuales censan los pasos que el paciente realiza en un ambiente totalmente natural46. En nuestro medio, Bermúdez et al.47 determinaron la actividad física por podometría en pacientes con SM, encontrando que dichos sujetos presentaron un recuento menor de pasos por día en comparación con aquellos sin SM (2.813,9±749,2 frente a 4.800,6±1.012,5 pasos/día; p<0,0001). Además, se observó una correlación negativa entre el recuento de pasos por día con la tasa metabólica basal (r=-0,341; p=0,033), el IMC (r= -0,674; p=0,0001), el porcentaje de grasa corporal (r= -0,646; p=0,0001) y la circunferencia abdominal (r=-0,638; p=0,0001).
Por su parte, los métodos indirectos miden la actividad física mediante el registro en cuadernos o cuestionarios. Los registros personales en cuadernos consisten en anotar todas las actividades posibles en el día, el motivo de la actividad, la duración, la intensidad, la posición del cuerpo, entre otros detalles; mientras que los cuestionarios se basan en la autoaplicación de una serie de preguntas destinadas a evaluar la actividad física diaria, pudiendo ser aplicados en persona, por teléfono o incluso enviados por correo46.
Existen 3 tipos de cuestionarios: los globales, que evalúan el nivel de actividad física general y dan información sobre los tipos y patrones de actividad física; los recordatorios, que permiten evaluar la actividad física realizada hace días, semanas o un mes, lo cual permite conocer el tipo de actividad física predominante; y los cuantitativos, que miden la actividad física de varios meses, así como su duración e intensidad, por lo cual son claves para cuantificar el pronóstico del paciente46. Uno de los cuestionarios más utilizados es el IPAQ (siglas en inglés de International Physical Activity Questionnaire), desarrollado bajo la supervisión de la OMS en 1998 con el objetivo de crear una herramienta que permitiera estimar la actividad física en poblaciones entre 18-65 años de diferentes países. Existen 2 formas del cuestionario, el corto (IPAQ-SF) para estudios de vigilancia, y el largo (IPAQ-LF) destinado a obtener información referente a la duración e intensidad de la actividad física en el trabajo, el hogar, el transporte y en períodos de ocio48,49.
ConclusiónEl conocimiento de los beneficios biológicos que ofrece el acondicionamiento físico permite no solo reconocer su rol en el tratamiento de pacientes cardiometabólicos y en la reinserción de pacientes obesos en control de peso, sino también evaluarlo de manera objetiva y así poder prescribirlo de manera adecuada, sin condicionar al paciente a extenuación y/o agravamiento de lesiones previas osteomusculares. El desarrollo de métodos cuantitativos que permiten una determinación de MET consumidos durante una determinada actividad, permitirán un mayor control del cumplimiento del tratamiento y reforzar el papel preventivo del acondicionamiento cardiorrespiratorio en las enfermedades cardiovasculares y metabólicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.