Definición del problema
Estamos asistiendo a un proceso creciente de medicalización de situaciones que anteriormente no se consideraban entidades médicas. Márquez y Meneu1, en un editorial publicado recientemente, analizan esta progresiva medicalización de la vida y describen que una de las formas que puede adoptar es «reclamando la eficacia incontestada de la medicina científica, y la bondad de todas sus aportaciones, desatendiendo las consideraciones sobre el necesario equilibrio entre sus beneficios y los riesgos o pérdidas que implican». Este proceso se ha dado en distintos aspectos del ciclo reproductivo de las mujeres, como los embarazos, el parto y la menopausia.
La menarquia, el embarazo o la menopausia son situaciones biológicas de cambio. La primera representa el comienzo del ciclo reproductivo y la última, el cierre.
La menopausia se define como la fecha de la última menstruación, que se produce como consecuencia del cese de la actividad folicular ovárica. Deben transcurrir por lo menos 12 meses desde la última menstruación para poder considerarse como la fecha de menopausia. En torno a esta fecha se distinguen 2 fases, en las que algunas mujeres pueden presentar síntomas: la premenopausia o transición menopáusica, que se refiere al intervalo de 2 a 8 años que la precede, y la posmenopausia, que incluye de 2 a 6 años tras la menopausia. La perimenopausia es el período de 2 a 6 años previos a la menopausia y el año posterior a la última menstruación. Todas estas fases se agrupan bajo la denominación de climaterio.
La menopausia ocurre en torno a los 50 ± 2 años. Si acontece antes de los 40 años se habla de menopausia precoz, y si se produce después de los 55 años, de menopausia tardía.
Según la evidencia disponible en este momento, el descenso de los estrógenos se asocia con modificaciones del ciclo durante la etapa de transición premenopáusica (proiomenorrea, hipermenorrea y amenorrea), y en la posmenopausia con 3 situaciones de salud2,3: trastornos vasomotores, atrofia urogenital y disminución de masa ósea4,5. Cada uno de ellos puede afectar de forma variable en frecuencia e intensidad a las mujeres en el climaterio6,7.
Sin embargo, existe una tendencia a relacionar la mayoría de los síntomas que acontecen entre los 50 y 65 años con la menopausia. Se puede afirmar, con un adecuado grado de evidencia, que en las mujeres posmenopáusicas no presentan asociación causal con la concentración de estrógenos: los trastornos del ánimo, los trastornos cognitivos, el incremento del riesgo cardiovascular, las algias osteomusculares, la disminución de la libido y la incontinencia urinaria de esfuerzo.
El tratamiento hormonal combinado (estrógenos más gestágenos) es uno de los tratamientos de elección para los síntomas menopáusicos y la prevención de la osteoporosis, pero no está exento de riesgos; no siempre que se ha recomendado se ha realizado un adecuado balance riesgo-beneficio. Este tratamiento se ha indicado en las últimas décadas para la prevención primaria y secundaria de las enfermedades cardiovasculares y para el tratamiento de síntomas que no tienen una relación causal con la menopausia.
Es conveniente aclarar en este punto que sólo es correcto utilizar el término «tratamiento hormonal sustitutivo» (THS) cuando se administra a mujeres con menopausia precoz, quirúrgica o farmacológica para tratar síntomas. En mujeres con menopausia fisiológica, cuando es necesario tratar, se debe denominar «tratamiento con estrógenos» (mujeres histerectomizadas) o «tratamiento hormonal combinado de estrógenos y gestágenos» (mujeres con útero). El término «a medio plazo» generalmente se refiere a la duración del tratamiento hormonal entre 2 y 5 años; a partir de los 5 años se denomina «largo plazo».
Es objetivo de este trabajo dar respuesta a la siguiente pregunta: ¿es seguro a medio-largo plazo el tratamiento con estrógenos en mujeres posmenopáusicas?
Se realizó una búsqueda bibliográfica en septiembre de 2003, en las bases de datos MEDLINE mediante PubMed, Ovid, publicaciones electrónicas y Cochrane Library, sobre revisiones sistemáticas, metaanálisis, ensayos clínicos y guías de práctica clínica, ya que durante el primer semestre de este año se han publicado datos de gran interés procedentes del ensayo clínico Women's Health Initiative (WHI). También se ha utilizado la revisión bibliográfica realizada en el último año para la elaboración de un protocolo de menopausia8 recientemente publicado.
Síntesis de las evidencias
Los trastornos vasomotores, la atrofia urogenital y la disminución de masa ósea, que incrementa el riesgo de fractura, son las 3 entidades clínicas asociadas al descenso de estrógenos tras la menopausia y que, por lo tanto, se pueden beneficiar del tratamiento con estrógenos9,10.
En estudios de seguimiento, de base poblacional, en mujeres perimenopáusicas, como el Proyecto Manitoba y el Massachusetts Women Health's Study11 no se encontró asociación entre las concentraciones de estrógenos y la depresión. En un metaanálisis publicado en 199612 se constató que la incidencia de depresión no aumenta tras la menopausia, ya que su frecuencia es similar a la de otras edades. Con los datos procedentes de ensayos clínicos, se puede afirmar que no existe asociación causal entre las concentraciones de estrógenos y los trastornos psicoafectivos13 (depresión, ansiedad, irritabilidad) o cognitivos14.
Otros síntomas asociados al climaterio, sin relación causal, son las algias osteomusculares, la disminución de la libido y la incontinencia urinaria de esfuerzo. La mayor parte de la sintomatología osteomuscular que la mujer presenta en esta etapa de la vida está relacionada con la baja potenciación del sistema musculotendinoso y con procesos degenerativos en la zona articular.
La disminución de la libido es otro síntoma asociado a la menopausia. Sin embargo, los resultados de ensayos clínicos15 concluyen que no existe tal relación. La disminución de la frecuencia de relaciones sexuales está más relacionada con la dispareunia por la sequedad vaginal, la pérdida de la pareja (separación, divorcio, viudedad) y la disminución de deseo en la pareja que con disminución de la libido en las mujeres.
La incontinencia urinaria de esfuerzo, con características diferenciadas de la micción imperiosa y la poliuria, está relacionada con una mayor paridad y con traumatismos del suelo pélvico en el parto. No existe evidencia de que las mujeres posmenopáusicas tengan mayor incidencia que las premenopáusicas16. Respecto a la acción de los estrógenos, en 2 ensayos clínicos17 no se encontraron diferencias en el número de episodios de incontinencia ni en la calidad de vida. En el Heart and Estrogen/progestin Replacement Study (HERS)18 se encontró un empeoramiento de la incontinencia en el grupo de mujeres tratadas con estrógenos.
Los resultados de la mayoría de los estudios observacionales publicados durante décadas concluyeron que los estrógenos tenían un efecto cardioprotector y que tras la menopausia se producía un incremento del riesgo cardiovascular, por lo que diversos organismos y sociedades científicas recomendaban la prevención primaria y secundaria de enfermedades cardiovasculares con tratamiento estrogénico en mujeres posmenopáusicas. La revisión de estos datos, una vez corregidas las posibles variables de confusión, constató que no existe ningún beneficio cardiovascular19.
En un metaanálisis de estudios observacionales20 se observó una reducción del 35-50% del riesgo cardiovascular asociado al tratamiento con estrógenos, pero las mismas autoras se plantean las limitaciones de estos resultados por la presencia de sesgos no controlados. En una revisión publicada recientemente21 se constatan las mismas limitaciones que llevaron a la sobrevaloración de los beneficios de los estrógenos y a la subestimación de los riesgos. Se detectó un sesgo de selección, ya que sólo se incluyó a mujeres con pocos factores de riesgo y hábitos de vida saludables, que no eran representativas de la población general. En segundo lugar, se identificó un sesgo de cumplimiento; una mejor adhesión al tratamiento está asociada a comportamientos más saludables que disminuyen el riesgo de enfermar, tanto en el grupo de intervención como en el de placebo. Además, las mujeres que interrumpieron el tratamiento por presentar efectos adversos precoces no se registraron como usuarias, por lo que esos efectos perjudiciales están subestimados.
Un ejemplo de estos estudios es el Nurse's Health Study, que con sus primeros resultados contribuyó al mito22 del efecto cardioprotector. En un editorial23 publicado en 2000, ante el incremento del riesgo de cáncer de mama identificado en otros trabajos, sus autores comentan que la disminución del riesgo cardiovascular y de fractura ósea no justifica el uso de estrógenos, ya que otras intervenciones, como la actividad física, mejoras en la dieta y el abandono del tabaco, son muy beneficiosas sobre el riesgo cardiovascular y no presentan efectos adversos. En un artículo reciente, la mayoría de los autores de este trabajo recomiendan su uso únicamente para el tratamiento de los trastornos vasomotores y la atrofia urogenital, a corto plazo y a la dosis eficaz más baja24.
Con el fin de responder a la incertidumbre que generaban los resultados contradictorios y negativos de algunos trabajos bien diseñados respecto a los riesgos que presentaba el tratamiento hormonal con estrógenos, en la década de los noventa se pusieron en marcha varios ensayos clínicos aleatorizados de gran tamaño:
1. En el Postmenopausal Estrogen Progestin Intervention Trial (PEPI)25, un ensayo clínico aleatorizado donde se emplearon distintas pautas (estrógenos-gestágenos) en 875 mujeres sanas para valorar su acción sobre el perfil lipídico, se constató un incremento del 10-15% de HDL-colesterol y un descenso del HDL-colesterol unido a lipoproteínas de baja densidad en todos los grupos. Sin embargo, en las mujeres no histerectomizadas que recibieron sólo estrógenos se produjo un incremento anual del 10% en la incidencia de hiperplasia endometrial atípica, lesión precursora del carcinoma de endometrio. Tras la confirmación de que el tratamiento sólo con estrógenos en mujeres con útero incrementa el riesgo de cáncer de endometrio, se estableció la obligatoriedad de asociar un gestágeno en todas las mujeres menopáusicas con útero que deban recibir tratamiento con estrógenos.
2. Los resultados de un metaanálisis realizado por el Collaborative Group on Hormonal Factors in Breast Cancer26 mostraron un aumento de la incidencia de cáncer de mama en las mujeres con tratamiento estrogénico durante más de 5 años (riesgo relativo = 1,35). Se ha constatado que este incremento se mantiene mientras se realiza el tratamiento27, y a los 5 años de su interrupción el riesgo se iguala al de las no usuarias. Según se recoge en el estudio Breast Cancer Detection Demostration Project28, el riesgo es mayor cuando se asocia un gestagéno, el número de pacientes que habría que tratar para producir un cáncer sería de 1.100 mujeres si son estrógenos y de 641 con tratamiento combinado estrógeno-gestágeno.
3. En mujeres posmenopáusicas usuarias de estrógenos se constató29 un incremento del riesgo de trombosis venosa profunda que era 2-3 veces superior al de la población general.
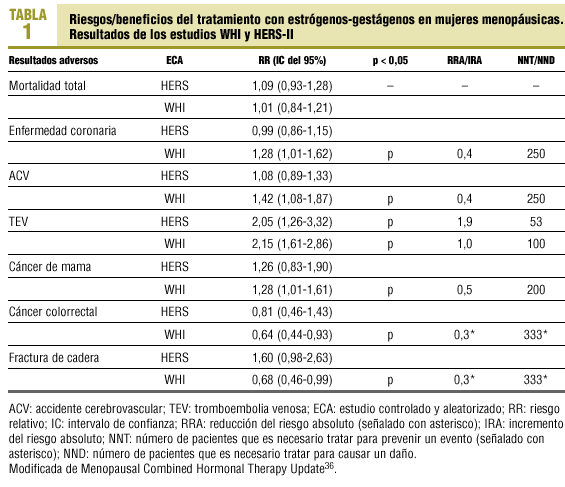
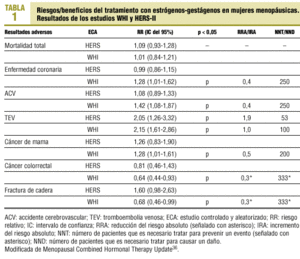
En agosto de 1998 se publicaron los resultados del HERS30, ensayo clínico aleatorizado con doble enmascaramiento, que durante 4,1 años siguió a 2.763 mujeres con antecedentes de enfermedad coronaria para evaluar la intervención con estrógenos en la prevención secundaria de la enfermedad. No se encontró una disminución del número de episodios coronarios en el grupo de intervención y sí se apreció un incremento de la enfermedad tromboembólica (RR = 2,89; 95% IC, 1,50-5,58) y enfermedad biliar (RR = 1,38; 95% IC, 1,00-1,92) en el primer año en este grupo, por lo que los autores no recomiendan el tratamiento con estrógenos para realizar prevención secundaria de cardiopatía isquémica, y advierten del riesgo de trombosis venosas profundas y patología quirúrgica biliar.
En mayo de 2002 se publicaron los resultados del HERS-II31, continuación durante 2,6 años del HERS, esta vez sin enmascaramiento. Se confirmaron los hallazgos de la primera parte del ensayo: no hay diferencias en la aparición de nuevos episodios coronarios entre el grupo placebo y el de intervención, pero en el grupo de intervención con estrógenos-gestágenos se produce un incremento de enfermedad tromboembólica y patología biliar. En consecuencia, los autores concluyen que no se debe recomendar el tratamiento hormonal con estrógenos-gestágenos para la prevención secundaria de la enfermedad cardiovascular.
4. Con el objetivo principal de evaluar los riesgos-beneficios del tratamiento con estrógenos-gestágenos en mujeres sanas posmenopáusicas, en el año 1998 se pone en marcha un ensayo clínico aleatorizado, doble ciego, el WHI32. Entre 1992 y 1998 se reclutó a 164.500 mujeres sanas de 50-79 años, que se asignaron aleatoriamente a 3 ensayos clínicos y un estudio observacional. Las 27.500 mujeres del tercer ensayo se dividieron en 2 grupos, uno formado por 16.608 mujeres (con útero), de las que la mitad recibió estrógenos-gestágenos, y un segundo asignado a placebo. También se aleatorizó a las 10.892 mujeres histerectomizadas para recibir estrógenos o placebo.
En noviembre de 2000 se publicó una alerta sanitaria con los datos preliminares del grupo de mujeres que recibían estrógenos más gestágeno, al detectarse un discreto incremento del riesgo cardiovascular, que se volvió a detectar en el año 2001. El Comité de Monitorización y Seguridad de Datos decidió seguir el ensayo en las dos ocasiones ante la posibilidad de un beneficio, pero obligó a los investigadores a enviar a cada mujer en tratamiento un escrito para informarle del riesgo de presentar episodios de infarto agudo de miocardio, accidente vascular cerebral y tromboembolismo. El 31 de mayo de 2002, tras 5,2 años de seguimiento, el Comité de Monitorización y Seguridad de Datos decidió interrumpir este brazo del ensayo WHI, porque los riesgos excedían los beneficios.
El Women's International Study of long Duration Oestrogen after Menopause (WISDOM) se puso en marcha en el Reino Unido, al igual que el WHI en EE.UU., con el fin de valorar los riesgos/beneficios del tratamiento hormonal. Incluyó a 34.000 mujeres de 50-64 años para seguimiento hasta 2012. Aunque en el mes de julio de 2002 los investigadores decidieron continuar el ensayo clínico europeo, en octubre de ese mismo año, y ante la evidencia de los resultados del WHI, el Britain Research Medical Council decidió también parar el grupo del ensayo donde las mujeres recibían estrógenos más gestágenos.
A pesar de la consistente evidencia que se ha recogido sobre el balance negativo entre riesgos y beneficios del tratamiento hormonal con estrógenos, «defensores» de la medicalización del climaterio han argumentado que estos efectos deletéreos sólo se pueden atribuir a la combinación utilizada en el WHI (estrógenos equinos-medroxiprogesterona), y que no se pueden generalizar a otras presentaciones. Sin embargo, se dispone de resultados de otros ensayos clínicos aleatorizados que han utilizado otros estrógenos y otras vías de administración. En el ESPRIT33, un ensayo clínico aleatorizado en el que se utilizó valerato de estradiol sin asociación de gestágeno para valorar la prevención secundaria de cardiopatía isquémica, no se encontraron diferencias respecto al riesgo coronario entre el grupo de intervención y el placebo. También se ha argumentado que es la asociación del gestágeno la que produce los efectos negativos, en el WEST34, otro ensayo clínico aleatorizado cuyo fin fue evaluar la prevención secundaria de la enfermedad cerebrovascular con el 17-B-estradiol, se encontró un incremento del riesgo cerebrovascular. En el PHASE35, ensayo clínico aleatorizado, el estrógeno utilizado fue el beta-estradiol por vía transdérmica, y también presentó un incremento (no significativo) del riesgo cardiovascular.
En la tabla 1 se presentan conjuntamente los resultados del WHI y HERS-II, y se señalan los resultados para los que existe significación estadística entre el grupo de placebo y el de intervención36. Además, para cada resultado se recogen los riesgos relativos, los intervalos de confianza, el número de mujeres que es necesario tratar para prevenir un evento y el número de mujeres que es necesario tratar para causar un daño, así como la reducción y el incremento del riesgo absoluto.
5. De los resultados de estudios observacionales se concluyó que el riesgo de cáncer de ovario aumenta en las mujeres que reciben tratamiento con estrógenos a largo plazo, dato corroborado por estudios posteriores37,38. En el ensayo clínico aleatorizado WHI39 se encontró un incremento de 42 cánceres de ovario por 100.000 mujeres-año (no significativo) en el grupo de mujeres tratadas (estrógenos más gestágenos), frente a 27 en el grupo placebo.
6. La información es insuficiente para establecer una asociación causal entre estrógenos y melanoma40.
7. Los estrógenos han mostrado su eficacia en el incremento de densidad mineral ósea y una reducción significativa de las fracturas vertebrales y no vertebrales tanto en mujeres sanas como en aquellas con antecedentes de fractura. Los resultados del WHI mostraron una reducción del 34% en el riesgo de fracturas de cadera.
Este efecto se mantiene mientras se administra el tratamiento, pero tras su interrupción se produce una pérdida de densidad mineral ósea, igual a la que ocurre tras la menopausia. Esto, unido a los efectos secundarios que provoca (incremento del riesgo cardiovascular y de cáncer de mama), lo convierte en una alternativa de segunda elección para la prevención de fracturas óseas, que precisa un tratamiento a largo plazo.
8. En la mayoría de los estudios observacionales también se ha constatado un ligero efecto protector del tratamiento con estrógenos frente al cáncer de colon, efecto que desaparece a los 5 años de interrumpir el tratamiento41. En el WHI se encontró una reducción del 34% en el grupo de intervención, con 5 casos menos de cáncer colorrectal por cada 10.000 mujeres/año en tratamiento.
Traducción en la práctica clínica
Son necesarias una valoración individualizada y una información objetiva sobre riesgos y beneficios cuando una mujer tenga necesidad de iniciar un tratamiento hormonal con estrógenos. No todos los motivos de consulta requieren una prescripción farmacológica y, en muchas ocasiones, con una adecuada información las mujeres comprenderán que los cambios experimentados por su organismo son los que cabe esperar con el paso de los años. Según los resultados del Massachusetts Women's Health Study, las mujeres no consideran la menopausia una experiencia negativa y no piensan que vaya a afectar negativamente a su salud física ni mental. En una encuesta realizada en el País Vasco por el Instituto de la Mujer42 en 1993, el 80% de las entrevistadas ven la menopausia como una etapa de cambios y sólo un 3% como una enfermedad.
Actualmente no contamos con datos de prevalencia sobre la frecuencia de síntomas climatéricos en la población general43. La información disponible procede bien de mujeres que acuden a unidades de menopausia o bien de estudios observacionales. El Study of Health Women's Across the Nation (SWAN)44, en marcha actualmente, aportará datos sobre la incidencia de síntomas y su relación con las concentraciones de estrógenos.
Para la prevención de las fracturas óseas, actualmente se dispone de opciones farmacológicas como los bisfosfonatos y los moduladores selectivos de los receptores de estrógenos (SERM), que han demostrado ser eficaces en la prevención de las fracturas óseas.
Al valorar el riesgo/beneficio, en el uso de los bifosfonatos es necesario tener en cuenta la presentación de efectos secundarios en el tubo digestivo.
El más utilizado de los SERM es el raloxifeno. Este fármaco presenta un riesgo de tromboembolismo similar al de los estrógenos (RR, 2,13; IC del 95%, 1,21-3,75). Durante el tratamiento con raloxifeno se produce un incremento en la incidencia de sofocos46.
En el ensayo clínico aleatorizado Multiple Outcomes of Raloxifene Evaluation (MORE)45, se encontró una reducción del 64% en la incidencia de cáncer de mama en mujeres con receptores de estrógenos positivos en la mama, que no se detectó en el grupo de mujeres con receptores de estrógenos negativos.
Respecto al cáncer de colon, aunque en los resultados del WHI se recoge un efecto protector, al realizar un balance de riesgos y beneficios, carece de fundamento recomendar la toma de estrógenos para la prevención de cáncer colorrectal.
Puntos clave
¿Es seguro el tratamiento hormonal con estrógenos a medio-largo plazo?
* El tratamiento hormonal con estrógenos a corto plazo es una opción eficaz para el tratamiento de trastornos vasomotores y la atrofia genital.
* La densidad mineral ósea se incrementa durante el tiempo que se realiza el tratamiento hormonal con estrógenos, para descender tras su interrupción.
* El tratamiento hormonal con estrógenos está contraindicado para la prevención primaria y secundaria de las enfermedades cardiovasculares.
* El tratamiento con estrógenos-gestágenos a medio-largo plazo incrementa el riesgo de cáncer de mama.
* El tratamiento con estrógenos a medio-largo plazo incrementa el riesgo de tromboembolia venosa.
* El tratamiento con estrógenos-gestágenos incrementa el riesgo de patología biliar quirúrgica.