Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es una entidad clínica que, a diferencia de otras neumopatías, no viene definida por su presentación clínica (p. ej., el asma) o por las alteraciones patológicas que comporta (p. ej., la fibrosis pulmonar idiopática), sino por sus consecuencias sobre la función pulmonar: la reducción de los flujos aéreos. Otras enfermedades torácicas pueden también producir esta clase de limitación funcional, pero en el caso de la EPOC este tipo de obstrucción presenta características propias: apenas es reversible con tratamiento y progresa en gravedad con el tiempo. Para realizar, por tanto, el diagnóstico de EPOC es necesario confirmar la presencia de limitación irreversible al flujo aéreo mediante espirometría. En este trabajo se discuten los principales parámetros funcionales que deben medirse de forma habitual y en situaciones especiales y su utilidad en el tratamiento del paciente con EPOC.
Relación patología-función
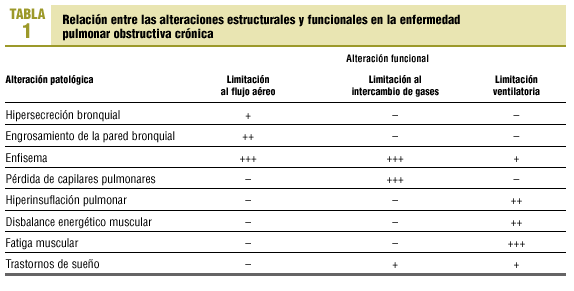
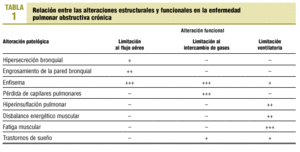
La relación entre las alteraciones estructurales y funcionales en la EPOC es relativamente débil1. Con el paso del tiempo y la progresión de la enfermedad, el paciente con EPOC presenta anomalías estructurales en todo el aparato respiratorio (bronquios, parénquima pulmonar, caja torácica) y sistémicas (acidosis, hipoxia, hipercapnia, corazón pulmonar, desnutrición, fatiga muscular generalizada, etc.). Las consecuencias funcionales pueden agruparse en la evidencia de obstrucción al flujo aéreo y en la presencia de reducción en el intercambio de gases (hipoxia) y en la ventilación alveolar (hipercapnia) (tabla 1).
La hipersecreción y el engrosamiento de la pared bronquial reducen la luz de la vía aérea. Es sin embargo la presencia de enfisema el principal factor limitante del flujo aéreo. La rotura de las paredes alveolares y sobre todo la pérdida de anclajes de los alveolos a las paredes de los bronquiolos hacen que durante la espiración, especialmente durante la espiración forzada, la luz de los bronquiolos tienda a colapsarse sin terminar la espiración. Como consecuencia, queda aire atrapado en los alveolos que no sale al exterior y por tanto en la siguiente inspiración apenas se recambia por aire fresco pues estas unidades están ya ocupadas por aire. Este aumento de volumen extrapulmonar (atrapamiento aéreo) no participa en el intercambio de gases y produce una hiperinsuflación progresiva del tórax que altera la configuración de la caja torácica y la posición de los músculos respiratorios.
La destrucción de paredes alveolares propias del enfisema se asocia a la pérdida de capilares pulmonares y con ello la superficie para el intercambio de gases se reduce. La consecuencia inmediata es la hipoxemia y el aumento de la resistencia vascular pulmonar. A largo plazo se desarrollará hipertensión pulmonar y corazón pulmonar2.
La elevada resistencia al flujo aéreo aumenta el trabajo de la respiración; los cambios en la configuración de la caja torácica y la hiperinsuflación aplanan el diafragma. Ambos factores contribuyen a incrementar el consumo de oxígeno por los músculos respiratorios. Si coexiste hipoxia, desnutrición u otras alteraciones bioquímicas, la sobrecarga de trabajo muscular no puede entonces compensarse y la actividad de los músculos respiratorios puede ser ineficiente para mantener la ventilación pulmonar. Esta situación, junto al progresivo incremento del espacio muerto pulmonar (unidades alveolares con desequilibrio de la relación ventilación-perfusión), se traduce en la aparición de hipercapnia y acidosis en fases avanzadas de la enfermedad. Finalmente, durante el sueño muchos pacientes presentan desaturación arterial de O2 y, en algunos casos, apneas. Esta situación agrava las alteraciones hemodinámicas y contribuye al desarrollo de insuficiencia cardiorrespiratoria.
Pruebas de función pulmonar
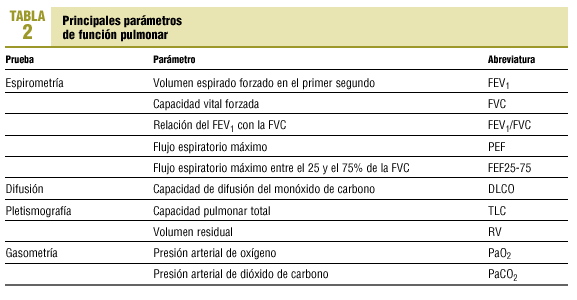
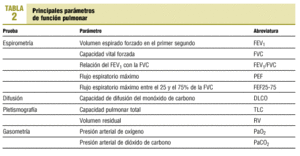
Dado que la relación entre las alteraciones estructurales y la función en la EPOC es pobre, la gravedad del enfisema o de la bronquitis se correlaciona débilmente con las pruebas de función pulmonar. Esto, no obstante, es cierto para los casos de EPOC poco avanzados ya que a medida que avanza la enfermedad, ciertos parámetros funcionales son predictores de morbilidad y mortalidad. En la tabla 2 se reflejan los principales parámetros obtenidos en las diversas exploraciones funcionales.
Espirometría
Es la prueba más sencilla y accesible para el manejo de la EPOC. Debe realizarse siempre ante la sospecha de esta enfermedad. Sirve para confirmar el diagnóstico de EPOC, establecer la gravedad y el pronóstico de la enfermedad y evaluar la reversibilidad de la obstrucción.
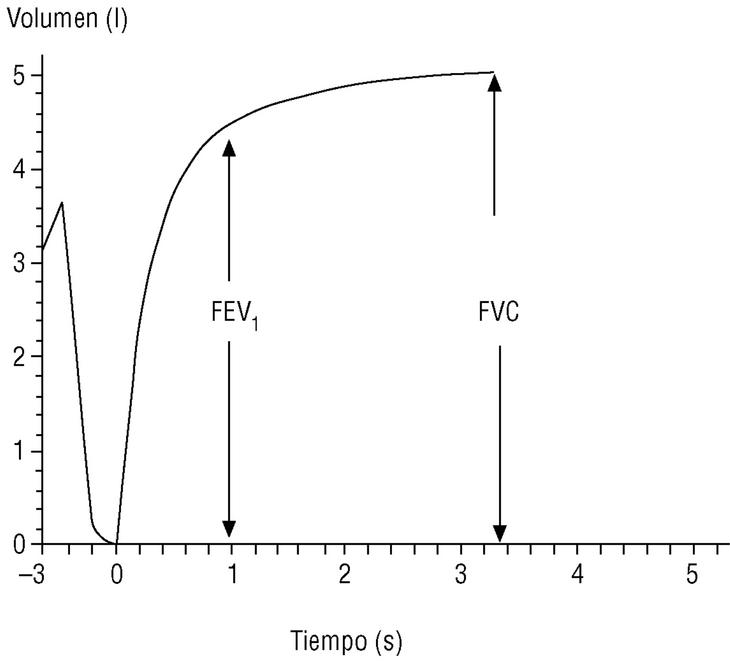
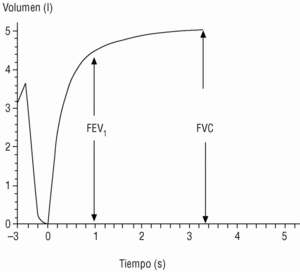
En el seguimiento del paciente la espirometría debe realizarse con periodicidad; esto permite evaluar la respuesta al tratamiento y conocer la velocidad de progresión de la enfermedad. Los actuales espirómetros son muy manejables y proporcionan el valor de numerosos parámetros. Los de mayor significación clínica son los obtenidos durante la maniobra de espiración forzada (fig. 1):
Figura 1. Espirometría normal. Desde la capacidad pulmonar total, el sujeto espira de forma rápida y forzada hasta el volumen residual (capacidad vital forzada [FVC]). El volumen espirado en el primer segundo (FEV1) suele corresponder a un volumen del 75% o mayor de la FVC.
Capacidad vital forzada (FVC). Es la cantidad total de aire espirado. Suele estar reducida de forma paralela al grado de atrapamiento aéreo.
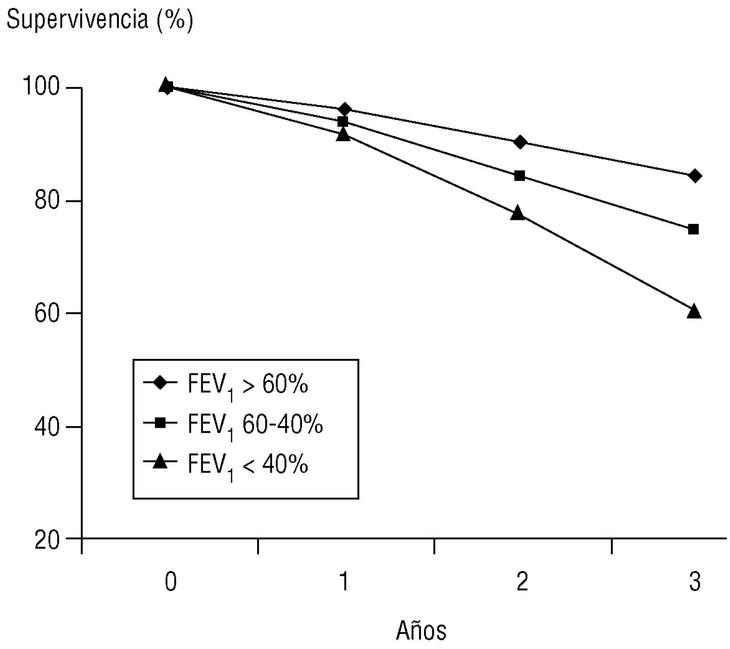
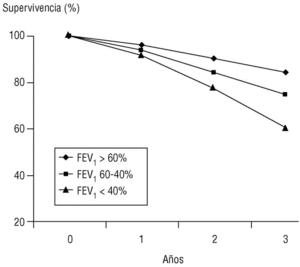
Volumen espirado forzado en el primer segundo (FEV1). Como su nombre indica, es la cantidad de aire espirado en el primer segundo de la maniobra de FVC. El FEV1 en porcentaje del valor previsto se ha tomado para establecer la gravedad de la EPOC en todas las clasificaciones nacionales e internacionales. La supervivencia de pacientes con EPOC está relacionada de forma inversa con su valor (fig. 2).
Figura 2. Relación entre el valor del volumen espirado en el primer segundo (FEV1), expresado como porcentaje del valor previsto, y la supervivencia. Los pacientes fueron seguidos de forma prospectiva durante tres años y estaban agrupados en tres subgrupos según su FEV1 al inicio del estudio. La diferencia de las curvas actuariales de supervivencia es claramente diferente entre subgrupos y empeora con el FEV1.
Relación FEV1/FVC. En general, las personas sin limitación al flujo aéreo presentan una relación superior a 0,7. Es decir, el 70% de la FVC es exhalado durante el primer segundo de la espiración forzada. Un valor inferior implica que existe limitación al flujo aéreo. Por tanto, en la EPOC, por definición, la relación FEV1/FVC debe ser siempre inferior a este valor.
Prueba broncodilatadora. Es necesario realizarla al menos en el estudio inicial del paciente. Tras 15-20 min de administrar 2-4 inhalaciones de un ß2-agonista de corta duración, se repite la espirometría y se mide el FEV1. Se considera que un incremento del 12%, asociado a por lo menos una ganancia de 200 ml, es el valor necesario para dar una respuesta como positiva. A pesar de que la EPOC se define como una obstrucción fundamentalmente irreversible, hasta un 20% de los pacientes pueden tener una prueba broncodilatadora positiva; cuando los valores espirométricos se normalizan tras la prueba broncodilatadora o la respuesta es muy positiva, hay que pensar en la posibilidad de un diagnóstico de asma.
En la EPOC la obstrucción al flujo aéreo puede reducirse actuando sobre el tono vagal colinérgico de las vías aéreas. La atropina o el bromuro de ipratropio producen broncodilatación por este mecanismo. Como la duración de su efecto es breve (4-6 h), se produce un incremento del tono vagal y, por tanto, un nuevo descenso de los flujos aéreos (depresión o valle del FEV1) tras la desaparición del efecto de una dosis única. La alternativa, por tanto, es la administración regular de anticolinérgicos a la espera de la comercialización del tiotropio, un anticolinérgico de larga duración.
Otra prueba que puede realizarse es la prueba de respuesta a corticoides. Se administran corticoides orales a dosis de 0,5 mg/kg/día en una sola dosis matutina durante 15 días y se comprueba la respuesta espirométrica. Los pacientes que mejoran más de un 15% el FEV1 se consideran respondedores y en ellos se puede ensayar la administración de corticoides inhalados. De todos modos, se cuestiona la fiabilidad de la prueba de corticoides para predecir la buena respuesta a los corticoides inhalados.
Interpretación de resultados
Los espirómetros actuales disponen de ecuaciones de regresión para calcular el valor predicho de los parámetros del paciente que estudiamos teniendo en cuenta su edad, sexo, altura y peso. Se considera normal un intervalo entre el 80 y el 120% del valor predicho. Esto significa que pueden aparecer cambios importantes con la progresión de la EPOC mientras el paciente se mantiene en el «límite previsto normal». Por consiguiente, las espirometrías en el seguimiento de los pacientes con EPOC deben compararse con las pruebas previas y no con el valor previsto.
Los pasos que se deben seguir en la interpretación son:
1. Verificar que se ha realizado una maniobra de espiración forzada adecuada.
2. Clasificar el tipo de anomalía (normal, déficit obstructivo, déficit restrictivo o mixto).
3. Analizar el resultado del valor numérico del FEV1 para establecer la gravedad del déficit obstructivo (FEV1/FVC < 70% del predicho):
FEV1 > 80% del predicho: obstrucción leve.
FEV1 60-80% del predicho: obstrucción moderada.
FEV1 40-60% del predicho: obstrucción grave.
FEV1 < 40% del predicho: obstrucción muy grave.
Hay diversas clasificaciones de gravedad, todas ellas basadas en los valores del FEV1; sin embargo, no existe aún una validación de estas clasificaciones con la clínica. Además, la gravedad de la enfermedad, si bien guarda una estrecha relación con el FEV1, depende también de otros factores, como la capacidad de ejercicio, la intensidad de los síntomas, la frecuencia de las agudizaciones, etc.
4. Realizar una prueba broncodilatadora si la espirometría es anormal.
Difusión pulmonar
No existe una prueba que evalúe la capacidad real de transferencia de O2 por la membrana alveolocapilar. Como alternativa se utiliza la llamada capacidad de transferencia de monóxido de carbono (DLCO). Consiste en medir la cantidad de CO que atraviesa la membrana por unidad de tiempo. La prueba informa sobre la superficie vascular pulmonar disponible para el intercambio de gases. En la EPOC avanzada el valor de la DLCO se relaciona de forma inversa con la extensión del enfisema. En general, es necesaria una pérdida de más del 50% de la membrana alveolocapilar para que la DLCO comience a reducirse. Esta prueba estará indicada en pacientes con enfisema moderado o grave y en los pacientes con EPOC que presenten una disnea o limitación al ejercicio desproporcionadas en relación con la afectación del FEV1.
Volúmenes pulmonares
Como reflejo del atrapamiento aéreo que se produce por el cierre prematuro de las vías aéreas durante la espiración, el volumen residual aumenta por encima de un 120% de su valor previsto. Cuando coexiste además una hiperinsuflación pulmonar, la capacidad pulmonar total (TLC) se eleva por encima del 120% de su valor previsto. Como en el caso de la DLCO, la obtención de volúmenes pulmonares no debe realizarse de manera habitual, pero es útil disponer de esta información al menos en la evaluación inicial de los pacientes con EPOC. Un valor de TLC inferior a un 80% del previsto debe hacer sospechar la presencia de un proceso restrictivo parenquimatoso o toracógeno asociado.
Gasometría
Debería obtenerse siempre cuando, al inicio del estudio de un paciente con EPOC, el FEV1 se encuentra reducido por debajo del 40% de su valor teórico, o bien independientemente del valor del FEV1 si existen sospechas de la presencia de insuficiencia respiratoria o cardíaca: cianosis central, edemas periféricos o distensión venosa yugular. El diagnóstico de insuficiencia respiratoria se establece cuando la presión arterial de O2 (PaO2) es inferior a 60 mmHg con o sin hipercapnia asociada (presión arterial de CO2 [PaCO2] > 45 mmHg). La monitorización de la saturación arterial de O2 (SaO2) mediante oxímetro de pulso es muy útil para el seguimiento de pacientes y permite ahorrar gasometrías, sobre todo en situación de agudización. La indicación de oxigenoterapia debe basarse, no obstante, en el valor de la PaO2, no en el de SaO2.
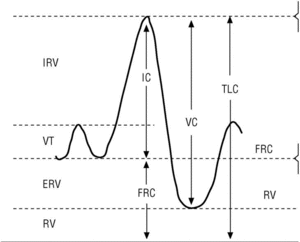
Importancia de la capacidad inspiratoria (CI)
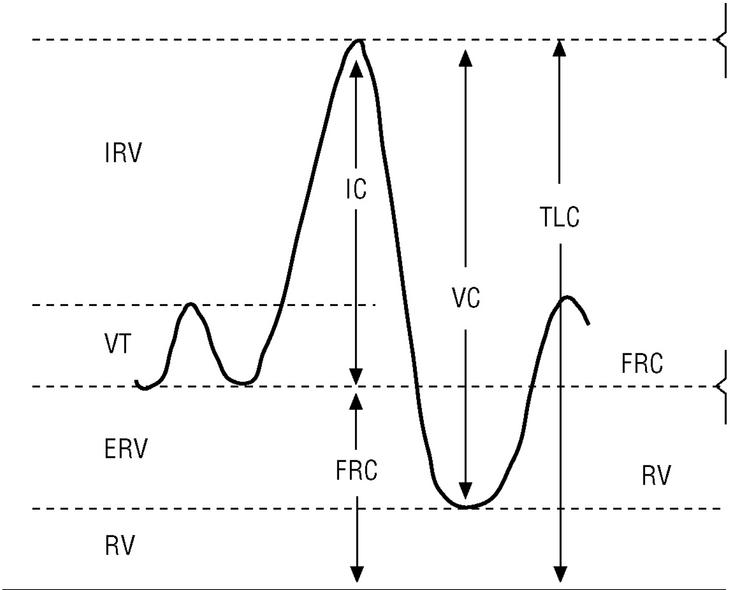
La CI es la cantidad de aire que puede tomarse en una inspiración máxima desde la posición de reposo (capacidad funcional residual [FRC]) hasta la máxima insuflación pulmonar (TLC) (fig. 3). La FRC es la cantidad de aire que hay en el tórax después de una espiración normal; este volumen de aire suele ser del 30 al 40% de la TLC en una persona sana. En pacientes con EPOC esta relación aumenta paralelamente al grado de hiperinsuflación pulmonar. La CI es en realidad el valor inverso de la FRC y además puede obtenerse fácilmente durante la maniobra de espirometría. Por tanto, si se dispone de un espirómetro podemos evaluar el grado de hiperinsuflación pulmonar de los pacientes con EPOC.
Figura 3. Obtención de la capacidad inspiratoria con un espirómetro. Tras varias respiraciones normales (VT), al paciente se le indica que realice una inspiración máxima (capacidad inspiratoria [IC]) hasta que sienta su tórax totalmente insuflado (capacidad pulmonar total [TLC]). Seguidamente se le indica que espire de forma lenta hasta que sienta que su tórax se ha vaciado por completo (nivel de volumen residual [RV]) y de esta forma se obtiene una capacidad vital lenta (VC).
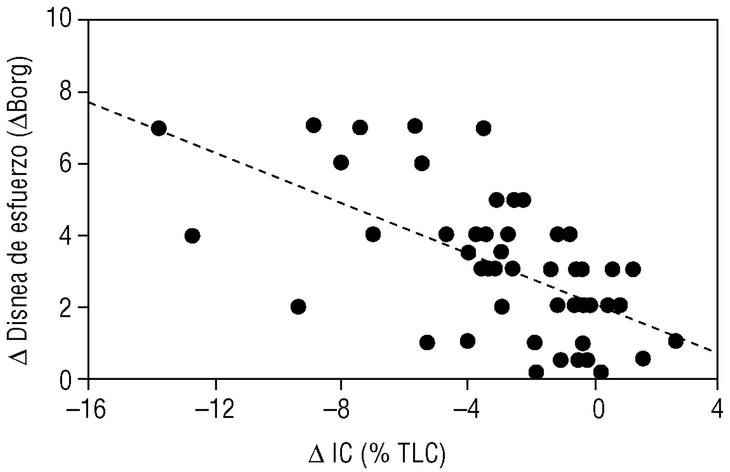
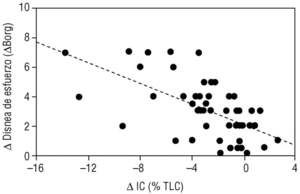
En los últimos años se ha demostrado que durante el ejercicio los pacientes con EPOC desarrollan una mayor hiperinsuflación pulmonar que la que ya tienen durante el reposo (hiperinsuflación dinámica). Se ha demostrado que esta hiperinsuflación dinámica es un factor determinante en la patogenia de la disnea de esfuerzo, síntoma prínceps de la EPOC3. Nuestro propio grupo ha demostrado que durante un ejercicio submáximo (como caminar) la capacidad inspiratoria se reduce y se asocia de forma paralela al grado de disnea que el paciente percibe durante su esfuerzo4 (fig. 4). Estudios experimentales han demostrado que muchos pacientes con EPOC muestran un alivio de la disnea inducida por el esfuerzo sin mejorar los flujos aéreos. Esta mejoría sintomática era paralela al aumento de la capacidad inspiratoria inducida por un fármaco broncodilatador como ipratropio5. El mismo mecanismo (reducción de la hiperinsuflación dinámica) parece explicar la mejoría de la disnea tras la cirugía de reducción de volumen pulmonar.
Figura 4. Relación entre el desarrollo de atrapamiento aéreo y la aparición de la disnea de esfuerzo. Cuando un paciente con enfermedad pulmonar obstructiva crónica (EPOC) realiza un ejercicio de marcha, su capacidad inspiratoria se reduce (δIC) porque se desarrolla hiperinsuflación pulmonar. Esta reducción en la IC induce de forma proporcional disnea de esfuerzo. (Tomada de Marín et al4.)
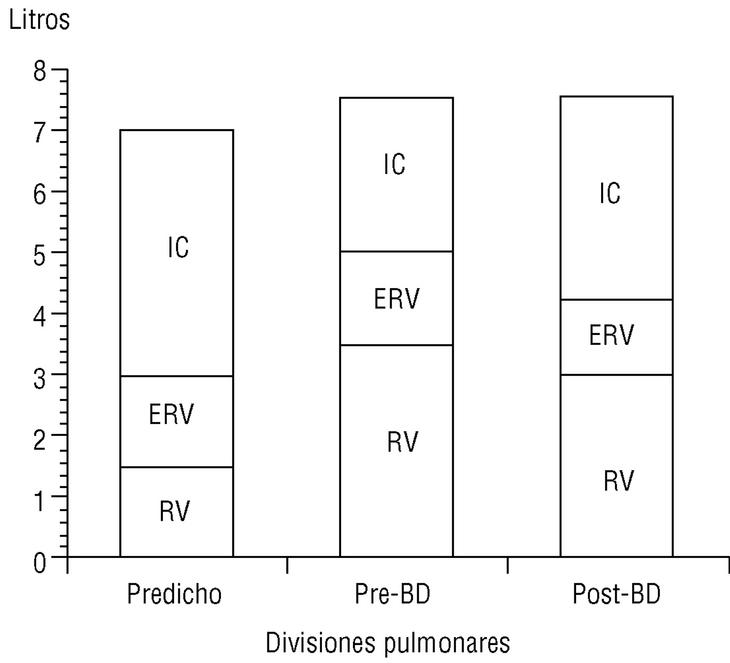
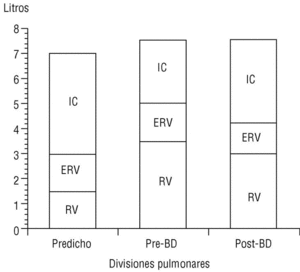
La CI, medida durante la maniobra de capacidad vital lenta en un espirómetro convencional, es una maniobra sencilla de obtener y muy reproducible. Recientemente O'Donnell et al, al administrar un broncodilatador anticolinérgico (bromuro de ipratropio) a pacientes con EPOC, comprobaron que la disnea de esfuerzo y la capacidad de trabajo mejoraban de forma paralela al incremento inducido sobre la CI, pese a que el efecto del fármaco sobre el FEV1 era muy modesto6. Es decir, el incremento del volumen aéreo «operativo» que implica la mejoría de la CI permite al paciente respirar de una forma más eficiente (respiraciones más profundas y lentas) y aumentar su capacidad ventilatoria de cara al esfuerzo. En el estudio señalado, con tan sólo un incremento de la CI del 14% tras el tratamiento con bromuro de ipratropio, se obtuvo una mejora del 32% en la capacidad de ejercicio. Nuestro grupo ha confirmado, mediante la medición de volúmenes estáticos por pletismografía, la mejoría de la CI y la reducción paralela de la FRC tras la administración de bromuro de ipratropio (fig. 5). Es probable, por tanto, que la CI sea un parámetro de función pulmonar cada vez más utilizado en el manejo del paciente con EPOC dadas la sencillez de su obtención y su sensibilidad para detectar mejoría clínica tras la administración de broncodilatadores.
Figura 5. Cambio de la capacidad inspiratoria tras la administración de bromuro de ipratropio (BI). En un paciente con enfermedad pulmonar obstructiva crónica (EPOC), el volumen residual está aumentado y la capacidad inspiratoria, reducida (barra central), respecto a un sujeto normal (barra izquierda). A los 30 min de administrar BI, la capacidad inspiratoria aumenta y el volumen residual se reduce de forma significativa (barra derecha). Datos propios obtenidos mediante pletismografía.
Otros parámetros de función pulmonar
La mayor parte de los pacientes con EPOC no requiere la medición de otros parámetros funcionales además de los arriba indicados. No obstante, en laboratorios de fisiología respiratoria bien dotados en el ámbito de centros de tercer nivel se realizan en casos seleccionados ciertos procedimientos específicos. Por ejemplo, puede determinarse el estado de la función de músculos respiratorios mediante la medición de las presiones positivas y negativas que se generan en la boca durante maniobras de espiración e inspiración máximas (PEM, PIM). También puede determinarse la pérdida de retracción elástica asociada al enfisema pulmonar introduciendo un sensor de presión intraesofágico. El valor práctico de estas pruebas no se ha probado y su realización se reserva para estudios de investigación.
Prueba de esfuerzo
Las pruebas de esfuerzo cardíacas, respiratorias o, mejor, cardiopulmonares han pasado de ser procedimientos diagnósticos reservados a centros de investigación a pruebas de exploración prácticamente habituales para enfermos con enfermedad torácica. Las pruebas de esfuerzo permiten al médico conocer las alteraciones fisiológicas dinámicas de la enfermedad y su impacto en la vida diaria de los pacientes. La actividad física es un componente esencial de la calidad de vida y su deterioro junto a la disnea son las dos causas más importantes de consulta al médico generalista. Cuando la sintomatología del paciente aparece durante el esfuerzo y no en reposo, la aproximación diagnóstica lógica es reproducir el síntoma con una prueba de esfuerzo controlada.
Fisiología del esfuerzo normal
La actividad física depende de la contracción muscular en un proceso activo que consume energía procedente de la metabolización del trifosfato de adenosina en presencia de oxígeno. La cantidad de O2 consumida (VO2) refleja la intensidad del ejercicio realizado y puede medirse al analizar el O2 inhalado. El VO2 máximo que un sujeto es capaz de alcanzar en una prueba de esfuerzo máxima depende de la edad, sexo, talla, peso y nivel de entrenamiento. El aumento de VO2 con el ejercicio depende de la correcta integración y función del aparato cardiopulmonar, vasos y función muscular. Los cambios que se producen durante el ejercicio progresivo pueden agruparse en:
Incremento de la ventilación en paralelo a la producción de CO2.
Aumento de la ventilación y perfusión alveolar por reclutamiento de alveolos y capilares pulmonares.
Reducción de las resistencias al flujo aéreo por ligera broncodilatación y respiración a volúmenes pulmonares estáticos más elevados.
Aumento del gasto cardíaco paralelo al VO2.
Mejora en la perfusión tisular y extracción de O2 de los tejidos.
La prueba de esfuerzo cardiopulmonar progresiva puede realizarse mediante una cinta sin fin o bicicleta ergométrica. En ambos casos la resistencia al esfuerzo se incrementa de forma progresiva y el paciente detiene el esfuerzo a voluntad cuando se encuentra exhausto. Durante la prueba se miden en boca los flujos aéreos y el consumo de O2 y producción de CO2. Se monitoriza además de forma continua el electrocardiograma y la SaO2.
Ejercicio en pacientes con EPOC
La intolerancia al ejercicio es el síntoma más frecuente y preocupante de los pacientes con neumopatías crónicas. Los pacientes con EPOC muestran durante las pruebas de esfuerzo cardiopulmonares máximas las siguientes alteraciones:
Reducción del VO2 máximo.
Reducción de la capacidad ventilatoria máxima. La ventilación (VE) a máximo esfuerzo tiene tendencia a acercarse a la máxima capacidad ventilatoria del paciente (MVV). De esta forma la reserva ventilatoria (VE/MVV), que en sujetos normales suele ser superior a un 25%, en pacientes con EPOC es inferior a esta cifra.
Tendencia a la caída de la PaO2 en muchos casos.
Disnea de esfuerzo por compromiso de músculos respiratorios y desarrollo de hiperinsuflación pulmonar dinámica.
Posible compromiso en la respuesta hemodinámica cardíaca.
La información que proporciona una prueba de esfuerzo en pacientes con EPOC puede resumirse en los siguientes puntos:
Establece de forma objetiva y cuantifica la capacidad de ejercicio. Permite por tanto aclarar una disnea desproporcionada con las pruebas basales (p. ej., FEV1 poco afectado). Hay que indicar que el valor del VO2 máximo no puede predecirse por las pruebas basales.
Aporta información sobre la posible participación de otra enfermedad asociada (p. ej., cardiopatía isquémica).
Identifica qué factores (obstructivos, musculares, cardíacos, metabólicos, etc.) son los responsables de la intolerancia al esfuerzo.
Identifica y cuantifica el grado de desentrenamiento (elevada relación del VO2 y del trabajo realizado).
Evalúa posibles causas psicológicas en la limitación al ejercicio.
Permite indicar las características del programa de rehabilitación.
Otro grupo de pruebas de esfuerzo que no precisan una tecnología relativamente compleja son las pruebas de marcha. El sujeto camina por un pasillo durante un tiempo (p. ej., 6 min) a la velocidad que él mismo elige con el objetivo de recorrer la máxima distancia. Estas pruebas han demostrado ser buenos predictores de supervivencia en pacientes con insuficiencia cardíaca y en pacientes con EPOC grave. En todo caso se trata de un instrumento de exploración funcional que debe todavía estandarizarse, pero parece que se consolidará en el futuro en la práctica clínica.
Correspondencia: José M. Marín Trigo. Servicio de Neumología. Hospital Universitario Miguel Servet. P.º Isabel la Católica, 1-3. 50006 Zaragoza. España. Correo electrónico: jmmarint@posta.unizar.es
Manuscrito recibido el 29 de enero de 2002.
Manuscrito aceptado para su publicación el 3 de julio de 2002.