Definición del problema
En nuestro medio, ¿a quién, cuándo y con qué prueba se debe realizar el cribado de cáncer de cérvix?
Síntesis de las evidencias
Magnitud del problema
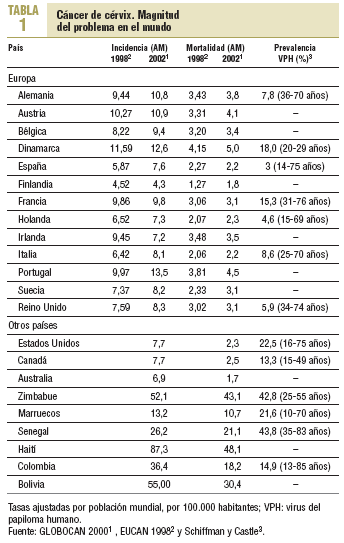
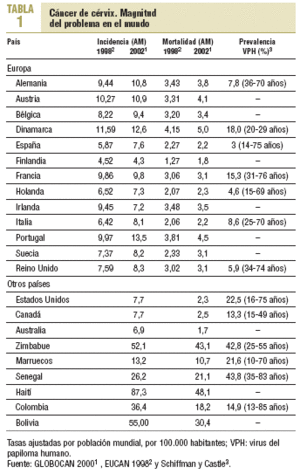
El cáncer de cérvix es el segundo tumor más común entre las mujeres y un 80% de los casos ocurren en los países en vías de desarrollo. Las tasas más elevadas se presentan en algunos países del este de Asia, América Central, Caribe y América del Sur1-3 (tabla 1). En España, en el año 2002 se registraron 2.103 nuevos casos y 739 defunciones. Estas cifras representan unas tasas de incidencia y mortalidad ajustadas por población mundial de 7,6 y 2,2 por 100.000 mujeres, respectivamente, y se sitúan entre las más bajas del mundo1.
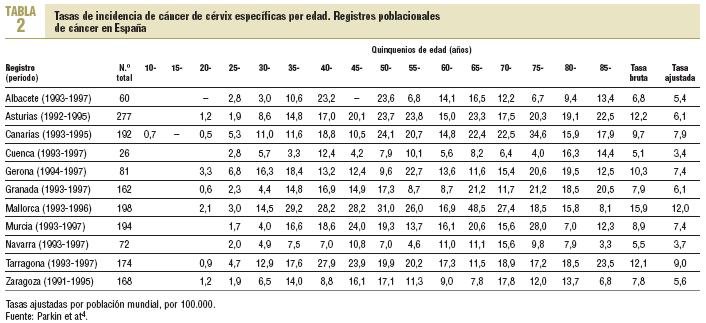
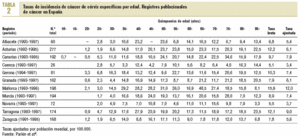
Según datos de los diferentes registros poblacionales de cáncer disponibles en España (tabla 2), las tasas de incidencia más elevadas se observan en Mallorca (12,0 por 100.000) y Tarragona (9,0 por 100.000), y las más bajas en Navarra (3,7 por 100.000) y Murcia (3,4 por 100.000)2. Estos registros también muestran que las tasas específicas por edad son poco homogéneas, lo que se debe en parte a las diferencias geográficas, pero también al escaso número de efectivos2. En general, las tasas más elevadas se distribuyen entre los grupos de 40 a 55 años.
A pesar de la baja incidencia y mortalidad por cáncer de cérvix en España, en el curso de las 3 últimas décadas se ha producido una tendencia paulatina al aumento1,3. No obstante, los registros más antiguos (Zaragoza, Navarra y Tarragona) no muestran una tendencia homogénea2. En España, al igual que en otros países, la interpretación de la tendencia del cáncer de cérvix es problemática por los errores de clasificación entre cáncer de cérvix invasivo, de cuerpo de útero y de útero no especificado. Es así que, cuando el cáncer de útero se valora desde una perspectiva conjunta, la tendencia es a la disminución y los resultados son más acordes con los de los países europeos4.
Historia natural y factores de riesgo
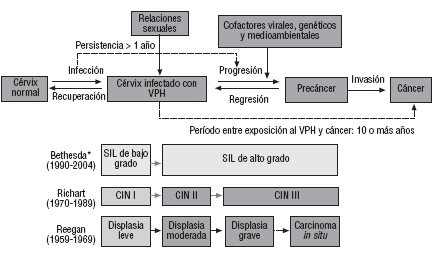
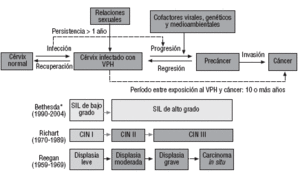
En la figura 1 se presenta la evolución de la historia natural del cáncer de cérvix y las diversas clasificaciones de las lesiones premalignas del cuello del útero (CIN [Cervical Intraepithelial Neoplasia] para el diagnóstico histológico y SIL [Squamous Intraepithelial Lesion] para las alteraciones citológicas), las cuales han evolucionado paralelamente al conocimiento de su etiología y historia natural. La clasificación que se utiliza actualmente es la de Bethesda.
El virus del papiloma humano (VPH) es un factor causal y necesario para el desarrollo del cáncer escamoso de cérvix y de su lesión precursora, SIL de alto grado5. El contacto sexual (heterosexual u homosexual) es un requisito necesario para adquirir el VPH en el tracto genital5. El mayor riesgo de infección por el VPH se asocia al inicio temprano de las relaciones sexuales, a la promiscuidad tanto masculina como femenina, a la no utilización de preservativo y no estar circuncidado6. En el patrón de prevalencia del VPH en los países occidentales, la infección es más elevada en la edad de mayor actividad sexual y posteriormente se reduce, de modo que es muy baja hacia los 50 años5. La prevalencia del VPH es muy diferente entre países, y la población española presenta una de las más bajas del mundo, entre un 2 y un 3% de las mujeres3, dato que concuerda con la baja incidencia de cáncer de cérvix en nuestro medio.
Las mujeres portadoras de infecciones crónicas por el VPH (el 10-20% de las mujeres infectadas) constituyen el grupo de riesgo alto de desarrollar el cáncer3. La edad media de las mujeres con lesiones CIN III es de 30 años. Las mujeres con cáncer invasivo son 10 o más años mayores que las mujeres con CIN III3. En nuestro medio, un estudio realizado en la década de los noventa describe una frecuencia de 12 casos de CIN III por cada 100.000 mujeres/año, con una edad media de 37 años (intervalo de confianza del 95%, 20-82)7.
La infección por el VPH, aun siendo un factor causal y necesario, no es suficiente para que se desarrolle el cáncer de cérvix. La respuesta inmunológica a la infección por el VPH desempeña un papel crucial en la progresión hacia cáncer genotipos y variantes virales, carga viral, inmunondepresión por coinfección por el virus de la inmunodeficiencia humana (VIH)6. Asimismo, el tabaco, la multiparidad y el uso de anticonceptivos a largo plazo son cofactores de progresión claramente establecidos6. Otros cofactores descritos menos concluyentes son la infección por Chlamydia, la infección crónica del cérvix y la dieta6.
Prevención primaria
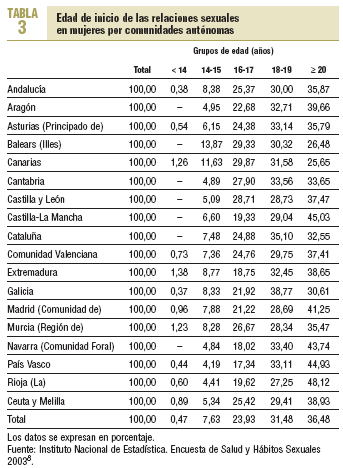
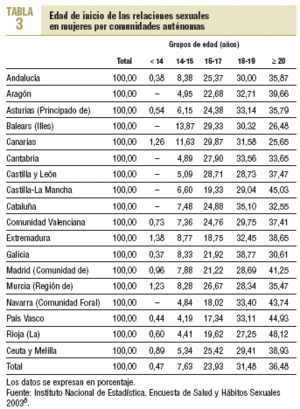
La prevención de la transmisión del VPH requiere información e intervenciones que permitan concienciar a mujeres y varones del riesgo de infección por este virus derivado de las relaciones sexuales sin protección, sobre todo con múltiples compañeros. En España, según datos de la Encuesta de Salud y Hábitos Sexuales de 20038, la edad de inicio de las relaciones sexuales es de 18,1 años para los varones y de 19,1 años las mujeres (tabla 3). El uso del preservativo en la primera relación sexual es cada vez más frecuente, y entre los menores de 30 años se estima en un 79,6%. Un 24,4% de los varones y un 55,6% de las mujeres de 18 a 49 años han tenido relaciones sexuales con una única pareja en toda su vida. El 4,1% de las mujeres reconoce haber tenido 10 o más parejas, porcentaje que en el caso de los varones se eleva al 21,6%.
Por otro lado, el futuro de la prevención primaria del cáncer de cérvix y de otras enfermedades relacionadas con el VPH (condilomas, cáncer oral) está en el desarrollo de las vacunas. Actualmente están en marcha diversos ensayos clínicos aleatorizados, y los primeros resultados con la vacuna L1 VLP del VPH-16 (gen L1 de expresión tardía; VLP [virus-like particle]; serotipo 16 del VPH) en mujeres jóvenes han mostrado que en general se tolera bien y genera títulos elevados de anticuerpos9. Sin embargo, los expertos calculan que tendrá que transcurrir una década antes de la comercialización de las vacunas contra el VPH.
Métodos de cribado
Citología convencional. La eficacia del cribado del cáncer de cérvix sólo se ha demostrado a partir de estudios observacionales, comparaciones geográficas y cambios de tendencia10. En los países donde una gran parte de las mujeres se realizan la citología de cribado cada 3-5 años, a través de programas de cribado poblacional organizados (Finlandia, Suecia, Reino Unido), la incidencia del cáncer de cérvix se ha reducido en un 80%4. El cribado oportunista también ha mostrado una disminución de las tasas, aunque de forma menos acentuada4.
Se desconoce la edad óptima de inicio y finalización de la citología. A partir de la historia natural de la infección por el VPH y la edad de presentación de las lesiones avanzadas (CIN III, SIL de alto grado), algunos autores proponen que el cribado podría iniciarse de forma segura 3 años después del inicio de las relaciones sexuales, o a la edad de 21 años, a pesar del escaso beneficio entre las mujeres que nunca han tenido actividad sexual11. Otros autores no justifican el cribado antes de los 25 años, ya que el riesgo de cáncer invasivo es muy bajo y la prevalencia de lesiones preinvasivas, muy alta12,13. Además, existe un riesgo de sobretratamiento de lesiones menores que con el tiempo regresan espontáneamente a la normalidad12. Asimismo, también hay escasa evidencia de que el cribado sea beneficioso más allá de los 60 años12,13, ya que la incidencia de lesiones avanzadas declina a partir de los 50 años11-13. En las mujeres histerectomizadas por una lesión benigna, la citología no aporta ningún beneficio11.
Tampoco se dispone de evidencia directa sobre el intervalo óptimo entre las citologías11-13. La mayor parte de cánceres invasivos en poblaciones ampliamente cubiertas por programas de cribado corresponden a mujeres que nunca han participado o a las que hace más de 5 años que no se les realiza una citología11,13. Asimismo, también se ha demostrado que el beneficio obtenido al realizar las citologías a intervalos menores de 3 años es muy escaso14.
La proporción de lesiones preinvasivas no detectadas por la citología también viene determinada por la sensibilidad del test. Una revisión sistemática que evalúa la validez de la citología en poblaciones con baja prevalencia muestra que la especificidad es más alta y homogénea (85-100%) que la sensibilidad (22-99%)15. Las limitaciones más importantes para conseguir una alta sensibilidad se derivan de la recogida y el procesamiento de las muestras y de la lectura e interpretación. En los últimos años se han desarrollado nuevos procedimientos, como la citología de base líquida (CBL) y las lecturas automatizadas, con el objetivo de mejorar la calidad de las muestras y reducir la tasa de falsos negativos de la citología convencional15.
Citología de base líquida. En la CBL la muestra se recoge mediante una espátula que cepilla las células del cuello cervical y se introduce en un frasco de cristal que contiene un líquido conservante. En el laboratorio un proceso automático separa las células del moco u otras sustancias y se extienden sobre un porta en forma de capa fina.
A pesar de que no existen ensayos clínicos aleatorizados que hayan evaluado esta técnica en términos de disminución de cánceres invasivos o de mortalidad, la evidencia disponible muestra que probablemente la CBL reduce el número de resultados falsos negativos, lo que conduce a una reducción del cáncer invasivo, así como una reducción del número de muestras incorrectas y del tiempo dedicado a la recogida de la muestra16. La CBL también permite disponer de una muestra para estudiar el VPH, lo que puede ser de utilidad en el manejo de las mujeres que presentan células escamosas atípicas en la citología11. La CBL se considera que es coste-efectiva cuando el intervalo de cribado es de 3 años o superior11,16, y con un intervalo de cribado de 5 años podría ser la opción más coste-efectiva. Esta técnica se está utilizando de forma piloto en diversos programas del Reino Unido17.
Test del ADN del virus del papiloma humano. Es un test de biología molecular que determina la presencia del VPH. Los estudios observacionales muestran que el test VPH es más sensible y menos específico que la citología, sobre todo en mujeres jóvenes18,19. Actualmente están en marcha ensayos clínicos aleatorizados que evalúan el test VPH como test de cribado inicial, ya sea conjuntamente con la citología o como sustituto de ésta19. Añadir el test VPH a la citología en mujeres con riesgo elevado podría mejorar la eficacia del cribado, complementar la evaluación ante citologías anormales y hacer el seguimiento de las mujeres tratadas por una lesión premaligna19.
Plasmación en la práctica clínica
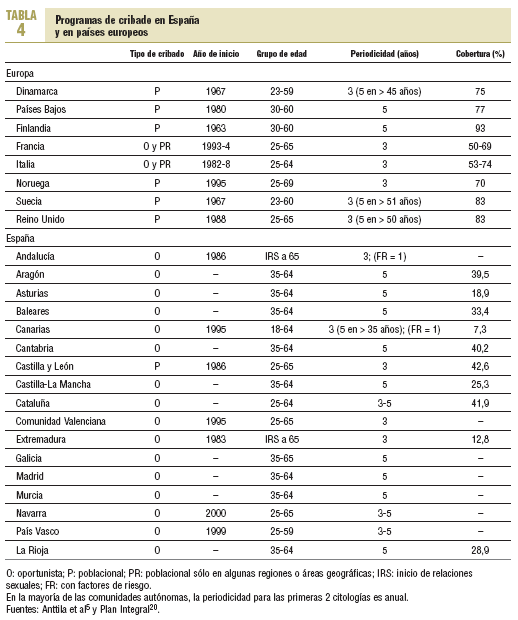
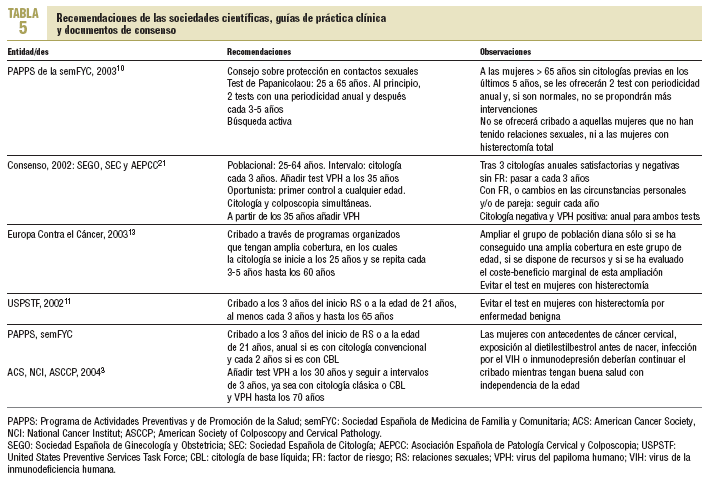
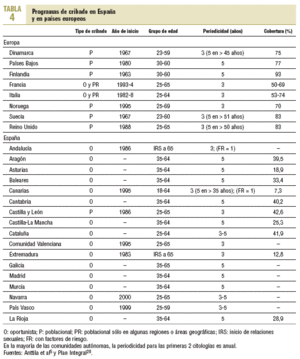
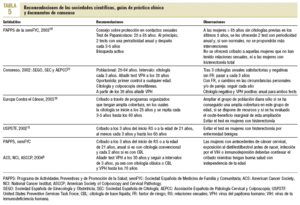
El cribado de cáncer de cérvix es una intervención muy extendida y presenta una amplia variación, tanto de las recomendaciones como en la organización de las actividades relacionadas con este cribado, entre las diferentes instituciones y sociedades científicas (tablas 4 y 5)3,5,10,11,13,20,21. La Unión Europea recomienda que el cribado se ofrezca a través de programas poblacionales organizados que tengan amplia cobertura, en los cuales la citología se inicie a los 25 años y se repita cada 3-5 años hasta los 60 años13. Al principio de la década de los noventa algunos países europeos con larga tradición en programas poblacionales (Finlandia, Holanda) modificaron sus propias recomendaciones y establecieron el inicio del cribado a los 30 años de edad, con una periodicidad de 5 años y hasta los 60 años4.
A pesar de la escasa evidencia disponible sobre la eficacia del test VPH en el cribado inicial, el American Cancer Institut, el National Cancer Institut y la American Society of Colposcopy and Cervical Pathology han consensuado añadir el test VPH a partir de los 30 años22. Asimismo, recomiendan diferenciar la periodicidad de la citología en función de si se realiza la citología convencional o la CBL (convencional anual y CBL bienal) y finalizar el cribado a los 70 años.
En nuestro ámbito las recomendaciones también varían ampliamente. Actualmente y tras la modificación de sus recomendaciones, el Programa de Actividades Preventivas y de Promoción de la Salud (PAPPS) recomienda la citología convencional en las mujeres de 25-65 años, al principio 2 citologías con periodicidad anual y después cada 3-5 años. Por el contrario, la Sociedad Española de Ginecología y Obstetricia, la Sociedad Española de Citología y la Asociación Española de Patología Cervical y Colposcopia recomiendan que el cribado poblacional empiece a los 25 años, con periodicidad de 3 años y hasta los 65, añadiendo el test VPH a partir de los 35 años21. Asimismo, si el cribado es oportunista, recomiendan simultáneamente la citología y la colposcopia.
Actualmente todas las comunidades autónomas ofrecen cribado oportunista, excepto Castilla y León, y las coberturas están muy por debajo de los porcentajes europeos (tabla 4)20. Según los resultados de una encuesta telefónica sobre la realización de la citología en España, efectuada en octubre de 2000, sólo un 50% de las mujeres de 40 a 70 años se habían realizado una citología de cribado en los últimos 5 años23. Las citologías se habían practicado mayoritariamente a través del sistema sanitario público (84,4%) y en mujeres de nivel socioeconómico alto y residentes en núcleos urbanos23. No obstante, otros estudios han mostrado que los grupos de edades más jóvenes y sin factores de riesgo son los que más se benefician de la citología de cribado23 y un porcentaje elevado de citologías se realizan a través de los seguros privados.
Desde la óptica de la calidad, un programa poblacional aporta claras ventajas al cribado oportunista en la consulta del médico de familia o del ginecólogo. Un programa poblacional tiene estándares de calidad que se aplican en los diferentes aspectos de participación y cobertura, protocolización y adopción de controles de calidad en las técnicas de la toma cervical y la lectura de la citología, los tiempos de cribado, diagnóstico y tratamiento, así como los resultados del tratamiento obtenidos24. Un programa poblacional organizado minimiza los efectos adversos, es más equitativo porque ofrece la misma posibilidad de acceso a toda la población diana y previene la sobreutilización4. En nuestro medio, al no existir programas poblacionales de cáncer de cérvix, el profesional de atención primaria debe tomar conciencia de su papel en la prevención de este cáncer.
Conclusiones
En mujeres sanas y sin factores de riesgo se debe recomendar la citología de cribado a partir de los 25-30 años y hasta los 60-65 años, con una periodicidad de 3 a 5 años. Se recomienda proceder a la búsqueda activa del riesgo individual de cada mujer con relación a su historia sexual. La citología no debe recomendarse a mujeres sin útero.
En las mujeres con mayor riesgo (inicio temprano de las relaciones sexuales, promiscuidad, parejas de riesgo), se podría aconsejar la edad de inicio de la citología a los 25 años. En este punto cabe señalar que ser inmigrante de un país con alta prevalencia de VPH o el hecho de ser fumadora no son por sí mismo factores de mayor riesgo.
En las mujeres con citología anormal, la periodicidad de la citología y la conducta diagnóstica y de seguimiento, incluida la realización del test VPH, dependerá del tipo de lesión y de la presencia de infección. La conducta a seguir es decisión del ginecólogo, quien debe tener en cuenta las recomendaciones de guías de práctica clínica consensuadas.
Los profesionales de atención primaria deben aconsejar sobre el uso del preservativo, hacer búsqueda activa de las mujeres con mayor riesgo y promover el cribado entre las mujeres de riesgo medio que nunca o durante los últimos 5 años se hayan realizado una citología.
Las comunidades autónomas tendrán que valorar la implantación de programas poblacionales organizados que cumplan los diferentes estándares de calidad.