Evaluar la prevalencia, severidad y factores de riesgo asociados a la retinopatía diabética (RD) en Cantabria.
DiseñoEstudio transversal de base poblacional.
EmplazamientoCentro de salud de Cantabria.
ParticipantesMuestra aleatoria de 442 pacientes con diabetes mellitus tipo 2.
Mediciones principalesRetinografía no midriática, clasificándolas según la International Clinical Diabetic Retinopathy Disease Severity Scale. Los factores de riesgo estudiados: edad, sexo, edad diagnóstico, años de evolución de la diabetes, grado de control glucémico (HbA1c), tratamiento de la diabetes, control de la tensión arterial, control lipídico, obesidad, tabaquismo, hematocrito bajo, embarazo, déficit de vitamina D, nefropatía y eventos cardiovasculares.
ResultadosPrevalencia de RD del 8,56% (IC: 5,81-11,32). RD no proliferativa leve: 5,07% (IC: 2,89-7,25); RD no proliferativa moderada: 1,38% (IC: 0,17-2,60); RD no proliferativa severa: 0,27% (IC: 0,006-1,28); RD proliferativa: 1,84% (IC: 0,46-3,22); edema macular diabético: 2,30% (IC: 0,77-3,83). Edad media: 70 años, edad de diagnóstico 58,97 años; índice de masa corporal 29,86; hipertensos 78,40%; dislipidemia 67,30% y HbA1c mediana 6,76%. El déficit de 25 (OH) D fue del 77%. En el análisis multivariante los factores independientes fueron tratamiento de la diabetes mellitus tipo 2, índice de masa corporal, años de evolución y control de la diabetes.
ConclusionesLa prevalencia de RD ha disminuido hasta el 8,56%; esta disminución se asocia a la mejora en el control de los factores de riesgo modificables. Los factores de riesgo asociados de forma independiente fueron: tratamiento, índice de masa corporal, años de evolución y control de la diabetes. Las variables control hipertensión arterial, eventos cardiovasculares y nefropatía también mostraron capacidad predictiva para la RD.
To assess the prevalence and risk factors associated with diabetic retinopathy (DR) in Cantabria.
Designross-sectional population based study.
LocationHealth center of Cantabria.
ParticiantsA random sample of 442 patients with type 2 diabetes.
Main measurementsNon-mydiatric retinography, classifying them according to the International Clinical Diabetic Retinopathy Disease Severity Scale. The analyzed risk factors were: age, gender, age at diabetes onset, duration of diabetes, glycated haemoglobin levels (A1C), treatment of diabetes, blood pressure (systolic and diastolic), serum lipids concentration, body mass index, smoking status, hematocrit, pregnancy, serum vitamin D (25 OH D) levels, nephropathy and cardiovascular events.
ResultsThe prevalence of DR was 8.56% (CI: 5.81-11.32): Mild non-proliferative DR: 5.07% (CI: 2.89-7.25); Moderate non-proliferative DR: 1.38% (CI: 0.17-2.60); Severe non-proliferative DR: 0.27% (CI: 0.006-1.28); proliferative DR: 1.84% (CI: 0.46-3.22). Diabetic macular oedema: 2.30% (CI: 0.77-3.83). Mean age: 70 years, mean diagnostic age: 58.97 years, mean body mass index 29.86, 78.40% patients with hypertension, 67.30% dyslipidemia and median A1C: 6.7%. A deficit of 25 (OH) D was identified in 77% of patients. In the multivariate analysis, treatment of type 2 diabetes, body mass index, duration of diabetes and metabolic control of glycaemia were identified as independent risk factors.
ConclusionsThe prevalence of DR, compared with former studies, has decreased to 8.56%; this decrease is associated with the improvement in the control of modifiable risk factors. The associated independent risk factors were: treatment, body mass index, duration and control of diabetes. The variables antihypertensive treatment, cardiovascular events and nephropathy showed predictive value for DR.
La retinopatía diabética (RD) causa el 2,6% de los casos mundiales de ceguera1; en países desarrollados ha pasado de ser la principal causa (14,4%) a ser sobrepasada por enfermedades hereditarias de la retina (20,2%). Esto se atribuye a los programas de cribado de RD y a la mejora de control glucémico2,3.
Existen grandes diferencias en cuanto a las prevalencias de RD, debido a las distintas metodologías utilizadas y a las características poblacionales. También se observa un rápido avance en los cuidados y tratamiento del paciente diabético, permitiendo un mejor abordaje de la enfermedad. Estos factores hacen que los estudios no deban generalizarse y que trabajos con más de 10 años puedan no reflejar la situación actual4,5.
Si revisamos estudios realizados en España a partir del año 20006–25, encontramos características poblacionales similares pero con gran variabilidad metodológica, obteniendo prevalencias que varían el 7,20% y el 37,50%.
La prevención mediante un buen cribado5,26 y el control de los factores de riesgo (FR) son el tratamiento más eficaz26,27. FR como años de evolución de la diabetes4,7,13,28, control glucémico4,7,13,26,28, tratamiento de la diabetes13,15,28,29, hipertensión arterial (HTA) y grado de control4,7,13,28,30 se comportaron como FR independientes para la RD en múltiples estudios. Otros FR analizados son la nefropatía diabética13,31, algunas complicaciones cardiovasculares32, control perfil lipídico4,7,30, déficit de vitamina D33,34, el índice de masa corporal (IMC)30, tabaquismo7 y hematocrito35.
Los objetivos de este trabajo son estimar la prevalencia y severidad de la RD en pacientes con diabetes mellitus tipo 2 (DM2) en el área urbana de Santander, y evaluar la asociación de la RD con: edad, años de evolución de la diabetes, grado de control glucémico, tratamiento de la diabetes, control de la tensión arterial, control lipídico, obesidad, tabaquismo, hematocrito bajo, déficit de vitamina D, nefropatía y eventos cardiovasculares (ECV).
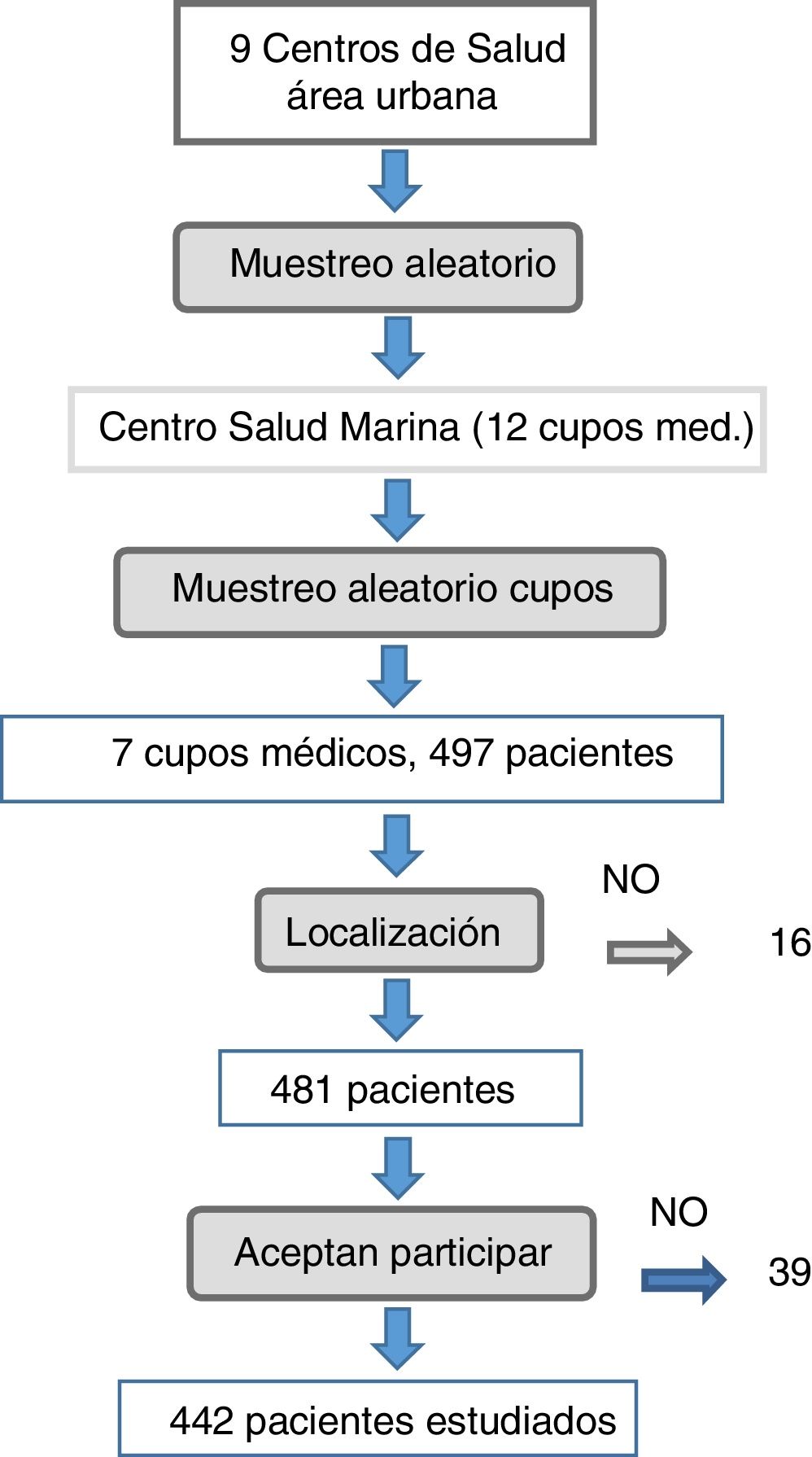
MétodoEstudio transversal de base poblacional en pacientes con DM2, realizado entre noviembre de 2013 y febrero de 2015, este artículo forma parte de la tesis doctoral de J.M. Castillo, y está disponible en: https://repositorio.unican.es/xmlui/handle/10902/9734. El ámbito de estudio fue el área urbana de Santander, con 10.744 pacientes con DM2 conocidos. La población diana fueron los pacientes del ámbito de estudio con diagnóstico de DM2 registrado en su historia clínica. Se realizó un muestreo aleatorio por conglomerados polietápico. En una primera etapa se seleccionó de forma aleatoria uno de entre los 9 Centros de Salud del área urbana, resultando seleccionado el C.S. La Marina. En una segunda etapa se seleccionaron cupos médicos del centro hasta completar el tamaño muestral. Ambas etapas se realizaron por muestreo aleatorio simple, con probabilidad proporcional a su tamaño poblacional. Cada facultativo actualizó los listados de pacientes con DM2, previamente a la captación de estos, para evitar errores de diagnóstico.
Para la estimación del tamaño muestral se utilizó la prevalencia (25%) de un estudio previo realizado en Cantabria17. Se aceptó un nivel de confianza del 95%, para una precisión del+4%. Se precisa una muestra de al menos 433 sujetos, asumiendo una población de referencia de 10.750 individuos. Se seleccionaron un total de 497 pacientes para compensar pérdidas.
Los pacientes incluidos fueron informados por carta y citados telefónicamente en consulta de oftalmología del Hospital Universitario Marqués de Valdecilla, realizándose prueba de agudeza visual con optotipo Snellen con la graduación del paciente; retinografía, con retinógrafo Zeiss Visucam PRONM, obteniendo 2 fotografías a 45°, una centrada en la mácula y otra en el disco óptico, siguiendo el protocolo EURODIAB36 y sin midriasis. Las fotos fueron realizadas por un investigador validado por el servicio de oftalmología, y evaluadas por un oftalmólogo especialista en retina, según las categorías de la Internacional Clinical Diabetic Retinopathy Severity Scale37.
Asimismo se les realizó en su centro de salud una analítica que incluía 25 (OH) D; 1,25 (OH)2 D, iPTH, calcio, albúmina y hemoglobina glucosilada (HbA1c), siendo analizada en el laboratorio de endocrinología del Hospital Universitario Marqués de Valdecilla. Los niveles en sangre de HbA1c (en sangre total) se determinaron mediante cromatografía líquida de alta presión. La valoración de los niveles de iPTH y 25(OH) D se realizó mediante inmunoanálisis específico quimioluminiscente automatizado. El análisis de los niveles de 1,25(OH)2 vitamina D se realizó mediante radioinmunoanálisis.
Los datos de los pacientes fueron obtenidos de la historia clínica informatizada del Servicio Cántabro de Salud. Las variables clínicas analizadas fueron: edad, género, peso, talla, IMC, años de diagnóstico de DM2, tratamiento actual de DM2, antecedentes familiares de DM2, antecedentes personales de HTA y dislipidemia, nefropatía, ECV, tratamiento de la dislipidemia, tratamientos crónicos, suplementación con calcio o vitamina D, embarazo y tabaquismo.
Para valorar el control glucémico se recogieron todas las HbA1c medias de los últimos 6 años. Para el control lipídico se recogieron los valores medios de colesterol total, colesterol-HDL, colesterol-LDL y triglicéridos del periodo 2009-2014. Se analizó el grado de control glucémico y lipídico siguiendo las recomendaciones ADA 2015 para ambos38; y la clasificación individualizada para el control glucémico según criterios de Ismail-Beiji39. Para valorar el control de la tensión arterial, se cogieron las tensiones medias del mismo periodo, siguiendo las recomendaciones del Eigth Joint National Committee (JNC8) para pacientes con DM240. Para valorar los estadios de insuficiencia renal se siguieron los criterios de clasificación de la Kidney Disease Improving Global Outcomes41.
Los procesos se realizaron tras la firma del consentimiento informado, aprobado por el Comité Ético de Investigación Clínica de Cantabria (acta 4/2014). Los datos fueron anonimizados y tratados de un modo confidencial con arreglo a la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal. Se mantuvo la confidencialidad de la información con arreglo a la Ley 41/2002, de 14 de noviembre y la Ley de Cantabria 7/2002, 10 de diciembre, de Ordenación Sanitaria de Cantabria.
El análisis estadístico se realizó empleando el software: IBM SPSS Statistics versión 25.0 (Armonk, NY: IBM Corp). Las variables cualitativas se describieron empleando los porcentajes con los intervalos de confianza (IC) del 95% para las variables principales. En las variables cuantitativas se comprobó el ajuste de los datos a la distribución normal mediante test de Kolmogorov-Smirnov, empleando según los casos la media aritmética y la desviación estándar o la mediana y el rango intercuartílico. En la comparación de las áreas bajo la curva (ABC) de la característica operativa del receptor (COR) se empleó el procedimiento de DeLong et al. (1988).
Para los test de hipótesis (análisis univariante), se empleó el test de Chi cuadrado o el test exacto de Fisher para las variables cualitativas. Se utilizaron los test de t de Student o la U de Mann-Whitney para variables cuantitativas. Se situó la significación estadística en valores de p<0,05.
Para identificar las variables asociadas al riesgo de padecer RD, realizamos un análisis de regresión logística. La variable dependiente se dicotomizó, en las categorías: ausencia de RD y presencia de RD; esta última categoría incluía cualquier grado de RD. Se realizó un análisis univariante estimando la OR y la significación, con el estadístico de Wald, de cada variable independiente. Posteriormente en la selección de las variables para el análisis multivariante, se empleó el criterio propuesto por Hosmer y Lemeshow, compartido por otros autores de referencia42, en el que se incluyen inicialmente aquellas con un nivel de significación (p<0,25) en el análisis univariante. Posteriormente se empleó el método hacia atrás condicional, para la selección automática de variables del modelo final. Este modelo se comparó con otros, con el mismo número de variables, basados en la fisiopatología y conocimiento actual del tema. Para comparar la capacidad predictiva de los diferentes modelos se utilizó el ABC de cada modelo para predecir la existencia de RD.
En el metaanálisis empleamos el programa Comprehensive Meta-analysis Version 3 (Comprehensive Meta-Analysis Version 3. Borenstein M., Hedges L., Higgins J., Rothstein H. Biostat, Englewood, NJ 2013), se evaluó la heterogeneidad entre estudios con el estadístico I2, para la síntesis de datos se empleó el método de efectos aleatorios.
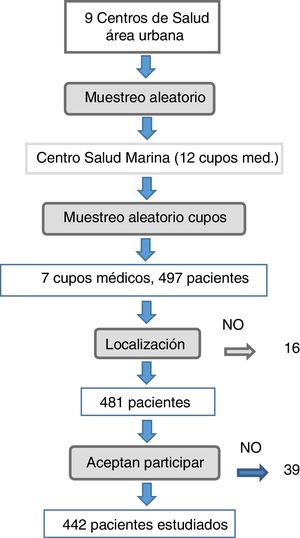
ResultadosCaracterísticas de la muestraComo se aprecia en la figura 1, de los 497 pacientes que cumplieron criterios de inclusión 16 de ellos fueron ilocalizables, 22 no quisieron participar, 5 fueron eliminados por incapacidad física y 12 porque no acudieron a la cita en 2 ocasiones. Finalmente se realizó el estudio a 442 pacientes, no pudiendo incluirse 55 (11%). Tasa de participación del 89%.
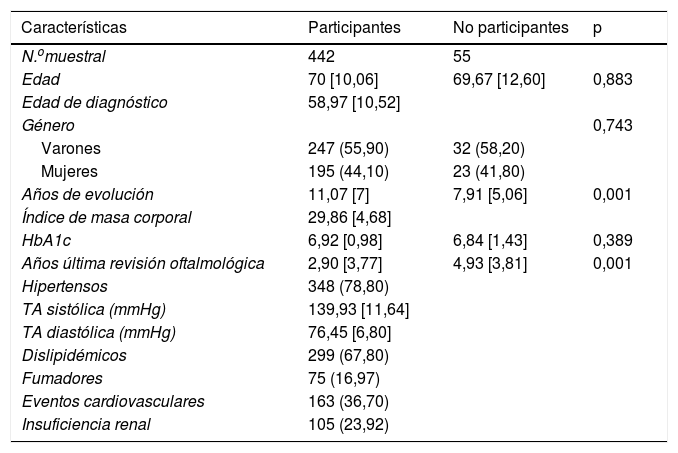
En la tabla 1 se puede observar las características poblacionales de participantes y no participantes, encontrándose diferencias significativas en años de evolución de la diabetes (11,07 vs. 7,91) y años transcurridos desde la última revisión oftálmica (2,90 vs. 4,93).
Comparación de los pacientes que finalmente participaron en el estudio en comparación con los que no lo hicieron, con relación a las variables clínicas y sociodemográficas
| Características | Participantes | No participantes | p |
|---|---|---|---|
| N.omuestral | 442 | 55 | |
| Edad | 70 [10,06] | 69,67 [12,60] | 0,883 |
| Edad de diagnóstico | 58,97 [10,52] | ||
| Género | 0,743 | ||
| Varones | 247 (55,90) | 32 (58,20) | |
| Mujeres | 195 (44,10) | 23 (41,80) | |
| Años de evolución | 11,07 [7] | 7,91 [5,06] | 0,001 |
| Índice de masa corporal | 29,86 [4,68] | ||
| HbA1c | 6,92 [0,98] | 6,84 [1,43] | 0,389 |
| Años última revisión oftalmológica | 2,90 [3,77] | 4,93 [3,81] | 0,001 |
| Hipertensos | 348 (78,80) | ||
| TA sistólica (mmHg) | 139,93 [11,64] | ||
| TA diastólica (mmHg) | 76,45 [6,80] | ||
| Dislipidémicos | 299 (67,80) | ||
| Fumadores | 75 (16,97) | ||
| Eventos cardiovasculares | 163 (36,70) | ||
| Insuficiencia renal | 105 (23,92) |
HbA1c: hemoglobina glucosilada; TA: tensión arterial.
Las cifras representan el número de sujetos (%) o la media aritmética [desviación estándar]
En cuanto al tratamiento de la DM2 el 12,4% estaban tratados con dieta, el 67,3% con antidiabéticos orales (ADO), el 13,1% con ADO+insulina y el 7,2% con insulina, siendo el fármaco más utilizado la metformina sola o combinada (68,2%).
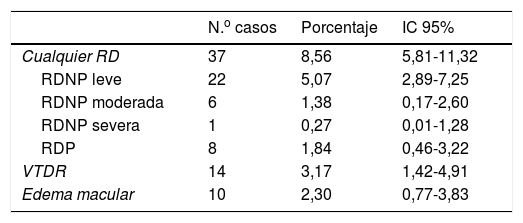
Prevalencia de retinopatía diabéticaDe los 442 pacientes estudiados, en 10 casos (2,25%) no se obtuvieron retinografías valorables, consiguiendo una prevalencia de RD sobre los 432 casos restantes del 8,56% (IC: 5,81-11,32) (tabla 2).
Prevalencia de retinopatía diabética
| N.o casos | Porcentaje | IC 95% | |
|---|---|---|---|
| Cualquier RD | 37 | 8,56 | 5,81-11,32 |
| RDNP leve | 22 | 5,07 | 2,89-7,25 |
| RDNP moderada | 6 | 1,38 | 0,17-2,60 |
| RDNP severa | 1 | 0,27 | 0,01-1,28 |
| RDP | 8 | 1,84 | 0,46-3,22 |
| VTDR | 14 | 3,17 | 1,42-4,91 |
| Edema macular | 10 | 2,30 | 0,77-3,83 |
IC 95%: intervalo de confianza del 95%; RD: retinopatía diabética; RDNP: retinopatía diabética no proliferativa; RDP: retinopatía diabética proliferativa; VTDR: visión amenazada.
De los casos encontrados, todos tenían más de 5 años de evolución de la DM2. Debemos destacar por su relevancia clínica que el 39,14% (IC: 34,48-43,8) de la muestra no había sido revisado por un oftalmólogo hacia 3 o más años y que del total de casos con RD se encontró que el 16,22% (IC: 2,99-29,44) llevaban 4 o más años sin ser revisados. De los 425 casos en los que se valoró la agudeza visual, en 2 (0,5%) se encontró una agudeza visual inferior a 1/10 para ambos ojos, ceguera legal. En otros 7 casos (1,6%) tenían una agudeza visual, en ambos ojos, inferior a 4/10, baja visión.
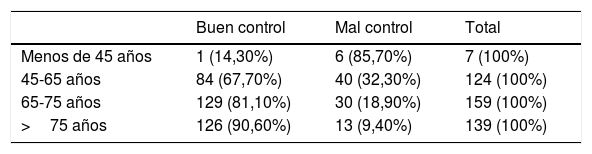
Factores de riesgo asociados a la retinopatía diabéticaLa media de hemoglobina de los 6 años fue del 6,92%, desviación estándar 0,98, mediana 6,76%, con un 60,63% de los pacientes con una media<7% y un 88,1% con HbA1c<8. Al valorar el control de la diabetes de forma individualizada siguiendo la clasificación de Ismail-Beiji, el 79,3% cumplían los objetivos terapéuticos. Encontramos que en la población más joven el grado de cumplimiento de los objetivos disminuye, encontrándose una asociación lineal (p<0,001) entre la edad y el grado de control.
El porcentaje de pacientes hipertensos fue del 78,8%, una media de 139/76mmHg y 12,7 años de evolución media de la HTA.
La prevalencia de dislipidemia fue del 67,80%. El grado de control para cada factor lipídico fue: colesterol-LDL (25,5%), colesterol-HDL (66,6%) y triglicéridos (64,9%). Solo se obtuvo un 13,7% de buen control para las 3 variables.
Para analizar los FR de la RD realizamos un análisis univariante de cada factor, en función de la RD (tabla S1). Destacar que en algunas de las variables categorizadas las categorías de peor control tenían OR elevadas.
Para el análisis multivariante, tomamos como variable dependiente la RD dicotomizada. Dado el escaso número de casos (37 pacientes, con RD) realizamos un modelo de regresión hacia atrás condicional obteniendo el primer modelo. Con modelos de 4 FR, y atendiendo a la evidencia actual, realizamos los siguientes modelos (tabla S2). En este proceso se obtuvo que las variables tratamiento de la diabetes (p<0,0001), años de evolución (p=0,037) y control glucémico (p=0,028) se comportaron como FR independientes para la RD. La obesidad se comportó como un factor protector de la RD (OR 0,538; p=0,029). El tratamiento de la diabetes fue el FR con mayor fuerza de asociación especialmente para los pacientes tratados con insulina (insulina+ADO: OR=12,47; IC: 1,42-109,15; insulina: OR=22,35; IC: 2,42-206,43).
Las variables que mejor establecen el ABC son el IMC, tratamiento de la diabetes y años de evolución. Un modelo con estas 3 variables obtendría un ABC del 80,9%. HTA, nefropatía y ECV, a pesar de no ser FR independientes, tenían un valor predictivo similar al ser añadidas al modelo anterior.
Se realizó un análisis de colinealidad mediante test de tolerancia, siendo negativa para todas las variables incluidas en los modelos multivariantes.
DiscusiónAunque la estructura sanitaria y las características demográficas de la muestra son similares al resto de la comunidad autónoma, los resultados del presente estudio solamente serían extrapolables a poblaciones con unas características similares con respecto a las variables que se conoce que influyen en la aparición de la RD, entre otras: años de evolución y control glucémico.
En el caso de Cantabria17, hay una disminución importante de la prevalencia de RD en 13 años, del 25,9 al 8,56%. Ha descendido significativamente la RD no proliferativa y el edema macular, mientras que la RD proliferativa se mantiene en porcentajes similares. Teniendo en cuenta la elevada edad y menos años de evolución de diabetes de los pacientes con RD proliferativa, podría ser que estos tardan más en ser diagnosticados de diabetes o que la diabetes tardía afecta más a los ojos de quienes la padecen, tal y como ya se concluye en otros estudios29.
Esta disminución se relaciona con el mejor control de los FR, sobre todo el control glucémico pasando de una HbA1c media de 7,50% en el estudio de De la Mora a un 6,92%, conclusión que comparten otros estudios7,12,28. Todos los pacientes con RD tenían más de 5 años de evolución de la DM, siendo indicador de detección precoz de la DM2. Esto puede hacer replantearnos la recomendación existente en DM2 de realizar cribado en el momento del diagnóstico, a la vista de estos resultados podría replantearse modificar esta recomendación, y realizarse en los primeros 5 años tras el diagnóstico.
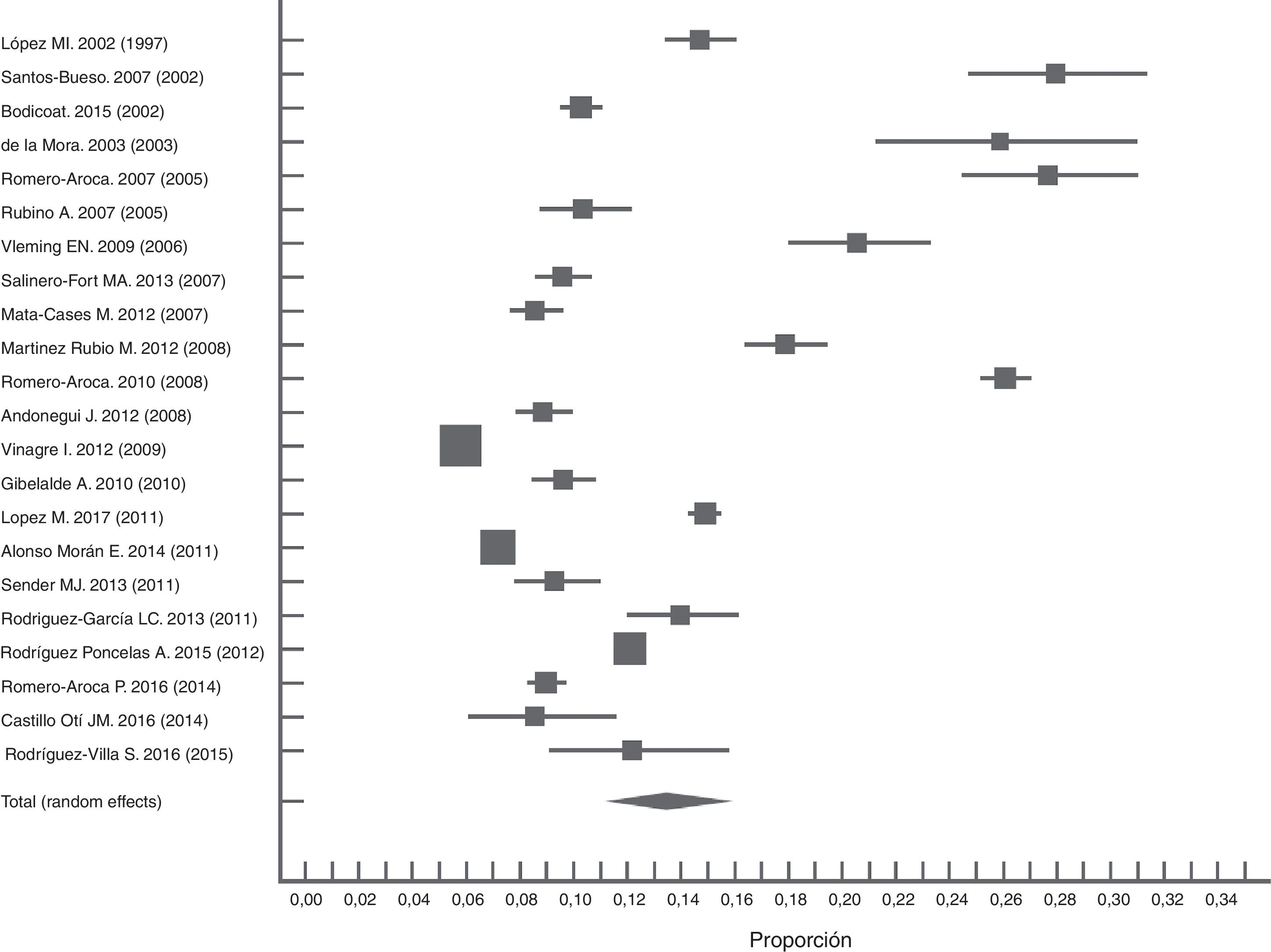
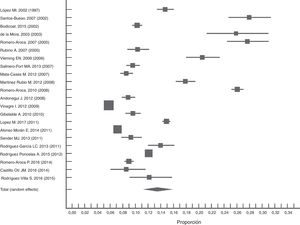
En estudios nacionales observamos características poblacionales similares con metodologías y resultados heterogéneos (I2=99,7). Haciendo un metaanálisis de los estudios publicados después del año 2000, la prevalencia conjunta empleando el procedimiento de efectos aleatorios fue del 13% (IC: 10,7-15,7). Podemos observar una tendencia a la disminución de la prevalencia de la RD en los últimos años (fig. 2). Encontramos el límite superior de este estudio dentro del IC de la estimación global del metaanálisis.
En este estudio obtuvimos un buen control glucémico, tanto en la media de los 6 últimos años como en la valoración individual de cada paciente, siguiendo la clasificación de Ismail-Beigi. Según esta última se obtuvo que el 79,3% de los pacientes estaban bien controlados; por encima del 67,4% de otro estudio similar realizado en Burgos43. Encontramos que a medida que la población es más joven el grado de cumplimiento de los objetivos terapéuticos disminuye (tabla 3). Clínicamente es un factor importante, puesto que los grupos de edad jóvenes tienen peor cumplimiento y estarán expuestos a FR durante más años. Resultados similares obtuvieron en un estudio realizado en Cataluña28, observando un repunte de la incidencia de RD y edema macular en los pacientes jóvenes, entre 31 y 70 años, relacionado con el mal control metabólico. Por tanto, el control de la HbA1c del presente estudio es bueno por tener una HBA1c media<7%, pero se debe intensificar en los grupos de edad más jóvenes.
Grado de control por grupos de edad, según los criterios de Ismail-Beigi39
| Buen control | Mal control | Total | |
|---|---|---|---|
| Menos de 45 años | 1 (14,30%) | 6 (85,70%) | 7 (100%) |
| 45-65 años | 84 (67,70%) | 40 (32,30%) | 124 (100%) |
| 65-75 años | 129 (81,10%) | 30 (18,90%) | 159 (100%) |
| >75 años | 126 (90,60%) | 13 (9,40%) | 139 (100%) |
En el análisis multivariante obtuvimos que el IMC se mostró como un factor protector en pacientes obesos; tratamiento con insulina, control glucémico y años de evolución fueron FR independientes para la RD. Existen estudios en los que estas 3 variables se presentan como FR independientes8,13,28. Para el IMC existen estudios en los que no se ha relacionado con la RD4,7 y otros en los que se ha comportado como factor protector30, como en el caso del presente estudio por lo que se precisan más estudios.
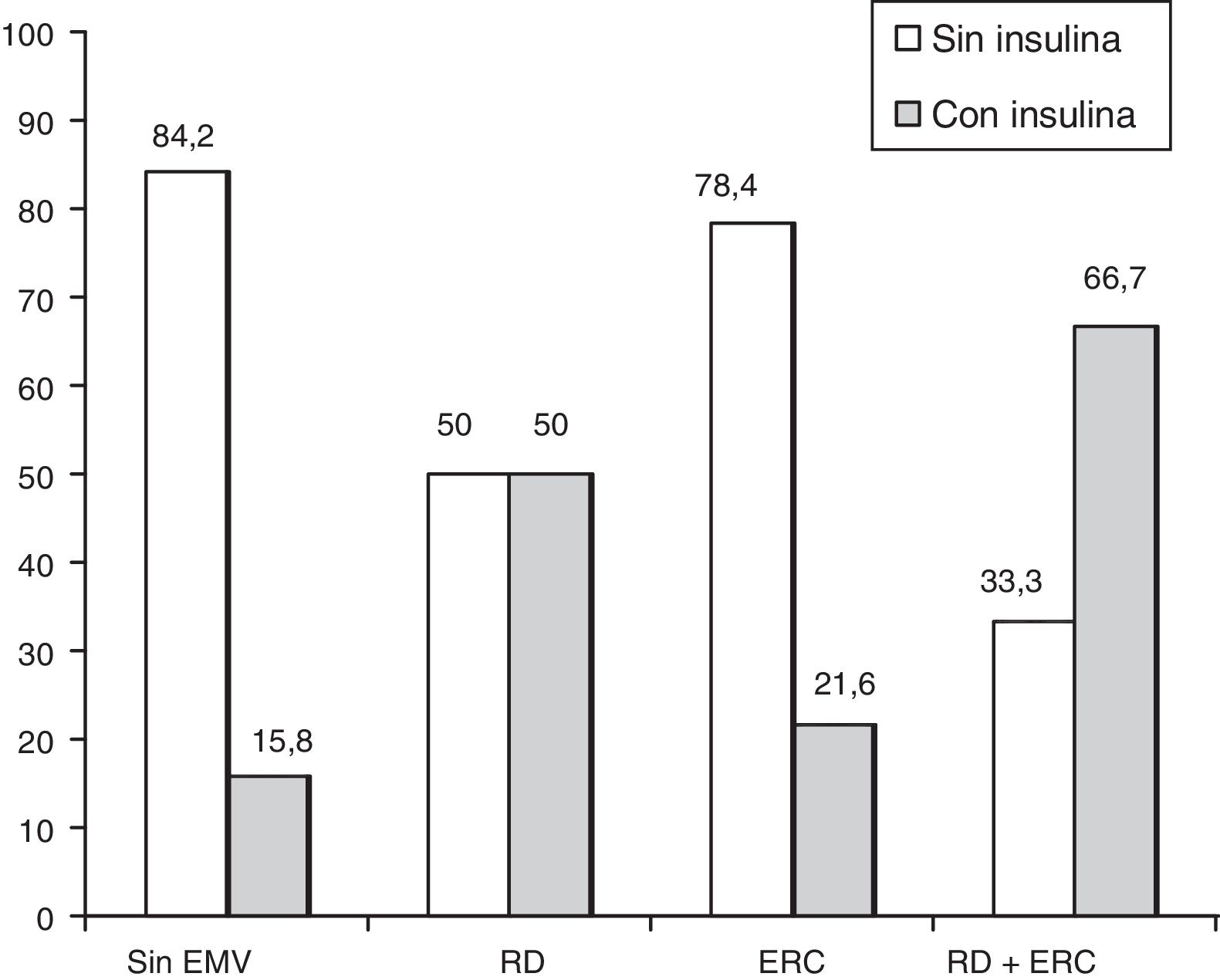
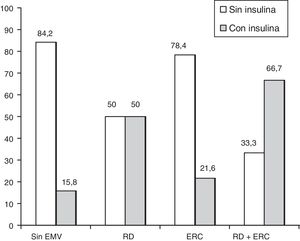
El tratamiento de la diabetes se comporta como el FR con mayor fuerza de asociación especialmente para los pacientes insulinizados. Aunque la insulinización se relaciona con mal control y más tiempo de evolución de la diabetes, esta asociación se mantiene una vez ajustado por el resto de variables. Por tanto es posible que la insulina tenga algún efecto negativo para el desarrollo de RD. Este efecto no se manifestó en otra lesión microvascular como es la nefropatía (p=0,864) (fig. 3). En este sentido, en un estudio de cohortes encontraron que los pacientes que se insulinizaban padecían más RD que los pacientes que continuaban con ADO44. Otros estudios realizados en Cataluña asociaron el aumento de incidencia de RD al tratamiento con insulina7,28. En otro estudio realizado en Extremadura, también obtuvieron una OR 2,39, muy similar a la de este estudio, para los pacientes tratados con ADO, y para los tratados con insulina fue de 10,3215. También se puede encontrar otros estudios a nivel internacional, en el que encontraron asociación significativa entre RD y tratamiento con insulina en pacientes con DM229.
Las variables que mejor establecen ABC son IMC, tratamiento de DM2 y años de evolución. Cuando se suprime la variable tratamiento de la diabetes es cuando más disminuye el ABC. HTA, nefropatía y ECV a pesar de no ser FR independientes tienen un valor predictivo similar. En diferentes estudios la HTA también se ha comportado como un FR independiente para la RD4,7,28,30. En el presente trabajo podemos establecer 2 niveles de riesgo que se mantienen en todo el estudio y que vienen determinados por la OR. El primero entre no ser HTA y ser hipertenso bien controlado o hipertenso grado i, OR 4,5 y 5,3; el segundo, entre estos últimos y los hipertensos grado ii, la OR es de 10 (p=0,023 en análisis multivariante). En un ensayo clínico ACCORD26, en el que se realizó control intensivo de glucemia, dislipidemia y tensión arterial; no observaron que el control intensivo de la tensión arterial produjera ningún beneficio en la evolución de la RD. Debemos advertir que el control intensivo consistía en una sistólica inferior a 120mmHg, mientras que el estándar era de una sistólica inferior a 140mmHg; niveles en los que tampoco se observó ninguna diferencia en nuestro estudio.
También hemos observado que los niveles más severos de todas las variables categorizadas, que quedan incluidas en el análisis multivariante, dan OR muy elevadas para la RD. Por ello clínicamente se debieran tratar de evitar esos niveles y tenerlo muy en cuenta a la hora de planificar el seguimiento de la RD.
ConclusionesLa prevalencia de RD en nuestro medio es inferior a la descrita en otros estudios similares, relacionándose con una mejora en el grado de control de los FR modificables, en especial control glucémico, y el diagnóstico precoz de la DM2, puesto que no encontramos ningún paciente que tuviera RD con menos de 5 años de evolución de la DM2. El control general de los FR modificables en nuestro grupo de pacientes es considerado adecuado, aunque se debería mejorar en los grupos de edad más jóvenes.
Los FR independientes fueron tratamiento de la DM2, IMC, años de evolución y control de la DM2; las variables control de la HTA, ECV y grado de nefropatía, también se mostraron con capacidad predictiva de la RD. Los peores niveles de control de las diferentes variables poseen un riesgo elevado de RD, por lo que se debería tener en cuenta a la hora de planificar el control y seguimiento de estos pacientes.
Puede consultarse material adicional a este artículo en su versión electrónica disponible en DOI:10.1016/j.aprim.2018.10.001.
La retinopatía diabética sigue siendo una importante causa de ceguera en la actualidad. La prevalencia de la retinopatía diabética ha disminuido debido al mejor control glucémico y de otros factores de riesgo. Se conocen algunos factores de riesgo asociados a la retinopatía diabética.
Qué aporta este estudioSe detecta una disminución importante de la prevalencia de retinopatía diabética en Cantabria. Este descenso se asocia al mejor control de los factores de riesgo modificables. Solo los peores niveles de control de los factores de riesgo se asocian a un mayor riesgo de retinopatía diabética.
Castillo-Otí JM, Cañal-Villanueva J y Muñoz-Cacho P han contribuido en la concepción y el diseño del estudio; Castillo-Otí JM, García-Unzueta MT, Galván-Manso AI y Callejas-Herrero MR en la recogida de datos y su procesamiento; García-Unzueta MT en todas las pruebas relativas a los análisis clínicos; Castillo-Otí JM y Muñoz-Cacho P en el análisis estadístico de los resultados y la versión inicial del artículo; Castillo-Otí JM, Cañal-Villanueva J, García-Unzueta MT, Galván-Manso AI, Callejas-Herrero MR y Muñoz-Cacho P en la aprobación final de la versión para ser publicada, y se hacen responsables de que todos los aspectos que integran el manuscrito han sido revisados y discutidos entre los 6 autores con la finalidad de que sean expuestos con la máxima precisión e integridad.
FinanciaciónNovartis farmacéutica S.A. que cedió un retinógrafo Zeiss VISUCAM PRONM, al Hospital Universitario Marqués de Valdecilla para la realización de este trabajo.
La Red de Grupos de Estudio de la Diabetes en Atención Primaria de la Salud. (redGDPS). Este grupo donó tres mil euros (3.000 euros) para financiar el costo de reactivos para las determinaciones de 25 (OH) D y la 1,25 (OH)2 D.
Conflicto de interesesLos autores firmantes del presente manuscrito declaran haber recibido financiación de Novartis farmacéutica S.A. y de la redGDPS para la realización de este estudio.
A Novartis Farmacéutica S.A. por su desinteresada colaboración en este estudio con la donación del retinógrafo, y a la Fundación redGDPS por financiar los reactivos de la vitamina D.
El presente artículo forma parte de la tesis doctoral de Castillo-Otí JM, realizada en la Universidad de Cantabria.