Introducción
El cáncer de estómago es la segunda localización oncológica más frecuente en el mundo, con un 9,9% del total de casos, que se incrementa al 11,9 en varones y se reduce al 7,6 en mujeres, en las que se sitúa en cuarto lugar por detrás del cáncer de mama, colon-recto y cuello uterino1. Su incidencia es diferente en países en vías de desarrollo, en los que el número de nuevos casos anuales en varones es muy cercano al del cáncer de pulmón, de la de países desarrollados en los que los cánceres de próstata y colon-recto superan en número de casos al de estómago2. En las mujeres, la diferencia entre países desarrollados y en desarrollo es menor, pero igualmente se mantiene. De hecho, el 38% de los casos de cáncer gástrico se dan en China, donde es el cáncer más frecuente en ambos sexos, igual que en otras zonas del sudeste asiático. También es el más frecuente, incluso supera al de pulmón, en las áreas tropicales de Sudamérica, y en Europa presenta tasas elevadas en los países del este1. La razón de tasas de mortalidad e incidencia oscila, en varones, entre 0,40 en Japón y 0,89 en los países de Asia central, con 0,86 en Europa, mientras que en las mujeres las cifras varían entre 0,44 en Japón y 0,92 en las áreas templadas de Sudamérica, con 0,83 en Europa1. La base de datos de la Organización Mundial de la Salud (OMS) muestra grandes variaciones en las tasas de mortalidad ajustadas por edad según el sexo y el país3. En los años 1995-1998 dichas tasas superaron las 25 y 10 defunciones (por cada 100.000 individuos) en varones y mujeres, respectivamente, en los países europeos de Bielorrusia, Estonia, Rusia, Letonia, Lituania y Ucrania. España presentó en 1995 último año del que se disponen datos unas tasas ajustadas de 12,2 y 5,5 defunciones (por cada 100.000 individuos) en varones y mujeres, respectivamente,, superiores a las de Dinamarca, Francia, Finlandia, Grecia, Islandia, Irlanda, Luxemburgo, Holanda, Noruega, Suecia y Reino Unido3. Nuestro país vecino, Portugal, presenta tasas que casi duplican a las españolas, pero con tendencia a la reducción de las mismas, siguiendo la tendencia decreciente general4,que podría obedecer a varias razones. Por una parte, las técnicas de congelación y refrigeración han reducido el consumo de salazones y ahumados, sistemas de conservación de alimentos asociados en estudios ecológicos a una alta incidencia de cáncer de estómago5. Por otra, los actuales sistemas de cultivo y las mejoras del transporte permiten un mayor consumo de frutas y verduras mantenido durante todo el año que se asocia a una reducción del riesgo de cáncer de estómago6. Recientemente, se ha especulado que el consumo de té verde estaría igualmente asociado a un descenso en el riesgo de este tipo de cáncer; si bien existe consenso respecto al papel protector de una dieta con alto contenido en frutas, vegetales y cereales integrales, y un incremento del riesgo asociado a una dieta rica en sal y alimentos salados o ahumados, y posiblemente al consumo habitual de carne y pescado cocinados en barbacoa6, el efecto protector del té verde no se ha consolidado7. El consumo de alcohol también es probablemente un factor de riesgo de padecer cáncer gástrico, pero en la localización en cardias8. Además, se están analizando las relaciones del cáncer de estómago con la infección por Helicobacter pylori9 para esclarecer si los tratamientos antibióticos erradicadores de la misma serían protectores respecto a su aparición o a la evolución maligna de adenomas gástricos o, por el contrario y como otros autores apuntan, actuarían como factor de riesgo del cáncer de estómago, ya que determinadas cepas de
H. pylori (cagA+) parecen proteger de la aparición de adenocarcinomas en cardias gástrico10. Estudios de intervención que tratan el H. pylori en pacientes con diferente evolución del proceso oncológico gástrico11 ayudarán a esclarecer esta relación. Se ha confirmado la existencia de una susceptibilidad genética al desarrollo del cáncer de estómago a través de estudios llevados a cabo en grupos étnicos cerrados12 y familiares de pacientes13, tras tener en cuenta posibles factores de confusión como la dieta14. Anotar por último que, aunque se observó a finales de los años ochenta una relación entre la exposición al óxido de etileno15,16 y un incremento en la mortalidad por cáncer de estómago, esta asociación no ha podido confirmarse mediante estudios más recientes que medían mortalidad17 e incidencia18 en cohortes con exposición ocupacional.
El objetivo de este trabajo es describir la tendencia de la mortalidad por cáncer de estómago en Andalucía en el último cuarto de siglo, así como conocer su distribución geográfica actual por distritos sanitarios de atención primaria.
Material y métodos
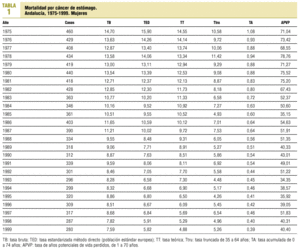
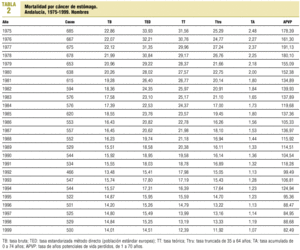
Las defunciones por cáncer de estómago rúbrica 151 de la CIE 8-9 y C16 de la CIE 10 son las que han publicado los institutos nacional (INE) y andaluz (IEA) de estadística para 1975-1991 y 1992-1999, y los datos de este último año son provisionales. El criterio de inclusión ha sido la residencia del fallecido en un municipio andaluz, y las poblaciones utilizadas son las estimadas por el IEA. Para describir la evolución temporal se han calculado, para cada sexo, las tasas brutas, ajustadas por edad método directo y población de referencia europea, truncadas de 35 a 64 años, y de años potenciales de vida perdidos entre 1 y 70 años (APVP)19. Como aproximación al riesgo de morir por cáncer de estómago en ausencia de otras causas, se han calculado tasas acumuladas de 0 a 74 años20 por 100. Para cuantificar los cambios que tuvieron lugar a lo largo del intervalo 1975-1999, se han ajustado modelos de regresión lineal, con el año de defunción y la tasa ajustada como variables independiente y dependiente, respectivamente, y se han estimado los coeficientes de regresión en cada sexo, usando el programa SPSS versión 8.0 y fijando en el 5% el nivel de significación estadística para la prueba de independencia de las variables y para los valores diferentes de cero de la ordenada en el origen y de la pendiente de la recta de regresión. Con anterioridad se había comprobado la normalidad de la distribución. Las tasas ajustadas por edad de los distritos de atención primaria del último quinquenio, agrupadas en quintiles, son la base de la distribución geográfica de la mortalidad actual por cáncer de estómago. La representación gráfica se ha realizado con el programa MapMaker.
Resultados
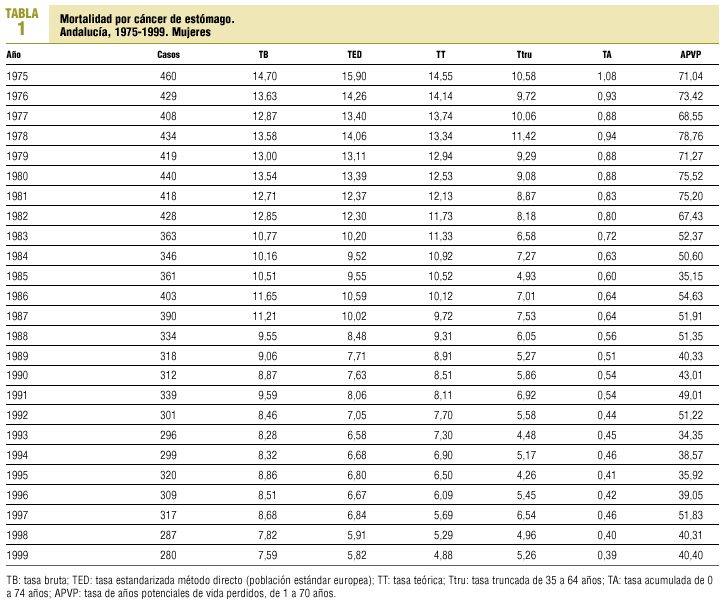
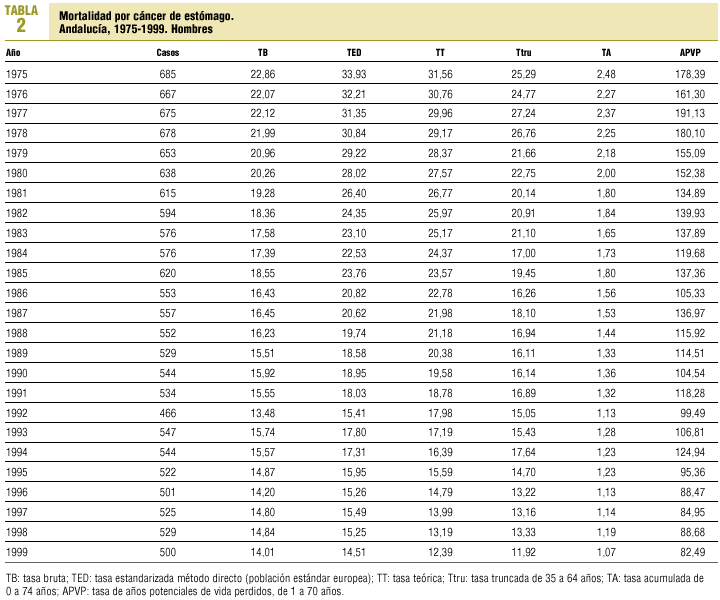
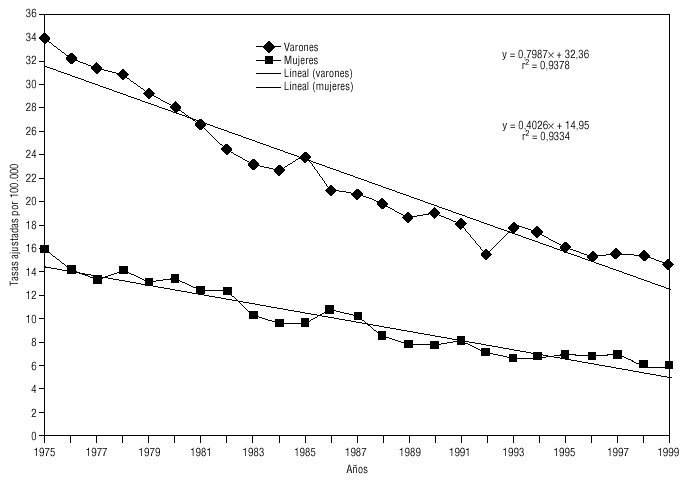
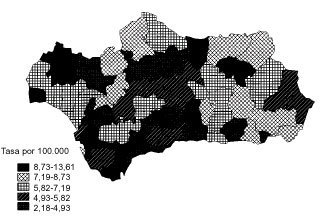
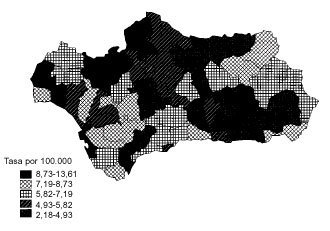
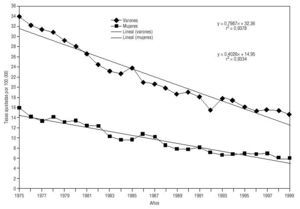
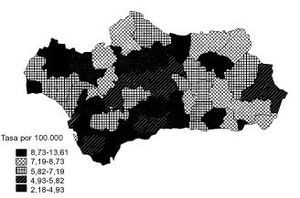
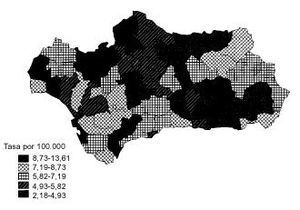
La tendencia de la mortalidad por cáncer de estómago en Andalucía entre 1975 y 1999 es notablemente descendente (tablas 1 y 2). Las tasas brutas se han reducido a la mitad en mujeres y en dos tercios de la cifra inicial en varones. Las ajustadas por edad aún han experimentado variaciones de mayor entidad, pasando de 15,9 a 5,8 defunciones por cada cien mil mujeres y de 33,9 a 14,5 defunciones por cada cien mil varones, con una reducción global del 63,5% en mujeres y del 57,2% en varones. La razón de varones a mujeres se mantiene por encima de 2 en la práctica totalidad de los años de la serie. Los indicadores de mortalidad prematura tasas truncadas y APVP se han reducido también en ambos sexos, mientras las tasas acumuladas han descendido del 1,08 al 0,39% en mujeres y del 2,48 al 1,07% en varones. La figura 1 representa las tasas ajustadas por edad, las ecuaciones de regresión y las tendencias obtenidas para ambos sexos al aplicar el modelo lineal, que es el que mejor se ajusta a la evolución observada. Las tasas teóricas de mortalidad se pueden estimar utilizando las expresiones que aparecen en dicha figura. Los mapas 1 y 2 (figs. 2 y 3) muestran la distribución geográfica de la mortalidad actual por cáncer de estómago según los distritos sanitarios. Se observan zonas en las provincias de Granada (Guadix), Sevilla, Huelva y Córdoba (sierras norte) donde la mortalidad por cáncer de estómago es 3 veces superior en los varones a la registrada en los distritos de más baja mortalidad; las diferencias son aún más acusadas en las mujeres.
Fig 01:Evolución de la mortalidad por cáncer de estómago en Andalucía, 1975-1999.
Fig 2:Mortalidad por cáncer de estómago en mujeres en Andalucía, 1995-1999.
Fig 3:Mortalidad por cáncer de estómago en varones en Andalucía, 1995-1999.
Discusión
Los resultados muestran un notable descenso de la mortalidad por cáncer de estómago en Andalucía, a pesar de que sigue siendo la tercera localización más frecuente en varones y la cuarta en mujeres21. Esta tendencia concuerda con la observada en España, que presentó sus tasas más elevadas a mediados de los años sesenta, y desde entonces el descenso ha sido continuado y acusado3 hasta llegar a las tasas actuales, ya anotadas. Los motivos de este decremento, también observado en los países de nuestro entorno, están asociados a un descenso en la incidencia y, más recientemente, a un incremento de la supervivencia. Durante décadas, la supervivencia al cáncer de estómago fue tan baja, inferior al 10% a los 5 años, que se aceptaba que la tendencia de la mortalidad era un fiel reflejo del descenso de la incidencia22 que reflejaban los registros de cáncer, tanto en España como en los países occidentales. Recientemente se han publicado23 estimaciones de supervivencia ligeramente superiores, 19,3% en varones y 23,6% en mujeres a los 5 años como promedio europeo, con intervalos que oscilan entre 8,4 y 10,1% en Polonia (varones y mujeres) hasta 25,3 en España (varones) y 32,1% en Islandia (mujeres), que ciertamente colaboran en el descenso de las tasas de mortalidad. La tendencia observada en Andalucía coincide, por tanto, con la esperada. Respecto a la distribución geográfica actual de la mortalidad, con notables diferencias por distritos de atención primaria, se podría cuestionar tanto la fiabilidad de la información como la estabilidad en áreas pequeñas de índices de mortalidad que miden eventos poco frecuentes. Sin embargo, los estudios de concordancia de causas de muerte, que comparan certificados de defunción con información clínica de pacientes fallecidos, adjudican a las estadísticas oficiales de defunción una alta fiabilidad, tanto en España24 como en países25 de desarrollo, con normativa y tradición epidemiológica similares, pero afectando las discrepancias oncológicas principalmente a las localizaciones en útero y a los mesoteliomas26 y habiéndose reducido27 las discordancias globales de la mortalidad por cáncer un 35% entre finales de los años setenta y ochenta. Y en cuanto a la estabilidad de las mediciones, precisamente buscando ésta se han realizado tasas medias del último quinquenio; al ampliar el período temporal, la mortalidad se estabiliza incluso en áreas de pequeña población como los distritos sanitarios de atención primaria. Los intentos de caracterización de las zonas de alta y baja mortalidad han fomentado el desarrollo de sofisticadas técnicas estadísticas28, útiles para buscar patrones de distribución geográfica, pero que sin duda alejan los resultados de los datos reales29, motivo que nos ha decidido a elegir la representación de las tasas ajustadas por edad. Andalucía, tomada en su conjunto, presenta tasas de incidencia30 y mortalidad bajas como para proponer programas de detección precoz como los llevados a cabo en Japón. Estos programas utilizan técnicas estandarizadas de doble contraste de bario y posterior gastroscopia (en población de edad igual o superior a los 40 años) que han hecho del cáncer de estómago una enfermedad detectada en estadios precoces, con una reducida razón de tasas de mortalidad e incidencia1. Sí sería razonable, en cambio, definir posibles medidas de prevención a llevar acabo en aquellas áreas en las que detectamos una elevada mortalidad. Y previamente sería necesario analizar la morbilidad, los patrones dietéticos, la susceptibilidad genética y la prevalencia de infección por H. pylori a través de estudios analíticos que tuvieran en cuenta posibles factores de confusión como las exposiciones ocupacionales y el nivel socioeconómico.
Correspondencia: Miguel Ruiz Ramos Registro de Mortalidad. Avda. Blas Infante, 6. Edificio Urbis, 8.ª planta. 41009 Sevilla.Correo electrónico: mruiz@iea.junta-andalucia.es Manuscrito aceptado para su publicación el 18-VII-2001.