Evaluar la tolerancia a lixisenatida y sus efectos sobre el peso y el control metabólico de pacientes con diabetes tipo2 y obesidad.
DiseñoEstudio prospectivo.
EmplazamientoConsultas de atención especializada de Endocrinología y Nutrición en Almería, Granada y Málaga.
ParticipantesPacientes con diabetes tipo2 y obesidad.
IntervencionesRespuesta y tolerancia al tratamiento con lixisenatida.
Mediciones principalesSe analizaron datos clínicos y analíticos con medidas de cambio intrasujeto antes-después del tratamiento.
ResultadosEvaluamos 104 pacientes (51% mujeres) con diabetes tipo2 y obesidad (Almería 18,3%; Granada 40,4%; Málaga 41,3%). Edad media 58,4±10,5años y duración media de diabetes 11,2±6,7años. El tiempo medio desde la visita basal a la revisión tras inicio de tratamiento con lixisenatida fue de 3,8±1,6meses. Encontramos mejoría significativa del peso (p<0,001), índice de masa corporal (p<0,001), circunferencia de cintura (p=0,002), presión arterial sistólica (p<0,001) y diastólica (p=0,001), glucemia en ayunas (p<0,001), HbA1c (p=0,022), colesterol total (p<0,001), colesterol LDL (p=0,046) y triglicéridos (p=0,020). No se observó alteración de cifras de amilasa en relación con el tratamiento con lixisenatida, y el 7,9% no lo toleraron.
ConclusionesLixisenatida consigue: 1)mejoría significativa de parámetros antropométricos y control glucémico (glucemia basal y HbA1c); 2)descenso significativo de la presión arterial y del perfil lipídico, y 3)seguridad y buena tolerancia en la mayoría de los pacientes. Además, encontramos una significativa intensificación del tratamiento antihipertensivo e hipolipemiante.
To evaluate tolerance to lixisenatide and its effects on weight and metabolic control in type2 diabetes and obese patients.
DesignProspective study.
SettingEndocrinology clinics in Almeria, Granada and Malaga.
ParticipantsPatients with type2 diabetes and obesity.
InterventionsResponse and tolerance to lixisenatide treatment.
Main measurementsClinical and analytical data of the subjects were evaluated at baseline and after treatment.
ResultsThe study included 104 patients (51% women) with type2 diabetes and obesity (Almeria 18.3%; Granada 40.4%; Malaga 41.3%). The mean age was 58.4±10.5years, and the mean duration of diabetes was 11.2±6.7years. The patients were re-evaluated at 3.8±1.6months after treatment with lixisenatide. Significant improvements were found in weight (P<.001), body mass index (P<.001), waist circumference (P=.002), systolic blood pressure (P<.001), diastolic blood pressure (P=.001), fasting glucose (P<.001), HbA1c (P=.022), Total cholesterol (P<.001), LDL-cholesterol (P=.046), triglycerides (P=.020), hypertension drugs (P<.001), and lipids drugs (P<.001). No changes were observed in levels of amylase related to lixisenatide treatment, and 7.9% of patients did not tolerate it.
ConclusionsLixisenatide achieved significant improvements in anthropometric parameters, glycaemic control (fasting glucose and HbA1c), blood pressure and lipids. It was safe and well tolerated in most patients. In addition, there was a significant increase in the use of antihypertensive and lipid-lowering therapy.
La diabetes mellitus tipo2 (DM2) supone una carga sanitaria en aumento a nivel mundial. Una parte sustancial de esta carga se debe al desarrollo de enfermedad cardiovascular (ECV). Hasta la fecha no se ha demostrado de forma convincente que el control intensivo de la glucosa reduzca significativamente los resultados de ECV1.
El riesgo de desarrollar DM2 aumenta exponencialmente con el aumento del índice de masa corporal (IMC), especialmente si el acúmulo graso es de distribución central o a nivel de músculo esquelético, hígado y otros órganos como páncreas. Además, la coexistencia de DM2 y obesidad aumenta el riesgo de desarrollar otras enfermedades tales como ECV, apnea obstructiva del sueño, patología osteoarticular, muchos tipos de cáncer y depresión. En las personas con intolerancia a la glucosa, la pérdida de peso moderada puede reducir el desarrollo de diabetes manifiesta en un 50% o más en 4años. Por ello, la reducción ponderal debe considerarse un objetivo clave en el manejo global del paciente con DM2 con sobrepeso u obesidad2.
Dado la etiopatogenia multifactorial de la DM2, las dianas terapéuticas son múltiples. Esto se traduce en un amplio arsenal terapéutico para mejorar no solo el control glucémico del paciente, sino también el resto de los factores de riesgo cardiovascular modificables. Resulta de vital importancia evaluar los nuevos tratamientos en la práctica clínica habitual. Entre los nuevos fármacos para la diabetes, lixisenatida pertenece al grupo denominado análogos del péptido similar al glucagón1 (GLP-1). Los GLP-1 se administran por vía subcutánea, son polipéptidos con una estructura similar al GLP-1 con modificaciones en su estructura que impiden su degradación por la enzima dipeptidil-peptidasa-4 (DPP-4) y, por tanto, presentan mayor durabilidad en la circulación comparado con el GLP-1 nativo3. Actúan produciendo la liberación de insulina pancreática e inhibiendo la de glucagón de manera glucosa-dependiente, y reducen la glucemia de manera eficaz con bajo riesgo de hipoglucemias1,4. Entre sus otros efectos hay que destacar que actúan a nivel periférico a través de reflejos entéricos de la comida, induciendo pérdida de peso al enlentecer el vaciamiento gástrico, y también participan a través de mecanismos de señalización centrales, regulando el apetito y promoviendo la saciedad5. El tratamiento con insulina conlleva a menudo aumento de peso, por lo que los análogos de GLP-1 constituyen una alternativa terapéutica muy atractiva previa a la insulinización del paciente o como tratamiento complementario con menos requerimientos de insulina, limitando el aumento de peso asociado a la insulinoterapia2. Además presentan efectos favorables sobre los factores de riesgo de ECV como la dislipidemia, la hipertensión arterial y la mejora de la función endotelial y la contractilidad cardíaca1,3,4, así como efectos favorables sobre el metabolismo de las lipoproteínas intestinales posprandiales, la modulación de la inflamación mediada por la inmunidad innata y sobre marcadores indirectos de función renal3.
Por todo lo expuesto, el objetivo de nuestro estudio fue evaluar la tolerancia a lixisenatida (Lyxumia® Sanofi Aventis S.A.) y sus efectos sobre el peso y control metabólico (control glucémico, lipídico, tensional…) de pacientes con DM2 y obesidad en la práctica clínica habitual en consultas de atención especializada en Andalucía Oriental (Almería, Granada y Málaga).
Material y métodosEstudio prospectivo con medidas de cambio intrasujeto antes-después de los primeros 104 pacientes con DM2 y obesidad que inician tratamiento con lixisenatida en consultas externas de Endocrinología y Nutrición en Almería, Granada y Málaga durante 2014-2015. Se incluyeron en el estudio al menos los primeros 10 pacientes consecutivos con DM2 y obesidad (IMC≥30) a los que los especialistas en Endocrinología y Nutrición que participaban en el estudio pautaron lixisenatida. El estudio se realizó de conformidad con la Declaración de Helsinki. Los pacientes fueron informados de las características del estudio antes de otorgar su consentimiento informado.
Variables de estudioSe recogieron datos antropométricos (peso, IMC y circunferencia de cintura [CC]), cifras de presión arterial sistólica (PAS) y presión arterial diastólica (PAD) y frecuencia cardíaca (FC), así como variables analíticas (glucosa en ayunas, HbA1c, fracciones lipídicas y cociente microalbúmina/creatinina). Dado que los análogos de GLP-1 presentan efectos favorables sobre la dislipidemia, la hipertensión arterial y las lipoproteínas, y debido a que nuestros pacientes toman con frecuencia antihipertensivos y/o hipolipemiantes, se hace necesario analizar estas variables en los subgrupos de pacientes en los que no se haya iniciado ni intensificado el tratamiento antihipertensivo o hipolipemiante para poder descartar que los cambios a este nivel se debieran a cambios en la medicación. Por ello, se analizaron los subgrupos de pacientes sin y con tratamiento previo sin cambios en dosis con antihipertensivos (24 y 76%, respectivamente) e hipolipemiantes (27,9 y 72,1%, respectivamente). Además, se valoró la aparición de efectos secundarios tales como hipoglucemias (definidas como glucemias capilares menores de 60mg/dl), náuseas y vómitos (considerando la no tolerancia digestiva a aquella sintomatología que obligaba a suspender la medicación y/o persistía de forma moderada-severa más de un mes de tratamiento).
Análisis de laboratorioLa glucosa en plasma (mmol/l) se analizó mediante el sistema bioquímico Modular DPD (Roche Diagnostics, Barcelona, España). La HbA1c (mmol/mol) se midió utilizando método immunoturbidimétrico para sangre anticoagulada completamente hemolizada en autoanalizador Cobas Integra 700 (Roche Diagnostics). El perfil de lípidos incluyendo colesterol total (CT, mmol/l), triglicéridos (TG, mmol/l), colesterol LDL (cLDL, mmol/l) y colesterol HDL (cHDL, mmol/l) se cuantificó por colorimetría enzimática en autoanalizador bioquímico modular DPD (Roche Diagnostics). El cociente microalbúmina/creatinina (mg/l y mg/g) se determinó mediante prueba immunoturbidimétrica en un sistema Cobas Integra 700 (Roche Diagnostics).
Análisis estadísticoEl análisis estadístico descriptivo incluyó media, desviación estándar (DE) y porcentaje para las variables cualitativas. La asociación se calculó mediante el test de Chi cuadrado mostrando el riesgo a través de la OR con un intervalo de confianza (IC) del 95%. Los datos en cada visita se compararon con el test t de Student. El nivel de significación aceptado fue de p<0,05. Los análisis se realizaron con el paquete estadístico SPSS versión 15.
ResultadosEvaluamos 104 pacientes (51% mujeres) con DM2 y obesidad (Almería 18,3%, Granada 40,4%, Málaga 41,3%). La edad media fue de 58,4±10,5años y la duración media de diabetes de 11,2±6,7años. Los pacientes presentaban antecedentes familiares de ECV en un 35,6% y de diabetes en un 69,6%. Respecto al tratamiento hipoglucemiante en la visita basal, el 92,2% estaban en tratamiento con agentes orales, el 13,5% con análogos de GLP-1 y el 67,3% con insulina (basal 44,2%, premezclas 12,5% y basal-bolo 10,6%). El tiempo medio desde la visita basal a la revisión tras inicio de tratamiento con lixisenatida fue de 3,8±1,6meses.
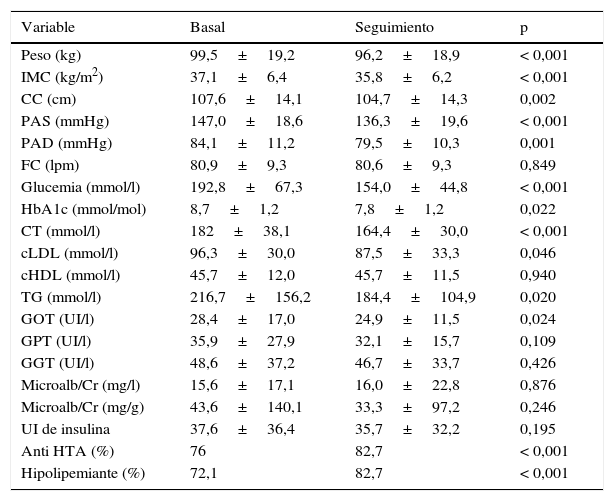
La tabla 1 muestra la evolución de las variables clínico-analíticas antes y durante el tratamiento con lixisenatida en la totalidad de pacientes incluidos en el estudio. Se analizó que la mejoría de las cifras de presión arterial y perfil lipídico no se debiera a la intensificación del tratamiento antihipertensivo o hipolipemiante. Esta mejoría seguía siendo significativa en los subgrupos con antihipertensivos e hipolipemiantes antes y durante el tratamiento con lixisenatida (PAS, p=0,001; PAD, p=0,005; CT, p<0,001, cLDL, p=0,013 y TG, p=0,014) mientras que el subgrupo de pacientes sin tratamiento previo antihipertensivo o hipolipemiante sólo mantuvo significativo el descenso de PAS (p=0,036). No se observó alteración de las cifras de amilasa en relación con el tratamiento (amilasa media 57,8±19,4UI/l). Respecto a la tolerancia digestiva a lixisenatida, el 7,9% no lo toleraron, el 5% toleraron la dosis de 10μg/día y el 85,1% toleraron la dosis de 20μg/día.
Evolución de las variables clínico-analíticas antes y durante el tratamiento con lixisenatida en el total de los pacientes evaluados
| Variable | Basal | Seguimiento | p |
|---|---|---|---|
| Peso (kg) | 99,5±19,2 | 96,2±18,9 | < 0,001 |
| IMC (kg/m2) | 37,1±6,4 | 35,8±6,2 | < 0,001 |
| CC (cm) | 107,6±14,1 | 104,7±14,3 | 0,002 |
| PAS (mmHg) | 147,0±18,6 | 136,3±19,6 | < 0,001 |
| PAD (mmHg) | 84,1±11,2 | 79,5±10,3 | 0,001 |
| FC (lpm) | 80,9±9,3 | 80,6±9,3 | 0,849 |
| Glucemia (mmol/l) | 192,8±67,3 | 154,0±44,8 | < 0,001 |
| HbA1c (mmol/mol) | 8,7±1,2 | 7,8±1,2 | 0,022 |
| CT (mmol/l) | 182±38,1 | 164,4±30,0 | < 0,001 |
| cLDL (mmol/l) | 96,3±30,0 | 87,5±33,3 | 0,046 |
| cHDL (mmol/l) | 45,7±12,0 | 45,7±11,5 | 0,940 |
| TG (mmol/l) | 216,7±156,2 | 184,4±104,9 | 0,020 |
| GOT (UI/l) | 28,4±17,0 | 24,9±11,5 | 0,024 |
| GPT (UI/l) | 35,9±27,9 | 32,1±15,7 | 0,109 |
| GGT (UI/l) | 48,6±37,2 | 46,7±33,7 | 0,426 |
| Microalb/Cr (mg/l) | 15,6±17,1 | 16,0±22,8 | 0,876 |
| Microalb/Cr (mg/g) | 43,6±140,1 | 33,3±97,2 | 0,246 |
| UI de insulina | 37,6±36,4 | 35,7±32,2 | 0,195 |
| Anti HTA (%) | 76 | 82,7 | < 0,001 |
| Hipolipemiante (%) | 72,1 | 82,7 | < 0,001 |
CC: circunferencia de cintura; cHDL: colesterol HDL; cLDL: colesterol LDL; CT: colesterol total; FC: frecuencia cardíaca; GGT: gamma-glutamil transpeptidasa; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico-pirúvica; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal; Microalb/Cr: cociente microalbúmina/creatinina; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos; UI: unidades de insulina.
Los datos están expresados como media±desviación estándar.
La continua investigación en diabetes y su etiopatogenia multifactorial multiplica las posibles dianas terapéuticas dando como resultado un amplio arsenal de fármacos todos ellos orientados a mejorar el control glucémico del paciente ya sea por mecanismos directos o indirectos sobre el metabolismo de los hidratos de carbono. Algunos de ellos asocian mejoras metabólicas y no meramente glucémicas, siendo este el caso de los análogos de GLP-1.
Respecto al control glucémico, nuestro estudio observa mejoría significativa de la glucemia en ayunas y HbA1c en la misma línea que otros autores. Entre los distintos análogos de GLP-1 se han descrito mejorías similares de la glucemia basal, aunque lixisenatida 20μg alcanza mayores reducciones del área bajo la curva respecto a glucemia posprandial (no cuantificada en nuestro estudio) y mayor enlentecimiento de vaciado gástrico que otros análogos de GLP-16. Respecto al descenso de HbA1c, encontramos un descenso significativo en nuestros pacientes. Los análogos de GLP-1 han demostrado no inferioridad respecto a otros agentes hipoglucemiantes7, e incluso mayor y similar reducción de HbA1c en un metaanálisis respecto a agentes orales e insulina basal y bifásica, respectivamente8. Tanto la insulina como los análogos de GLP-1 reducen de forma eficaz y sin diferencias estadísticamente significativas la HbA1c, pero la insulina resulta más eficaz que los análogos de GLP-1 en la reducción de la concentración de la glucosa en ayunas, mientras que los agonistas de GLP-1 son más eficaces en la reducción de la concentración de glucosa posprandial9.
Nuestro estudio pone de manifiesto una reducción significativa de peso e IMC bajo tratamiento con lixisenatida en consonancia con lo descrito por otros autores con una pérdida media de peso de 3,2kg9. Los resultados son similares a los publicados previamente, con reducciones de 1,4 y 4,8kg frente a placebo e insulina, respectivamente7, así como lo encontrado en un metaanálisis con reducciones de 3,3kg frente a controles diabéticos bajo otros tratamientos y de 1,2kg comparado con placebo10.
A pesar de conseguir disminuciones similares de HbA1c, se ha descrito un 35% menos de riesgo de hipoglucemia (p=0,001) con GLP-1 que con insulina9. Meier et al.6 encontraron mayor riesgo de hipoglucemias con lixisenatida frente a liraglutida frente a lo observado por Rosenstock et al.11, con menos hipoglucemias sintomáticas en el grupo de lixisenatida (2,5 vs 7,9%; p<0,05). En línea con este último estudio, nuestros pacientes no presentaron hipoglucemias sintomáticas.
Ampliamente conocidos son los efectos gastrointestinales, más frecuentemente náuseas y vómitos, de los análogos de GLP-1 respecto a otros tratamientos para la diabetes7,9. Se ha descrito un perfil de tolerabilidad más favorable de lixisenatida frente a exenatida 2veces al día (náuseas 24,5% vs 34,5%, respectivamente; p<0,05)11 y liraglutida6. La mayoría de los pacientes de nuestro estudio presentaron buena tolerancia al tratamiento con lixisenatida.
Se observó mejoría del perfil lipídico. La mejora de las cifras de CT, cLDL y TG se mantuvo significativa en el subgrupo que ya tomaba hipolipemiantes antes de iniciar lixisenatida. En consonancia con nuestros resultados, otros autores han descrito mejoría de los lípidos en pacientes tratados con análogos de GLP-11,3,4.
El tratamiento con lixisenatida redujo las cifras de presión arterial tanto sistólica como diastólica en consonancia con lo publicado por otros autores9,10.
No encontramos cambios significativos en la FC. Sin embargo, un metaanálisis concluye que los análogos de GLP-1 incrementan la FC en 1,8 latidos por minuto (lpm) frente a placebo, y en 1,9lpm frente a otros antidiabéticos, siendo más evidente este efecto con liraglutida que con exenatida 2veces al día10. Lixisenatida produce menor elevación6 e incluso descenso de FC12 respecto a liraglutida.
Observamos mejoría de las cifras de transaminasas tras el tratamiento con lixisenatida, siendo significativa para GOT. Una revisión sistemática de ensayos clínicos aleatorizados de lixisenatida (12 versus placebo y 3 versus liraglutida, exenatida y sitagliptina con una duración media de 29semanas) puso de manifiesto que lixisenatida aumentaba la proporción de pacientes que normalizaban las cifras de GPT sin cambios significativos respecto a GOT, fosfatasa alcalina y bilirrubina. El beneficio de lixisenatida sobre GPT se limitaba a pacientes con sobrepeso u obesidad13.
Algunos estudios experimentales y clínicos han expresado su preocupación con respecto a los posibles efectos secundarios cardiovasculares y pancreáticos de los análogos de GLP-1. Los datos hasta la fecha muestran que no existen conclusiones firmes con respecto a estas asociaciones potenciales, si bien sugieren un ligero riesgo de pancreatitis aguda sin mayor riesgo de cáncer de páncreas4,14. Varios ensayos clínicos de resultados cardiovasculares están en marcha para ampliar información sobre los posibles efectos de estas terapias1,4. El estudio ELIXA ha establecido la seguridad de lixisenatida en pacientes con DM2 y un evento reciente de síndrome coronario agudo15.
Nuestro análisis muestra que el tratamiento con lixisenatida mejora de forma significativa los parámetros antropométricos, el control glucémico en términos de glucemia en ayunas y HbA1c, y mejora significativamente las cifras de presión arterial y las fracciones lipídicas. Encontramos buena tolerancia en la mayoría de los pacientes. Además, observamos una significativa intensificación del tratamiento antihipertensivo e hipolipemiante, no solo hipoglucemiante, en nuestra práctica clínica con un abordaje metabólico global de los pacientes.
Nuestro estudio presenta varias limitaciones, como no haber evaluado la glucemia posprandial, la ausencia de grupo control y el corto periodo de seguimiento, que solo ha permitido evaluar variables intermedias tales como los factores de riesgo cardiovascular. Serían necesarios estudios más prolongados en la práctica clínica habitual con grupo control que permitan comparar y evaluar los efectos de lixisenatida en variables finales como mortalidad e incidencia de complicaciones de la diabetes. Además, dado que la gran mayoría de nuestros pacientes perdieron peso, en mayor o menor medida, no podemos descartar que la mejoría del perfil tensional y lipídico se deba a la propia pérdida de peso y no a lixisenatida, precisando de mayores tamaños muestrales para poder analizar los subgrupos de pacientes.
Actualmente los análogos de GLP-1 son ampliamente utilizados dado su eficacia antidiabética, bajo riesgo de hipoglucemia y relativos pocos efectos secundarios, así como por ofrecer potenciales beneficios adicionales como pérdida de peso, efectos positivos sobre la presión arterial, los niveles de lípidos, y cardio y neuroprotección4,16. Además, se han descrito beneficios en años-calidad de vida y reducción de los costes de salud17. Sin embargo, se requieren estudios más duraderos y de amplios tamaños muestrales para evaluar la eficacia y la seguridad a largo plazo de las terapias con análogos de GLP-1.
- 1.
Amplio arsenal de nuevos fármacos orientados a mejorar el control glucémico del paciente.
- 2.
Asocian mejoras metabólicas y no meramente glucémicas, entre ellos los análogos de GLP-1.
- 3.
Necesidad de evaluar la tolerancia y resultados de estos fármacos en la práctica clínica habitual.
- 1.
Lixisenatida mejora significativamente los parámetros antropométricos y el control glucémico.
- 2.
Lixisenatida consigue descenso significativo de la presión arterial y del perfil lipídico.
- 3.
Seguridad del tratamiento y buena tolerancia en la mayoría de los pacientes.
Los autores declaran que no existen conflictos de intereses.
A Daniel Cepero-García, Elena Ferrándiz-Millón y Mercedes Vázquez-Gutiérrez, de la UGC de Endocrinología y Nutrición, Hospital de Torrecárdenas, Almería; a Rosa Orduña-Espinosa, de la UGC de Endocrinología y Nutrición, Hospital San Cecilio, Granada; a Joaquín Pechuán-Asensio, Consulta privada de Endocrinología, Granada, y a Purificación Galera-Martínez, de la UGC de Endocrinología y Nutrición, Hospital Virgen de las Nieves, Granada, por su valiosa contribución a este trabajo.
A los pacientes que han participado en este estudio.
Este trabajo ha sido financiado, en parte, con ayudas del Instituto de Salud Carlos III (PI15/01114) y de la Consejería de Innovación, Ciencia y Empresa de la Junta de Andalucía (PI11-CTS-8181). Este estudio ha sido cofinanciado con fondos FEDER.