Nuevas vacunas frente a patógenos específicos
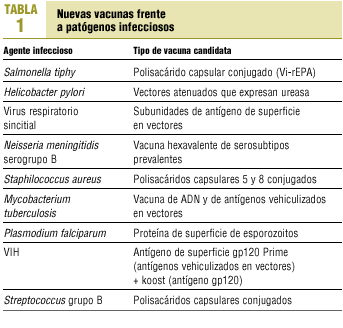
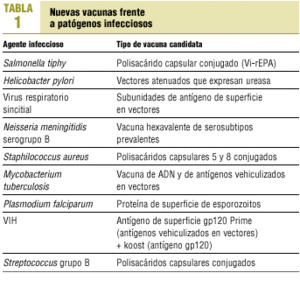
Debido a las limitaciones de las vacunas antitifoideas existentes (parenteral inactivada de célula entera, oral atenuada y parenteral Vi polisacárida) en cuanto a edad de utilización, necesidad de recuerdos y moderada efectividad clínica, no se ha podido instaurar un programa de control de la fiebre tifoidea basado en la vacunación sistemática de la población. Por otra parte, es bastante improbable que en países no desarrollados mejoren a corto plazo las condiciones higiénicas de la aguas de bebida y de los comestibles. Por ello, es posible que en los próximos años se disponga de una vacuna antitifoidea (Vi-rEPA) en la que el polisacárido capsular Vi, factor esencial de virulencia, sea conjugado covalentemente con una proteína recombinante atóxica antigénicamente idéntica a la exotoxina A de Pseudomona aeruginosa (rEPA). Hasta ahora se han publicado los resultados de un ensayo clínico en niños mayores de 2 años, con una efectividad clínica superior al 90%1.
Se acepta universalmente el papel de Helicobacter pylori en la génesis de la úlcera péptica, del linfoma de la mucosa gástrica asociado al tejido linfoide y del adenocarcioma gástrico. El tratamiento convencional de la infección por H. pylori se acompaña de una baja aceptación por parte del paciente, y se está detectando la aparición de cepas resistentes a los antibióticos. Ya se han publicado ensayos clínicos en humanos, en pequeña escala, utilizando como vector atenuado Salmonella typhi o Salmonella typhimurium que expresan la ureasa de Helicobacter2,3, por lo que es probable que, una vez resueltos aspectos de la inmunidad esterilizante, de los adyuvantes y de las gastritis postinmunización4, se pueda disponer de una vacuna para utilizar a gran escala.
Las estrategias de vacunación frente a los patógenos respiratorios infantiles más frecuentes, virus respiratorio sincitial y parainfluenza, tuvieron unos comienzos desastrosos cuando, hace más de 4 décadas, una vacuna inactivada con formalina, frente al primer virus comentado, originó una enfermedad respiratoria grave e incluso muertes en los receptores5. La ausencia de una inmunidad duradera tras la infección natural y la complejidad de la respuesta inmune son obstáculos importantes en el desarrollo de una inmunización efectiva. La estrategia más viable para el virus respiratorio sincitial pasa por la vacunación de individuos con mayor riesgo, más para prevenir la enfermedad grave que para la infección. Los preparados que se encuentran en fases iniciales de desarrollo son: una vacuna atenuada intranasal y otra de subunidades con antígenos proteicos de superficie F y FG vehiculizados por vectores recombinantes o plásmidos, que podría administrarse a embarazadas para proteger al recién nacido al aumentar los anticuerpos específicos humorales y de la leche materna. Frente al virus parainfluenza tipo 3, son esperanzadores los ensayos con una vacuna adaptada al frío6.
En los próximos años es más que probable que se disponga de una vacuna dirigida frente a Neisseria meningitidis del serogrupo B. Los ensayos actualmente en marcha incluyen un preparado hexavalente de proteínas externas de membrana, que consta de 6 porinas de clase 1 (serosubtipos) prevalentes en una comunidad, desarrollado por el National Institute of Public Health and Environment de Holanda (RIVM), que ha demostrado capacidad de provocar respuestas bactericidas séricas en lactantes7 y escolares8, con generación de memoria inmunológica9. La segunda estrategia se conoce con el nombre de «vacunología inversa» y se basa en la secuenciación del genoma de Neisseria para localizar genes cuya expresión proteica sea capaz de desencadenar una respuesta bactericida10.
Recientemente se han presentado los resultados preliminares de la fase III de ensayo clínico en humanos11 de una vacuna conjugada frente a los polisacáridos 5 y 8 de Staphilococcus aureus12. La reducción de las tasas de infecciones hospitalarias en población de alto riesgo, durante 10 meses de seguimiento, ha alcanzado un 57%.
Las perspectivas actuales para disponer a corto plazo de vacunas frente a un virus (inmunodeficiencia humana), a una bacteria (Mycobacterium tuberculosis) y a un parásito (Plasmodium falciparum), los cuales provocan juntos la muerte de más de 5.000.000 de personas anualmente en el mundo13, no son tan halagüeñas. Frente a la tuberculosis, las vacunas potenciales candidatas, ensayadas en animales, son las de subunidades que incluyen proteínas, lípidos e hidratos de carbono en cantidades variables, las de ADN que transportan genes que codifican antígenos protectores del tipo de 65 kd14, las que vehiculizan antígenos en vectores y las cepas genéticamente atenuadas de M. tuberculosis.
La dificultad para disponer de una vacuna frente a la malaria es aún mayor. P. falciparum dispone de 6.000 genes aproximadamente y expresa proteínas específicas distintas para cada una de las fases de su ciclo vital. Teóricamente se podría trabajar en dos tipos de vacuna, una para los viajeros susceptibles que previniera la infección de los hematíes, y una segunda, para los niños del África subsahariana, que limitaría la replicación en la fase eritrocítica sin prevenir la infección15. Actualmente se trabaja para crear una vacuna antipalúdica multiantigénica y multifásica, de la que existen tres aproximaciones. Una de ellas incluye la proteína de superficie de los esporozoitos16, RTS,S, que se está ensayando en niños de Gambia. Otra utiliza una vacuna de ADN para producir una respuesta primaria y otra vacuna de proteínas o virus recombinantes para inducir una respuesta secundaria (prime-boost)17, y una tercera se basa en la secuenciación genómica de P. falciparum, que se completará para el año 200318.
Desde 1987, cuando se inició la fase I de la primera vacuna candidata frente al virus de la inmunodeficiencia humana (VIH), se han llevado a cabo más de 60 ensayos en fases I y II con 30 vacunas distintas19. Las estrategias más prometedoras se basan en la inserción de genes patógenos en vectores del tipo de adenovirus, de enterobacterias o del bacilo Calmette-Guérin, en la utilización de plásmidos de ADN que incluyen genes que codifican una proteína antigénica y en la técnica prime-boost mediante la que se consiguen, con dos vacunas distintas, respuestas de linfocitos T citotóxicos y de síntesis de anticuerpos18. En la actualidad solamente una vacuna preventiva, constituida por el antígeno de superficie gp120, ha entrado en la fase III de evaluación de la eficacia, estando previsto un análisis provisional de resultados para noviembre de este año, y el definitivo para un año más tarde. El precio estimado por dosis se situará alrededor de los 20-30 dólares estadounidenses. Para el año 2002, se iniciará la fase III de una vacuna, en sujetos tailandeses y americanos VIH negativos, que utilizará en primer lugar el canarypox recombinante (ALVAC-HIV) como vector de gp120, Gag y proteasa del VIH (prime), y posteriormente el gp120 (rGP120 B/E) como booster, de la que se esperan resultados para el año 200620. Debido a las dificultades encontradas hasta ahora en el desarrollo de una vacuna efectiva (replicación viral persistente a pesar de buenas respuestas humorales y celulares, mutaciones virales rápidas, escasa concentración de anticuerpos en mucosas, capacidad de inserción de los retrovirus en el ADN del huesped, entre otras)21, deberá tenerse en cuenta que es poco probable que se pueda disponer de una vacuna preventiva eficaz para los próximos años, y que a lo largo del camino será frecuente escuchar frases como la pronunciada por Ronald Kennedy: «Mi laboratorio ha cosechado grandes éxitos en identificar una vacuna que no funciona»22.
Las vacunas candidatas frente a patógenos infecciosos con mayores posibilidades de comercialización a corto-medio plazo se detallan en la tabla 1.
Vacunas preventivas y terapéuticas frente a enfermedades no infecciosas
Son múltiples los ensayos clínicos realizados, en animales o en humanos, de terapia génica frente al cáncer que utilizan plásmidos o vectores virales que incluyen genes junto a citocinas, que van dirigidos a moléculas angiogénicas o a antígenos tumorales específicos que desencadenan una amplia gama de respuestas inmunes intratumorales. Se encuentran en fase avanzada, entre otras, vacunas terapéuticas de vectores virales recombinantes frente al cáncer colorrectal y melanoma23, vacunas de células autólogas de cáncer prostático o pancreático irradiadas y manipuladas genéticamente para segregar factor estimulador de colonias de granulocitos y macrófagos24,25, y vacunas frente al linfoma folicular que emplean inmunoglobulinas sintetizadas por células B clonales cancerosas y el adyuvante GM-CSF26. Incluso frente a esta última patología, muy recientemente, se ha ensayado, por su poder citorreductor, la vacuna atenuada antisarampionosa inyectada intratumoralmente27.
Una vacuna conjugada dirigida al tratamiento y prevención del tabaquismo, que utiliza nicotina unida a un transportador proteico para generar anticuerpos frente a las formas nativas de nicotina formando grandes complejos inmunes que impiden el paso de la nicotina a la barrera hematoencefálica, ya ha obtenido la patente en EE.UU; y se encuentran próximos los ensayos en humanos28.
Las enfermedades metabólicas y degenerativas también son objeto de atención. Están en marcha ensayos frente a la diabetes tipo 2 utilizando técnicas que impidan la autoagregación del polipéptido de amiloide de los islotes (hIAPP) y, por tanto, la formación de los depósitos en los islotes pancreáticos29; frente a la enfermedad de Alzheimer, inmunizando con anticuerpos frente a los péptidos Aß, con lo que se impide el depósito de amiloide en el sistema nervioso30,31, y frente a la epilepsia mediante un adenovirus administrado oralmente que incluye ADN que codifica un gen que bloquea el receptor cerebral NMDA protegiendo las neuronas de estímulos convulsivos32. Por último, no tardará en poder controlarse la caries dental mediante una vacuna intranasal que induce formación de IgA salival y evita la colonización bucal por Streptococcus mutans33.
Estrategias en vacunología para un futuro próximo
Al margen de todos los nuevos preparados ya comentados, que pueden ver la luz en un futuro más o menos próximo, es preciso profundizar en nuevas técnicas que aumenten la aceptabilidad de los programas de vacunación. Básicamente, esto se puede conseguir disminuyendo las visitas a los puntos de vacunación, bien porque dispongamos de vacunas combinadas, bien porque para conseguir una buena protección precisaríamos de menos inoculaciones.
Se están ensayando nuevas combinaciones vacunales para todas las edades de la vida y frente a patógenos respiratorios, sexuales, digestivos y meníngeos, vacunas más estables que no precisen «cadena del frío», nuevos adyuvantes que al aumentar la potencia de los inmunógenos van a ser útiles para los sujetos que no responden a vacunas convencionales y al mismo tiempo pueden reducir el número de inyecciones, y también se trabaja en encapsular antígenos en bioesferas biodegradables que permiten una liberación lenta del inmunógeno y, por tanto, brindan la posibilidad de administrar una dosis única34,35.
Por último, debido a la necesidad de inmunizar en edades tempranas de la vida frente a algunos patógenos especialmente prevalentes y graves en la etapa neonatal (Streptococcus grupo B) y en los primeros meses de la vida (Haemophilus influenzae tipo b, N. meningitidis y Streptococcus pneumoniae), cobra un interés inusitado la vacunación de la gestante en el último trimestre del embarazo36,37 y la inmunización temprana del recién nacido38,39.
Conclusiones
Por todo lo expuesto, no cabe la menor duda de que la vacunología es una de las ramas de la medicina con un futuro más prometedor, tanto por la prevención de enfermedades infecciosas de alta morbimortalidad como por la reducción de patologías degenerativas y metabólicas. No obstante, queda mucho camino por recorrer, fundamentalmente haciendo llegar vacunas «de primera generación» a aquellos países y zonas en los que enfermedades prácticamente olvidadas en nuestro medio siguen cobrándose muchas vidas humanas, y profundizando en temas derivados de la seguridad vacunal y de la comunicación de los riesgos con ella asociados, aspecto este que bien podría comprometer el esperanzador futuro de la vacunología del siglo xxi.
Correspondencia: J.A. Navarro Alonso. Dirección General de Salud Pública. Consejería de Sanidad y Consumo. C/ Ronda de Levante, 11. 30008 Murcia. Correo electrónico: josea.navarro2@carm.es