Introducción
El dolor es el síntoma más temido de los enfermos de cáncer. Se manifiesta en un 30% de ellos en el momento del diagnóstico y en el 70-80% en las fases finales de la enfermedad1-4. Debe esperarse la presentación del dolor independientemente del tipo de cáncer.
El tratamiento farmacológico, combinado con medidas físicas y psicosociales, puede controlar el dolor hasta en un 95% de los casos; en el 5% restante debe recurrirse a técnicas invasivas3,4. El tratamiento se basa en el uso de analgésicos administrados por vía oral, lo que permite que el abordaje del dolor pueda realizarse en el primer nivel de salud5,6. Sin embargo, numerosos informes publicados demuestran que el dolor oncológico no recibe el tratamiento adecuado, señalándose como posibles causas las derivadas de los profesionales (actitud, motivación y formación escasa en la terapéutica del dolor y en cuidados paliativos), las relacionadas con los pacientes y sus familias (miedo a la adicción a los opiáceos e incumplimiento terapéutico) y las debidas al sistema de salud (problemas para la dispensación de opioides y políticas sanitarias inadecuadas para el uso de éstos)3,4,7-10. De todas ellas, las relacionadas con los profesionales son las más importantes3,7-10.
En el presente artículo se abordará el concepto de dolor, los síndromes dolorosos de origen oncológico y la líneas generales del tratamiento. En el siguiente artículo de la serie se hablará del uso de los opioides en el tratamiento del dolor oncológico.
Concepto de dolor
La Asociación Internacional para el Estudio del Dolor lo define como «una experiencia sensorial y emocional desagradable, asociada a una lesión presente o potencial de los tejidos, y expresada en dichos términos». Es, por tanto, una experiencia subjetiva; su vivencia y expresión dependen de las características de la persona que lo experimenta1,2,4,10-12.
Para poder aplicar un tratamiento adecuado, deberían identificarse los componentes físicos y los no físicos que influyen en el sufrimiento general del enfermo y exacerban el dolor. En este sentido es útil tener presente el concepto de «dolor total» que acontece en los pacientes afectados por enfermedades en fase terminal, y que engloba el estímulo físico con los factores psicológicos, sociales y espirituales de las personas afectadas1,2,4,9,10-12.
Síndromes dolorosos
En relación al mecanismo de producción y el órgano afectado se diferencian 3 síndromes dolorosos1,3,11-14:
1. Dolor somático producido por la afectación de órganos densos como huesos, músculos y tejido celular subcutáneo. El dolor somático se caracteriza por estar localizado en la zona afectada, por incrementarse con la presión de dicha área y por ser continuo (aunque pueden presentarse exacerbaciones temporales en su intensidad). Como ejemplo, puede presentarse el dolor producido por una metástasis ósea. El dolor somático responde adecuadamente a los analgésicos no opiáceos y opiáceos. La instauración de uno u otro analgésico dependerá de la intensidad del dolor.
2. Dolor visceral derivado de la afectación de las vísceras huecas. El dolor visceral se expresa como dolor continuo o cólico, referido a una zona cutánea amplia (por la cuantiosa y variada inervación de las vísceras), y la presión sobre la zona referida como dolorosa puede desencadenar o no dolor. Responde adecuadamente a AINE, opiáceos y fármacos espasmolíticos como el butiil-bromuro de hioscina cuando hay un componente cólico.
3. Dolor neuropático provocado por la afectación del sistema nervioso. Puede expresarse como la presencia de parestesias continuas, episodios de dolor lancinante, o como ambos. Puede ser espontáneo o evocado por estímulos y afecta a los territorios nerviosos lesionados. El dolor neuropático no responde bien a los opiáceos y es preciso utilizar fármacos coanalgésicos, según se describe más adelante.
Por último debe considerarse la presencia o no del dolor esporádico, irruptivo o episódico11,13,14. Éste se caracteriza por episodios de dolor intenso, de inicio rápido y duración variable, en pacientes cuyo dolor basal está adecuadamente controlado con analgésicos. Cuando el dolor está relacionado con el movimiento, recibe el nombre de dolor incidental. El dolor esporádico afecta aproximadamente a la mitad de los enfermos con dolor oncológico. Su tratamiento se basa en el incremento de las dosis basales de analgésicos cuando los episodios de dolor son numerosos (>= tres) y en el uso de dosis extras (denominadas dosis de rescate) de analgésicos de acción rápida y vida media corta en los episodios dolorosos.
Debería tenerse presente que, además de los síndromes dolorosos provocados por el cáncer en su evolución, el paciente puede presentar dolor de origen no oncológico que también precisa ser tratado.
Tratamiento del dolor oncológico crónico: aspectos generales
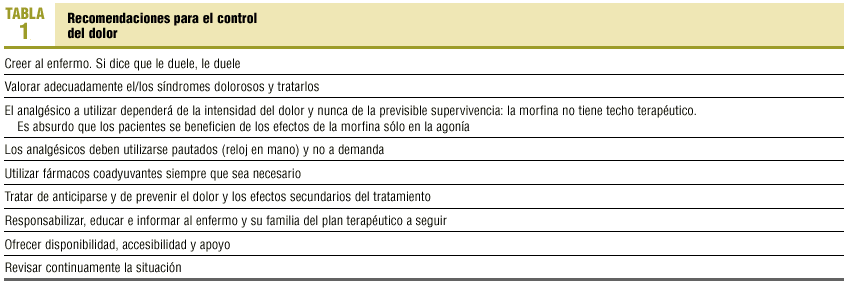
Se basa en el uso de los analgésicos en relación a su eficacia para el control del dolor. Los de mayor eficacia para el control del dolor somático y visceral son los opiáceos mayores. Éstos carecen de techo analgésico, por lo que siempre que se incremente la dosis se obtendrá efecto analgésico. El resto de los analgésicos presenta el fenómeno de techo farmacológico: una vez administrada la dosis máxima, el incremento de la dosis no aumenta el efecto15,16. En la tabla 1 se describen las recomendaciones básicas para el control del dolor en los pacientes con cáncer en fase terminal1-4,16.
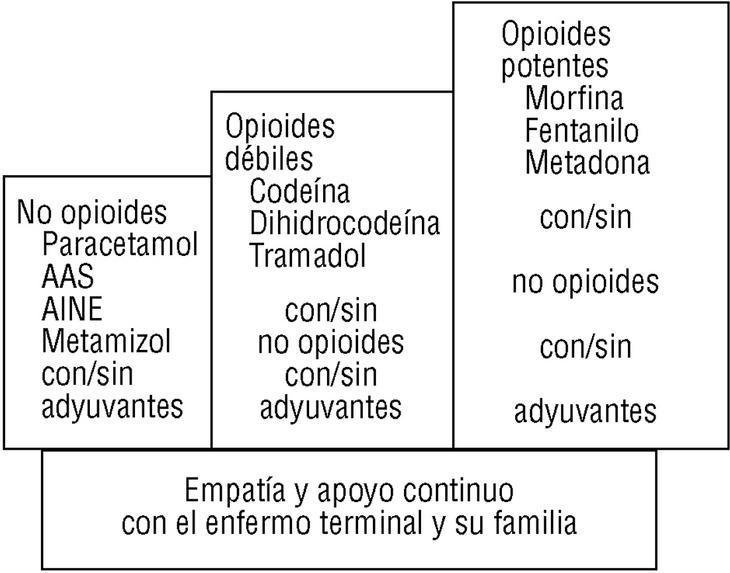
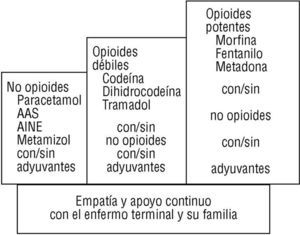
La utilización de la escalera analgésica de la OMS10,14,16 es la base del tratamiento analgésico (fig. 1). Respecto a la misma, debe entenderse que:
Figura 1
1. Debe perseguirse siempre la ausencia completa del dolor.
2. La utilización de un escalón terapéutico determinado obedece a la ineficacia de los fármacos previos en el alivio completo del dolor.
3. La no respuesta continuada del dolor a los analgésicos debe plantear la necesidad de utilizar coanalgésicos por la presencia de un dolor neuropático. En la aplicación de
la escalera analgésica de la OMS se utilizan fármacos con actividad analgésica per se (analgésicos de primer, segundo y tercer escalón) y los coanalgésicos que sin actividad analgésica general producen analgesia en determinados síndromes dolorosos, comp en el dolor neuropático3,4,10,15-17.
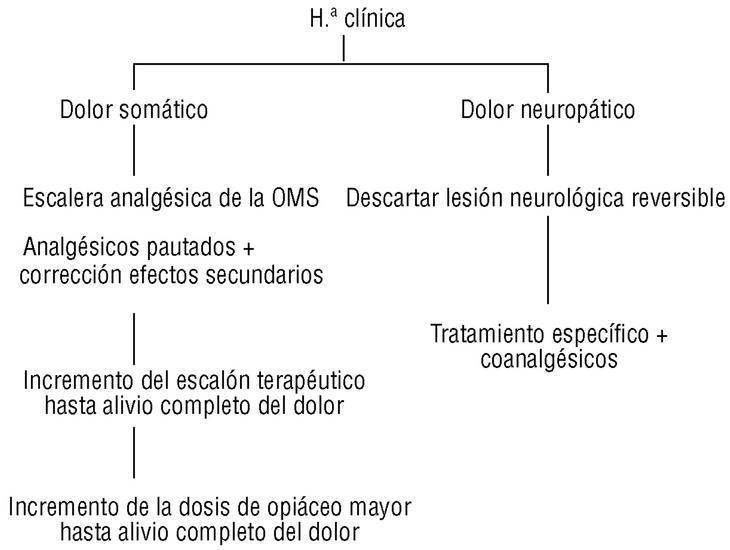
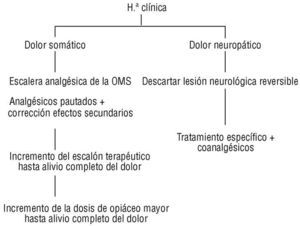
4. Los analgésicos deben utilizarse pautados y de forma continuada para conseguir una situación basal de no dolor. El uso «a demanda» de los analgésicos sólo favorece la presencia de un dolor no controlado y un incremento de la toxicidad por consumo excesivo. En la figura 2 se describe el esquema general del diagnóstico y tratamiento del dolor, y en la tabla 2 los criterios de derivación a unidades especializadas.
Figura 2
Uso de los AINE en el control del dolor oncológico crónico
Corresponde al primer escalón de la escalera analgésica de la OMS. Son eficaces en el control de dolores leves1,3,10,16,18. Los AINE pueden asociarse a los opiáceos para obtener un efecto analgésico aditivo. Están especialmente indicados, solos o combinados con los opiáceos, en el tratamiento del dolor por metástasis óseas, afección hepática, tenesmo vesical y rectal.
No se dispone de estudios que muestren que un AINE es más efectivo que otro en el control del dolor oncológico (incluyendo dentro del grupo a metamizol y paracetamol en dosis elevadas para el control del dolor, 1-2 g/6-8 h en el caso del metamizol y 1g/68 h en el caso del paracetamol). La elección de un AINE en lugar de otro debería basarse en la comodidad de su posología, menor efecto gastrolesivo y su coste. Salvo por la presencia de indicaciones específicas en relación a la existencia de un elevado riesgo de úlcera gastroduodenal, el uso de los AINE inhibidores de la COX-2 no tendría por qué desplazar el uso de los otros AINE más económicos e igualmente efectivos en el tratamiento del dolor. No existen estudios publicados sobre la eficacia de los AINE inhibidores de la COX-2 en el control del dolor oncológico.
El tratamiento con AINE debe iniciarse con dosis bajas, incrementando la dosis hasta el máximo, si fuera preciso. La ausencia de respuesta a las dosis máximas es indicativo de la necesidad de utilizar analgésicos del segundo escalón.
La necesidad o no de realizar protección gastroduodenal por el uso de AINE dependerá de las condiciones del paciente. Para realizar ésta se seguirán los criterios utilizados en la población general.
Uso de los coanalgésicos: tratamiento del dolor neuropático1-4,16,17
Ante un dolor neuropático debería plantearse la remisión del paciente a una unidad especializada para descartar una lesión reversible del sistema nervioso (compresiones tumorales de médula, plexos nerviosos o nervios periféricos). Una vez aplicado el tratamiento específico, o cuando su aplicación no es posible, se administrará un coanalgésico.
La amitriptilina está especialmente indicada en dosis de 50-75 mg/día (incrementos de 25 mg cada 48-72 h) en los dolores neuropáticos que se expresan como parestesias continuas, y como fármaco de segunda línea en los dolores lancinantes. La carbamacepina, en dosis de 900-2.400 mg/día, se utiliza para el control del dolor lancinante. Dada la elevada incidencia de efectos adversos que presenta, está siendo desplazada por la gabapentina, que se dosifica incrementando 300-400 mg/24-48 h hasta 900, 1.200, 2.400 o 3.600 mg/día, según respuesta.
En el tratamiento del dolor neuropático es preciso esperar, una vez conseguida la dosis eficaz del fármaco, al menos 7 días para evaluar su efecto. La no respuesta a uno de los fármacos expuestos debe considerarse como un criterio para la remisión del paciente a una unidad especializada. Si ello no fuera posible, debería intentarse en el primer nivel de salud conseguir una situación de analgesia cambiando de un coanalgésico a otro o asociando 2 conalgésicos.
Otras alternativas para el control del dolor neuropático disponibles en unidades especializadas son: lidocaína, mexiletina, baclofén, topiramato, lamotrigina, ketamina y técnicas invasivas de bloqueo nervioso o administración espinal de fármacos.
Los corticoides también presentan actividad analgésica en el dolor neuropático (por reducción de la compresión originada por la masa tumoral) y otros dolores como el óseo, por infiltración hepática, el tenesmo rectal, la afección muscular o las cefaleas por hipertensión intracraneal. En estos casos se utilizan dosis variables sin que esté adecuadamente definida la dosis eficaz. El tratamiento puede iniciarse con 8-12 mg/día de dexametasona incrementando o reduciendo la dosis hasta encontrar la mínima eficaz.
El dolor por tenesmo rectal o vesical puede responder a AINE, los corticoides o los clorpromacina (50-100 mg/día).
Consideraciones sobre el tratamiento del dolor óseo
Si bien el dolor óseo responde adecuadamente a AINE, opiáceos, o su asociación, puede haber pacientes con dolores resistentes o difíciles de controlar a causa de ser incidentales severos. Las conductas terapéuticas actuales basadas en la irradiación paliativa, el uso de bifosfonatos potentes como el pamidronato y el tratamiento quirúrgico de las metástasis óseas (especialmente en las fracturas patológicas) hacen recomendable que los pacientes afectados por dolor moderado-severo secundario a metástasis óseas sean valorados por unidades especializadas si sus expectativas vitales lo permiten. En aquellos casos en los que el dolor sea muy leve, no se disponga de unidades de paliativos o de dolor de referencia, la situación funcional no recomiende el traslado del paciente o las expectativas vitales son muy cortas, está indicado instaurar en el primer nivel de salud sean un tratamiento combinado de AINE y dosis crecientes de opiáceos hasta el control completo del dolor.
Correspondencia: Miguel Ángel Benítez del Rosario. Apdo de Correos 10.521. 38080 Santa Cruz de Tenerife.Correo electrónico: mabenitez@comtf.es Escalera analgésica de la OMS, modificada por los autores.