La dextrocardia es una malposición en la cual el eje mayor del corazón está hacia la derecha y en dirección caudal, en este caso en situs solitus por encontrarse la aurícula izquierda al lado izquierdo del corazón así como la aurícula derecha en el lado derecho y las vísceras abdominales en concordancia1. La incidencia de malformaciones cardiacas adicionales a situs solitus en dextrocardia es del 90%, incluyendo drenaje anómalo de venas pulmonares, tetralogía de Fallot, defectos septales, estenosis pulmonar, coartación aórtica (CoAo) y transposición corregida de grandes vasos1.
Reportamos un caso de CoAo y enfermedad arterial coronaria (EAC) en una paciente femenina con situs solitus en dextrocardia. La importancia de este artículo radica en la demostración de las herramientas semiológicas y de estudios complementarios para el diagnóstico de tan compleja asociación.
Caso clínicoMujer de 43años de edad que fue admitida en nuestro Instituto por presentar dolor subesternal opresivo con intensidad 6/10 de la escala visual análoga desencadenado por esfuerzos físicos con duración aproximada de 10min, transfictivo hacia la espalda acompañado de diaforesis, náuseas y mareo que mejora con reposo desde hace 6meses. De manera incidental en la niñez se encontró dextrocardia e hipertensión arterial sistémica (HAS) diagnosticada a los 16años; toma losartán 100mg e hidroclorotiazida 12.5mg cada 24h, e informa mal control de la presión arterial. Niega consumo de cigarrillos, drogas ilícitas y antecedentes familiares de enfermedad cardiaca.
En su exploración física se documentó una presión arterial en miembros superiores con 180/90mmHg, y en extremidades inferiores 100/60mmHg, resto de signos vitales dentro de la normalidad. El índice de masa corporal fue de 25kg/m2. El examen del cuello no reveló ingurgitación yugular, con pulsos carotídeos normales sin soplos. Los campos pulmonares bien ventilados, soplo sistólico gradoi en la región interescapular y soplo continuo que se extiende en toda la pared torácica. El ápex cardiaco se palpó en el quinto espacio intercostal línea medio clavicular derecha, con ruidos cardiacos normales, desdoblamiento fisiológico del segundo ruido, sin soplos, frote o galopes. No se palpa hepatomegalia ni ascitis. Disminución de pulsos en extremidades inferiores. No se observó cianosis ni edema.
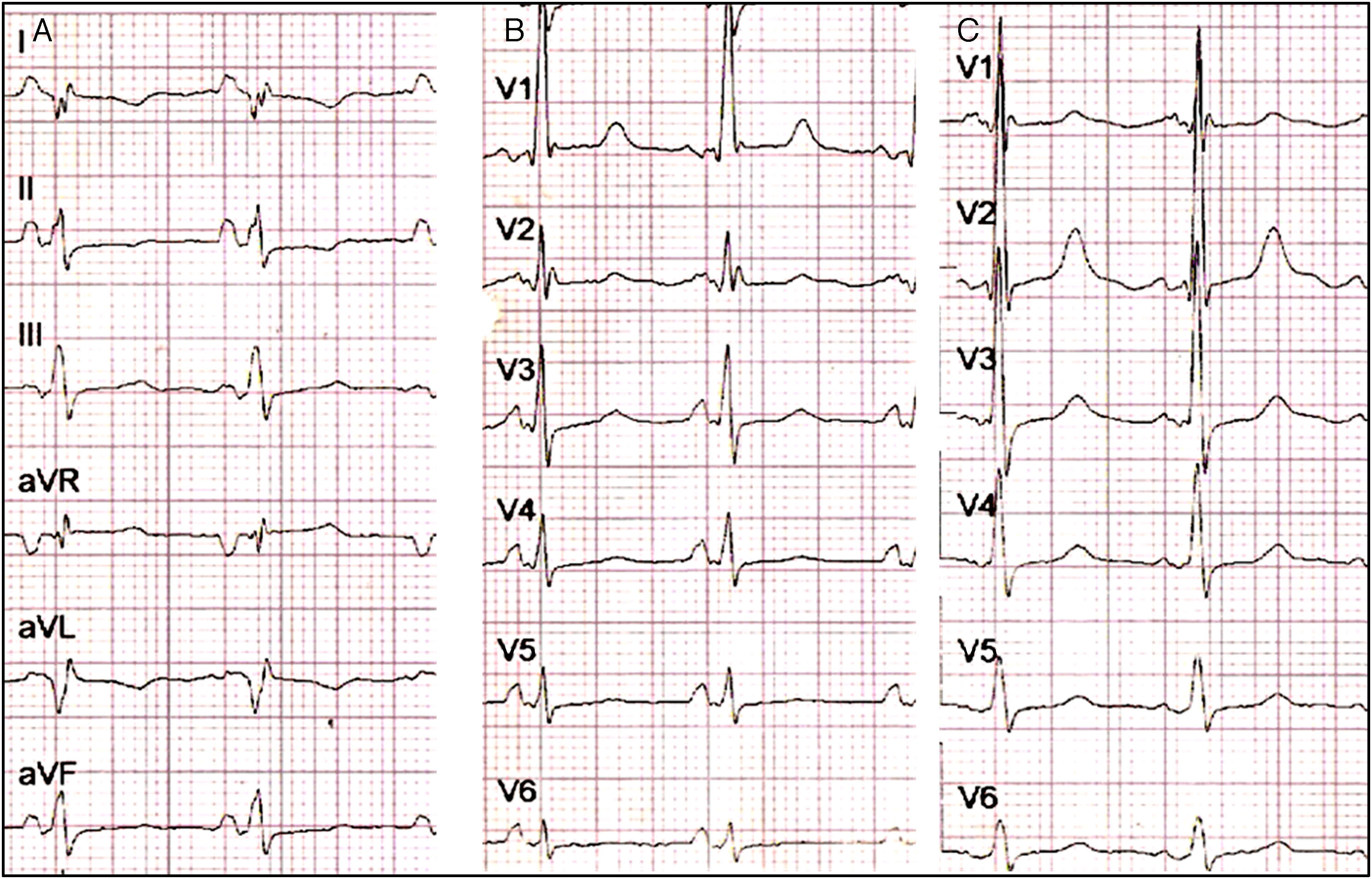
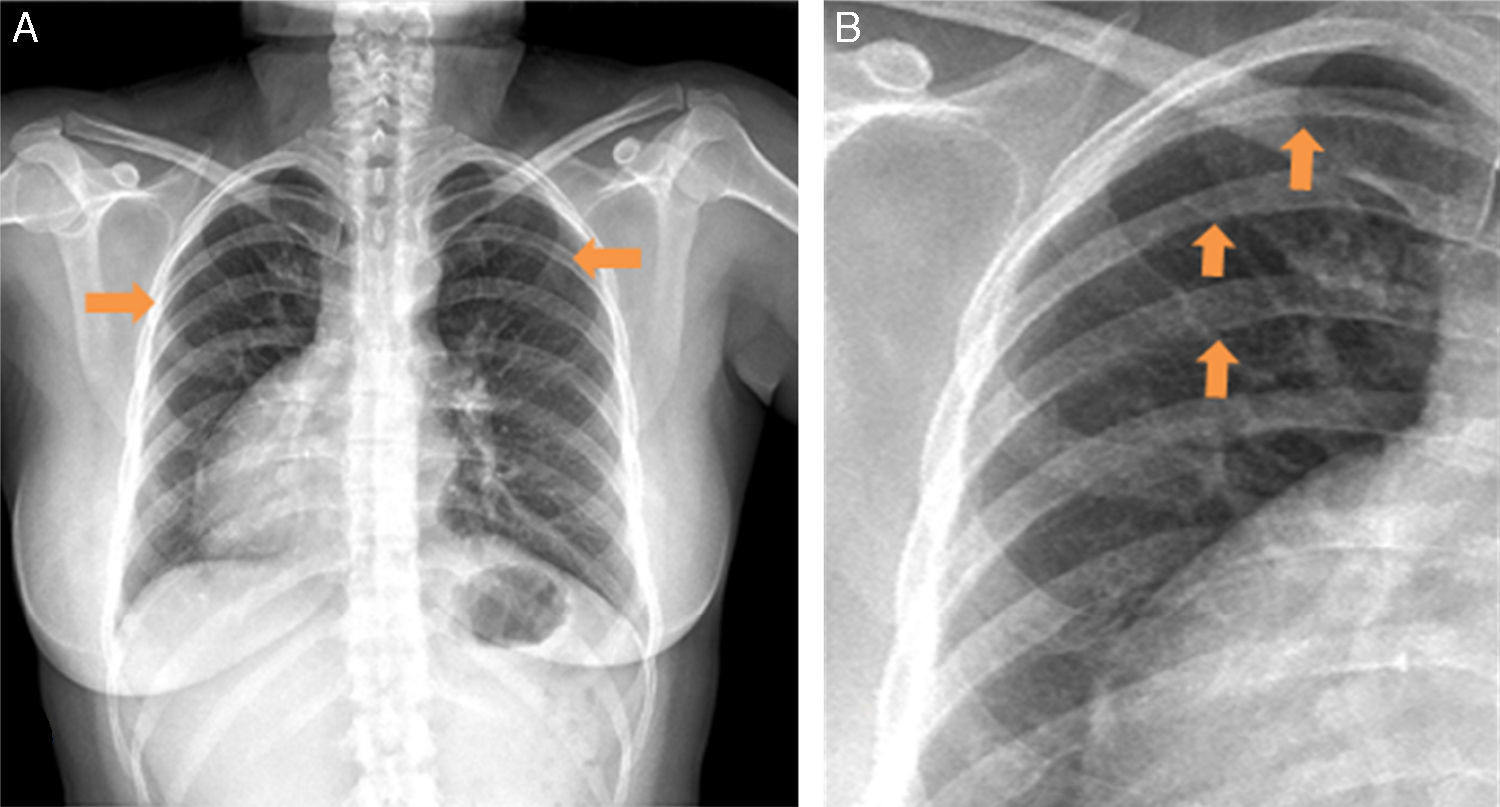
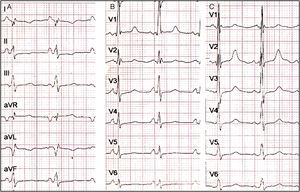
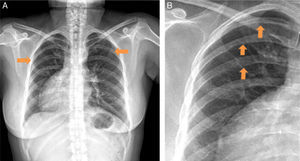
El electrocardiograma (ECG) estándar mostró ritmo sinusal con ondas p positivas y negativas en DI y aVR, respectivamente (fig. 1). Ondas R altas se observaron en V1 y V2, ondas T negativas en DI, DII, aVL, onda T aplanada en aVF, de V4 a V6. Disminución en el voltaje de la onda R de V1 a V6 sugirió que el corazón estaba al lado derecho del tórax. En el ECG del lado derecho, V1D-V6D mostraron mayores voltajes de onda R. La radiografía de tórax posteroanterior (PA) confirmó dextrocardia, signo de Roesler en la tercera, cuarta y quinta costillas de forma bilateral (fig. 2). Los campos pulmonares sin lesiones. La burbuja gástrica estaba hacia la izquierda.
A)El ECG estándar muestra situs solitus en dextrocardia, ritmo sinusal, ondas P positivas en DI y negativas en aVR, ondas T negativas en DI, DII, aVL, onda T aplanada en aVF. B)Precordiales izquierdas: muestra disminución en el voltaje de la onda R de V1 a V6, ondas R altas en V1, ondas T aplanadas de V4 a V6. C)Precordiales derechas: muestra ondas R altas de V1 a V3; sugiere hipertrofia del ventrículo izquierdo.
Radiografía de tórax en PA. A)Paciente con dextroápex: la burbuja gástrica a la izquierda y la sombra hepática derecha. B)Se identifican muescas costales inferiores debido a la tortuosidad de las arterias intercostales (punta de flechas), conocido como signo de Roesler, en la tercera, cuarta y quinta costillas.
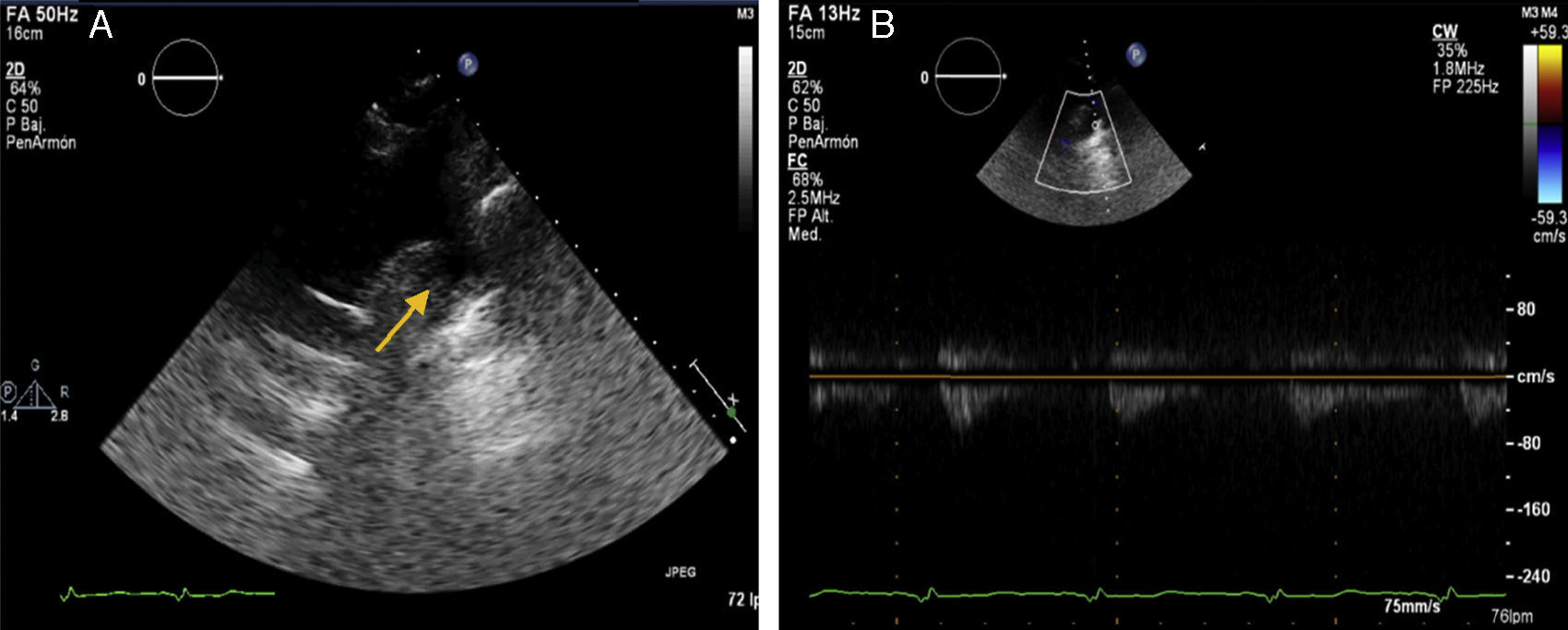
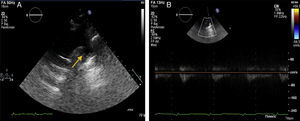
Sus paraclínicos, como biometría hemática, función renal, electrolitos, función tiroidea, glucosa y perfil lipídico, con rangos dentro de la normalidad. El ecocardiograma transtorácico del lado derecho del pecho (fig. 3) documentó situs solitus en dextrocardia, conexión auriculoventricular y ventrículo arterial concordante, aurícula izquierda dilatada, hipertrofia concéntrica del ventrículo izquierdo, fracción de acortamiento del ventrículo derecho 45%, TAPSE 19mm, fracción de expulsión del ventrículo izquierdo de 55% sin reportarse alteraciones en la contractilidad segmentaria, disfunción diastólica con patrón pseudonormalizado con incremento en las presiones de llenado, el eco Doppler color no mostró enfermedad valvular, válvula aórtica trivalva, presión sistólica de la arteria pulmonar 30mmHg, no se observó istmo, la velocidad máxima (Vmax) en el sitio de la interrupción de la aorta fue <1m/s. Se solicitó una angiotomografía (TC) de cráneo para descartar aneurisma del polígono de Willis.
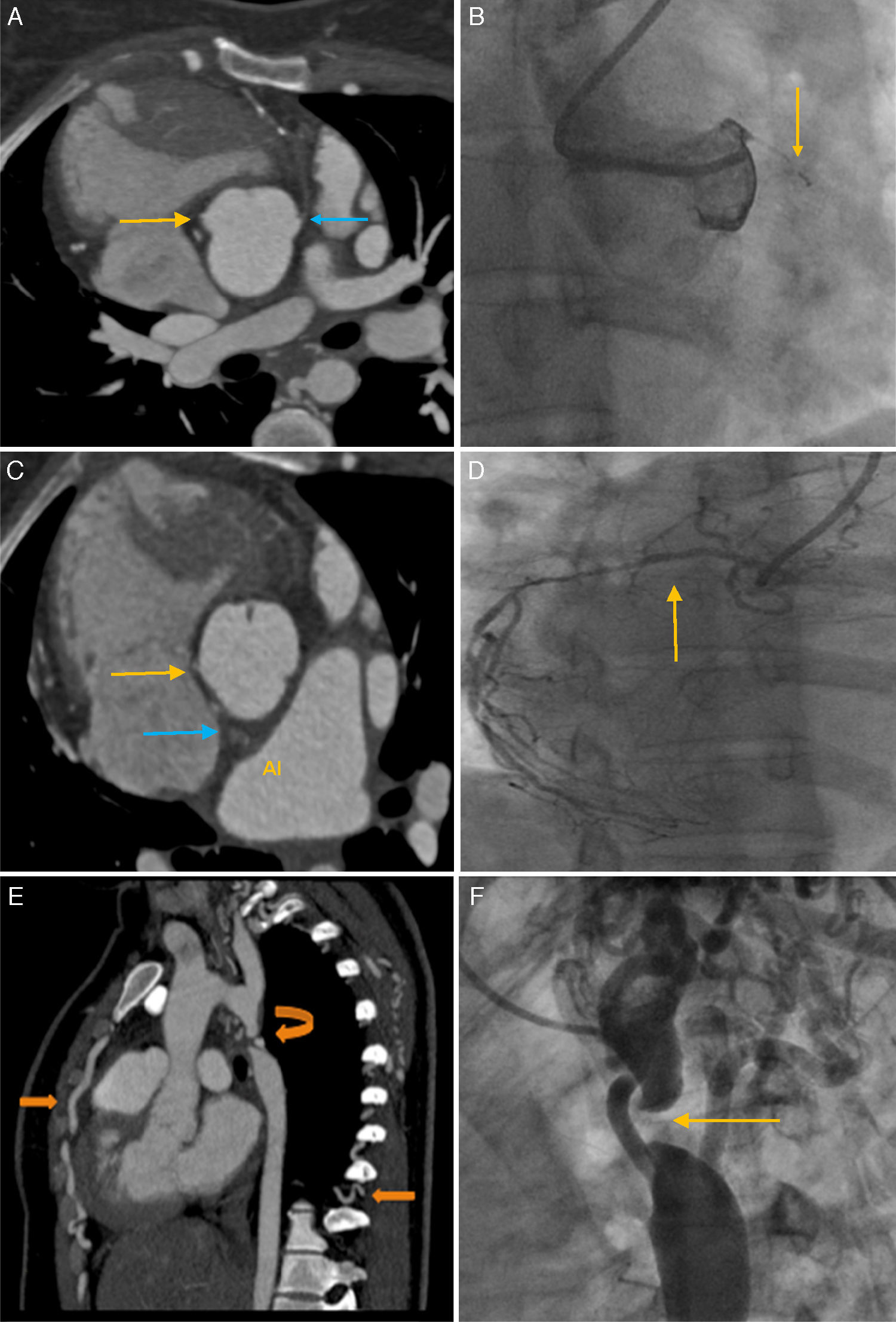
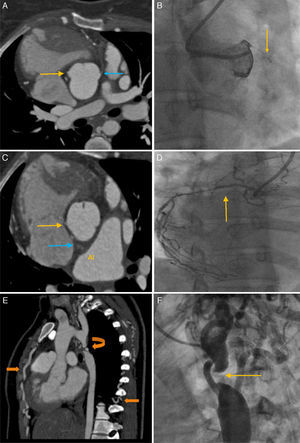
Hasta el momento se diagnosticó CoAo, para lo que se planificó una aortoplastia con balón; previo a este procedimiento se realizó una TC de coronarias y aorta; en el primer estudio se encontró a la arteria circunfleja (Cx) que nace del seno de Valsalva derecho, con dominancia izquierda, con disminución de su calibre proximal, y que da origen a la descendente posterior y ramos posterolaterales; la coronaria derecha (CD) tiene enfermedad difusa; tronco de la coronaria izquierda y ramo intermedio ausente; la descendente anterior (DA) con oclusión total desde su origen, segmento ocluido de 29mm (fig. 4), presencia de medio de contraste en su segmento distal por colaterales. En la TC de aorta se observó disminución gradual del calibre de la aorta con aspecto en pico de ave con interrupción a 13mm posterior al origen de la arteria subclavia izquierda (ASI), a 6mm se observa recanalización por múltiples colaterales cervicales, escapulares, intercostales y mamarias, plano valvular aórtico 24mm, senos de Valsalva 31mm, unión sinotubular 26mm, arco proximal 26mm, arco transverso 19cm, arco distal 16mm, aorta a nivel del diafragma 12mm, tronco de la pulmonar 27mm, rama derecha 18mm y rama izquierda 20mm.
A)TC coronarias: muestra (punta de flecha amarilla) la CD; la DA nace del seno de Valsalva izquierdo (punta de flecha azul) con oclusión total proximal. B)Coronariografía de la DA en oblicua anterior derecha (OAD) 30°/cráneo 0°: muestra obstrucción total proximal (punta de la flecha). C)TC coronarias (punta de flecha amarilla): señala el origen de la Cx del seno de Valsalva derecho, diferente ostium que la CD, tiene trayecto retro aórtico (punta de flecha azul). D)En oblicua anterior izquierda (OAI) 1°/cráneo 35°: muestra la CD con enfermedad difusa de todo el vaso. E)TC de aorta, corte sagital. Se observa CoAo distal al origen de la ASI (flecha curva) y circulación colateral por ramas intercostales y mamaria interna (punta de flecha). F)Angiografía de coartación de aorta en OAI 60°/caudo 0°: la punta de flecha señala el sitio de interrupción de la aorta.
Se llevó a la paciente a aortoplastia con balón. En la angiografía coronaria (fig. 4) por abordaje carporradial derecho, la DA mostró oclusión total crónica en su segmento proximal, con flujo distal TIMI0, y circulación coronaria contralateral de la arteria Cx a través de ramos septales, Rentrop III; nacimiento anómalo de la Cx del seno coronario derecho, es dominante; en su segmento proximal lesión difusa, estrechez del 85%, segmento medio con lesión corta, excéntrica del 70%, segmento distal lesión tubular, excéntrica del 70%, flujo distal TIMI3, ramo posterolateral, con lesión ostial corta del 75%. La CD no dominante de pequeño calibre, con enfermedad difusa, flujo distal TIMI3. Se realizó angiografía selectiva de arco aórtico distal: por vía radial derecha se avanzó un catéter multipropósito 6Fr, se observó imagen de fondo de saco ciego, posterior a nacimiento de la ASI. Posteriormente se realizó angiografía simultánea, realizando punción de la arteria femoral derecha, se colocó introductor 6Fr, se avanzó un catéter Pigtail 5Fr hasta la aorta descendente y catéter multipropósito 6Fr al arco aórtico, observando interrupción de la aorta de 6mm de longitud, con importante circulación colateral, sin ser posible realizar aortoplastia.
La paciente fue llevada a cirugía de corazón abierto con implante de tubo de derivación en la aorta, injerto de arteria mamaria interna izquierda a la DA e injerto de vena safena izquierda al ramo posterolateral, con una evolución satisfactoria.
DiscusiónNuestra paciente presentó situs solitus en dextrocardia asociada a CoAo y EAC. El tipo más frecuente de dextrocardia se observa en situs inversus, en el que el lóbulo más grande del hígado, la aurícula venosa y el segmento suprahepático de la cava inferior están en el lado izquierdo del cuerpo1. En contraste con situs inversus, situs solitus se describe cuando las vísceras están en posición normal, es decir, el estómago a la izquierda y el hígado a la derecha1.
El situs solitus en dextrocardia ocurre con una frecuencia de uno en aproximadamente 30.000 nacidos vivos2. El estudio retrospectivo liderado por Naveen Garga et al. mostró que de 125 pacientes con dextrocardia, el 39.2% tenían situs inversus, el 34.4% situs solitus y situs ambiguo 26.4% (dextromorfismo 18.4% y levomorfismo 8%), en situs solitus la concordancia auriculoventricular y ventrículo arterial estuvo presente en la mayoría de los casos. La edad media de diagnóstico de situs solitus en dextrocardia fue 9.8±9.8años (rango de 3días a 36años), con una relación de 1.5:1 hombres y mujeres, respectivamente3.
La asociación de situs solitus en dextrocardia con otras anormalidades cardiacas es mayor al 90%; de estos, el 2.3% es causado por CoAo3, por lo que ante un paciente con esta posición cardiaca se deben buscar intencionadamente otras cardiopatías. Sin embargo, se han reportado casos de dextrocardia en situs solitus aislada2.
La CoAo es una estenosis localizada distal al origen de la ASI. Se trata de una deformidad de la pared media arterial la cual estrecha concéntricamente la pared aórtica4. Entre las cardiopatías congénitas esta ocupa 5.29% de todas ellas5. Es más frecuente en hombres que en mujeres (1.7:1, respectivamente)4. El aneurisma del polígono de Willis y la válvula aórtica bicúspide se encuentran en un 50% de los casos de CoAo4, pero se descartó en la paciente.
El diagnóstico de CoAo se hace palpando los pulsos femorales, los cuales estarán disminuidos o ausentes con relación a las extremidades superiores; cuando es detectada, se utilizan el ecocardiograma, la tomografía axial computarizada y la arteriografía cuando precede al intervencionismo4.
La constricción de la aorta produce disminución del flujo sanguíneo hacia la parte inferior del cuerpo, de forma que los pulsos y la presión arterial son mayores en los brazos que en las piernas4. El signo clave para corroborar clínicamente el diagnóstico de CoAo es la diferencia de presión arterial entre miembros superiores e inferiores (>20mmHg), como lo manifestó esta paciente. La CoAo implica un importante incremento de la poscarga del ventrículo izquierdo, resultando en incremento del estrés parietal, hipertrofia concéntrica del ventrículo izquierdo, disfunción diastólica y desarrollo de arterias colaterales1,4. En el 50% de los casos se ven muescas costales (unilaterales o bilaterales, entre la segunda y la novena costillas). Las muescas son unilaterales si la arteria subclavia derecha e izquierda nace de la aorta distal a la coartación. Las muescas costales se visualizan como erosión de la superficie inferior de la zona posterior de una costilla, habitualmente en el tercio externo conocido como signo de Roesler4.
El ecocardiograma transtorácico, usando el plano supraesternal, muestra comúnmente un cayado aórtico transversal muy expandido y un flujo continuo rápido a través de la zona de coartación6. El Doppler es sensible para detectar la coartación, pero pueden producirse falsos negativos en el caso de conducto arterioso persistente o cuando hay vasos colaterales muy desarrollados; así, el Doppler subestimará la gravedad real de la obstrucción, como se observó en el presente caso. La interrupción del cayado aórtico podría considerarse una forma extrema de coartación, siendo la longitud de los segmentos desaparecidos variable6.
Las enfermedades del corazón son la principal causa de muerte en mujeres en los países industrializados, por lo que es crucial la reducción de los factores de riesgo7. La prevalencia de EAC en pacientes con CoAo se reporta en la literatura del 4.9 al 5.1%8. Según Roifman et al.8, la edad de presentación de EAC en pacientes coartados con factores de riesgo como hipertensión arterial, dislipidemia y diabetes mellitus tipo2 está comprendida entre los 55-60años. También se menciona que la CoAo desencadena disfunción endotelial, niveles de citoquinas proinflamatorias y rigidez vascular, pudiendo persistir incluso después de la reparación, lo que sugiere la posibilidad de un defecto de reactividad vascular8.
La CoAo debe ser diagnosticada de manera temprana, al explorar adecuadamente al niño. La reparación temprana en estos pacientes mejora la calidad de vida y la supervivencia a largo plazo. Cuando esto no ocurre, el paciente queda expuesto a la historia natural, con presencia y permanencia de la hipertensión arterial sistémica y otras como disección aórtica, enfermedad coronaria, falla cardiaca y endocarditis bacteriana4. Contreras et al.9 refieren en su estudio que la principal causa de hospitalización en pacientes con cardiopatía congénita en el departamento de urgencias del Instituto Nacional de Cardiología Ignacio Chávez de México fue la falla cardiaca (31.9%), siendo la infección el desencadenante de la insuficiencia cardiaca (50%), la endocarditis fue causante del proceso infeccioso y el choque séptico fue la causa más frecuente de muerte en esta población.
La guía de la Sociedad Europea de Cardiología 2010 para el manejo de cardiopatías congénitas refiere que los pacientes con CoAo que presentan diferencia de presión arterial >20mmHg entre las extremidades superiores e inferiores, independientemente de los síntomas, pero con hipertensión de extremidades superiores (>140/90mmHg en adultos), respuesta de la presión arterial patológica durante el ejercicio, o significativa hipertrofia del ventrículo izquierdo, tienen clasei nivelC de indicación para intervención, sea quirúrgica o por cateterismo10. Las indicaciones para la reparación quirúrgica de CoAo en un adulto son controvertidas. La terapia endovascular ha suplantado en gran parte a la cirugía tradicional, excepto en mujeres en edad fértil y en los pacientes con aneurismas asociados o hipoplasia del arco transversal11. Las técnicas quirúrgicas incluyen la resección y la anastomosis de extremo a extremo, aortoplastia con parche, aortoplastia con colgajo de subclavia y el tubo de derivación11. La alternativa menos invasiva que la cirugía es la angioplastia con balón; en los adultos casi siempre se coloca un stent en el segmento coartado. Se considera o se busca que el gradiente residual sea menor de 10mmHg. Las complicaciones son pocas, y pueden deberse a mala colocación del stent11. La elección final del tratamiento de la CoAo detectada tardíamente depende de varios factores, como la morfología y la severidad de la CoAo, condición vascular que incluye vasos colaterales y comorbilidad10,11.
En este caso, la sospecha diagnóstica de EAC se realizó en base a la clínica, alteraciones electrocardiográficas y confirmado por un estudio de imagen; se ha descrito en la literatura la realización de estudio de tomografía computarizada de emisión monofotónica usando 99mTc sestamibi con protocolo de un día (SPECT)12 para la determinación de isquemia e infarto en pacientes con dextrocardia.
Cabe mencionar que el origen anómalo de la arteria Cx del seno coronario derecho es raro; la incidencia de anomalías de las arterias coronarias se ha reportado entre el 0.6-1.3% en angiografía y el 0.3% en autopsias13.
Están reportados en la literatura casos de revascularización coronaria en pacientes con situs inversus en dextrocardia, no así en pacientes con situs solitus y dextrocardia.
ConclusionesEl situs solitus en dextrocardia se asocia en la mayoría de veces con otras malformaciones cardiacas, por lo que se debe examinar detenidamente al paciente y solicitar estudios complementarios si la exploración física no satisface. La permanencia de HAS secundaria a CoAo pudo llevar a la paciente a presentar una ateroesclerosis coronaria acelerada, desencadenando angina. Es crucial realizar el diagnóstico de CoAo en la niñez para evitar sus consecuencias.
Las enfermedades congénitas del corazón en el adulto comprenden un grupo complejo de patologías y son un reto en la práctica clínica del cardiólogo; se requiere un equipo multidisciplinario.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.