Objetivos. Presentar la morbimortalidad de nuestro servicio en la reparación abierta electiva de los aneurismas de aorta abdominal (AAA) y estudiar los diversos factores que pueden influir en ella. Pacientes y métodos. Desde 1987 hasta 2006 estudiamos 309 pacientes a quienes se practicó una reparación abierta electiva de su AAA. De ellos, 304 eran varones (98,4%), y la edad media, de 67,9 ± 7,1 años. Se clasificaron en cuatro períodos quinquenales para su estudio. Resultados. Ciento trece pacientes (36,6%) se clasificaron, de acuerdo con la clasificación de la American Society of Anesthesiologists (ASA), como ASA II, 168 (54,4%) como ASA III y 28 (9,1%) como ASA IV. Fallecieron postoperatoriamente nueve pacientes (2,9%), y la principal causa fue la pulmonar (55,5%). Las complicaciones postoperatorias fueron 56 (18,1%), 44 generales (14,2%) y 12 debidas a la técnica (3,9%). Con el tiempo aumentaron de forma significativa los pacientes operados por aumento de diámetro aórtico (de 3,3 a 40%) y los pacientes con ASA III (de 57 a 73,4%). Disminuyeron significativamente la mortalidad en pacientes ASA III (de 10 a 0%) y la estancia en la Unidad de Cuidados Intensivos (de 3,4 a 3,1 días). Sin embargo, aumentó significativamente el tiempo de oclusión aórtica (de 53,6 a 68,5 min). Con un seguimiento medio de 77,3 meses, la supervivencia fue del 77,3%, y la principal causa de muerte, la cardiopatía (12,7%). Se presentaron 19 complicaciones tardías derivadas del injerto (6,3%); la más frecuente fue el aneurisma anastomótico distal (2%). Conclusiones. En la actualidad, la reparación abierta electiva es una excelente técnica para el tratamiento quirúrgico de los AAA, con muy baja mortalidad hospitalaria y escasas complicaciones en su seguimiento a largo plazo. [ANGIOLOGÍA 2008; 60:177-88]
Aim. To present the morbidity and mortality rates in the open repair of abdominal aortic aneurysms (AAA) in our service and to study the different factors that can influence them. Patients and methods. We studied 309 patients who had undergone elective open repair of their AAA between 1987 and 2006. Three hundred and four were males (98.4%) and the mean age was 67.9 ± 7.1 years. Cases were divided into four five-year periods for the study. Results. One hundred and thirteen patients (36.6%) were classified, according to the American Society of Anaesthesiologists (ASA) classification, as ASA II, 168 (54.4%) were ASA III and 28 (9.1%) as ASA IV. Nine patients (2.9%) died during the postoperative period, the main cause being the pulmonary (55.5%). There were 56 cases of post-operative complications (18.1%), 44 general complications (14.2%) and 12 arising from the technique employed (3.9%). The number of patients who underwent surgery to increase the aortic diameter rose significantly with time (from 3.3 to 40%), and the same occurred with patients with ASA III (from 57 to 73.4%). There was a significant decrease in mortality in ASA IIIpatients (from 10 to 0%) and in the time spent in the intensive care unit (from 3.4 to 3.1 days). The aortic occlusion time, however, rose significantly (from 53.6 to 68.5 min). With a mean follow-up of 77.3% months, the survival rate was 77.3%, and the main cause of death was heart disease (12.7%). There were a total of 19 late complications deriving from the graft (6.3%), the most frequent being distal anastomotic aneurysms (2%). Conclusions. At the present time, elective open repair is an excellent technique for AAA treatment, with a very low rate of in-hospital mortality and few complications in its long-term follow-up.
Con el clásico trabajo presentado por Dubost [1] en 1952 se inició el tratamiento quirúrgico de los aneurismas de aorta abdominal (AAA) mediante su exclusión e interposición de un injerto. A pesar de los buenos resultados iniciales [2], con la mejora en la calidad de las prótesis que se implantan, el perfeccionamiento técnico y el excelente material quirúrgico con que se dispone en la actualidad, se han conseguido tasas de mortalidad inferior al 2% [3] en unidades especializadas. Es indudable que la mejora en las técnicas anestésicas y el gran desarrollo en los cuidados postoperatorios también han influido espectacularmente en conseguir estos resultados [4].
Los pacientes portadores de un AAA suelen ser varones, añosos y en ocasiones con factores de riesgo que hacen que debamos evaluar su riesgo quirúrgico. Para tal fin, se han desarrollado diversas escalas, como la Confidential Enquiry intro Perioperative Death o la de la British United Provident Association, aunque la clasificación de la American Society of Anesthesiologists (ASA) [5] sigue siendo en la actualidad para muchos profesionales punto de referencia para conocer el riesgo quirúrgico en cualquier tipo de intervención quirúrgica.
El principal objetivo de este trabajo es presentar nuestra experiencia en la reparación abierta (RA) electiva de los AAA a lo largo de los 20 años de existencia de nuestro servicio, estudiando aquellos factores intra y extraoperatorios que hayan podido influir de forma significativa en la morbimortalidad a lo largo del tiempo.
Pacientes y métodosHemos estudiado de forma retrospectiva los datos de 1.050 pacientes que han sido diagnosticados, tratados y/o controlados por ser portadores de un AAA de etiología arterioesclerótica desde mayo de 1987, fecha de inicio de la actividad de nuestro servicio. Desde el comienzo de nuestra actividad asistencial, nos interesó la historia natural de los AAA y los factores que pudiesen influir en su formación y crecimiento. Para ello, y desde entonces, realizamos pruebas de cribaje mediante ecografía abdominal a todos los pacientes con isquemia crónica de las extremidades inferiores y recogemos los datos de todos los pacientes ingresados en nuestro hospital con diagnóstico 441.3 (AAA roto) y 441.4 (AAA electivo) en el CIE-9 cada seis meses, para posteriormente ponernos en contacto con los pacientes e invitarlos a que acudan a nuestras consultas externas para su posterior control.
Es criterio de nuestro servicio realizar la reparación electiva de un AAA, cuando éste presenta un diámetro igual o mayor de 5 cm, crece rápidamente (0,5 cm o más en seis meses) o el paciente presenta síntomas debidos a la compresión de estructuras adyacentes por el AAA. No obstante, incluimos también en este estudio aquellos aneurismas pequeños (< 5 cm) en los que se asoció la exclusión del AAA a la resección de grandes aneurismas ilíacos o a la revascularización de miembros inferiores por enfermedad oclusiva aortoilíaca mediante la realización de un injerto aortobifemoral.
El riesgo quirúrgico lo cuantificamos en cinco tipos o clases, según la clasificación ASA, para unificar criterios con los anestesiólogos asignados de forma permanente a nuestro servicio. Por otra parte, describimos los principales factores de riesgo que presentan estos pacientes.
Estudiamos aquellas variantes pre y perioperatorias, como las pérdidas hemáticas, la reposición hemática, los tiempos de oclusión aórtica y de la intervención y la estancia en la Unidad de Cuidados Intensivos (UCI).
Definimos como mortalidad postoperatoria inmediata aquélla que se produce dentro de los 30 días posteriores a la intervención quirúrgica. En este apartado, estudiamos las causas que produjeron el fallecimiento. Hacemos distinción entre complicaciones generales y las propias de la intervención, ya que pensamos que las primeras son derivadas de los posibles factores de riesgo del paciente, y las segundas, del equipo quirúrgico y de la técnica utilizada. Estudiamos la tasa de supervivencia, las causas de muerte y las complicaciones derivadas de la intervención quirúrgica a lo largo del período de seguimiento.
Para realizar este trabajo, hemos clasificado a los pacientes en cuatro grupos quinquenales según el año en que fueron intervenidos. La variable principal a estudio es la morbimortalidad postoperatoria, así como la producida durante el seguimiento de estos pacientes. Las secundarias son aquellas que hayan podido influir en las primeras.
El análisis estadístico se realizó con el programa SPSS 12.0 para Windows. Expresamos las variables cualitativas como n y como porcentaje, y las cuantitativas, como media ± DE e intervalo para la serie total y en cada subgrupo. Utilizamos los test χ2, t de Student, ANOVA, test de tendencia de Mantel-Haenszel y tablas de vida, y consideramos p < 0,05 como significativo.
ResultadosDesde mayo de 1987 hasta diciembre de 2006, se han intervenido en nuestro servicio 394 AAA de etiología arterioesclerótica; de ellos, 309 (78,4%) fueron de forma electiva mediante RA y 71 (18,1%) de forma urgente. En enero de 2003, se introdujo en nuestro servicio la cirugía endovascular (TEV) para el tratamiento de los aneurismas aórticos (torácicos y abdominales). Desde entonces, hemos tratado 14 pacientes con un AAA con esta técnica, lo que supone el 8,6% de la cirugía electiva realizada desde la introducción de esta técnica.
De los 309 pacientes a los que se les realizó una RA electiva, 304 fueron varones (98,4%). La edad media global fue de 68 años (44-84), y destaca que 266 pacientes (86,1%) fueran menores de 75 años y 9 octogenarios (2,9%).
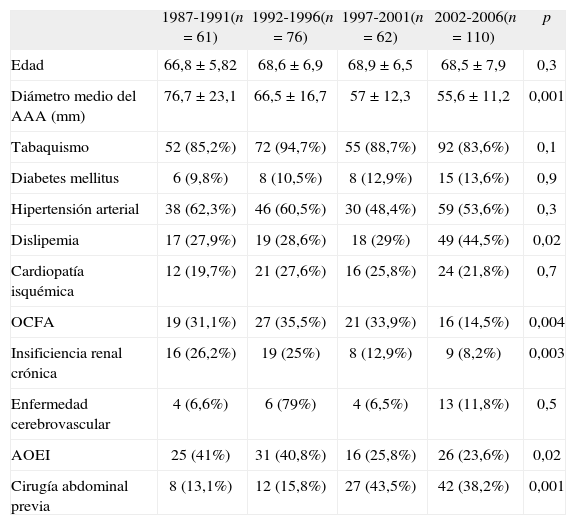
El diámetro medio de los AAA fue de 63,4 mm ± 17,9 (35-150), pero, dependiendo de la época en que se realizaron las RA, encontramos que los diámetros van disminuyendo significativamente, de 76,7 hasta 55,6 mm (Tabla I).
Factores de riesgo y patologías sobreañadidas.
| 1987-1991(n = 61) | 1992-1996(n = 76) | 1997-2001(n = 62) | 2002-2006(n = 110) | p | |
| Edad | 66,8 ± 5,82 | 68,6 ± 6,9 | 68,9 ± 6,5 | 68,5 ± 7,9 | 0,3 |
| Diámetro medio del AAA (mm) | 76,7 ± 23,1 | 66,5 ± 16,7 | 57 ± 12,3 | 55,6 ± 11,2 | 0,001 |
| Tabaquismo | 52 (85,2%) | 72 (94,7%) | 55 (88,7%) | 92 (83,6%) | 0,1 |
| Diabetes mellitus | 6 (9,8%) | 8 (10,5%) | 8 (12,9%) | 15 (13,6%) | 0,9 |
| Hipertensión arterial | 38 (62,3%) | 46 (60,5%) | 30 (48,4%) | 59 (53,6%) | 0,3 |
| Dislipemia | 17 (27,9%) | 19 (28,6%) | 18 (29%) | 49 (44,5%) | 0,02 |
| Cardiopatía isquémica | 12 (19,7%) | 21 (27,6%) | 16 (25,8%) | 24 (21,8%) | 0,7 |
| OCFA | 19 (31,1%) | 27 (35,5%) | 21 (33,9%) | 16 (14,5%) | 0,004 |
| Insificiencia renal crónica | 16 (26,2%) | 19 (25%) | 8 (12,9%) | 9 (8,2%) | 0,003 |
| Enfermedad cerebrovascular | 4 (6,6%) | 6 (79%) | 4 (6,5%) | 13 (11,8%) | 0,5 |
| AOEI | 25 (41%) | 31 (40,8%) | 16 (25,8%) | 26 (23,6%) | 0,02 |
| Cirugía abdominal previa | 8 (13,1%) | 12 (15,8%) | 27 (43,5%) | 42 (38,2%) | 0,001 |
AAA: aneurisma de aorta abdominal; AOEI: arteriopatía obstructiva de extremidades inferiores; OCFA: obstrucción crónica al flujo aéreo.
Los principales factores de riesgo que presentaban los pacientes, así como las patologías asociadas más frecuentes fueron: cardiopatía isquémica (23,6%), broncopatía crónica (26.9%), insuficiencia renal crónica (16,8%), arteriopatía obstructiva de las extremidades inferiores (31,7%) y enfermedad carotídea extracraneal (8,7%). Entre los antecedentes personales cabe destacar que el 28,8% de los pacientes había sufrido alguna cirugía abdominal previa. Al igual que la edad y el diámetro de los AAA, en la tabla I presentamos las características demográficas de los pacientes en relación con el período de tiempo en que fueron intervenidos, y encontramos que disminuyeron de forma significativa la broncopatía crónica, la insuficiencia renal crónica y la arteriopatía obstructiva de las extremidades inferiores, mientras que aumentaron significativamente los pacientes con una dislipemia y alguna cirugía abdominal previa. No hubo diferencias significativas en la edad y el resto de factores de riesgo cardiovascular.
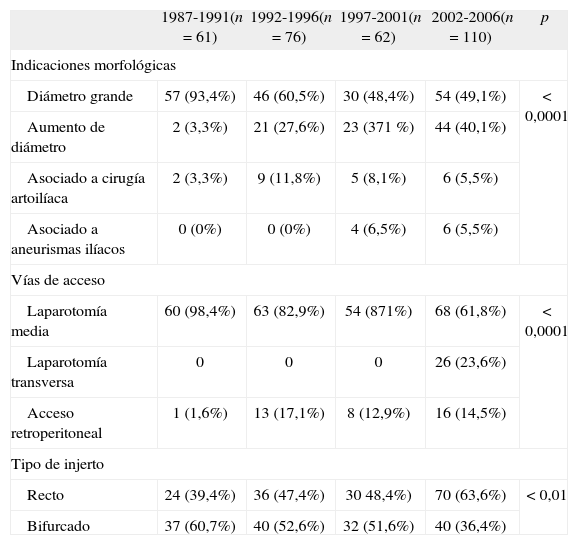
En 187 ocasiones (60,5%), los pacientes fueron intervenidos por presentar un AAA mayor de 50 mm en el momento del diagnóstico; en 90 (29,1%) por aumentar su tamaño hasta 50 mm o más; en 22 (7,1%) por encontrarse asociado a cirugía por enfermedad oclusiva del sector aortoilíaco; y en 10 (3,2%), por ser AAA pequeños asociados a la resección de grandes aneurismas ilíacos (Tabla II).
Indicaciones para la reparación de los aneurismas de aorta abdominal.
| 1987-1991(n = 61) | 1992-1996(n = 76) | 1997-2001(n = 62) | 2002-2006(n = 110) | p | |
| Indicaciones morfológicas | |||||
| Diámetro grande | 57 (93,4%) | 46 (60,5%) | 30 (48,4%) | 54 (49,1%) | < 0,0001 |
| Aumento de diámetro | 2 (3,3%) | 21 (27,6%) | 23 (371 %) | 44 (40,1%) | |
| Asociado a cirugía artoilíaca | 2 (3,3%) | 9 (11,8%) | 5 (8,1%) | 6 (5,5%) | |
| Asociado a aneurismas ilíacos | 0 (0%) | 0 (0%) | 4 (6,5%) | 6 (5,5%) | |
| Vías de acceso | |||||
| Laparotomía media | 60 (98,4%) | 63 (82,9%) | 54 (871%) | 68 (61,8%) | < 0,0001 |
| Laparotomía transversa | 0 | 0 | 0 | 26 (23,6%) | |
| Acceso retroperitoneal | 1 (1,6%) | 13 (17,1%) | 8 (12,9%) | 16 (14,5%) | |
| Tipo de injerto | |||||
| Recto | 24 (39,4%) | 36 (47,4%) | 30 48,4%) | 70 (63,6%) | < 0,01 |
| Bifurcado | 37 (60,7%) | 40 (52,6%) | 32 (51,6%) | 40 (36,4%) | |
Se realizaron 245 laparotomías medias (79,3%), 26 laparotomías transversas (8,4%) y 38 accesos retroperitoneales (12,3%) (Tabla II).
Para la sustitución aórtica, se utilizaron en todas las intervenciones prótesis de dacron, y cuando se realizaron derivaciones bifurcadas con anastomosis inguinales, las prótesis se impregnaron con rifampicina previamente a su colocación. A 160 pacientes se les implantó una prótesis recta (51,8%) en posición aortoaórtica, y a 149 (48,2%) una bifurcada, en las que la posición aortobifemoral fue la más utilizada, en 70 ocasiones (46,9%). Aunque no se hallaron diferencias significativas, aumentó progresivamente el número absoluto de prótesis rectas en detrimento de las bifurcadas, del 37,3% al principio del estudio, al 62,7% actual (p = 0,01).
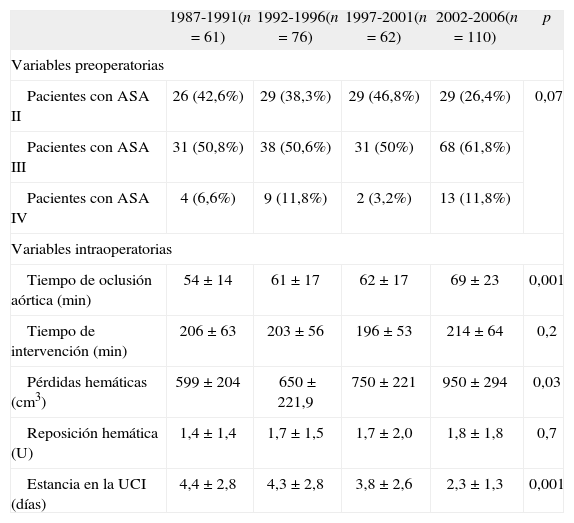
De los 309 pacientes, 113 (36,3%) se clasificaron como ASA II, 168 (54,5%) como ASA III y 28 (9,2%) ASA IV. Los pacientes menores de 75 años representaban el 93,8%, 82,1% y 78,6% de los grupos ASA II, III y IV, respectivamente. A lo largo del estudio se observó cómo los pacientes con ASA II disminuyeron, mientras que los considerados como ASA III o IV aumentaron, aunque sólo con tendencia estadística, de tal forma que en el último quinquenio, el 74,6% de los pacientes a los que se les realizó una RA tenía un riesgo anestésico ASA III y IV (Tabla III).
Resultados generales.
| 1987-1991(n = 61) | 1992-1996(n = 76) | 1997-2001(n = 62) | 2002-2006(n = 110) | p | |
| Variables preoperatorias | |||||
| Pacientes con ASA II | 26 (42,6%) | 29 (38,3%) | 29 (46,8%) | 29 (26,4%) | 0,07 |
| Pacientes con ASA III | 31 (50,8%) | 38 (50,6%) | 31 (50%) | 68 (61,8%) | |
| Pacientes con ASA IV | 4 (6,6%) | 9 (11,8%) | 2 (3,2%) | 13 (11,8%) | |
| Variables intraoperatorias | |||||
| Tiempo de oclusión aórtica (min) | 54 ± 14 | 61 ± 17 | 62 ± 17 | 69 ± 23 | 0,001 |
| Tiempo de intervención (min) | 206 ± 63 | 203 ± 56 | 196 ± 53 | 214 ± 64 | 0,2 |
| Pérdidas hemáticas (cm3) | 599 ± 204 | 650 ± 221,9 | 750 ± 221 | 950 ± 294 | 0,03 |
| Reposición hemática (U) | 1,4 ± 1,4 | 1,7 ± 1,5 | 1,7 ± 2,0 | 1,8 ± 1,8 | 0,7 |
| Estancia en la UCI (días) | 4,4 ± 2,8 | 4,3 ± 2,8 | 3,8 ± 2,6 | 2,3 ± 1,3 | 0,001 |
ASA: riesgo anestésico según la American Society of Anesthesiologists; UCI: Unidad de Cuidados Intensivos.
Por lo que respecta a parámetros operatorios, los tiempos medios de oclusión aórtica y de intervención fueron de 62,4 ± 19,4 y 205,8 ± 60,1 minutos, respectivamente. Durante la intervención, las pérdidas hemáticas fueron de 830,1 ± 691,6 cm3 de media, y se precisó la transfusión de 1,6 ± 1,6 U de sangre. La estancia media en la UCI fue 3,6 ± 2,2 días (Tabla III).
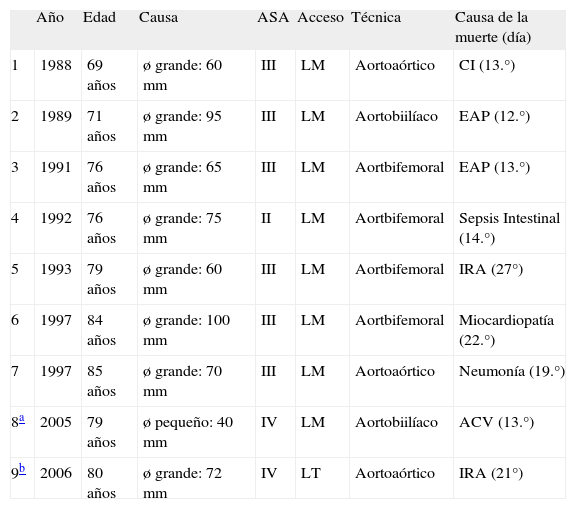
En el postoperatorio inmediato fallecieron nueve pacientes y la mortalidad postoperatoria global fue del 2,9%. En la tabla IV presentamos las características de los pacientes fallecidos en el postoperatorio inmediato, y se observa que solamente dos pacientes (0,7%) tenían menos de 75 años. Siete pacientes (77,8%) eran mayores de 75 años, y el 88,9% de los fallecimientos se produjo en pacientes con un ASA III o IV preoperatorio. Por lo que respecta a las causas de muerte, cuatro pacientes (1,3%) fallecieron por causas respiratorias, dos (0,6%) por patología cardíaca, dos (0,6%) por patologías infecciosas y uno (0,3%) neurológica.
Características de los nueve pacientes varones fallecidos
| Año | Edad | Causa | ASA | Acceso | Técnica | Causa de la muerte (día) | |
| 1 | 1988 | 69 años | ø grande: 60 mm | III | LM | Aortoaórtico | CI (13.°) |
| 2 | 1989 | 71 años | ø grande: 95 mm | III | LM | Aortobiilíaco | EAP (12.°) |
| 3 | 1991 | 76 años | ø grande: 65 mm | III | LM | Aortbifemoral | EAP (13.°) |
| 4 | 1992 | 76 años | ø grande: 75 mm | II | LM | Aortbifemoral | Sepsis Intestinal (14.°) |
| 5 | 1993 | 79 años | ø grande: 60 mm | III | LM | Aortbifemoral | IRA (27°) |
| 6 | 1997 | 84 años | ø grande: 100 mm | III | LM | Aortbifemoral | Miocardiopatía (22.°) |
| 7 | 1997 | 85 años | ø grande: 70 mm | III | LM | Aortoaórtico | Neumonía (19.°) |
| 8a | 2005 | 79 años | ø pequeño: 40 mm | IV | LM | Aortobiilíaco | ACV (13.°) |
| 9b | 2006 | 80 años | ø grande: 72 mm | IV | LT | Aortoaórtico | IRA (21°) |
ø: diámetro; ACV: accidente cerebrovascular; ASA: riesgo anestésico según la American Society of Anesthesiologists; CI: cardiopatía isquémica; EAP: edema agudo de pulmón; IRA: insuficiencia respiratoria aguda; LM: laparotomía media; LT laparotomía transversa.
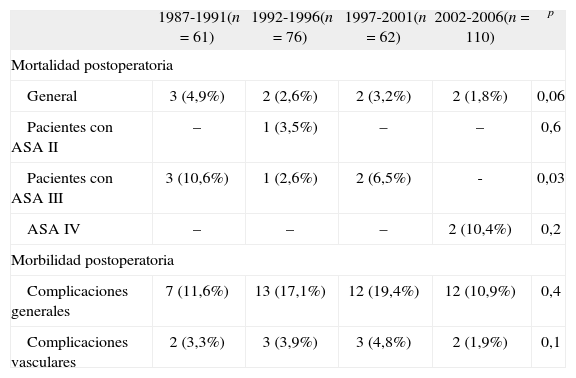
En la tabla V se observa que, aunque no se produce una disminución significativa de la mortalidad postoperatoria, en el último quinquenio la mortalidad postoperatoria es inferior al 2%. Si estudiamos la mortalidad de los pacientes según el ASA preoperatorio, comprobamos que, aunque hayan aumentado progresivamente los pacientes operados con ASA III hasta alcanzar el 61,8% en el último período, ha disminuido significativamente la mortalidad en estos pacientes, y la mortalidad de los pacientes con ASA III en los últimos 10 años ha sido del 2% (2/99).
Morbimortalidad postoperatoria
| 1987-1991(n = 61) | 1992-1996(n = 76) | 1997-2001(n = 62) | 2002-2006(n = 110) | p | |
| Mortalidad postoperatoria | |||||
| General | 3 (4,9%) | 2 (2,6%) | 2 (3,2%) | 2 (1,8%) | 0,06 |
| Pacientes con ASA II | – | 1 (3,5%) | – | – | 0,6 |
| Pacientes con ASA III | 3 (10,6%) | 1 (2,6%) | 2 (6,5%) | - | 0,03 |
| ASA IV | – | – | – | 2 (10,4%) | 0,2 |
| Morbilidad postoperatoria | |||||
| Complicaciones generales | 7 (11,6%) | 13 (17,1%) | 12 (19,4%) | 12 (10,9%) | 0,4 |
| Complicaciones vasculares | 2 (3,3%) | 3 (3,9%) | 3 (4,8%) | 2 (1,9%) | 0,1 |
ASA: riesgo anestésico según la American Society of Anesthesiologists.
Se produjeron 44 complicaciones generales postoperatorias (14,2%), de las cuales 15 (4,9%) fueron cardíacas, ocho (2,6%) respiratorias, 14 (4,5%) intestinales (fundamentalmente, el íleo prolongado), tres (0,9%) renales, y en cuatro ocasiones (1,3%), infecciones cutáneas. Se produjeron 10 complicaciones vasculares (3,2%) que precisaron intervención. De ellas, tres (0,9%) se debieron a una hemorragia retroperitoneal, tres (0,9%) a la trombosis aguda de una rama protésica, y cuatro (1,4%) a embolización arterial distal (Tabla V).
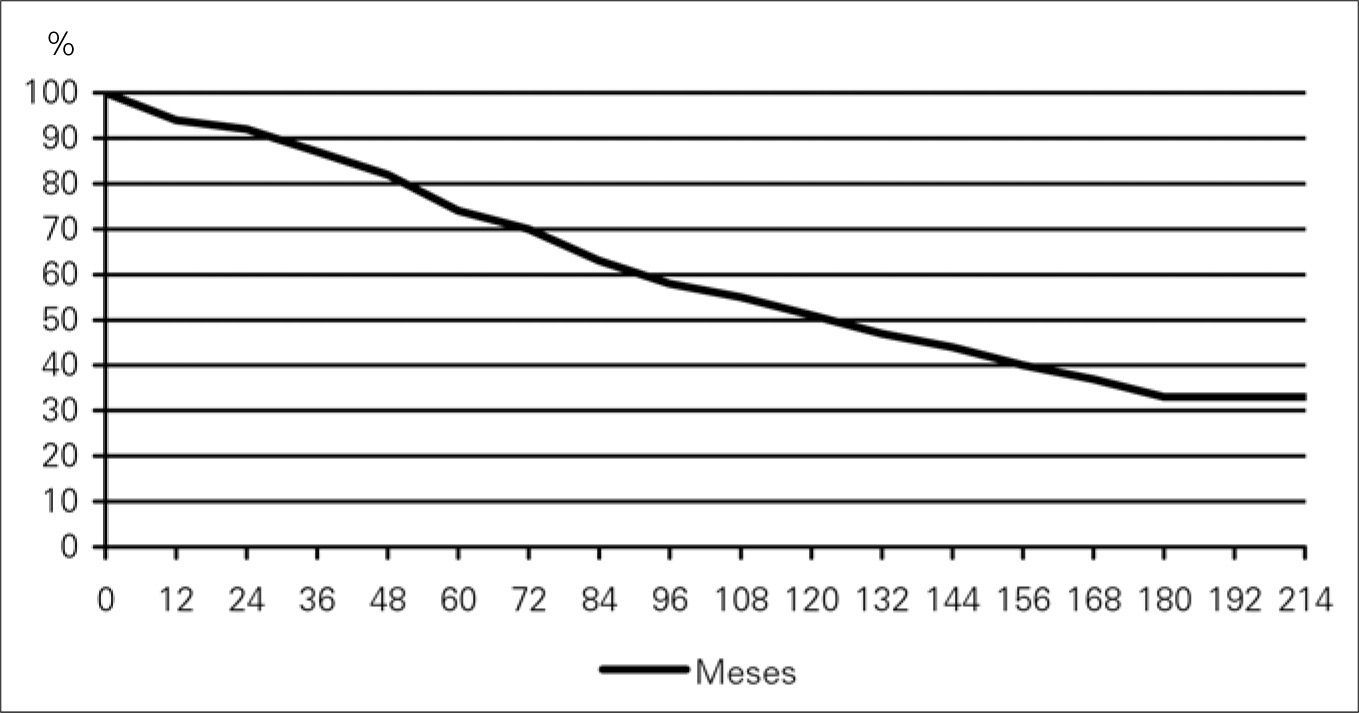
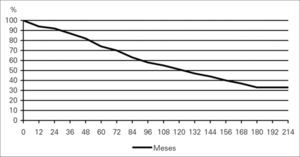
Los 300 pacientes que sobrevivieron a la RA electiva tuvieron un seguimiento medio de 77,3 ± 152,2 meses (1-229). Perdimos tres pacientes (1%) durante el seguimiento. Durante este tiempo fallecieron 102 pacientes, con unas tasas de supervivencia de 94, 74, 51 y 33% al año, 5, 10, y 15 años respectivamente, con un error típico ≥ 0,05 (Figura).
Las principales causas de muerte fueron: 38 neoplasias (12,7%), 34 cardiopatías (10,3%), 12 respiratorias (4%), siete neurológicas (2,3%), cuatro generales (1,3%) y dos (0,7%) nefrológicas. Cuatro pacientes (1,3%) fallecieron a causa de una fístula protesicoentérica a los 6 meses, 3, 8 y 11 años de haberse practicado la RA electiva.
La principal complicación tardía derivada de la intervención fue la eventración a nivel de la incisión de la laparotomía xifopubiana, que se presentó en 44 casos (14,7%), y su reparación quirúrgica fue necesaria en 11 ocasiones. Destacamos que, aunque el tiempo de seguimiento medio es corto (12,7 meses), ningún paciente con laparotomía transversa ha presentado esta complicación. Se presentaron 18 complicaciones vasculares tardías (6%): seis aneurismas anastomóticos distales (2%), seis fístulas protesicoentéricas (2%), tres oclusiones de rama (1%) y tres infecciones protésicas (1%).
DiscusiónEn principio, los AAA con 5,5 cm o más de diámetro son susceptibles de proceder a su tratamiento, bien sea mediante RA [6,7], bien mediante TEV [8]. No obstante, existen autores, como Hertzer et al [9], que tratan mediante RA los AAA mayores de 3,5 cm; y Laheij et al [10], que dentro del programa EUROSTAR refiere que el 25% de los AAA tratados tenía menos de 5 cm de diámetro. Pero, además, en la bibliografía reciente aparecen numerosos autores, como Shaw, del grupo de Veith, que han establecido el diámetro 'quirúrgico' en los 5 cm, entre los cuales nos incluimos [11-17]. Por otra parte, compartimos con Brewster et al [18] la afirmación de que, en la actualidad, está plenamente justificada la RA de los AAA ≥ 5 cm siempre que se tenga una mortalidad postoperatoria menor del 3%, ya que el riesgo de rotura anual es del 3-15%.
Pensamos que gran parte de los resultados obtenidos se deben al programa de detección precoz que comenzó en 1987, ya que, a lo largo del tiempo, el diámetro de los AAA intervenidos ha ido disminuyendo progresivamente hasta 2 cm. Hertzer et al [9], al presentar sus resultados entre 1973 y 2003, también disminuyen estos parámetros, pero no de forma significativa. La gran frecuencia de pacientes con una arteriopatía obstructiva de las extremidades inferiores en los primeros años (41%) se debe al programa de detección precoz [19] de AAA y al comienzo del cribaje de AAA en pacientes con isquemia de miembros inferiores [20]. El posterior descenso puede no deberse a la disminución de AAA en pacientes isquémicos, sino al aumento de pacientes diagnosticados casualmente durante el estudio de otras patologías. El aumento de los pacientes con cirugía abdominal previa lo achacamos a que al aumentar la edad de los pacientes y la aparición de las técnicas laparoscópicas, se ha incrementado el número de intervenciones quirúrgicas.
Directamente relacionado con el diagnóstico precoz y seguimiento de los AAA, encontramos que han ido disminuyendo progresivamente las intervenciones por diámetro grande, en beneficio de las RA realizadas por aumento del diámetro aórtico.
Por lo que respecta a la vía de abordaje, en el último quinquenio hemos reducido en un 30% el uso de la laparotomía media a favor de la laparotomía transversa cuando es posible, ya que estamos comprobando que en los pacientes se reducen el dolor postoperatorio y las complicaciones respiratorias, lo que también han observado Tekkis et al [21], y por el alto índice de eventraciones que se producen, que alcanza incluso el 30% de herniaciones [22], a pesar de haber utilizado todos los métodos y materiales posibles. En la actualidad, preferimos la laparotomía transversa o la vía retroperitoneal. No obstante, en nuestro trabajo, esta complicación se presenta en el 14,7% de las ocasiones, cifra inferior al 32% publicado por Papadimitriou et al [23] y al 90% de hernia con un seguimiento medio de 4 años que presentan Fassiadis et al [24].
La utilización de prótesis rectas (52%) coincide con las implantadas por otros autores, como el 57% de Sicard et al [25], aunque en la actualidad esta proporción en nuestro caso es mayor (63%), al igual que otros autores [26,27], con la consiguiente reducción del tiempo operatorio, ya que los pacientes que intervenimos mediante RA en la actualidad tienen más edad y presentan mayor riesgo quirúrgico.
El riesgo preoperatorio según la clasificación ASA es uno de los principales indicadores para decidir el tratamiento que se debe seguir en pacientes con AAA (conservador, RA convencional o TEV). Cronenwett [28] afirma que los pacientes jóvenes, con escasos factores de riesgo y larga expectativa de vida (ASA II), serían candidatos para RA, mientras que aquellos pacientes mayores, con factores de riesgo elevado (ASA III y IV), lo serían para TEV o tratamiento conservador. Sin embargo, recientemente, equipos de cirujanos vasculares están publicando trabajos [25,29,30] en los que refieren que más del 70% de los pacientes a los que se les practicó un RA tenían un ASA III o IV; incluso, en algunas publicaciones, estos pacientes suponen el 90% de las intervenciones. En nuestro caso, aunque el porcentaje global es del 63,6%, en el último quinquenio se eleva al 73% de la cirugía realizada, por lo que nuestro planteamiento es continuar realizando una RA en este tipo de pacientes, siempre que se mantenga nuestra actual mortalidad.
En la bibliografía reciente, Sicard et al [25] y Cruz et al [31] han presentado sus resultados en RA. Estos autores tienen menor tiempo de intervención (170 min) y estancia en la UCI (2 días) que nosotros (206 min y 3,6 días, respectivamente). No obstante, aunque con el paso del tiempo ha aumentado el tiempo de intervención, la estancia en la UCI ha ido disminuyendo de forma significativa, hasta ser en la actualidad de 2,3 días. Las pérdidas hemáticas presentadas por estos autores fueron de 1.500 cm3, en este caso superiores a las de nuestra serie, 830 cm3. Un reciente trabajo de Prault et al [3] presenta resultados muy similares a los obtenidos por nuestro grupo. Con referencia a otro parámetro estudiado, como el tiempo de oclusión aórtica, sólo hemos encontrado un trabajo [32] en los últimos años que presenta un tiempo de 87 min, muy superior al nuestro, 62 min, a pesar de que ha aumentado estadísticamente con el tiempo. Una posible explicación al aumento del tiempo de oclusión aórtica, tiempo de intervención y pérdidas hemáticas es el cambio generacional que se ha producido en nuestro servicio, con la incorporación de cirujanos jóvenes recién acabada su etapa de médico interno residente y que precisan, por norma general, siempre hay excepciones, mayor tiempo para realizar las técnicas quirúrgicas. Sin embargo, no ha impedido que la mortalidad postoperatoria en el último período haya disminuido, lo que puede significar que estas variaciones no han influido en el resultado general.
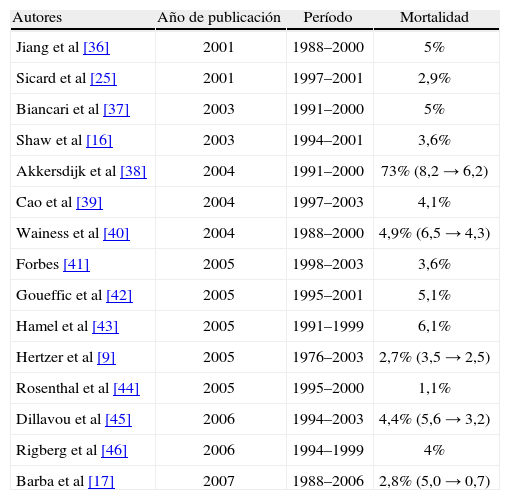
Hallin et al [33] realizaron en 2001 una revisión de la mortalidad postoperatoria en pacientes con un AAA ≥ 5 cm entre los años 1982-1994, y encontraron valores diferentes (0-12%). En el mismo año, Norman et al [34] presentaron una serie más exhaustiva entre 1980-1999, también con resultados muy dispares (0-10,4%). Por nuestra parte, hemos realizado una revisión bibliográfica desde el año 2001 hasta el 2007 de aquellas series con períodos de tiempo superior a cinco años (Tabla VI) [9,16,17,25,35-45], y también hemos encontrado variaciones (1,1-7,3%). Hay que destacar que existen cinco trabajos en los que se presenta la tendencia de la mortalidad a lo largo de los años, y encontramos un descenso en todos los casos. A la vista de lo expuesto anteriormente, pensamos que en la actualidad una Unidad de Angiología y Cirugía Vascular debería tener una mortalidad en la RA electiva de los AAA menor del 3%. Estamos de acuerdo con Rosenthal et al [43] y Dimick et al [46] en que la mortalidad postoperatoria es menor cuando la RA la realizan cirujanos vasculares, pero no con lo expuesto por Dueck et al [47], cuando afirman que para tener buenos resultados se deben operar 24 AAA/cirujano/año. Para nosotros, lo más importante es que el grupo tenga los mismos criterios tanto diagnósticos como terapéuticos, y que se realice la misma indicación y la misma técnica en los mismos casos, lógicamente siempre que sea posible.
Mortalidad postoperatoria en la bibliografía.
| Autores | Año de publicación | Período | Mortalidad |
| Jiang et al [36] | 2001 | 1988–2000 | 5% |
| Sicard et al [25] | 2001 | 1997–2001 | 2,9% |
| Biancari et al [37] | 2003 | 1991–2000 | 5% |
| Shaw et al [16] | 2003 | 1994–2001 | 3,6% |
| Akkersdijk et al [38] | 2004 | 1991–2000 | 73% (8,2 → 6,2) |
| Cao et al [39] | 2004 | 1997–2003 | 4,1% |
| Wainess et al [40] | 2004 | 1988–2000 | 4,9% (6,5 → 4,3) |
| Forbes [41] | 2005 | 1998–2003 | 3,6% |
| Goueffic et al [42] | 2005 | 1995–2001 | 5,1% |
| Hamel et al [43] | 2005 | 1991–1999 | 6,1% |
| Hertzer et al [9] | 2005 | 1976–2003 | 2,7% (3,5 → 2,5) |
| Rosenthal et al [44] | 2005 | 1995–2000 | 1,1% |
| Dillavou et al [45] | 2006 | 1994–2003 | 4,4% (5,6 → 3,2) |
| Rigberg et al [46] | 2006 | 1994–1999 | 4% |
| Barba et al [17] | 2007 | 1988–2006 | 2,8% (5,0 → 0,7) |
Por lo que respecta a las causas de muerte postoperatoria en la bibliografía, encontramos que en pacientes menores de 70 años es inferior al 1,5% [26]. En nuestra serie, fue del 0,7%. La muerte por patología cardíaca presenta variaciones entre el 0,3% [48] y el 3,2% [29]; en nuestra serie fue del 0,6%. La insuficiencia respiratoria fue la causante del 1,3% de las muertes en nuestros pacientes, pero, además, representa el 44,4% de todas las causas. De este elevado porcentaje, la mitad de los fallecimientos se produjo en los tres primeros años, y creemos que fue consecuencia del nacimiento del servicio con la incorporación de especialistas de distintas procedencias y con distintos criterios a los equipos de cirujanos, anestesiólogos e intensivistas. Por el contrario, en los últimos 10 años, y debido a la compenetración entre los miembros de los servicios involucrados, podemos comprobar cómo sólo han fallecido dos pacientes, y lo fueron debido al alto riesgo quirúrgico y a la imposibilidad de realizar otro tipo de cirugía.
Con relación a las complicaciones generales, encontramos en la bibliografía porcentajes próximos al 25% [3,15,25], aunque otros autores presentan porcentajes menores del 19% [26,29,31,35,38,48]. En el presente trabajo, nuestra tasa de complicaciones global fue del 14,2%; sin embargo, en el último quinquenio ha descendido hasta el 10,9%. Como en todos ellos, las complicaciones cardíacas fueron las más frecuentes. No obstante, en nuestro caso, las complicaciones digestivas, y fundamentalmente el íleo paralítico, fueron la segunda causa; por ello, hemos optado por la laparotomía transversa [21] en el último período, y tenemos que reconocer que ha disminuido esta complicación.
Las complicaciones vasculares postoperatorias varían en la bibliografía desde el 0,9 [48] hasta el 8,6% [15], y la complicación más temida, como es la hemorragia aguda retroperitoneal, también varía entre el 0,6 [49] y el 3,4% [15]. En el presente trabajo, las complicaciones vasculares supusieron el 3,2%, y las provocadas por hemorragia retroperitoneal el 0,9%, aunque, como en el caso de las complicaciones generales, en el último período éstas han disminuido y no hemos tenido hemorragias postoperatorias.
Norman et al [34] presentan la supervivencia a cinco años de distintos estudios. En ella, observamos que la mayoría obtiene supervivencias menores del 80% a cinco años. Hertzer et al [48], con un seguimiento medio de 44,4 meses, presentan una supervivencia del 94, 75 y 49% al año, 5 y 10 años, respectivamente. En nuestra serie comprobamos que la supervivencia de nuestros pacientes es similar a la presentada por los diversos autores.
En lo referente a la causa de muerte durante el seguimiento, la patología cardíaca supone el 10,3%, similar a autores, como Menard et al [27], pero muy inferior al 40% presentada por otros autores [34]. La neoplasia como causa de muerte en nuestro estudio sí resulta similar a la referida por numerosos autores [27,34,48].
Para nosotros, lo que tiene verdadera importancia son las complicaciones vasculares derivadas de la RA durante el seguimiento. En nuestro caso es del 6%, muy superior a la obtenida por Hertzer et al, del 0,3% [48], pero significativamente menor que la de otros autores como Biancari (15,4%) [50]. Estas complicaciones para Cappeller et al [51], tienen una mortalidad del 0,2%, mientras que para otros [50] suponen el 1,9%. En nuestra serie, las complicaciones vasculares tuvieron una mortalidad tardía del 1,3%.
En conclusión, la RA de los AAA es una excelente técnica con una baja mortalidad postoperatoria y con escasas complicaciones vasculares a largo plazo. Igualmente, en la actualidad, pacientes con un ASA III preoperatorio pueden beneficiarse de esta técnica en aquellas unidades que tengan una mortalidad postoperatoria menor del 3%.