Presentar los resultados del tratamiento quirúrgico electivo de los aneurismas inflamatorios de aorta abdominal (AIAA) y analizar la evolución de la inflamación periaórtica (IPA) y de los reactantes de fase aguda (RFA) tras la intervención.
Material y métodoSe ha realizado un análisis retrospectivo de los AIAA intervenidos de forma electiva entre 1990 y 2010 mediante cirugía abierta. El seguimiento mediano ha sido de 71 meses y se ha analizado la evolución de la IPA y de los RFA tras la intervención.
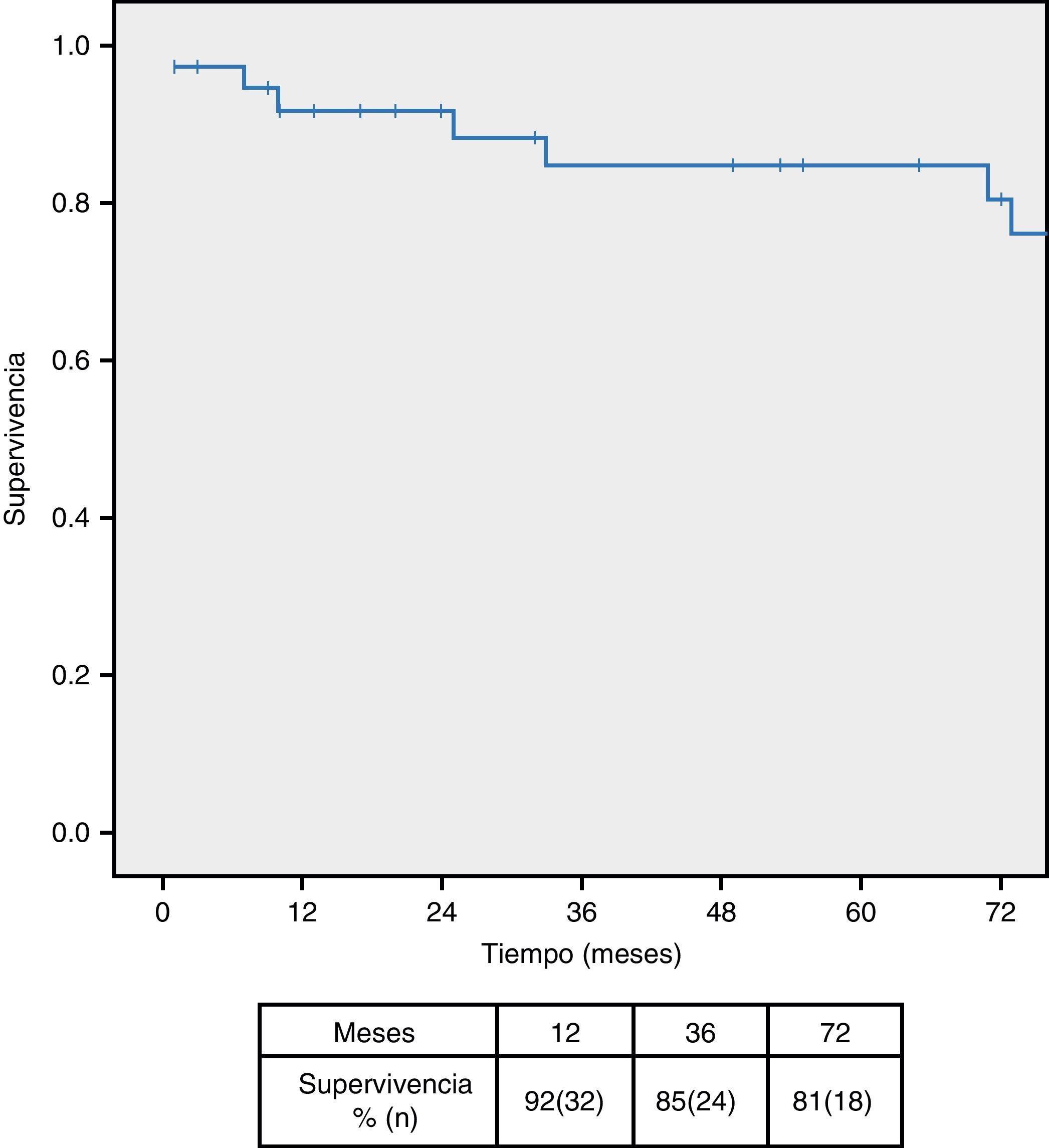
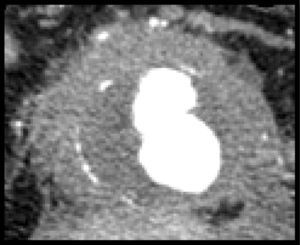
ResultadosSe han tratado 38 pacientes, de los cuales 12 (31,5%) eran sintomáticos. Se evidenció hidronefrosis en 7 casos (18,4%), siendo necesaria la colocación de doble-J preoperatorio en 5 (13,1%). Un paciente (2,6%) falleció en el postoperatorio inmediato y se realizaron 3 reintervenciones por sangrado (7,8%). Durante el seguimiento la hidronefrosis mejoró en 5 pacientes (71%), siendo la supervivencia a los 12, 36 y 72 meses del 92, 85 y 81% respectivamente.
En cuanto a los RFA, se produjo una reducción significativa tanto de la velocidad de sedimentación globular (VSG) (p 0,01), como de la proteína C reactiva (PCR) (p 0,01) tras la cirugía. De igual forma, se redujo de forma significativa la IPA durante el seguimiento, fundamentalmente a partir de los 9 meses tras la intervención (p 0,02).
ConclusionesLa cirugía electiva del AIAA ofrece unos buenos resultados a corto y largo plazo, asociándose a una disminución de los RFA y de la IPA, esta última fundamentalmente a partir del noveno mes postoperatorio.
To show the results of selective surgical treatment of inflammatory abdominal aortic aneurysms (IAAA), and to analyse the evolution of periaortic inflammation (PAI) and acute phase reactants (APR) after surgery.
Patients and methodA retrospective analysis was made of the IAAA electively operated on between 1990 and 2010 by means of open surgery. The median follow-up period was 71 months and an analysis was made of the PAI and APR after surgery.
ResultsA total 38 patients underwent treatment, of which 12 (31.5%) were symptomatic. Hydronephrosis was evident in 7 cases (18.4%). The implantation of a pre-operative double-J catheter was necessary in 5 cases (13.1%). One patient (2.6%) died in the immediate post-operative period, and 3 were re-operated on due to bleeding (7.8%). During the follow-up period the hydronephrosis improved in 5 patients (71%), with a survival rate at 12, 36 and 72 months of 92%, 85% and 81%, respectively.
With regard to the APR, a significant reduction was produced both in the erythrocyte sedimentation rate (ESR) (P=.01) and in the C-reactive protein (CRP) (P=.01) after surgery. Likewise, the PAI was significantly reduced during the follow-up period, mainly from the ninth month following the surgery (P=.02).
ConclusionsSelective surgery of IAAA offers good results in the short and long term, associated with a decrease in the APR and PAI, the latter mainly from the ninth month of the post-operative period.
Los aneurismas inflamatorios de aorta abdominal (AIAA), descritos por Walker et al. en 1972, se caracterizan por la presencia de un infiltrado inflamatorio de la pared aórtica así como del tejido periaórtico compuesto fundamentalmente por células plasmáticas, linfocitos y macrófagos1–3. Su etiología continúa siendo desconocida a pesar de las múltiples teorías propuestas en los últimos años. Aunque todavía no se puede afirmar que se trate de una entidad aparte o tan solo representen un extremo del espectro de la inflamación presente en todos los AAA, los AIAA son considerados una patología con unas características clínicas, histológicas y radiológicas bien definidas4.
En las primeras series publicadas sobre el tratamiento quirúrgico de los AIAA se reporta una alta tasa de complicaciones intraoperatorias y una elevada morbimortalidad en relación con la iatrogenia sobre estructuras periaórticas5. En 1978, Goldstone propuso una modificación de la técnica quirúrgica e insistió en la exclusión de los AIAA con la mínima disección posible. Crawford y Pennell en 1985 confirmaron una reducción de la morbimortalidad del tratamiento quirúrgico de los AIAA hasta llegar a equipararse a los AAA no inflamatorios6.
Existe controversia acerca de la evolución de la inflamación periaórtica (IPA). En varios estudios de los años 90 se observó una remisión completa de los síntomas tras el tratamiento quirúrgico, por lo que se pensó que la IPA desaparecería durante el seguimiento7,8. Sin embargo, estudios más recientes ponen en duda este punto de vista9,10, describiendo casos de progresión de la IPA y aparición de hidronefrosis tras la cirugía.
El objetivo del estudio es presentar los resultados del tratamiento quirúrgico electivo de los AIAA, así como analizar la evolución de la IPA y de los reactantes de fase aguda (RFA) tras la intervención.
Material y métodosDiseño del estudioSe han analizado de forma retrospectiva aquellos pacientes con un AIAA, intervenidos mediante cirugía abierta de forma electiva entre 1990 y 2010. Han sido tratados aquellos AIAA con un diámetro superior a 5cm, entendiendo AIAA como aquel que presentaba IPA en la TAC preoperatoria (con independencia del espesor de la misma) o bien aquel sin claros signos radiológicos, pero con signos inflamatorios hallados intraoperatoriamente (fibrosis periaórtica, pared aórtica engrosada y/o adherencias a las estructuras periaórticas). Se ha realizado valoración por parte del Servicio de Urología en aquellos casos con afectación ureteral.
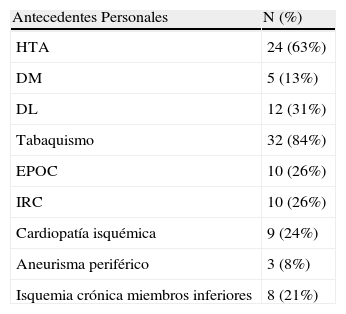
PacientesHan sido tratados 38 pacientes entre 1990 y 2010. Se han incluido en el estudio datos referentes a la demografía (edad y sexo), factores de riesgo cardiovascular (hipertensión arterial, dislipemia, diabetes mellitus y tabaquismo) y comorbilidad asociada (enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica, cardiopatía isquémica, isquemia crónica de miembros inferiores y aneurisma periférica asociada), analizándose los resultados en términos de morbimortalidad precoz y durante el seguimiento.
Inflamación periaórticaEn todos los casos se realizó una TAC preoperatoria donde se valoraron las características anatómicas del aneurisma (diámetro máximo, longitud y diámetro de cuello proximal y características del sector ilíaco), el espesor máximo de la IPA y la afectación de estructuras vecinas (compresión ureteral, adherencias duodenales, vena renal izquierda y sigma). Todos los pacientes tienen realizado al menos una TAC durante el seguimiento en el que hemos analizado la evolución de la IPA. El tiempo de realización del mismo ha sido variable en función de diferentes motivos: afectación de estructuras periaórticas y de la patología concomitante. Se ha considerado como significativo una reducción de la IPA>25%. Todas las mediciones de la IPA fueron realizadas por un mismo observador.
Reactantes de fase agudaDe igual manera, se evaluaron los RFA en el preoperatorio y a lo largo del seguimiento, analizando fundamentalmente la VSG, PCR convencional, fibrinógeno y leucocitos. El análisis de los RFA y la realización de la TAC durante el seguimiento se realizaron en el mismo periodo de tiempo.
Análisis estadísticoEl análisis estadístico se ha realizado empleando los test Chi-cuadrado y T de Student, según la variable analizada. La supervivencia y el periodo libre de reintervención se han calculado mediante curvas de Kaplan-Meier. Se estudio la relación entre la reducción relativa (%) del PAI medido en milímetros (mm) y el tiempo de realización de la TAC durante el seguimiento, mediante el análisis de la covarianza (ANCOVA). La variable dependiente de este análisis fue la reducción relativa y como covariables se introdujeron en el modelo el tiempo de realización de la TAC en meses y el valor del PAI previo a la intervención quirúrgica. Tras la realización del modelo se comprobó el supuesto de normalidad y de homogeneridad de variancias. Para todas las pruebas se aceptará un valor de significación del 5%. El procesamiento y análisis de los datos se realizó mediante el paquete estadístico SPSS 15.0.
ResultadosEntre 1990 y 2010 se han tratado mediante cirugía abierta electiva 667 aneurismas de aorta abdominal, de los cuales 38 eran AIAA (5,7%). Todos los pacientes eran varones, con una edad media de 66 años (rango 48-81). Los factores de riesgo cardiovascular y la comorbilidad asociada se muestran en la tabla 1. Doce pacientes (31,5%) presentaban síntomas, en forma de dolor lumbar y/o abdominal.
Factores de riesgo cardiovascular y comorbilidad
| Antecedentes Personales | N (%) |
| HTA | 24 (63%) |
| DM | 5 (13%) |
| DL | 12 (31%) |
| Tabaquismo | 32 (84%) |
| EPOC | 10 (26%) |
| IRC | 10 (26%) |
| Cardiopatía isquémica | 9 (24%) |
| Aneurisma periférico | 3 (8%) |
| Isquemia crónica miembros inferiores | 8 (21%) |
DM: diabetes mellitus; DL: dislipemia, EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IRC: insuficiencia renal crónica.
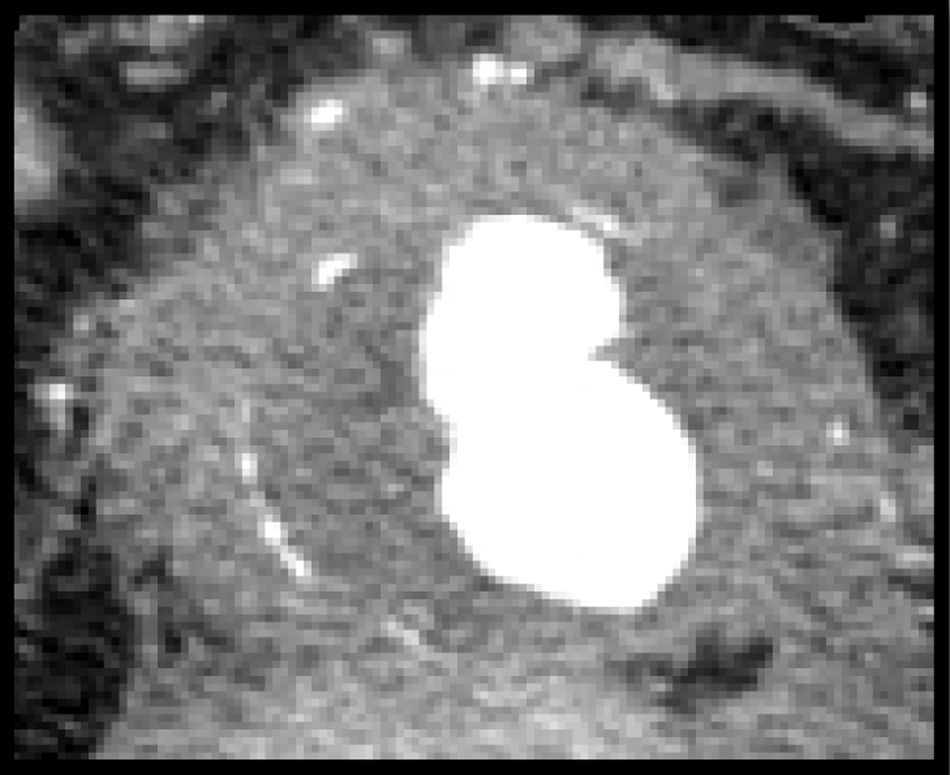
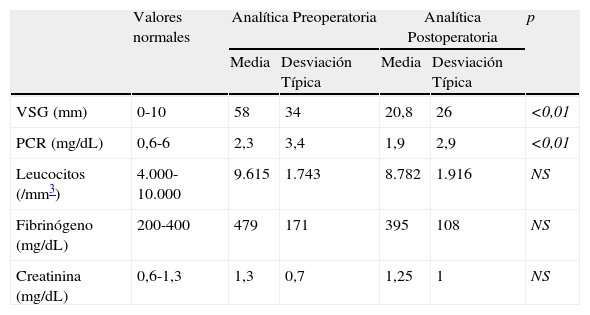
Se realizó una TAC preoperatoria a todos los pacientes (fig. 1). El diámetro medio de los AIAA fue de 68mm (DE 19,0) y se asoció aneurisma ilíaco en 12 casos (31,5%). La IPA media preoperatoria fue de 14mm (DE 1,7), evidenciándose adherencias a la 3.ª porción del duodeno en 30 casos (78,9%), vena renal izquierda en 12 casos (31,5%), vena cava inferior en 25 casos (65,7%) y afectación de uréteres en 21 casos (55,2%). Siete pacientes (18,4%) presentaban hidronefrosis preoperatoria, siendo necesaria la colocación de un catéter doble-J preoperatorio por insuficiencia renal postrenal en 5 de ellos (13,1%). Así mismo, se realizó una analítica preoperatoria a todos los pacientes, encontrándose una VSG elevada (>10mm) en la mayoría de ellos (81,5%).
Se utilizó la anestesia combinada en 30 pacientes (78,9%), realizándose un abordaje retroperitoneal en 10 casos (26,3%) y transperitoneal mediante laparotomía media en el resto. Se realizó exclusión y by-pass aortoaórtico en 16 pacientes (42,1%), aortobiilíaco en 10 (26,3%), aortobifemoral en 10 (26,3%) y aortoiliofemoral en 2 (5,2%), siendo necesario un clampaje suprarrenal en 10 casos (26,3%). Hubo 3 complicaciones intraoperatorias (7,8%): 1 lesión iatrogénica de la 3.ª porción duodenal y 1 lesión de vena ilíaca que se resolvieron mediante sutura directa, así como una embolización femoropoplítea.
Durante el postoperatorio inmediato se produjeron 14 complicaciones médicas (36,8%): 6 casos (15,7%) de elevación transitoria de la creatinina (creatinina>2mg/dL), 5 íleos prolongados (13,1%) y 3 casos de distress respiratorio (7,8%). Tres pacientes (7,8%) fueron reintervenidos por sangrado y hubo un éxitus durante los primeros 30 días (2,6%).
El seguimiento mediano de la serie fue de 71 meses (rango 1-173), produciéndose 2 pérdidas durante el seguimiento. La supervivencia fue del 92, 85 y 81% a los 12, 36 y 72 meses respectivamente (fig. 2), siendo las neoplasias la causa más frecuente de mortalidad tardía (62,5%), seguida del IAM (25%). La tasa libre de reintervención fue del 92,1% al mes y a los 12 y 36 meses y del 86,8% a los 72 meses, siendo preciso reintervenir 2 pacientes durante el seguimiento (1 fracaso hemodinámico y una obstrucción de rama).
Se realizó una analítica postoperatoria en 35 casos, con un tiempo medio de realización de 45 meses, encontrándose una reducción significativa de la VSG y PCR tras la cirugía (p<0,01). No se encontraron diferencias significativas en cuanto a la evolución de la creatinina, fibrinógeno y leucocitos tras la cirugía (tabla 2).
Evolución de los reactantes de fase aguda
| Valores normales | Analítica Preoperatoria | Analítica Postoperatoria | p | |||
| Media | Desviación Típica | Media | Desviación Típica | |||
| VSG (mm) | 0-10 | 58 | 34 | 20,8 | 26 | <0,01 |
| PCR (mg/dL) | 0,6-6 | 2,3 | 3,4 | 1,9 | 2,9 | <0,01 |
| Leucocitos (/mm3) | 4.000-10.000 | 9.615 | 1.743 | 8.782 | 1.916 | NS |
| Fibrinógeno (mg/dL) | 200-400 | 479 | 171 | 395 | 108 | NS |
| Creatinina (mg/dL) | 0,6-1,3 | 1,3 | 0,7 | 1,25 | 1 | NS |
Se realizó una TAC postoperatoria en 35 pacientes con un tiempo medio de 49 meses tras la cirugía. La IPA media postoperatoria fue de 10mm (DE 3,0) produciéndose una disminución significativa de la misma en 25 casos (71,4%) y desapareciendo totalmente en 6 (17,1%). No hubo cambios en 10 casos (28,5%) y no se objetivó ningún aumento de la IPA. La hidronefrosis mejoró en 5 casos (71,4%), manteniéndose sin cambios en 2 pacientes (28,5%), los cuales no presentaron un empeoramiento de su función renal durante el seguimiento. No hubo ningún caso de hidronefrosis que apareciese tras la cirugía. Todos los catéteres doble-J implantados previo a la intervención fueron retirados durante los primeros seis meses del postoperatorio, sin complicaciones posteriores.
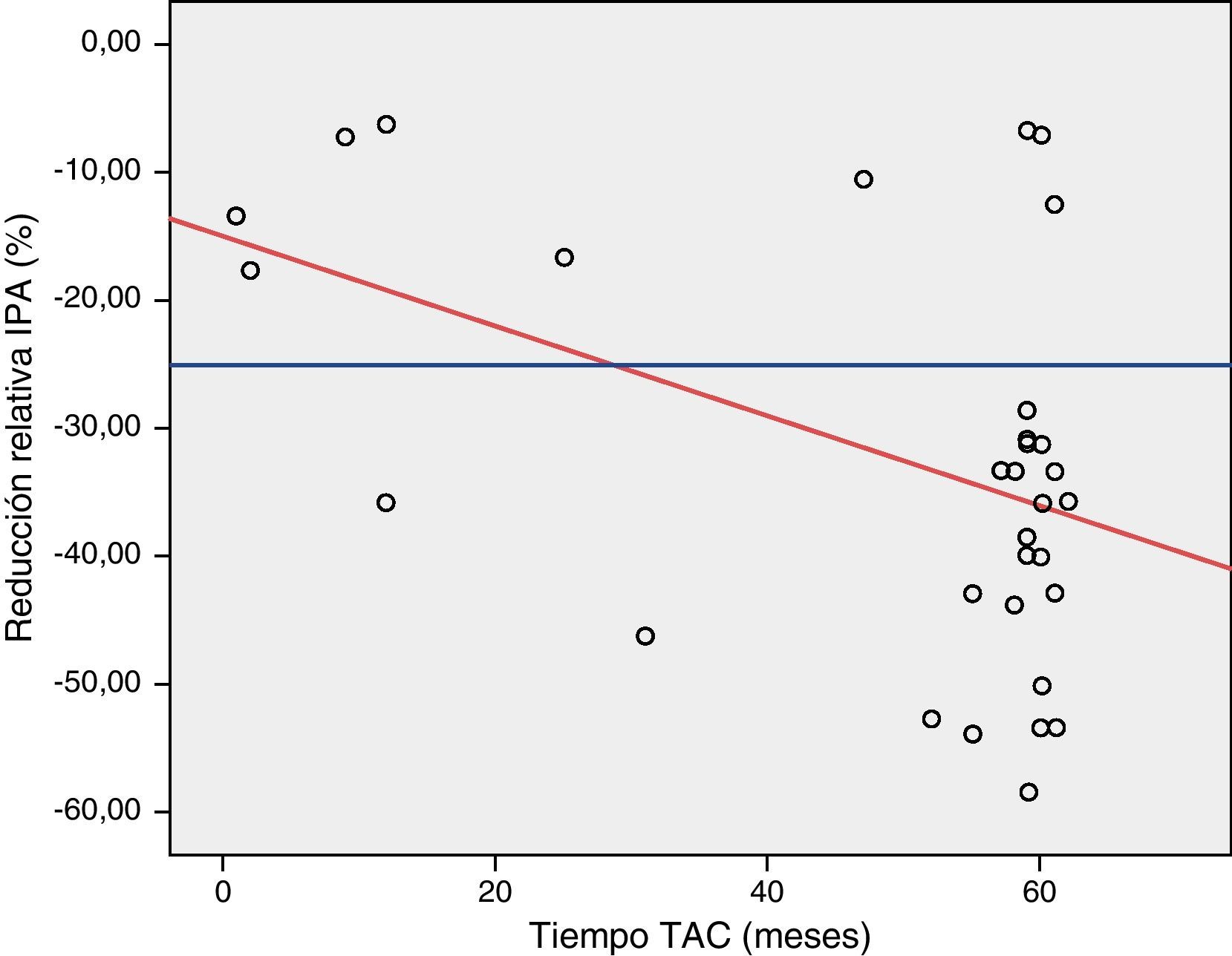
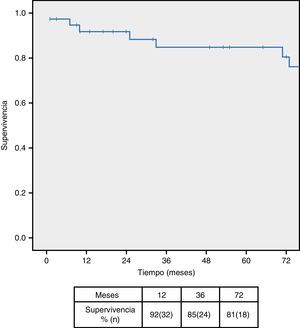
En el estudio mediante el test de ANCOVA encontramos una reducción del 0.3% del espesor máximo de la IPA por cada incremento de un mes en el tiempo de realización del TAC (fig. 3). Mediante el test exacto de Fisher encontramos una reducción mayor del 25% del espesor de la IPA en un porcentaje significativo de pacientes a partir del noveno mes de seguimiento (p 0.02). La presencia de un aneurisma ilíaco se asoció de forma significativa con la hidronefrosis preoperatoria (p 0,02, OR 8,5, IC 95% 1,3-54).
DiscusiónEn 1972, Walker et al. describieron los AIAA y los definieron como una entidad clínica y fisiopatológica distinta al AAA aterosclerótico, teoría que ha sido puesta en duda por estudios posteriores. Así pues, existe controversia en cuanto a su etiología y su mecanismo fisiopatológico. Se han propuesto diferentes factores tanto ambientales como genéticos implicados en la patogenia de los AIAA. Así, Rose et al. demostraron cambios inflamatorios de intensidad variable en todos los AAA estudiados, siendo considerado el AIAA el extremo de la reacción inflamatoria presente en todos los AAA en mayor o menor grado11. Posteriormente, Haug et al. propusieron un mecanismo autoinmune como desencadenante de la reacción inflamatoria, observando un aumento de la incidencia de enfermedades autoinmunes como el lupus eritematoso sistémico o la artritis reumatoide en los pacientes con un AIAA12. En 1994, Tanaka et al. sugirieron que la inflamación de la pared aórtica podría ser una respuesta a una infección por virus herpes simplex o citomegalovirus13,14. De igual manera, existe una fuerte carga genética implicada en el desarrollo del AIAA. Se estima que un 17% de los pacientes con AIAA tienen un antecedente familiar de AAA10. Rasmussen et al. identificaron en 2001 un factor de riesgo genético asignado al locus HLA-DR B1 presente en pacientes con un AIAA15. En definitiva, y de acuerdo con lo referido por Palmisano et al. en 2009, la patogenia de la IPA está aún por aclarar, siendo lo más probable que se trate de un proceso multifactorial en el que se ven involucrados factores genéticos y ambientales conectados entre sí mediante mecanismos inmunomediados16.
El AIAA se caracteriza por los cambios inflamatorios presentes tanto en la pared aórtica como en los tejidos periaórticos, existiendo también controversia acerca de la evolución de los mismos tras el tratamiento quirúrgico. Así, en un metaanálisis reciente, la IPA disminuye tras la exclusión del AIAA independientemente de la técnica utilizada (73% tras cirugía convencional vs. 65% tras EVAR p>0,05)17. Dichos resultados coinciden con la evolución de la IPA en nuestra serie. Cabe destacar que esta desapareció completamente en tan solo un 17% de los casos, en contra de publicaciones previas, en las que la IPA desaparece completamente tras la exclusión del AIAA. En nuestra serie hemos encontrado una reducción del 0,3% por cada mes de seguimiento, siendo significativa a partir del noveno mes postoperatorio.
La afectación ureteral por la IPA es uno de los puntos más estudiados dentro de esta entidad. Así, en nuestro estudio encontramos un 58,3% de los pacientes con afectación ureteral, de los cuales un 33% en la TAC preoperatoria presentaba hidronefrosis, frente al 20% descrito en la literatura5. Existe controversia en cuanto al manejo de estos pacientes. Los primeros estudios defendían la ureterolisis en todos aquellos casos con afectación ureteral a pesar de un aumento de la morbilidad quirúrgica18,19. Actualmente, el manejo de estos pacientes tiende a ser más conservador. Un estudio multicéntrico realizado en Suecia analiza 39 AIAA con afectación ureteral, realizándose ureterolisis en 19 casos. Concluye que no existen diferencias en la función renal durante el seguimiento entre ambos grupos20. Speziale et al. publican en 2001 en estudio en el que se analizan 14 pacientes con AIAA y afectación ureteral. En 12 casos no se realiza ureterolisis, de estos, 11 pacientes (91%) presenta una mejoría de la función renal durante el seguimiento21. En un metaanálisis publicado en 2009 la ureterolisis no se asocia de forma significativa a una mejoría de la hidronefrosis durante el seguimiento17. En nuestra serie realizamos un manejo conservador de los casos con afectación ureteral y se implantó un catéter doble J en los casos con insuficiencia renal posrrenal. Observamos una mejoría de la hidronefrosis en el 71% de los casos tras la cirugía.
En lo referente a los RFA, tanto la PCR como la VSG estaban elevadas en el estudio preoperatorio, estando aumentada esta última hasta en el 81.5% de los casos de nuestra serie, cifras similares a lo referido en la literatura1,9,10. Publicaciones actuales describen la utilidad de la VSG y PCR no solo en el diagnóstico, sino también en el seguimiento para monitorizar la evolución de la IPA22. En nuestra serie encontramos una reducción significativa de la VSG y PCR tras la cirugía, aunque con unos valores medios postoperatorios levemente elevados. Esto apoyaría la evolución postoperatoria de la IPA descrita previamente, la cual disminuye en la mayoría de los casos pero tan solo desaparece en el 17% de los pacientes.
En cuanto a los resultados en términos de morbimortalidad de la reparación abierta de los AIAA, Paravastu et al. describen una mortalidad a 30 días del 6,2 y del 14% al año, levemente superior al 2,6 y 8%, respectivamente, encontrado en nuestra serie. El autor concluye que la mortalidad a 30 días del tratamiento quirúrgico del AIAA es comparable a la del AAA arterioesclerótico17.
Las principales limitaciones del estudio son el diseño retrospectivo del mismo y el pequeño tamaño muestral. Dado que la recogida de la información ha sido retrospectiva y que carece de sentido longitudinal, cada paciente tiene una sola TAC de control durante el seguimiento, es necesario diseñar un estudio prospectivo con un protocolo de TAC en el postoperatorio para conocer la evolución de la IPA con un nivel de evidencia suficiente.
ConclusiónA pesar de las limitaciones del estudio, la cirugía electiva del AIAA ofrece unos buenos resultados a corto y largo plazo en términos de morbimortalidad. El manejo conservador de la hidronefrosis se ha asociado con buenos resultados, mejorando en la mayoría de los pacientes. Se produce una disminución significativa tanto de los RFA como de la IPA durante el seguimiento, esta última especialmente a partir del noveno mes postoperatorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.