Los estrógenos han sido implicados en el desarrollo de patología aterosclerótica a nivel de las extremidades inferiores y la aorta abdominal. El estudio de la historia reproductiva de las pacientes con estenosis carotídea puede contribuir al conocimiento de los factores de riesgo de aterosclerosis. El objetivo principal de este estudio fue investigar si existen diferencias en la historia reproductiva entre mujeres con patología oclusiva carotídea y mujeres sanas, así como su influencia en el grado de severidad de la misma.
Material y métodosSe realizó un estudio de casos y controles incluyendo a 153 pacientes con (78) y sin (75) patología oclusiva carotídea. Las pacientes con estenosis de carótida se subdividieron según el estudio mediante eco-Doppler en ligera (< 30%, 16,6%), moderada (30-49%, 16,6%), significativa (50-60%, 12,8%), severa (70-99%, 34,6%) y trombosada (100%, 19,2%). Se utilizó un cuestionario validado de 54 preguntas para obtener información sobre historia reproductiva (edad de menarquia y menopausia, número de hijos, uso de anticonceptivos y terapia hormonal sustitutiva y cirugía ginecológica), comorbilidades (diabetes, dislipidemia, tabaquismo, cardiopatía y enfermedad arterial periférica) y tratamiento farmacológico concomitante.
ResultadosAmbos grupos fueron comparables en edad, peso, altura y comorbilidades. Se encontraron diferencias significativas en cuanto al número de hijos (1,4 ± 1 vs. 3,2 ± 2, p = 0,04) y uso de estatinas (92,0 ± 28% vs. 13,3 ± 35%, p = 0,02), siendo mayor en el grupo de mujeres con patología carotídea. La influencia de posibles factores hormonales como la edad de menarquia y menopausia, así como la toma de anticonceptivos orales o sustitutos estrogénicos, no se demostró durante el estudio. No existieron diferencias significativas en la historia reproductiva entre los diferentes grados de estenosis carotídea.
ConclusionesLa multiparidad se asocia a un incremento de patología oclusiva carotídea. Este hallazgo sugiere que la maternidad podría comportarse como un factor de riesgo aterosclerótico y debería considerarse al establecer el riesgo cardiovascular en mujeres. El verdadero papel de los estrógenos sobre la patología oclusiva carotídea necesita ser todavía estudiado.
Estrogens have been implicated in the development of atherosclerotic disease in the lower limbs and abdominal aorta. The reproductive history study of patients with carotid stenosis may contribute to the understanding of the risk factors for atherosclerosis. The main objective of this study was to investigate whether there are differences in reproductive history between women with carotid occlusive disease and healthy women, and the influence of these differences on its severity.
Material and methodsA case-control study was conducted on 153 patients with (78), and without (75) carotid occlusive disease. Patients with carotid stenosis were sub-divided according to the Doppler ultrasound results, into slight (<30%, 16.6%), moderate (30-49%, 16.6%), significant (50-60%, 12.8%), severe (70-99%, 34.6%), and thrombosed (100%, 19.2%). A validated questionnaire of 54 questions was used to gather information on reproductive history (age at menarche and menopause, number of children, use of contraceptives and hormone replacement therapy, and gynecological surgery), comorbidities (diabetes, dyslipidemia, smoking, coronary artery disease, and peripheral artery disease), and concomitant drug therapy.
ResultsBoth groups were comparable in age, weight, height, and comorbidities. There were significant differences in the number of children (1.4 ± 1 vs 3.2 ± 2, P=.04) and statin use (92.0 ± 28% vs 13.3 ± 35%, P=.02), being higher in the group of women with carotid disease. The possible influence of hormonal factors such as age at menarche and menopause, as well as oral contraceptives or estrogen replacement was not demonstrated during the study. No significant differences were found in reproductive history between different degrees of carotid stenosis.
ConclusionsMultiparity is associated with increased carotid occlusive disease. This finding suggests that motherhood might behave as an atherosclerotic risk factor and should be considered when determining cardiovascular risk in women. The real role of estrogen in carotid occlusive disease still needs to be studied.
Los accidentes cerebrovasculares son responsables de 4,5 millones de muertes en el mundo cada año, siendo la tercera causa de muerte en los países desarrollados. La incidencia de ictus nuevos se aproxima a 160 por 100.000 habitantes y año. Aproximadamente, el 80% de los casos se debe a una etiología isquémica, siendo la causa más frecuente las lesiones oclusivas en el origen de la arteria carótida interna. La mortalidad asociada se encuentra entre un 10% y un 30%, con un elevado riesgo de recurrencia1,2. Las posibles secuelas son potencialmente invalidantes, con una gran carga socioeconómica3. Por ello, el estudio de aquellos factores epidemiológicos que contribuyen al desarrollo de esta enfermedad tiene una gran importancia en la prevención de la misma.
Distintos estudios han demostrado la existencia de diferencias entre hombres y mujeres en cuanto aterosclerosis. La incidencia de ictus, en general, es mayor en los hombres; sin embargo, a partir de los 85 años se hace mayor en las mujeres4,5. Por otra parte, la gravedad de un accidente cerebrovascular tiende a ser mayor en la mujer que en el hombre6. El sexo femenino se asocia a una peor recuperación funcional tras un accidente cerebrovascular agudo. La incidencia de enfermedad coronaria aumenta tras la menopausia y los niveles bajos de estradiol se han asociado al desarrollo de enfermedad coronaria precoz en la mujer7. Sin embargo, no se ha demostrado que la terapia hormonal sustitutiva suponga un factor protector8.
En el estudio de Hultgren et al. se busca la relación entre la historia reproductiva en la mujer y la enfermedad arterial periférica de las extremidades inferiores, utilizando un cuestionario sobre factores reproductivos y salud en general. La principal observación de este estudio fue, sorprendentemente, un menor uso de anticonceptivos orales en las mujeres con enfermedad arterial periférica. Los datos de este estudio indican que la historia reproductiva tiene menor importancia en la enfermedad arterial periférica que en otras manifestaciones de la aterosclerosis, como la enfermedad coronaria9. En un estudio de estructura similar, Villard et al. buscan la relación entre la historia reproductiva femenina y los aneurismas de aorta abdominal. No encontraron diferencias en la historia reproductiva al comparar ambos grupos de pacientes. Sin embargo, se observó que aquellas mujeres con aneurismas de mayor tamaño frecuentemente habían alcanzado la menopausia en edad más joven lo cual podría influir en un desarrollo más temprano de patología aneurismática, así como en un mayor crecimiento de los aneurismas10.
Se ha asociado la presencia de factores reproductivos como una menopausia temprana o la multiparidad a un mayor riesgo de coronariopatía, enfermedad arterial periférica o el desarrollo de enfermedad aneurismática de la aorta abdominal. Por otra parte, factores relacionados con los niveles de estrógenos endógenos diferencian a hombres y mujeres en la edad de aparición de estas patologías ateroscleróticas. Así pues, si existen factores relacionados con la historia reproductiva en la mujer que se asocien al desarrollo de estas patologías, deben existir del mismo modo factores que influyan en el desarrollo de aterosclerosis a nivel carotídeo y puedan suponer un factor de riesgo a tener en cuenta en el manejo de la prevención de la enfermedad cerebrovascular.
El objetivo principal de este estudio fue identificar aquellos factores relacionados con la historia reproductiva femenina que puedan contribuir al desarrollo de aterosclerosis a nivel de la bifurcación carotídea, comparando la historia reproductiva de 2 grupos de mujeres, uno con estenosis carotídea y otro sin ella.
Como objetivo secundario nos planteamos investigar si la historia reproductiva influye en el grado de estenosis carotídea de la paciente
Material y métodosSe diseñó un estudio observacional de casos y controles longitudinal, con recogida de las variables de forma prospectiva, con el objetivo de comparar la historia reproductiva femenina entre mujeres con y sin aterosclerosis a nivel de la bifurcación carotídea.
Población del estudioSe calculó el tamaño muestral del estudio para detectar diferencias medias de 3 años en la edad de menopausia (estimada en 49 años en los casos y 51 años en los controles, con una DE 4). Para detectar un 10% de diferencia entre los grupos con una probabilidad de error del 5%, se determinó que 73 pacientes deberían ser suficientes en cada grupo.
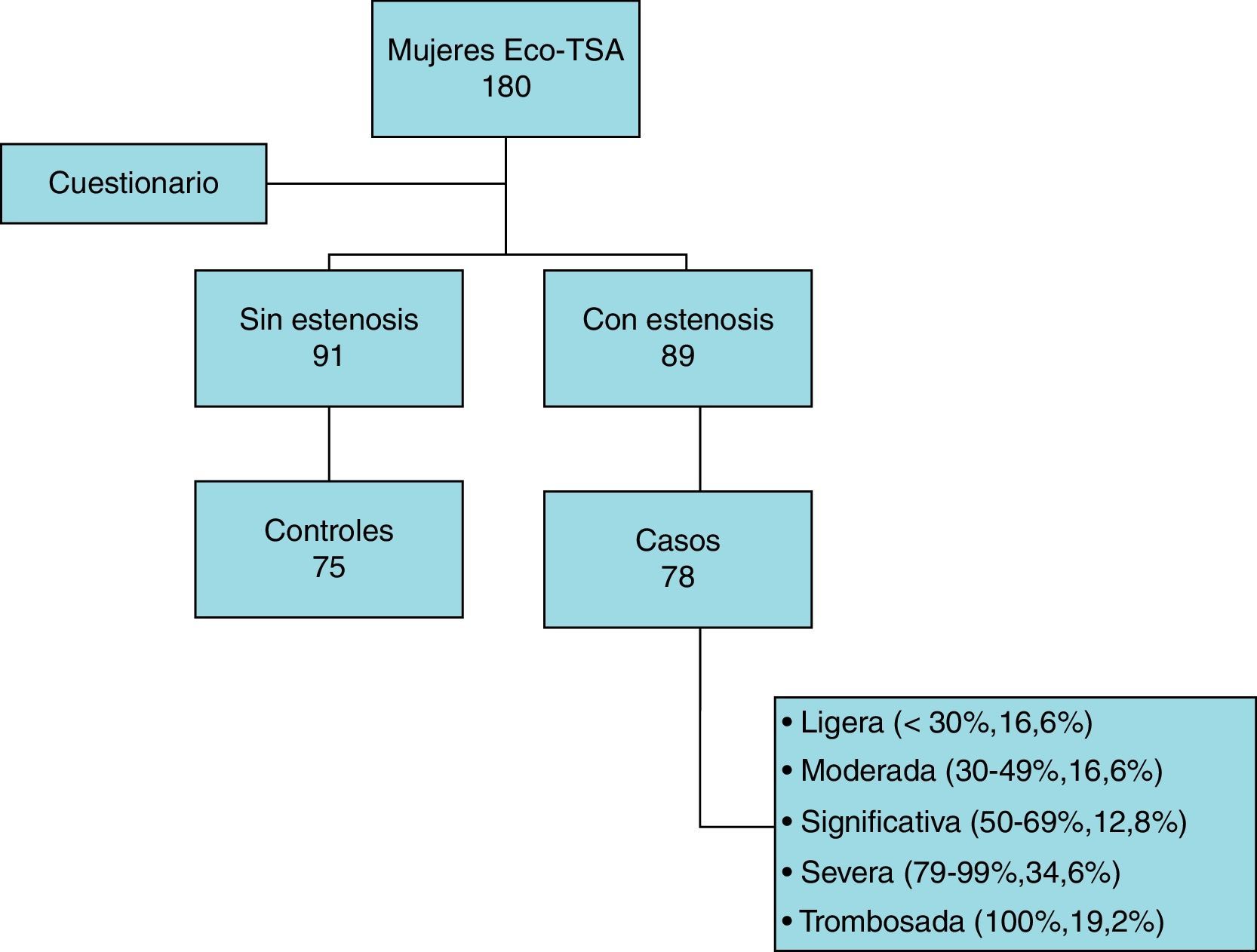
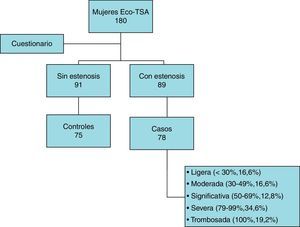
Se ofreció participar en el estudio a 180 mujeres a las que se había realizado un estudio de ecografía-Doppler de troncos supraaórticos de forma consecutiva. La ecografía fue realizada por un solo explorador experto. Se dividieron en 2 grupos, 91 mujeres sin estenosis carotídea y 89 con estenosis. Del grupo de mujeres sin estenosis carotídea, aceptaron participar en el estudio un total de 75, que formaron el grupo de los controles (participación de 82,4%); mientras que aceptaron 78 mujeres del grupo de pacientes con estenosis, formando el grupo de los casos (participación de 87,6%) (fig. 1).
El grupo de pacientes con estenosis carotídea se dividió en subgrupos según el grado de estenosis: ligera (estenosis < 30%, 16,6%), moderada (estenosis 30-49%, 16,6%), significativa (estenosis 50-69%, 12,8%), severa (estenosis 70-99%, 34,6%) y trombosada (estenosis 100%, 19,2%).
Protocolo de estudioSe utilizó un cuestionario de 54 preguntas acerca de salud en general e historia reproductiva femenina con formato similar al utilizado en los estudios publicados por Hultgren et al. y Villard et al.9,10. Las preguntas fueron abiertas (edad, peso, talla…) o de respuesta múltiple (sí, no, no sé) (véase el anexo).
Las preguntas acerca de salud se centraron en antecedentes de infarto agudo de miocardio, enfermedad arterial periférica, cardiopatía, diabetes mellitus, dislipidemia, hipertensión arterial y hábito tabáquico así como el índice de masa corporal y el uso de estatinas, antiagregantes, anticoagulantes y antihipertensivos.
Las cuestiones sobre historia reproductiva incluyeron la edad de menarquia y menopausia, el número de embarazos, el uso de anticonceptivos orales o terapia hormonal sustitutiva, cirugía ginecológica y el tratamiento para el cáncer de mama.
El 20% de los cuestionarios fueron validados comparando las respuestas con los datos recogidos en la historia clínica de las pacientes. Todas las respuestas sobre condiciones de comorbilidad concordaron con la información de los archivos del hospital.
Análisis e interpretación de los datosLa información generada en los cuestionarios se incluyó en una base de datos y fue clasificada para permitir su análisis.
La terapia anticonceptiva se definió como el uso de píldoras anticonceptivas que contuviesen estrógenos, progestágenos o ambos. La intervención ginecológica fue definida como la realización de histerectomía, salpingooforectomía o ambas. La terapia hormonal sustitutiva fue definida como el uso de terapia hormonal oral o exógena como tratamiento de los síntomas de la menopausia.
Dentro del grupo de mujeres con estenosis carotídea, se analizaron separadamente los subgrupos según el nivel de severidad de dicha estenosis (ligera, moderada, significativa, severa o trombosada).
Se utilizó el software SPSS para el análisis estadístico y se comprobó la normalidad de la muestra. Se utilizó el test de la t de Student para la comparación de las variables cuantitativas. Las comparaciones entre las variables cualitativas se realizaron mediante el test de la chi al cuadrado. La influencia de la edad, la toma de anticonceptivos orales y la terapia hormonal sustitutiva fueron evaluadas mediante análisis de regresión logística.
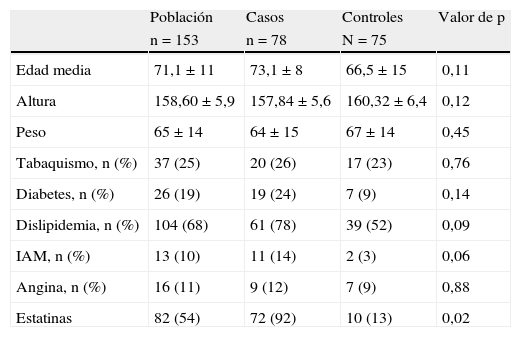
ResultadosLa edad media de la muestra fue de 71,1 años (73,1% casos vs. 66,5% controles, p = 0,11). La altura media de las mujeres fue de 158,6cm (157,8 casos vs. 160,3 controles, p = 0,12), con un peso medio de 65 kg (64 casos vs. 67 controles, p = 0,45).
Ambos grupos resultaron comparables en cuanto a factores de salud en general, como hábito tabáquico (26% vs. 23%, p = 0,76), diabetes mellitus (24% vs. 9%, p = 0,14), dislipidemia (78% vs. 52% p = 0,09), infarto agudo de miocardio (14% vs. 3%, p = 0,06) y angina (12% vs. 9%, p = 0,88) (tabla 1).
Características básicas e historia médica en casos y controles
| Población | Casos | Controles | Valor de p | |
| n=153 | n=78 | N=75 | ||
| Edad media | 71,1±11 | 73,1±8 | 66,5±15 | 0,11 |
| Altura | 158,60±5,9 | 157,84±5,6 | 160,32±6,4 | 0,12 |
| Peso | 65±14 | 64±15 | 67±14 | 0,45 |
| Tabaquismo, n (%) | 37 (25) | 20 (26) | 17 (23) | 0,76 |
| Diabetes, n (%) | 26 (19) | 19 (24) | 7 (9) | 0,14 |
| Dislipidemia, n (%) | 104 (68) | 61 (78) | 39 (52) | 0,09 |
| IAM, n (%) | 13 (10) | 11 (14) | 2 (3) | 0,06 |
| Angina, n (%) | 16 (11) | 9 (12) | 7 (9) | 0,88 |
| Estatinas | 82 (54) | 72 (92) | 10 (13) | 0,02 |
IAM: infarto agudo de miocardio.
Se encontraron diferencias estadísticamente significativas en el uso de estatinas, siendo mayor en el grupo de las pacientes con estenosis carotídea (92% vs. 13,3%, p = 0,02) (tabla 1).
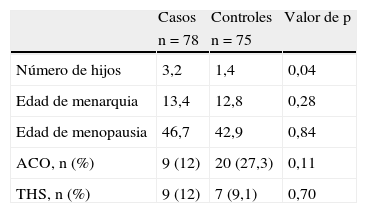
En cuanto a las variables relacionadas con la historia reproductiva, se encontraron diferencias estadísticamente significativas en el número de hijos, con una media de 3,2 hijos en el grupo de las mujeres con estenosis carotídea frente a una media de 1,4 en el grupo de las mujeres sin estenosis carotídea, con p = 0,04 (tabla 2).
Características de la historia reproductiva en casos y controles
| Casos | Controles | Valor de p | |
| n=78 | n=75 | ||
| Número de hijos | 3,2 | 1,4 | 0,04 |
| Edad de menarquia | 13,4 | 12,8 | 0,28 |
| Edad de menopausia | 46,7 | 42,9 | 0,84 |
| ACO, n (%) | 9 (12) | 20 (27,3) | 0,11 |
| THS, n (%) | 9 (12) | 7 (9,1) | 0,70 |
ACO: anticonceptivos orales; THS: terapia hormonal sustitutiva.
La edad media de la menopausia fue de 46,7 años en el grupo de los casos y 42,9 en el grupo de los controles (p = 0,84). La edad media de la menarquia fue de 13,4 en las mujeres con estenosis y de 12,8 en las mujeres sin estenosis (p = 0,28).
Tampoco se encontraron diferencias estadísticamente significativas en el uso de anticonceptivos orales y terapia hormonal sustitutiva. Un 12% de las pacientes con estenosis habían sido tomadoras de anticonceptivos orales frente a un 27,3% de las mujeres sin estenosis (p = 0,11). En el caso de la terapia hormonal sustitutiva, el 12% de las mujeres del grupo de los casos la había utilizado en algún momento de su vida, frente al 9,1% de las mujeres del grupo de los controles (p = 0,70) (tabla 2).
Dentro del grupo de mujeres con estenosis carotídea, se realizó una división de las integrantes del grupo en subgrupos según el nivel de estenosis. Del total de 78 mujeres de este grupo, 13 presentaban estenosis ligera (16,6%), 13 estenosis moderada (16,6%), 10 estenosis significativa (12,8%), 27 estenosis severa (34,6%) y 15 trombosis completa (19,2%).
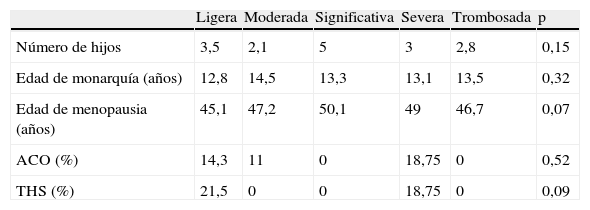
Todos los subgrupos resultaron comparables en cuanto a factores de salud en general. No se encontraron diferencias estadísticamente significativas entre subgrupos en cuanto a número de hijos, edad de menarquia y menopausia, y uso de tratamientos hormonales (tabla 3).
Características de la historia reproductiva en los subgrupos según nivel de severidad de estenosis carotídea
| Ligera | Moderada | Significativa | Severa | Trombosada | p | |
| Número de hijos | 3,5 | 2,1 | 5 | 3 | 2,8 | 0,15 |
| Edad de monarquía (años) | 12,8 | 14,5 | 13,3 | 13,1 | 13,5 | 0,32 |
| Edad de menopausia (años) | 45,1 | 47,2 | 50,1 | 49 | 46,7 | 0,07 |
| ACO (%) | 14,3 | 11 | 0 | 18,75 | 0 | 0,52 |
| THS (%) | 21,5 | 0 | 0 | 18,75 | 0 | 0,09 |
ACO: anticonceptivos orales; THS: terapia hormonal sustitutiva.
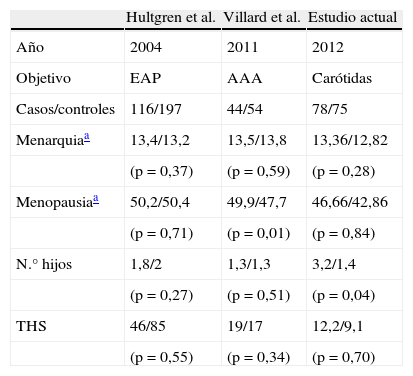
Distintos estudios han intentado encontrar aquellas características de la historia reproductiva femenina que pudieran suponer un factor de riesgo para el desarrollo de las distintas formas de aterosclerosis.
Dos de estos trabajos, al igual que nuestro estudio, presentan un diseño observacional de casos y controles en los que se busca la relación entre la historia reproductiva de la mujer y otras formas de aterosclerosis.
En el estudio realizado por Hultgren et al. en el 2004 acerca de la historia reproductiva femenina y el desarrollo de enfermedad arterial periférica, los autores concluyen que no existe ningún factor reproductivo que se asocie significativamente a la presentación de esta enfermedad9.
Por su parte, Villard et al. encuentran una asociación entre la edad de menopausia y el desarrollo de enfermedad aneurismática, de tal forma que las mujeres que tienen la menopausia a una edad más temprana tienen un mayor riesgo de desarrollo precoz y de mayor intensidad de enfermedad aneurismática10.
En el presente estudio, no se ha encontrado relación entre la aterosclerosis carotídea y una menopausia precoz; sin embargo, sí se ha encontrado una asociación estadísticamente significativa entre la multiparidad y el desarrollo de esta patología (tabla 4).
Estudios sobre historia reproductiva femenina y aterosclerosis
| Hultgren et al. | Villard et al. | Estudio actual | |
| Año | 2004 | 2011 | 2012 |
| Objetivo | EAP | AAA | Carótidas |
| Casos/controles | 116/197 | 44/54 | 78/75 |
| Menarquiaa | 13,4/13,2 | 13,5/13,8 | 13,36/12,82 |
| (p = 0,37) | (p = 0,59) | (p = 0,28) | |
| Menopausiaa | 50,2/50,4 | 49,9/47,7 | 46,66/42,86 |
| (p = 0,71) | (p = 0,01) | (p = 0,84) | |
| N.° hijos | 1,8/2 | 1,3/1,3 | 3,2/1,4 |
| (p = 0,27) | (p = 0,51) | (p = 0,04) | |
| THS | 46/85 | 19/17 | 12,2/9,1 |
| (p = 0,55) | (p = 0,34) | (p = 0,70) |
AAA: aneurisma de aorta abdominal; EAP: enfermedad arterial periférica; THS: terapia hormonal sustitutiva.
El otro hallazgo que resultó estadísticamente significativo en este estudio fue la presencia de un mayor uso de estatinas entre las mujeres que presentan estenosis carotídea. Sin embargo, no se encontraron diferencias significativas entre ambos grupos en la prevalencia de dislipidemia. Pensamos que este hallazgo se explica por el hecho de que las estatinas forman parte del tratamiento de la estenosis carotídea, así como de otras arteriopatías; de este modo, el 92% de mujeres que tomaban estatinas en el grupo de los casos corresponden a mujeres ya diagnosticadas de enfermedad carotídea que se sometían a un control ecográfico en el momento del estudio, que recibían tratamiento con estatinas para su estenosis carotídea independientemente de si presentaban o no dislipidemia.
No se encontraron diferencias significativas en el análisis por subgrupos según el grado de estenosis de los factores reproductivos femeninos. Si bien es preciso tener en cuenta que el número de pacientes de cada grupo es muy pequeño y puede ser insuficiente para encontrar diferencias estadísticamente significativas.
Existe la evidencia de que las mujeres disfrutan de protección frente a eventos cardiovasculares comparadas con los hombres, tanto que tienen 3 veces más probabilidad de sobrevivir a los 90 años. Es lógico pensar que los estrógenos tienen un importante papel en el endotelio vascular, que protege a las mujeres del desarrollo de aterosclerosis. Sin embargo, los distintos estudios sobre el uso de terapia hormonal sustitutiva no han demostrado beneficio en el uso de la misma como protección frente a eventos cardiovasculares.
Abundantes datos experimentales indican que los estrógenos tienen efecto neuroprotector11. Los estrógenos actúan sobre el cerebro de ambas formas, dependiente del receptor e independiente del receptor, principalmente manteniendo la viabilidad neuronal y el flujo sanguíneo cerebral. Algunos estudios indican que concentraciones fisiológicas de estradiol tienen efecto protector por mecanismos dependientes del receptor que permiten, en último término, la expresión de genes que promueven la supervivencia cerebral4. Los estrógenos influyen sobre los niveles de endotelina, la cual no es solo un vasoconstrictor, sino que también interactúa con otros factores para promover la coagulación y la proliferación vascular. En el estudio de Polderman se evidencia que las mujeres presentan niveles más bajos de endotelina que los hombres y que cuando estos se someten a cirugía de cambio de sexo y terapia hormonal sus niveles de endotelina se modifican hasta alcanzar los niveles característicos de su nuevo sexo12. Tanto la estenosis como el área de placa carotídea aumentan con la edad en ambos sexos; sin embargo, a cualquier edad, las mujeres presentan más estenosis y los hombres más placa. Estas diferencias parecen estar relacionadas con los efectos de las hormonas sexuales en el remodelado arterial13.
En los últimos años, el concepto del «síndrome metabólico de la menopausia» descrito por Spencer ha ganado popularidad4,14. Según este autor, durante la menopausia se producen una serie de alteraciones relacionadas con el déficit de estrógenos que llevarían a crear un perfil metabólico desfavorable para el desarrollo de patología cardiovascular. Las principales características de este síndrome incluyen la ganancia de peso, cambios en el perfil lipídico (aumento de LDL y triglicéridos, así como descenso de HDL), resistencia insulínica, disfunción endotelial, incremento de los niveles de homocisteína, lipoproteína y varios factores de la coagulación, así como factores fibrinolíticos. El resultado final de todos estos cambios metabólicos supondría un incremento del riesgo para el desarrollo de enfermedad cardiovascular y aterosclerosis. En efecto, el grosor de la pared carotídea, la cual se considera como un buen indicador de aterosclerosis carotídea, aumenta tras la menopausia según muchos estudios.
En la presente muestra, sin embargo, no se ha encontrado una asociación entre la edad de la menopausia y el desarrollo de aterosclerosis carotídea. De hecho, en contra de lo esperable, la edad media de la menopausia es mayor en el grupo de las mujeres con patología carotídea (46,7 años en los casos vs. 42,9 años en los controles). Sin embargo, la edad de la menarquia también es mayor en el grupo de los casos (13,4 años en los casos vs. 12,8 años en los controles). Esto supone que el tiempo total de exposición a estrógenos endógenos es similar en ambos grupos, aproximadamente 32 años. Pensamos que es el tiempo de exposición a estrógenos naturales el responsable de los efectos sobre la aterosclerosis y no la edad de la menopausia en sí misma. Esta circunstancia explicaría que en nuestra muestra no hayamos encontrado diferencias estadísticamente significativas entre la edad de menopausia y el desarrollo de aterosclerosis, como ocurre en otros estudios.
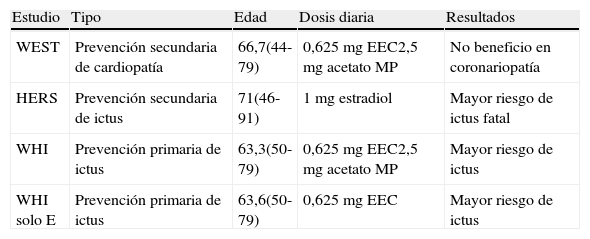
Tras las evidencias de la relación entre los estrógenos y la aterosclerosis, el desarrollo de la terapia hormonal sustitutiva parecía prometedor. Sin embargo, el resultado ha sido muy controvertido. Los primeros estudios observacionales de los años 80 y 90 arrojaron resultados muy positivos, como en el Lipid Research Clinic Program Follow up. En el Nurses’ Health Study se describió un incremento precoz de los fenómenos trombóticos con una posterior reducción de los eventos vasculares. Sin embargo, en el estudio Framingham, así como en el estudio Kaiser, se encontró un mayor riesgo de enfermedad coronaria8. Tras estos estudios observacionales, se diseñaron otros estudios experimentales, el más importante de los cuales es el Women's Health Initiative, en el que se concluyó no solo que no existe beneficio, sino que incluso existe un aumento significativo del riesgo de enfermedad coronaria en el uso de estrógenos y progestágenos, y un aumento del riesgo de ictus tanto en el uso de estrógenos y progestágenos como de estrógenos solos15,16 (tabla 5).
Estudios experimentales sobre terapia hormonal sustitutiva
| Estudio | Tipo | Edad | Dosis diaria | Resultados |
| WEST | Prevención secundaria de cardiopatía | 66,7(44-79) | 0,625 mg EEC2,5 mg acetato MP | No beneficio en coronariopatía |
| HERS | Prevención secundaria de ictus | 71(46-91) | 1 mg estradiol | Mayor riesgo de ictus fatal |
| WHI | Prevención primaria de ictus | 63,3(50-79) | 0,625 mg EEC2,5 mg acetato MP | Mayor riesgo de ictus |
| WHI solo E | Prevención primaria de ictus | 63,6(50-79) | 0,625 mg EEC | Mayor riesgo de ictus |
EEC: Estrógeno equino conjugado; HERS: Heart and Estrogen-Progestin Replacement Study; MP: medroxiprogesterona; WEST: Women's Estrogen for Stroke Trial; WHI: Women's Heart Initiative.
Modificado de Turtzo y McCullough5.
En nuestro estudio, no se han encontrado diferencias significativas en el uso de terapia hormonal sustitutiva entre el grupo de los casos y los controles, así como en el uso de anticonceptivos orales. Sin embargo, hay que tener en cuenta que el número total de pacientes en bajo tratamiento hormonal en la muestra es muy bajo, lo cual es esperable si se tiene en cuenta la edad media de las pacientes de la muestra y la poca disponibilidad de estos tratamientos en España en los años en los que hubiera estado indicado en estas mujeres.
La principal observación de nuestro estudio fue que las mujeres con estenosis carotídea presentaban un mayor número de hijos que las mujeres del grupo control. Este hallazgo coincide con otros estudios, como el estudio Rotterdam17. En este estudio se examina la asociación entre la paridad y los factores de riesgo cardiovascular y la presencia de aterosclerosis carotídea. Los autores encuentran que el riesgo de aterosclerosis carotídea es un 36% mayor en mujeres multíparas que en nulíparas y aumenta hasta un 64% en mujeres con más de 4 hijos, no disminuyendo la magnitud de esta asociación tras ajustar el análisis según factores de riesgo cardiovascular conocidos, incluidos la resistencia insulínica y los niveles lipídicos.
En el estudio de Skilton et al. del 2009, se evalúa la asociación entre el número de hijos y la aterosclerosis carotídea en mujeres y hombres jóvenes, con el objetivo de dilucidar si esta relación entre la paridad y la patología carotídea se relaciona predominantemente con la maternidad o con la crianza de los hijos18. Los resultados del estudio demuestran una asociación entre el mayor número de hijos y la aterosclerosis carotídea entre las mujeres jóvenes, pero no entre los hombres, y que es la maternidad y no la crianza de los hijos la que se relaciona con el desarrollo de patología carotídea. Las mujeres con 4 o más hijos tuvieron un riesgo 2 veces mayor de tener una placa carotídea. La asociación entre paridad y aterosclerosis carotídea resultó estadísticamente significativa tras ser ajustada por factores de riesgo cardiovascular, indicando que esta asociación supone un factor de riesgo independiente.
El embarazo se asocia a una serie de cambios en la estructura y función del sistema cardiovascular. Los cambios en las concentraciones de lipoproteínas e insulina tienen particular interés, dado que los niveles de lípidos (HDL, triglicéridos) y la diabetes son factores de riesgo cardiovascular mucho más fuertes en las mujeres que en los hombres. Los niveles de colesterol total, LDL y triglicéridos aumentan progresivamente durante el embarazo. Mientras que los niveles de triglicéridos descienden rápidamente tras el parto, el colesterol total y los niveles de LDL requieren mucho más tiempo para volver a sus niveles basales. Por otra parte, el embarazo ha demostrado tener un efecto desfavorable en los niveles de HDL, los cuales alcanzan un pico en la mitad de la gestación para después caer por debajo de los niveles basales. Además, el embarazo se asocia a niveles más altos de insulina, que tienden a persistir tras el embarazo. Estos cambios en los niveles de lipoproteínas y el metabolismo de la glucosa parecen ser el mecanismo que explicaría la asociación observada entre la multiparidad y la enfermedad cardiovascular. La modificación en la exposición a hormonas sexuales durante cada embarazo parece, por tanto, favorecer el desarrollo de aterosclerosis en etapas posteriores de la vida. Los embarazos repetidos podrían conllevar una alteración crónica del metabolismo, como un aumento de la adiposidad, de la resistencia insulínica y de la glucemia, lo que predispone a la formación de lesiones aterosclerosas18.
Algunos autores han especulado que la asociación entre la multiparidad y la enfermedad cardiovascular podría estar mediada por el estatus socioeconómico. El estudio Rotterdam demostró la esperada asociación entre un menor número de hijos y niveles más altos de educación, ingresos y nivel ocupacional. Realizando el análisis con un modelo univariante, el nivel socioeconómico también resultó ser un factor significativo predictor de riesgo de aterosclerosis carotídea. Sin embargo, tras ajustar a la edad y a otros factores de riesgo, el nivel socioeconómico no resultó ser un factor predictor independiente.
Como conclusión, la multiparidad parece estar relacionada con una mayor prevalencia de aterosclerosis carotídea, lo que indica la potencial importancia de considerar el número de hijos en la evaluación de los factores de riesgo para el desarrollo de esta enfermedad. Dado que se trata de un estudio de casos y controles, los resultados deben ser tomados con cautela, en espera de otros estudios que avalen estos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.