Evaluar si la inyección de trombina intrasaco durante el tratamiento endovascular (EVAR) de los aneurismas de aorta abdominal (AAA) reduce el porcentaje de fugas tipo II.
Material y métodosElaboramos un estudio de cohortes históricas de pacientes intervenidos mediante EVAR entre 2005 y 2012. Comparamos 2 grupos, uno formado por pacientes a los que realizamos EVAR de forma convencional (A) y otro al que añadimos la inyección de trombina (B). Las variables principales fueron: el porcentaje de fugas tipo II, el tiempo quirúrgico y las complicaciones relacionadas con la trombina. Analizamos los siguientes factores de control: permeabilidad de la arteria mesentérica inferior (AMI), oclusión con la endoprótesis de renales accesorias, número de lumbares permeables y antiagregación/anticoagulación postoperatoria. Calculamos los test estadísticos Chi cuadrado de Pearson, de Fisher y t de Student y como medidas de efecto, el riesgo relativo (RR) y la reducción absoluta del riesgo (RAR) con intervalos de confianza (IC) al 95%.
ResultadosEl porcentaje de fugas tipo II en el grupo A fue de 27% comparado con 16% en el grupo B (p=0,268; RR: 0,6 [IC 95%: 0,22-1,59]; RAR de 0,1% [IC 95%: −0,01-0,28]; NNT: 10). El tiempo quirúrgico fue en el grupo A de 270+65min y en el grupo B de 290+66min (p=0,156). No observamos ninguna complicación relacionada con la inyección de trombina. Detectamos como factor de interacción la permeabilidad de AMI.
ConclusionesLa inyección de trombina intrasaco es una técnica sencilla y segura que podría ser útil en la prevención de fugas tipo II, pero es conveniente realizar nuevos estudios para confirmar nuestra hipótesis.
To evaluate whether thrombin injection into the aneurysm sac during endovascular abdominal aortic aneurysm (AAA) repair reduces the percentage of type II endoleaks.
Materials and methodsAn historical cohort study was conducted on patients who underwent endovascular repair (EVAR) between 2005 and 2012. Two groups were compared; the first consisting of those who underwent conventional EVAR (A), and the second with those who had thrombin injection during the EVAR (B). The main endpoints were: the percentage of type II endoleaks, the surgical time and complications related to the thrombin injection. The control factors that were taken into account were: inferior mesenteric artery (IMA) patency, accessory renal arteries occlusion, number of lumbar arteries, and post-operative anti-platelet/anticoagulation treatment. The Pearson chi-squared, Fisher exact, and Student t tests were performed, as well as effect measurements such as, relative risk (RR), absolute risk reduction (ARR), with confidence intervals (CI) of 95%.
ResultsThe percentage of type II endoleaks in group A was 27% versus 16% in group B (P=.268; RR: 0.6 [95% CI: 0.22-1.59]; ARR 0.1% [95% CI: −0,01-0.28]; NNT: 10). Surgical time was not significantly increased with the addition of the injection technique (NT: 270+65min;T: [A: 270 + 65 min; B: 290 + 66 min. (p=.156)]]. No complications were observed with the thrombin injection.
ConclusionsThrombin injection into the aneurysm sac is a simple and safe technique, and could be useful to prevent type II endoleaks, but more studies are necessary to confirm this hypothesis.
Dentro de las posibles complicaciones del tratamiento endovascular (EVAR) en los aneurismas de aorta abdominal (AAA), la más frecuente es la fuga tipo II o reentrada, definida como la presencia de flujo retrógrado intrasaco procedente de arterias colaterales de la aorta: lumbares, renales accesorias y mesentérica inferior (AMI)1. Su incidencia según la literatura se encuentra entre el 10 y el 30%2–4.
Hay autores que han identificado factores de riesgo independientes para la aparición y persistencia de reentradas como el número de lumbares permeable y su grosor, la permeabilidad y calibre de AMI, la presencia de renales accesorias y la anticoagulación postoperatoria5–15.
La repercusión y la indicación de tratamiento de las fugas tipo II todavía se encuentran en discusión. Habitualmente presentan una evolución benigna y pueden resolverse de forma espontánea; sin embargo, en ocasiones se asocian a un constante crecimiento del AAA e incluso a su rotura16–22.
Existen métodos descritos para el tratamiento de este tipo de fugas: embolización transarterial o translumbar, punción ecoguiada de trombina en el saco aneurismático, ligadura vía laparoscópica; ninguno exento de complicaciones y, en ocasiones, con poca efectividad23–28.
Por todo esto, creemos que la mejor opción es la prevención.
El objetivo del estudio es evaluar nuestra experiencia en el uso de trombina inyectada intraoperatoriamente en el saco aneurismático, como método de prevención en la aparición de esta complicación, comparándolo con el procedimiento EVAR habitual.
Material y métodosDiseño del estudio y descripción de la muestraRealizamos un estudio analítico observacional prospectivo de cohortes históricas incluyendo a todos los pacientes intervenidos en nuestro hospital de AAA mediante EVAR, entre enero de 2005 y diciembre de 2012. Este estudio fue diseñado para comparar 2 grupos de pacientes, ambos intervenidos mediante EVAR, con la diferencia de que en uno el procedimiento realizado fue el habitual (grupo A) y en el otro se asoció inyección de trombina intrasaco intraoperatoria (grupo B).
La indicación de EVAR se basó en los siguientes criterios: abdomen hostil, comorbilidad asociada o pacientes mayores de 65 años que presentaban criterios anatómicos adecuados (longitud del cuello igual o mayor a 10mm, menos de 50% de calcio o trombo circunferencial en el cuello, angulación menor de 90°, ilíacas no tortuosas y con diámetro igual o mayor a 7mm).
La indicación de inyección de trombina se realizó según criterio del cirujano principal.
La información fue obtenida de una base de recogida de datos prospectiva, en la que están incluidos aspectos clínicos y radiológicos de cada paciente, así como evolución postoperatoria y seguimiento.
Consideramos como criterios de exclusión el éxitus precoz o seguimiento postoperatorio inferior a 6 meses.
Procedimiento quirúrgicoUtilizamos 2 modelos de endoprótesis, aortomonoilíacas y aortobiilíacas, de 3 diseños diferentes: Excluder (Gore®), Talent y Endurant (Medtronic®). En los casos en los que colocamos un dispositivo aortomonoilíaco, asociamos un oclusor contralateral y una derivación femorofemoral.
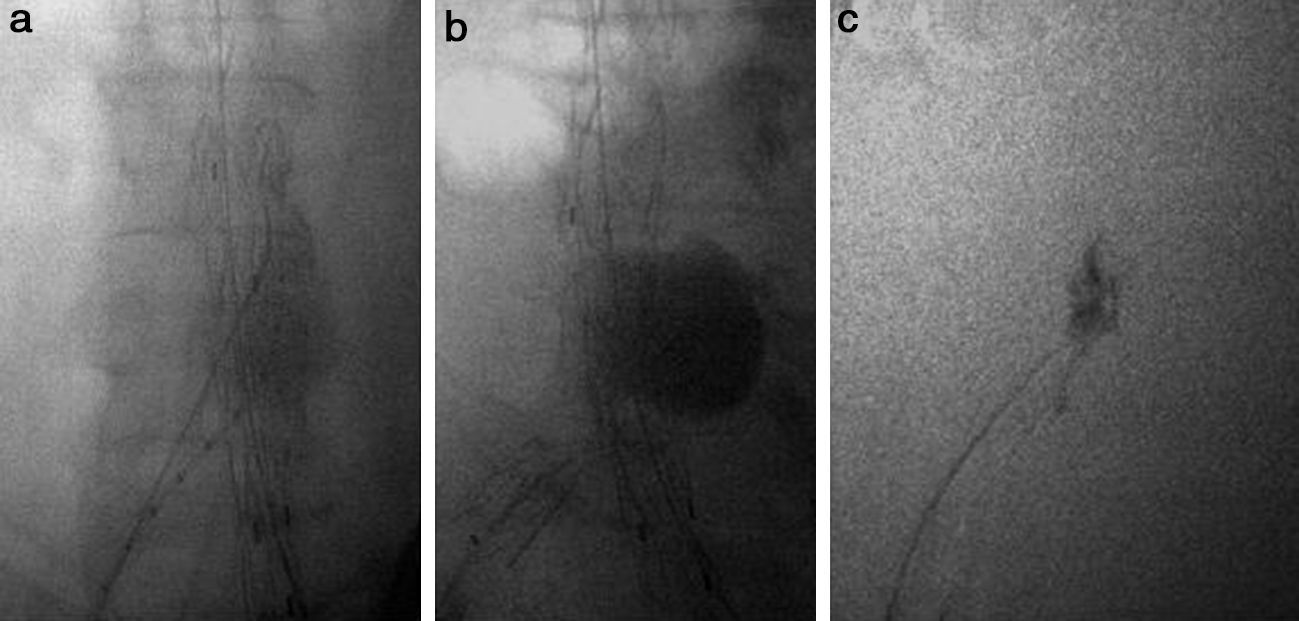
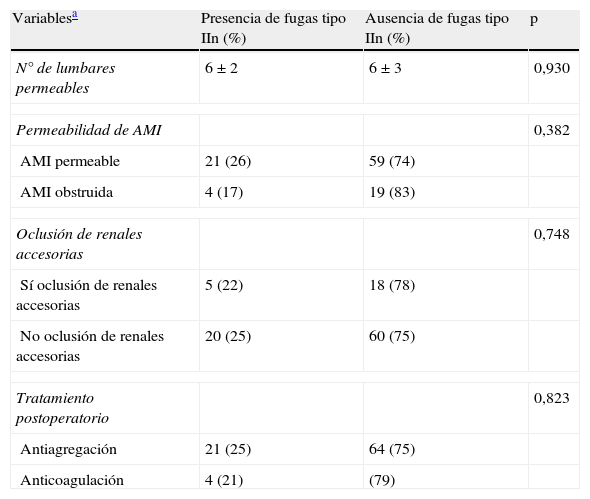
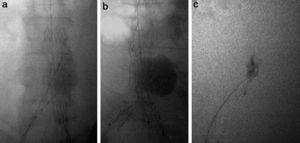
En el grupo en el que inyectamos trombina, una vez desplegado el cuerpo de la endoprótesis (según las características pertinentes de cada dispositivo) y tras haber cateterizado la rama contralateral, dejamos un catéter vertebral de 4F en el saco aneurismático de tal forma que, una vez desplegada la rama, queda emplazado entre la endoprótesis y la arteria nativa (fig. 1a). Comprobamos bajo escopia que el extremo proximal de dicha guía o catéter queda en el interior del saco aneurismático (fig. 1b).
A nivel ilíaco se coloca un balón de moldeo endoprótesis, para evitar la embolización distal de trombina. Tras comprobar la correcta colocación y anclaje de la endoprótesis, inyectamos por el catéter la trombina inflando a su vez el balón de moldeo a presiones medias. Decidimos la cantidad necesaria en dependencia del relleno persistente del saco aneurismático, con controles arteriográficos sucesivos (fig. 1c).
Al finalizar, retiramos el catéter vertebral e hinchamos totalmente el balón, moldeando el anclaje distal de la rama de la endoprótesis.
SeguimientoTodos los pacientes se incluyeron en el protocolo de seguimiento habitual del servicio que consiste en la realización de TAC periódicas, al mes y 6 meses tras la cirugía y posteriormente, anual. En cada TAC se evaluó la presencia o no de fugas tipo II y el diámetro del aneurisma excluido.
VariablesLa variable resultado principal fue el porcentaje de fugas tipo II en ambos grupos.
Las variables resultado secundarias fueron tiempo quirúrgico, complicaciones asociadas a la inyección de trombina, procedimientos asociados para tratamiento de fugas tipo II y persistencia de las fugas en la última revisión en ambos grupos.
Consideramos como fuga tipo II, las fugas procedentes de cualquier colateral de la aorta, persistentes en la primera TAC realizada durante el postoperatorio, excluyendo aquellas que aparecían en la arteriografía de comprobación intraoperatoria que no se vieron en el primer control, ni en los sucesivos.
El tiempo quirúrgico se midió en minutos; evaluamos cuánto tiempo incrementaba la inyección de trombina el acto quirúrgico.
Dentro de las posibles complicaciones relacionadas con la inyección de trombina, analizamos si hubo algún caso de embolización distal, isquemia aguda de miembros inferiores, isquemia mesentérica, paraplejía secundaria o reacción alérgica.
Para indicar el tratamiento de una fuga tipo II nos basamos en 2 criterios: uno fue la confirmación del crecimiento progresivo del saco aneurismático durante el seguimiento≥5mm, siempre y cuando el procedimiento necesario para ello fuera factible y no supusiera un riesgo inasumible para el paciente.
El otro criterio fue la permeabilidad de una colateral de la aorta de grueso calibre, bien fuera AMI o una arteria lumbar, a lo largo del seguimiento, aunque no se demostrara un crecimiento.
Realizamos además un análisis de la comorbilidad preoperatoria de los pacientes, características aneurismáticas tales como etiología, forma de presentación y anatomía, endoprótesis utilizada y tiempo de seguimiento en ambos grupos.
Por último, examinamos como posibles factores de confusión o interacción el número de lumbares permeables, la permeabilidad de AMI, la existencia de renales accesorias ocluidas con la endoprótesis intencionadamente y el tratamiento postoperatorio.
Análisis estadísticoPara el análisis descriptivo, las variables cualitativas se han expresado como porcentajes y las variables cuantitativas, como media y desviación típica.
Para comprobar la asociación entre variables se utilizaron los test estadísticos Chi cuadrado de Pearson, el test de Fisher y el test t de Student. Se utilizaron como medidas del efecto el riesgo relativo (RR), la reducción absoluta del riesgo (RAR) y el número necesario a tratar (NNT). Se analizó la existencia de factores de confusión o interacción en la relación entre la trombina y fugas tipo II mediante la realización de análisis estratificado.
La significación estadística se estableció con valores de p<0,05 y el intervalo de confianza al 95%. Se utilizó el programa IBM SPSS Statistisc versión 20.0.
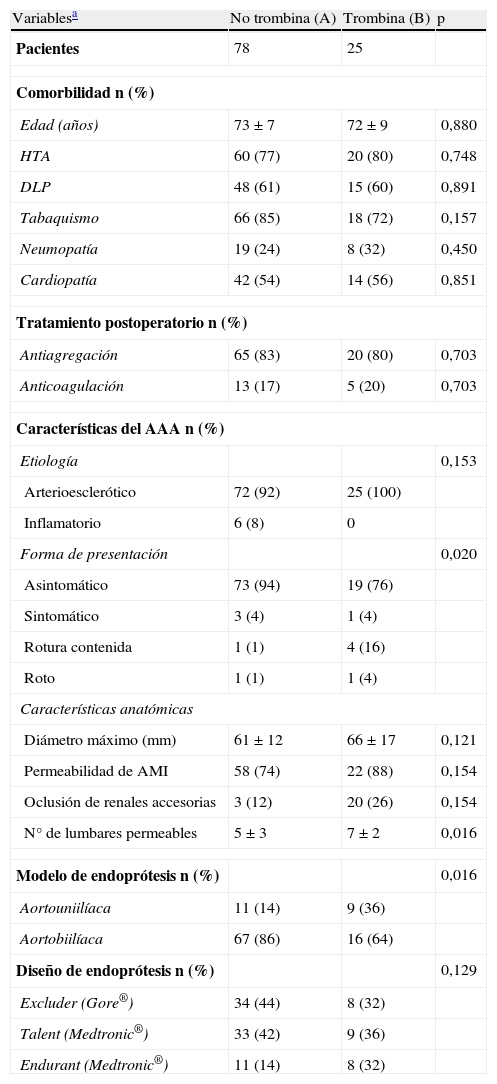
ResultadosIncluimos en el estudio a 103 pacientes; en 78 realizamos el procedimiento EVAR de la forma habitual (grupo A) y en 25 añadimos la inyección de trombina intraoperatoria (grupo B). La totalidad de la muestra fueron varones excepto una mujer del grupo A. La comorbilidad de los pacientes y las características aneurismáticas por grupos se adjuntan en la tabla 1 junto con el modelo y diseño de las endoprótesis utilizadas.
Análisis de la distribución de variables demográficas, anatómicas y dispositivos utilizados por grupos
| Variablesa | No trombina (A) | Trombina (B) | p |
| Pacientes | 78 | 25 | |
| Comorbilidad n (%) | |||
| Edad (años) | 73±7 | 72±9 | 0,880 |
| HTA | 60 (77) | 20 (80) | 0,748 |
| DLP | 48 (61) | 15 (60) | 0,891 |
| Tabaquismo | 66 (85) | 18 (72) | 0,157 |
| Neumopatía | 19 (24) | 8 (32) | 0,450 |
| Cardiopatía | 42 (54) | 14 (56) | 0,851 |
| Tratamiento postoperatorio n (%) | |||
| Antiagregación | 65 (83) | 20 (80) | 0,703 |
| Anticoagulación | 13 (17) | 5 (20) | 0,703 |
| Características del AAA n (%) | |||
| Etiología | 0,153 | ||
| Arterioesclerótico | 72 (92) | 25 (100) | |
| Inflamatorio | 6 (8) | 0 | |
| Forma de presentación | 0,020 | ||
| Asintomático | 73 (94) | 19 (76) | |
| Sintomático | 3 (4) | 1 (4) | |
| Rotura contenida | 1 (1) | 4 (16) | |
| Roto | 1 (1) | 1 (4) | |
| Características anatómicas | |||
| Diámetro máximo (mm) | 61±12 | 66±17 | 0,121 |
| Permeabilidad de AMI | 58 (74) | 22 (88) | 0,154 |
| Oclusión de renales accesorias | 3 (12) | 20 (26) | 0,154 |
| N° de lumbares permeables | 5±3 | 7±2 | 0,016 |
| Modelo de endoprótesis n (%) | 0,016 | ||
| Aortouniilíaca | 11 (14) | 9 (36) | |
| Aortobiilíaca | 67 (86) | 16 (64) | |
| Diseño de endoprótesis n (%) | 0,129 | ||
| Excluder (Gore®) | 34 (44) | 8 (32) | |
| Talent (Medtronic®) | 33 (42) | 9 (36) | |
| Endurant (Medtronic®) | 11 (14) | 8 (32) | |
AAA: aneurisma de aorta abdominal; AMI: arteria mesentérica inferior; DLP: dislipidemia; HTA: hipertensión arterial; N°: número.
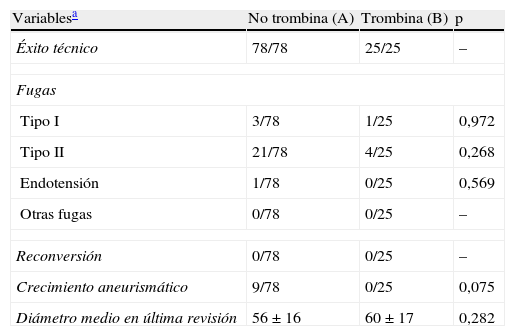
El tiempo medio de seguimiento fue en el grupo sin trombina (A) de 36±22 meses y en el grupo con trombina (B) de 21±16 meses (p=0,002).
La utilización de la inyección de trombina en el saco aneurismático supuso una reducción de la presencia de fugas tipo II; en el grupo A, 21 pacientes (27%) de los 78 desarrollaron una fuga tipo II respecto a 4 pacientes (16%) de los 25 del grupo B, aunque estas diferencias no alcanzaron significación estadística (p=0,268).
El RR de tener una fuga tipo II en los pacientes a los que asociamos trombina fue de 0,6 (IC 95%: 0,22-1,59) y la RAR de 0,1% (IC 95%: −0,01-0,28) que se corresponde con un NNT de 10 pacientes.
El tiempo medio quirúrgico fue en el grupo A de 270±65 min y en el grupo B de 290±66 min (p=0,156). No se observó ninguna complicación relacionada con la inyección de trombina durante, ni después del procedimiento.
El éxito técnico en ambos grupos fue del 100%.
Durante el seguimiento hubo 9 casos de crecimiento aneurismático, todos pertenecientes al grupo A (p=0,075), de los cuales 8 fueron secundarios a fugas tipo II y uno a endotensión, dado que no se pudo demostrar la existencia de otro tipo de fugas (tabla 2).
Análisis de los resultados del procedimiento y de la evolución postoperatoria por grupos
| Variablesa | No trombina (A) | Trombina (B) | p |
| Éxito técnico | 78/78 | 25/25 | – |
| Fugas | |||
| Tipo I | 3/78 | 1/25 | 0,972 |
| Tipo II | 21/78 | 4/25 | 0,268 |
| Endotensión | 1/78 | 0/25 | 0,569 |
| Otras fugas | 0/78 | 0/25 | – |
| Reconversión | 0/78 | 0/25 | – |
| Crecimiento aneurismático | 9/78 | 0/25 | 0,075 |
| Diámetro medio en última revisión | 56±16 | 60±17 | 0,282 |
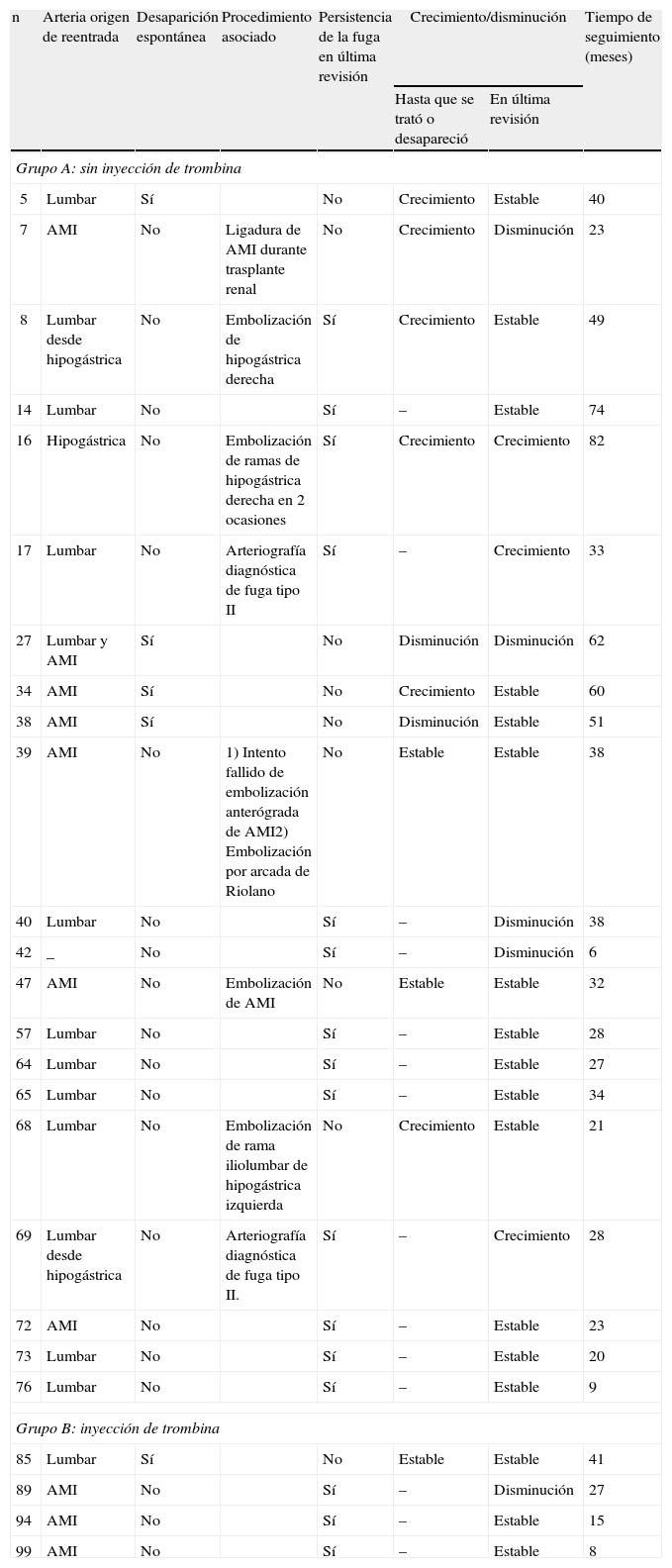
De los 8 casos de fugas tipo II del grupo A en los que hubo crecimiento del saco, 6 precisaron uno o más procedimentos asociados, siendo efectivos en 5. De los 3 restantes, el primero era por una reentrada a través de una lumbar que no pudimos confirmar con arteriografía; la paciente rechazó continuar con el seguimiento a posteriori. En el segundo caso está pendiente de confirmar la desaparición de la fuga tras un ingreso reciente en el que se embolizó, en 2 sesiones, la arteria hipogástrica izquierda y parte de sus ramas. Y el tercero está pendiente de ingreso para embolizar una rama iliolumbar de hipogástrica derecha.
Las fugas tipo II pertenecientes al grupo B no requirieron ningún procedimiento asociado en el seguimiento.
La evolución del resto de las fugas se detalla en la tabla 3.
Fugas tipo II. Evolución y procedimientos asociados
| n | Arteria origen de reentrada | Desaparición espontánea | Procedimiento asociado | Persistencia de la fuga en última revisión | Crecimiento/disminución | Tiempo de seguimiento (meses) | |
| Hasta que se trató o desapareció | En última revisión | ||||||
| Grupo A: sin inyección de trombina | |||||||
| 5 | Lumbar | Sí | No | Crecimiento | Estable | 40 | |
| 7 | AMI | No | Ligadura de AMI durante trasplante renal | No | Crecimiento | Disminución | 23 |
| 8 | Lumbar desde hipogástrica | No | Embolización de hipogástrica derecha | Sí | Crecimiento | Estable | 49 |
| 14 | Lumbar | No | Sí | – | Estable | 74 | |
| 16 | Hipogástrica | No | Embolización de ramas de hipogástrica derecha en 2 ocasiones | Sí | Crecimiento | Crecimiento | 82 |
| 17 | Lumbar | No | Arteriografía diagnóstica de fuga tipo II | Sí | – | Crecimiento | 33 |
| 27 | Lumbar y AMI | Sí | No | Disminución | Disminución | 62 | |
| 34 | AMI | Sí | No | Crecimiento | Estable | 60 | |
| 38 | AMI | Sí | No | Disminución | Estable | 51 | |
| 39 | AMI | No | 1) Intento fallido de embolización anterógrada de AMI2) Embolización por arcada de Riolano | No | Estable | Estable | 38 |
| 40 | Lumbar | No | Sí | – | Disminución | 38 | |
| 42 | _ | No | Sí | – | Disminución | 6 | |
| 47 | AMI | No | Embolización de AMI | No | Estable | Estable | 32 |
| 57 | Lumbar | No | Sí | – | Estable | 28 | |
| 64 | Lumbar | No | Sí | – | Estable | 27 | |
| 65 | Lumbar | No | Sí | – | Estable | 34 | |
| 68 | Lumbar | No | Embolización de rama iliolumbar de hipogástrica izquierda | No | Crecimiento | Estable | 21 |
| 69 | Lumbar desde hipogástrica | No | Arteriografía diagnóstica de fuga tipo II. | Sí | – | Crecimiento | 28 |
| 72 | AMI | No | Sí | – | Estable | 23 | |
| 73 | Lumbar | No | Sí | – | Estable | 20 | |
| 76 | Lumbar | No | Sí | – | Estable | 9 | |
| Grupo B: inyección de trombina | |||||||
| 85 | Lumbar | Sí | No | Estable | Estable | 41 | |
| 89 | AMI | No | Sí | – | Disminución | 27 | |
| 94 | AMI | No | Sí | – | Estable | 15 | |
| 99 | AMI | No | Sí | – | Estable | 8 | |
AMI: arteria mesentérica inferior.
En el caso definido como endotensión, dada la edad del paciente (87 años) y su mal estado general, se optó por tratamiento conservador.
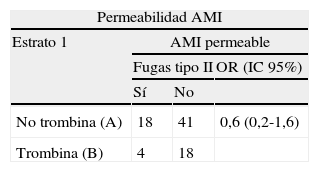
No se demostró una asociación entre los posibles factores confusores analizados y el porcentaje de fugas tipo II como se muestra en la tabla 4. Sin embargo en el análisis estratificado se observó que el efecto de la trombina fue diferente en dependencia de la permeabilidad de AMI, siendo mayor cuando esta se encontraba obstruida (tabla 5).
Factores de confusión e interacción. Distribución con respecto a las fugas tipo II en cada grupo
| Variablesa | Presencia de fugas tipo IIn (%) | Ausencia de fugas tipo IIn (%) | p |
| N° de lumbares permeables | 6±2 | 6±3 | 0,930 |
| Permeabilidad de AMI | 0,382 | ||
| AMI permeable | 21 (26) | 59 (74) | |
| AMI obstruida | 4 (17) | 19 (83) | |
| Oclusión de renales accesorias | 0,748 | ||
| Sí oclusión de renales accesorias | 5 (22) | 18 (78) | |
| No oclusión de renales accesorias | 20 (25) | 60 (75) | |
| Tratamiento postoperatorio | 0,823 | ||
| Antiagregación | 21 (25) | 64 (75) | |
| Anticoagulación | 4 (21) | (79) | |
AMI: arteria mesentérica inferior. N°: número.
Análisis estratificado de la permeabilidad de AMI
| Permeabilidad AMI | |||
| Estrato 1 | AMI permeable | ||
| Fugas tipo II | OR (IC 95%) | ||
| Sí | No | ||
| No trombina (A) | 18 | 41 | 0,6 (0,2-1,6) |
| Trombina (B) | 4 | 18 | |
| Estrato 2 | AMI obstruida | ||
| Fugas tipo II | OR (IC 95%) | ||
| Sí | No | ||
| No trombina (A) | 3 | 16 | 1,2 (1-1,4) |
| Trombina (B) | 0 | 3 | |
AMI: arteria mesentérica inferior.
Las fugas tipo II representan el tipo de endofugas más frecuente tras EVAR. El porcentaje de reentradas en nuestro servicio es del 27%, comparable al descrito en otros centros, y hemos observado que se reduce de forma considerable, aunque sin obtener diferencias estadísticamente significativas, hasta un 16%, al añadir la inyección de trombina, sin comprometer el resto del procedimiento ni la seguridad del paciente, ya que no ha habido complicaciones relacionadas con su uso.
Existen múltiples factores predictores de riesgo descritos en la literatura que influyen en su aparición. Aburahma et al.6 demostaron una asociación entre la existencia de colaterales de la aorta permeables con un mayor número de fugas tipo II. Abularrage et al.7 identificaron en 595 pacientes un incremento del riesgo de reentradas al evaluar variables preoperatorias demográficas, como la edad, y anatómicas como el tamaño del AAA y la presencia de un número considerable de lumbares o la permeabilidad de AMI.
Bobadilla et al.5 estudiaron la influencia de la antiagregación y anticoagulación como posibles predictores de riesgo y, al contrario que Fairman et al.15, encontraron un incremento en la incidencia de fugas tipo II en los pacientes anticoagulados (p=0,004).
Nosotros no hemos podido demostrar que las variables analizadas se comporten como factores de confusión como ocurre en uno de los estudios más amplios publicados como el de Jones et al.22 en 873 pacientes o en estudios como los de Broeders, Gould, Petrick et al.29–32.
Sin embargo, al realizar el análisis estratificado, hemos identificado la permeabilidad de AMI como factor de interacción o variable modificadora del efecto; es decir, la inyección de trombina intrasaco (factor de exposición) reduce la tasa de fugas tipo II (efecto) pero, según la permeabilidad de AMI, esta relación cambia, siendo débil cuando AMI está permeable (OR=0,6) y fuerte cuando AMI está obstruida (OR=1,2).
Como ya hemos mencionado en la introducción, existen diferentes opciones sobre el manejo de las reentradas; se han llevado a cabo distintos tipos de tratamiento, pero su efectividad todavía no está comprobada23–28.
Se han descrito múltiples estrategias para prevenir las fugas tipo II, tanto en modelos experimentales como humanos. En el año 2005, Rhee et al.33 evaluaron el uso de espuma de poliuretano en perros; observaron un descenso en la presión intrasaco respecto a la obtenida en el saco de los perros en los que persistían las reentradas. Previamente, ya en el año 1999 Walker et al.32 realizaron un estudio descriptivo sobre el efecto del Espongostan® intrasaco en la reducción de estas fugas; escogían sus casos en dependencia del grosor de las lumbares y de AMI; ningún paciente de su serie presentó fugas tipo II, aunque el mayor inconveniente fue la necesidad de recurrir en todos los casos a prótesis aortomonoilíacas para poder introducir los «cigarrillos de Espongostan®» creados manualmente de un calibre considerable.
Autores como Zanchetta y Muthu et al.34–37 recurrieron a la inyección de trombina intrasaco intraoperatoria, asociada o no a coils, con resultados excelentes.
Muthu et al.35 mostraron una disminución de la incidencia de reentradas, de un 26 a un 14% (p = 0,14), similar a la obtenida en nuestro estudio. En el estudio de Pilon et al.36 se obtuvo una reducción de la incidencia de 30 a 5,5% (p=0,05) de las fugas tipo II. Rosinvalle et al.37 demostraron una reducción de riesgo de 0,13 (p>0,0001) y obtuvieron una disminución de 15 a un 2,2% en la incidencia; hay que reseñar que en estos estudios la técnica de inyección de trombina estaba asociada a otras técnicas, como coils intrasaco o embolización de AMI, lo que pudo actuar como sesgo en los resultados obtenidos. En el estudio de Zanchetta et al.34 se utilizó únicamente la inyección intraoperatoria de trombina (n=84), obteniendo un descenso notable en la incidencia (2,4%) de fugas tipo II en su serie y la disminución estadísticamente significativa del diámetro del aneurisma (p=0,0001); a pesar de haber utilizado la misma técnica, este grupo no es comparable con el nuestro ni con otros descritos en la literatura, ya que la media del diámetro del AAA en la muestra era de 50,40 ± 6,7mm, el número de lumbares permeables de 1 a 3 pares y solamente 18 pacientes presentaban AMI permeable.
Al igual que Muthu et al., no hemos podido definir de forma exacta la dosis de trombina necesaria, aunque pensamos que hay que individualizarla en cada caso, dependiendo del tamaño del saco, del trombo formado intrasaco y del grosor de las colaterales.
En lo que respecta a nuestros resultados, la trombina ha supuesto una disminución en el porcentaje de reentradas sin comprometer el resto del procedimiento ni la seguridad del paciente, sin presentar complicaciones relacionadas con su uso. Respecto a la persistencia de las fugas tipo II en el último control, en un primer análisis realizado con menos pacientes observamos que, al realizar las curvas de supervivencia con el método Kaplan Meier, la desaparición era más precoz al asociar la inyección de trombina; sin embargo, en este análisis no hemos podido demostrarlo debido a la diferencia en el tiempo de seguimiento entre ambos grupos.
Las limitaciones de nuestro estudio son fundamentalmente el tamaño de la muestra, el análisis restrospectivo de la misma, a pesar de que los datos se han recogido de forma prospectiva, y la diferencia en el tiempo de seguimiento. Son necesarios nuevos estudios acerca de esta y otras formas de prevención ya que la disminución de la incidencia de fugas tipo II se traduce en el ámbito de la medicina en la mejoría coste-efectividad.
ConclusionesNuestro estudio muestra una tendencia a la disminución de las fugas tipo II al añadir la inyección de trombina intrasaco, aunque los resultados no han sido estadísticamente significativos; además, no se ha visto ninguna complicación relacionada con la técnica y el tiempo quirúrgico apenas se ha modificado. A pesar de la potencia limitada de nuestro estudio, pensamos que la inyección de trombina durante EVAR se perfila como una técnica sencilla y segura, que podría ofrecer unos buenos resultados en la prevención de fugas tipo II, pero sería conveniente realizar nuevos estudios para confirmar nuestra hipótesis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información del manuscrito fue presentada previamente en el 57 Congreso Nacional de la Sociedad Española de Angiología y Cirugía Vascular como comunicación oral: «Inyección intraoperatoria de trombina como método de prevención de fugas tipo II en EVAR». Celebrado del 1 al 4 de junio de 2011 en Valladolid.