La enfermedad tromboembólica venosa (ETV) es considerada como una enfermedad multifactorial. Es necesaria la presencia de factores genéticos, que predisponen al individuo a la trombosis, y factores ambientales, que desencadenan la trombosis (interacción gen-ambiente).
En los últimos años se han descrito numerosos polimorfismos asociados con un mayor o menor riesgo a padecer una enfermedad trombótica en sus distintas variantes. Una de estas mutaciones de interés es la C677T del gen metilentetrahidrofolato reductasa (MTHFR), que consiste en la sustitución de una citosina por una timina en el nucleótido 677. Este cambio de aminoácido genera una variante de MTHFR termolábil con capacidad reducida para metabolizar la homocisteína, pudiendo aparecer una hiperhomocisteinemia leve-moderada, factor de riesgo conocido en la ETV. Por tanto, C677T MTHFR podría predisponer a la aparición y recurrencia de la ETV. Este artículo pretende analizar el papel concreto desempeñado por este polimorfismo en la ETV, así como su aplicabilidad clínica.
Venous thromboembolism (VTE) is a multifactorial disease in which both environmental and genetic factors are involved. The presence of mutations in genes coding for haemostatic, fibrinolytic and, also, inflammatory proteins is associated with an increased risk of first episode and recurrence of venous thrombosis. So, in the last years, several polymorphisms associated with thrombosis have been reported. Recently, the 677C > T polymorphism in the methylenetetrahydrofolate reductase (MTHFR) gene (a C > T substitution at base pair 677 leading to the exchange of alanine to valine) has been proposed by some studies to be a thrombophilic risk factor. This mutation causes moderate hyper-Hcy, and Hyper-Hcy is well known to cause VTE. We analysed the role of C677T MTHFR in VTE, as well as its clinical applicability.
La enfermedad tromboembólica venosa (ETV) es una patología frecuente y grave que constituye una de las principales causas de morbimortalidad en el mundo occidental1. La incidencia anual de la trombosis venosa se estima en 1 de cada 1.000 personas en países desarrollados2. No obstante, la incidencia se incrementa notablemente con la edad; de 1 por 100.000 personas año en la infancia a 1 % en ancianos3. Esta enfermedad se manifiesta habitualmente como trombosis venosa profunda (TVP) de las extremidades inferiores o como embolismo pulmonar. Menos frecuentemente, la trombosis ocurre en otras localizaciones (senos cerebrales, venas de los brazos, retina, mesenterio, etc.).
La ETV es considerada como una enfermedad multifactorial. Es necesaria la presencia de factores genéticos, que predisponen al individuo a la trombosis, y factores ambientales, que desencadenan la trombosis (interacción gen-ambiente). La importancia de los factores genéticos en el riesgo de aparición de la ETV queda reflejada por la elevada presencia de un componente familiar en dichos casos. De tal modo, en los últimos años se ha observado un interés creciente en la definición de la influencia genética en la enfermedad trombótica para un mejor conocimiento de la fisiopatología y el desarrollo de estrategias terapéuticas y profilácticas.
El hecho de que la trombosis pudiera ser un rasgo hereditario no se reconoció hasta 1965, año en el que se describe el déficit de antitrombina4. Posteriormente, se describieron el déficit de proteína C5 en 1981, el déficit de proteína S en 19846, la mutación factor V Leiden en 19947 y la mutación G20210A del gen de la protrombina en 19968.
En 1995 Frost et al9 describieron un nuevo gen candidato para el riesgo trombótico, la mutación C677T del gen de la 5,10-metilentetrahidrofolato reductasa (C677T MTHFR). Esta mutación sería responsable de una hiperhomocisteinemia leve-moderada, factor de riesgo establecido para la trombosis, tanto arterial como venosa.
ObjetivosC677T MTHFR podría predisponer a la aparición y recurrencia de la ETV. Sin embargo, el papel concreto desempeñado por este polimorfismo en la ETV y su aplicabilidad práctica es muy discutido. Pretendemos revisar la prevalencia de la mutación C677T del gen de la metilentetrahidrofolato reductasa en diferentes zonas geográficas y su influencia en el desarrollo de la ETV.
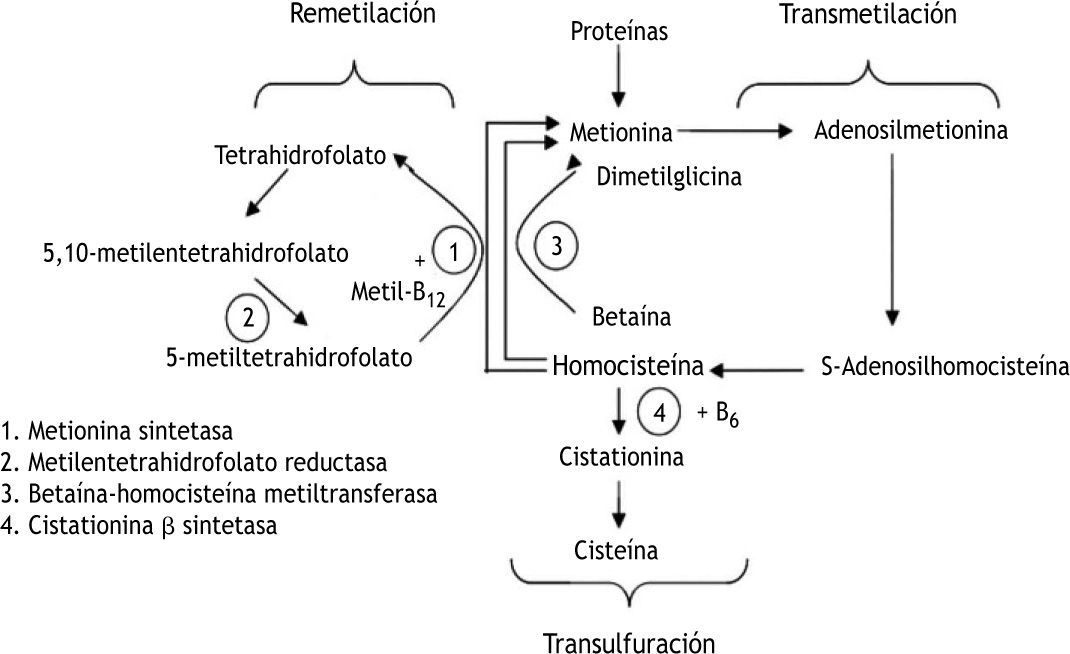
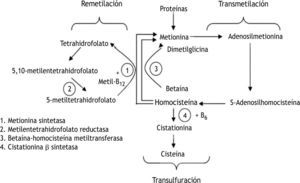
DesarrolloMutación C677T del gen de la metilentetrahidrofolato reductasaLa 5,10-MTHFR es una enzima que interviene en el metabolismo de la homocisteína, aminoácido sulfurado producto intermedio del metabolismo de la metionina, que a su vez procede de las proteínas de la dieta. La homocisteína se metaboliza por dos vías posibles: remetilación o transulfuración (fig. 1).
Metabolismo intracelular de la homocisteína. Remetilación: la homocisteína se metila para formar metionina mediante dos rutas metabólicas independientes. Una de ellas es catalizada por la metionina sintetasa, que requiere al 5-metiltetrahidrofolato como donante de grupos metilo y la vitamina B12 como cofactor. Así, el 5-metiltetrahidrofolato es convertido en tetrahidrofolato por la 5,10-metilentetrahidrofolato reductasa, entrando en el ciclo de los folatos para formar de nuevo 5-metiltetrahidrofolato. Transulfuración: si hay un exceso de metionina o se precisa sintetizar cisteína, la homocisteína entra en la vía de la transulfuración uniéndose a un residuo de serina para formar cistationina catalizado por la cistationina-b-sintetasa que requiere vitamina B6 como cofactor. La cistationina es hidrolizada posteriormente a cisteína, que se puede incorporar al glutation o bien sufrir nuevas reacciones metabólicas hasta que el sulfato se excreta por la orina. Fuente: De Stefano et al10.
Desde hace más de 40 años se sabe que la hiperhomocisteinemia grave se asocia a arterioesclerosis y trombosis arterial prematura, pero no ha sido hasta hace unos años cuando la hiperhomocisteinemia leve-moderada se describe como factor de riesgo independiente de aterosclerosis y trombosis11. A principios de la década de los sesenta, se comunica la presencia de homocisteína en la orina de pacientes con retraso mental y trombosis arterial prematura12,13. Años más tarde, se demuestra que la enzima cistationina-β-sintetasa era deficiente en estos pacientes y que los trastornos tromboembólicos eran muy frecuentes (homocistinuria clásica tipo I)14. A finales de los sesenta, se concluye que los trastornos vasculares en este tipo de pacientes estaban asociados a los niveles elevados de homocisteína15. Posteriormente, se describe la homocistinuria por déficit de MTHFR (homocistinuria clásica tipo II)16.
Las alteraciones genéticas asociadas con hiperhomocisteinemia leve (16-24mmol/l) o moderada (25-100mmol/l) se describen más tarde, en la década de los noventa, fundamentalmente, la mutación C677T o variante termolábil de la MTHFR y el déficit heterocigoto de cistationina-β-sintetasa. La primera de ellas constituye la forma genética más común de hiperhomocisteinemia leve-moderada.
Como se observa en la tabla 1, la hiperhomocisteinemia no solo puede deberse a defectos genéticos en el metabolismo de la homocisteína, sino también a causas adquiridas. La causa adquirida más común es la carencia de folatos, piridoxina o cobalamina.
Principales causas de hiperhomocisteinemia
| Congénitas |
| Déficit de cistationina-β-sintetasa (homocistinuria congénita clásica tipo I) |
| Deficiencia de MTHFR (homocistinuria congénita clásica tipo II) |
| Variante termolábil de MTHFR |
| Adquiridas |
| Envejecimiento |
| Déficit nutricional de folatos, cobalamina y/o piridoxina |
| Insuficiencia renal crónica |
| Hipotiroidismo |
| Anemia perniciosa |
| Neoplasias |
| Tóxicos (tabaco) |
| Fármacos |
| Antifolatos: metotrexato, fenotiacinas, antidepresivos tricíclicos, trimetropin |
| Anticobalamina: óxido nitroso |
| Antipiridoxina: azabrina, isoniacida, carbamacepina, teofilina, cicloserina |
MTHFR: 5,10-metilentetrahidrofolato reductasa.
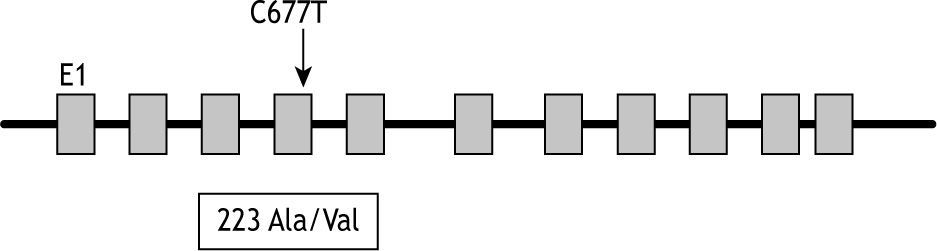
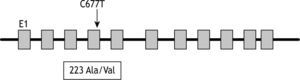
El gen de la MTHFR se localiza en el cromosoma 1p36.2 y la mutación C677T descrita por Frost9 consiste en la sustitución de una citosina por una timina en el nucleótido 677. Tal mutación origina la sustitución de una alanina por una valina en la posición 223 (fig. 2).
Este cambio de aminoácido genera una variante de MTHFR termolábil, caracterizada por una reducción del 50 % de su actividad a 37°C, en comparación con la variante normal. En consecuencia, se reduce la capacidad del metabolismo de la homocisteína y puede aparecer una hiperhomocisteinemia leve-moderada, sobre todo cuando la mutación se encuentra en homocigosis, y especialmente si se asocian bajas concentraciones séricas de folatos.
Los mecanismos por los cuales la hiperhomocisteinemia actúa como aterogénica y trombogénica son parcialmente conocidos: a) incremento en la proliferación de las células musculares e inhibición de la síntesis de ADN endoteliales17,18; b) aumento de la respuesta vasomotora y reducción de la expresión de la trombomodulina19; c) aumento de la expresión de factor tisular20; d) inhibición de la expresión de heparan-sulfato21; e) disminución de la liberación de óxido nítrico22 y prostaciclinas23, y f) reducción de la unión del activador tisular del plasminógeno a su receptor endotelial24.
Por tanto, la variante termolábil de la MTHFR (mutación C677T) ocasiona una hiperhomocisteinemia leve-moderada, que a su vez ha sido relacionada con la ETV25. Con estos datos se ha sugerido que la variante genética C677T MTHFR y la ETV podrían estar relacionadas.
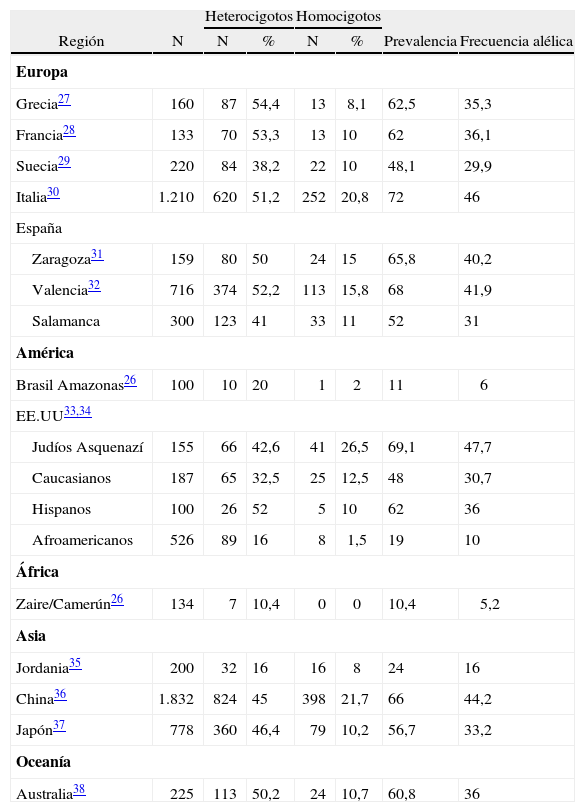
Prevalencia general de C677T MTHFRLa mutación C677T MTHFR es un hallazgo frecuente en la población caucasiana, encontrándose hasta en el 38 % de los sujetos no seleccionados26, pero es poco frecuente en raza negra, nativos de América del Sur y aborígenes de Oceanía. En el área geográfica de Salamanca la prevalencia es del 52 % y la frecuencia alélica del 31 %, cifras similares a las del resto de España y Europa (tabla 2).
Prevalencia del polimorfismo C677T del 5,10-metilentetrahidrofolato reductasa en varios países del mundo
| Región | N | Heterocigotos | Homocigotos | Prevalencia | Frecuencia alélica | ||
| N | % | N | % | ||||
| Europa | |||||||
| Grecia27 | 160 | 87 | 54,4 | 13 | 8,1 | 62,5 | 35,3 |
| Francia28 | 133 | 70 | 53,3 | 13 | 10 | 62 | 36,1 |
| Suecia29 | 220 | 84 | 38,2 | 22 | 10 | 48,1 | 29,9 |
| Italia30 | 1.210 | 620 | 51,2 | 252 | 20,8 | 72 | 46 |
| España | |||||||
| Zaragoza31 | 159 | 80 | 50 | 24 | 15 | 65,8 | 40,2 |
| Valencia32 | 716 | 374 | 52,2 | 113 | 15,8 | 68 | 41,9 |
| Salamanca | 300 | 123 | 41 | 33 | 11 | 52 | 31 |
| América | |||||||
| Brasil Amazonas26 | 100 | 10 | 20 | 1 | 2 | 11 | 6 |
| EE.UU33,34 | |||||||
| Judíos Asquenazí | 155 | 66 | 42,6 | 41 | 26,5 | 69,1 | 47,7 |
| Caucasianos | 187 | 65 | 32,5 | 25 | 12,5 | 48 | 30,7 |
| Hispanos | 100 | 26 | 52 | 5 | 10 | 62 | 36 |
| Afroamericanos | 526 | 89 | 16 | 8 | 1,5 | 19 | 10 |
| África | |||||||
| Zaire/Camerún26 | 134 | 7 | 10,4 | 0 | 0 | 10,4 | 5,2 |
| Asia | |||||||
| Jordania35 | 200 | 32 | 16 | 16 | 8 | 24 | 16 |
| China36 | 1.832 | 824 | 45 | 398 | 21,7 | 66 | 44,2 |
| Japón37 | 778 | 360 | 46,4 | 79 | 10,2 | 56,7 | 33,2 |
| Oceanía | |||||||
| Australia38 | 225 | 113 | 50,2 | 24 | 10,7 | 60,8 | 36 |
Aunque la presencia del alelo T del polimorfismo C677T de la MTHFR se asocia con unos niveles más altos de homocisteína, tanto en la población sana como en la población con ETV, no existe una asociación sólida entre este polimorfismo y la ETV. Inicialmente, esta mutación fue asociada con un riesgo aumentado de ETV39,40. Sin embargo, no hubo confirmación en estudios posteriores41,42.
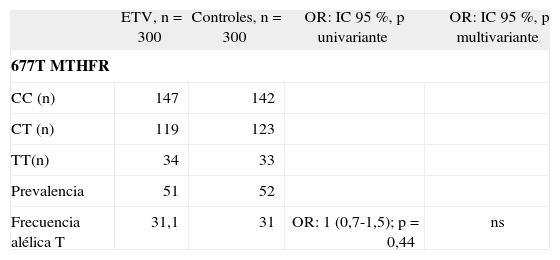
Bajo nuestra experiencia no existe asociación entre C677T MTHFR y ETV. En una muestra de 300 pacientes consecutivos con un primer episodio de ETV comparada con 300 controles sanos pareados uno a uno según edad (± 2 años) y sexo, comprobamos que la distribución de los diferentes genotipos del polimorfismo C677T del gen MTHFR y la frecuencia alélica T fue similar en ambas poblaciones, pacientes y control (odds ratio [OR] = 1,0, intervalo de confianza [IC] 95 % 0,7-1,5) (tabla 3).
Distribución de los genotipos y frecuencia alélica del polimorfismo C677T en la población ETV y su grupo control
| ETV, n = 300 | Controles, n = 300 | OR: IC 95 %, p univariante | OR: IC 95 %, p multivariante | |
| 677T MTHFR | ||||
| CC (n) | 147 | 142 | ||
| CT (n) | 119 | 123 | ||
| TT(n) | 34 | 33 | ||
| Prevalencia | 51 | 52 | ||
| Frecuencia alélica T | 31,1 | 31 | OR: 1 (0,7-1,5); p = 0,44 | ns |
ETV: individuos consecutivos no seleccionados diagnosticados de un episodio de enfermedad tromboembólica venosa (trombosis venosa profunda de extremidades y/o embolismo pulmonar) por medios objetivos (eco-doppler, gammagrafía ventilación/perfusión o angio-tomografía computarizada).
Población control: personas sanas que carecían de historia personal de enfermedad trombótica, donantes de sangre de Salamanca. IC: intervalo de confianza; MTHFR: 5,10-metilentetrahidrofolato reductasa; ns: no significativo; OR: odds ratio.
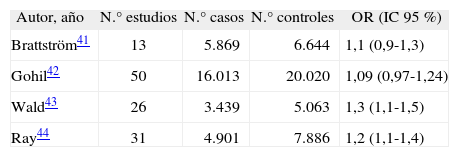
Nuestros resultados concuerdan con aquellos procedentes de dos metaanálisis de 65 estudios41,42 que incluyeron en total 21.882 pacientes con trombosis y 26.664 controles. Ninguno de los dos estudios demostró una asociación estadísticamente significativa entre homocigotos TT 677 MTHFR y ETV (OR = 1,2; IC 95 % 0,92-1,37; OR = 1,09; IC 95 % 0,97-1,24, respectivamente). Por el contrario, se han comunicado resultados discrepantes procedentes de otros dos metaanálisis43,44 que objetivaron una asociación estadísticamente significativa entre TT MTHFR y ETV, pero dicha asociación fue muy débil (tabla 4). Finalmente, en un estudio prospectivo con 9.238 sujetos libres de ETV que fueron seguidos durante 23 años, el ser homocigoto para TT MTHFR no se asoció con el desarrollo de ETV (log-rank = 0,29)45. Por tanto, el valor de TT MTHFR en ETV no se ha demostrado de forma concluyente.
Metaanálisis de T677T MTHFR frente a C677C MTHFR en la enfermedad tromboembólica venosa
| Autor, año | N.° estudios | N.° casos | N.° controles | OR (IC 95 %) |
| Brattström41 | 13 | 5.869 | 6.644 | 1,1 (0,9-1,3) |
| Gohil42 | 50 | 16.013 | 20.020 | 1,09 (0,97-1,24) |
| Wald43 | 26 | 3.439 | 5.063 | 1,3 (1,1-1,5) |
| Ray44 | 31 | 4.901 | 7.886 | 1,2 (1,1-1,4) |
IC: intervalo de confianza; MTHFR: 5,10-metilentetrahidrofolato reductasa; OR: odds ratio.
El riesgo de ETV se ha evaluado específicamente en determinados subgrupos de pacientes portadores de TT MTHFR. Así, el riesgo de ETV en presencia del genotipo T677T MTHFR se ha relacionado en pacientes portadores también del factor V Leiden46,47. Sin embargo, un metaanálisis48 que específicamente ha evaluado la posible interacción entre TT MTHFR y factor V Leiden concluyó que no existe interacción entre ellos para la ETV; el exceso de riesgo relativo debido a la interacción (RERI) fue de 0,13 (IC 95 % –3,60 a 3,86).
Se ha sugerido que la relación de C677T MTHFR y ETV no es igual en los diferentes grupos étnicos. Así, Gohil et al42 en su metaanálisis encuentran una asociación estadísticamente significativa entre TT MTHFR y ETV en la población china y tailandesa (OR = 1,57 [IC 95 % 1,23-2,00]). Según sus resultados, TT MTHFR tiene escaso valor en población caucasiana, pero puede tener importancia en otros determinados grupos étnicos.
Por otro lado, la influencia de C677T MTHFR en la recurrencia de la ETV no ha sido demostrada. Tras un seguimiento prospectivo de una población de 259 pacientes tras un primer episodio de ETV, demostramos que el ser portador de CT MTHFR o TT MTHFR no se asocia con un aumento de la recurrencia trombótica49. Ivanov et al50, tras analizar de forma retrospectiva 51 pacientes con historia de ETV recurrente, concluyen resultados muy similares a los nuestros. Además, una interacción sólida entre TT MTHFR y factor V Leiden en la recurrencia trombótica no ha sido demostrada47,48.
Recomendaciones finales- 1.
¿Debe incluirse el estudio del polimorfismo C677T en los estudios de trombofilia?
La mayoría de los estudios no han mostrado una asociación entre C677T y la ETV. Por tanto, en pacientes con ETV y que cumplan criterios para descartar la presencia de trombofilia (por ejemplo, edad de aparición inferior a 40 años), la determinación rutinaria de C677T no está justificada. Además, la búsqueda de C677T MTHFR en portadores asintomáticos no es una medida coste-eficaz.
- 2.
¿ Debe descartarse la presencia de C677T en pacientes con ETV e hiperhomocisteinemia?
Es difícil llegar a conclusiones claras con respecto a este interrogante, dada la gran cantidad de factores, incluyendo dietéticos, que pueden influir en la expresión de la hiperhomocisteinemia provocada o favorecida por dicha mutación. Pero, como C677T MTHFR, de forma aislada o asociada a otros defectos trombofílicos, no ha mostrado una influencia clara en la ETV, no se justifica la búsqueda de tal mutación.
Más interesante es aclarar si en los pacientes con ETV y C677T MTHFR puede recomendarse suplementación con ácido fólico para disminuir los niveles de homocisteína. La evidencia sobre si la suplementación con ácido fólico en pacientes con niveles elevados de homocisteína en plasma y ETV reduce el riesgo de recurrencia es inconcluyente. Varios estudios observacionales muestran la asociación que hay entre hiperhomocisteinemia y ETV. No se ha establecido un punto de corte, pero habitualmente se considera hiperhomocisteinemia los niveles plasmáticos superiores a 16mmol/l. Varios ensayos clínicos han evaluado la eficacia de los suplementos de ácido fólico o vitamina B en pacientes con ETV y que presentaban niveles elevados de homocisteína en plasma. Aunque todos ellos mostraron descensos, más o menos marcados, en los niveles plasmáticos de homocisteína, no hubo una reducción del riesgo de recurrencia trombótica en los pacientes que recibieron suplementos de ácido fólico frente a los que recibieron placebo51,52. Por tanto, hasta la fecha de hoy no hay evidencia científica para tratar de forma sistemática a los pacientes con ETV y C677T MTHFR con suplementos de ácido fólico mediante vitaminas del complejo B para prevenir la trombosis venosa.
La prevalencia del polimorfismo C677T del gen MTHFR es muy frecuente en nuestro medio, siendo similar a la de los países de nuestro entorno. Sin embargo, esta variación genética, al menos en población de origen caucasiano, no constituye un factor de riesgo de enfermedad tromboembólica venosa ni se relaciona con un incremento del riesgo de recurrencia. Por tanto, no se recomienda la búsqueda rutinaria de C677T MTHFR en la ETV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.