Los aneurismas de arteria iliaca después de la reparación de un aneurisma aórtico abdominal (AAA) son poco comunes y no se ha protocolizado el seguimiento del diámetro iliaco.
ObjetivoEvaluar la evolución del tamaño de las arterias iliacas mediante eco-doppler en pacientes intervenidos de AAA e interposición de injerto recto.
Material y métodosEstudio transversal de pacientes intervenidos de AAA entre enero de 1999 y marzo de 2008 a los que se les realiza un eco-doppler para valorar el diámetro de las arterias iliacas. Se recogen 45 pacientes. Variables estudiadas: diámetro iliaco preoperatorio (angio-tomografía computarizada) y postoperatorio, así como factores de riesgo vascular y comorbilidades. Se realizan las pruebas de la t de Student, Chi 2 y tablas de supervivencia.
ResultadosMedia de edad: 69 años (desviación estándar [DE] 6,8). Seguimiento medio: 4,5 años (DE 1,89). Tamaño preoperatorio medio de arterias iliacas: 13 mm (DE 0,45), en el seguimiento: 17 mm (DE 0,52), p = 0,001. Un 19 % de las iliacas presentó crecimiento durante el seguimiento. Se observó un menor crecimiento en pacientes con diabetes mellitus (0/24 %, riesgo relativo [RR] 0,76; intervalo de confianza [IC] 95 %: 0,7–0,9). No se ha podido determinar una correlación tiempo/crecimiento. Ningún paciente precisó tratamiento durante el seguimiento.
ConclusiónAunque en nuestra serie se demuestra un crecimiento significativo durante el seguimiento, no está justificado un protocolo de seguimiento ecográfico de arterias iliacas en este contexto por la baja/nula necesidad de tratamiento quirúrgico posterior
Iliac artery aneurysms are uncommon and there is current no protocol for the follow-up.
AimTo evaluate the progress of the diameter of the iliac arteries by echo-doppler in patients undergoing abdominal aortic aneurysm (AAA) open repair with an aorto-aortic prosthetic graft.
Material and methodsA cross-sectional study of patients undergoing AAA between January 1999 and March 2008, on whom an echo-doppler was performed to assess the diameter of iliac arteries. A total of 45 patients were included. The variables studied were: pre- and post-operative iliac diameter (angio-computerized tomography), vascular risk factors and comorbidities. Student t test, Chi-square test were performed and survival tables constructed.
ResultsThe mean age was: 69 years (SD 6.8). Follow-up: 4.5 years (1.89). Preoperative mean size of iliac arteries: 13 mm (0.45), follow-up: 17 mm (0.52), p = 0.001. Overall, the diameter increased in 19 % iliac arteries during growth monitoring. There was a lower expansion rate in diabetic patients (0%/24 %, relative risk [RR] 0.76, 95 % confidence interval [CI]: 0.7–0.9). We were unable to determine a time/expansion rate correlation. No patient required a repeat operation during the follow-up.
ConclusionAlthough our series showed a significant growth, the iliac arteries ultrasound follow-up is not justified, in this context, due to the low/no need for a subsequent surgical procedure.
La incidencia de aneurismas de arteria iliaca después de la reparación de un aneurisma aórtico abdominal (AAA) se ha considerado insignificante12 y no se ha protocolizado el seguimiento de la evolución del tamaño de las arterias iliacas tras esta intervención, a pesar de que se piensa que su evolución natural es el continuo crecimiento y la rotura. Cuando un cirujano se enfrenta a un AAA y decide realizar un procedimiento quirúrgico abierto debe elegir no sólo las dimensiones y material del injerto, sino el tipo del mismo (recto frente a bifurcado). Esta elección se realiza tomando como base el estudio de imagen preoperatorio, los hallazgos intraoperatorios, la edad y la expectativa de vida del paciente, las patologías asociadas y la dificultad técnica, ventajas e inconvenientes asociados a cada tipo de injerto3. Así, el injerto recto aorto-aórtico tiene la ventaja de ser más rápido y técnicamente más fácil que el bifurcado4, preserva el flujo anterógrado en los vasos iliacos, disminuye el riesgo de lesión ureteral, del eje iliaco venoso y la disfunción eréctil postoperatoria y tiene una menor tasa de complicaciones relacionadas con el injerto5. Sin embargo, tiene la desventaja de dejar a su evolución natural a las arterias iliacas6 con la posibilidad de expansión hasta la rotura. Este hecho lo evita precisamente el injerto bifurcado al realizarse la anastomosis distal sobre la arteria iliaca común (AIC) o externa, además de preservar el flujo en la arteria hipogástrica, bien por flujo anterógrado, bien por flujo retrógrado. Por otro lado, esta técnica conlleva mayor tiempo operatorio, mayor hemorragia y mayor morbimortalidad asociada5,7.
La mayoría de los estudios realizados sobre la evolución de los aneurismas iliacos se realizó en las décadas de los ochenta y noventa. A pesar de que se demostró una tasa de crecimiento anual de hasta 4mm89, no se protocolizó un seguimiento de las arterias iliacas10-13.
El objetivo de este estudio es evaluar la evolución del tamaño de las arterias iliacas mediante eco-doppler en pacientes sometidos a resección de AAA e interposición de injerto recto.
Material y métodosEntre enero de 1999 y marzo de 2008 se intervinieron de forma programada 80 pacientes con AAA a los que se les practicó resección del aneurisma e interposición de injerto recto aorto-aórtico. La indicación desde el punto de vista del tamaño arterial para este tipo de cirugía fue la existencia de una arteria aorta mayor de 55mm en varones y 50mm en mujeres y ambas arterias iliacas comunes menores de 30mm. Los pacientes con enfermedad arteriosclerótica avanzada (estadios IIb, III y IV de la clasificación de Fontaine) o con AIC mayores o iguales a 30mm fueron sometidos a resección del aneurisma e interposición de injerto bifurcado.
De los 80 pacientes intervenidos, 10 no fueron localizados, 4 no aceptaron participar en el estudio y 21 fallecieron. De los pacientes que fallecieron, uno de ellos fue al mes y medio de la cirugía debido a una neumonía; los restantes fallecieron pasados los primeros 6 meses de la intervención, todos ellos de causa no vascular. A ninguno se le había practicado ningún control postoperatorio de imagen para determinar la evolución del tamaño arterial. Entre las causas de fallecimiento, el cáncer fue la más frecuente en los distintos órganos, predominando el de pulmón.
De este modo, en este estudio transversal reclutamos a 45 pacientes (90 iliacas) a los que se practicó resección de AAA e interposición de injerto aorto-aórtico con carácter programado entre enero de 1999 y marzo de 2008.
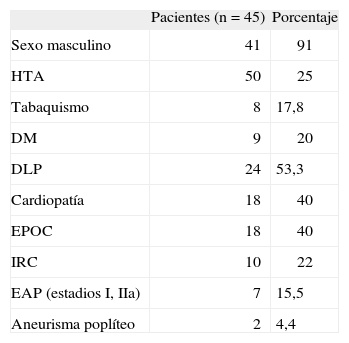
Se registraron el diámetro iliaco preoperatorio (determinado por tomografía axial computarizada [TAC]), los factores de riesgo vascular clásicos (tabaquismo activo y ex fumadores de menos de 5 años, hipertensión arterial definida como tensión arterial>140/90mmHg, diabetes mellitus [DM] definida como glucemia basal>120mg/dl, alteración del metabolismo lipídico definido como colesterol total>200mg/dl) diagnosticados y/o verificados en el estudio preoperatorio, las comorbilidades asociadas y la existencia de aneurismas arteriales a otros niveles. Todos estos datos quedan reflejados en la tabla 1.
Características demográficas de la población
| Pacientes (n=45) | Porcentaje | |
| Sexo masculino | 41 | 91 |
| HTA | 50 | 25 |
| Tabaquismo | 8 | 17,8 |
| DM | 9 | 20 |
| DLP | 24 | 53,3 |
| Cardiopatía | 18 | 40 |
| EPOC | 18 | 40 |
| IRC | 10 | 22 |
| EAP (estadios I, IIa) | 7 | 15,5 |
| Aneurisma poplíteo | 2 | 4,4 |
Cardiopatía: cualquier tipo de cardiopatía (valvular, isquémica y/o arrítmica); DLP: dislipidemia; DM: diabetes mellitus; EAP (estadios I, Ila): enfermedad arterial periférica en estadio I o Ila de la clasificación de Fontaine; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IRC: insuficiencia renal crónica definida como creatinina sérica>1,3mg/dl.
El diámetro aórtico medio preoperatorio fue de 64mm (rango, 50–120mm; desviación estándar [DE] 1,42). La Sociedad de Cirugía Vascular y la Sociedad Internacional de Cirugía Cardiovascular establecieron unos criterios para definir un diámetro iliaco normal (menor a 12mm), ectásico (entre 13 y 18mm) y aneurismático (por encima de 19mm)14. Según estos criterios nuestra serie se componía de 54 (60 %) arterias iliacas normales (media 10mm, rango 8–12mm; DE 0,11); 23 (26 %) ectásicas (media 16mm, rango 13–18mm; DE 0,16) y 13 (14 %) aneurismáticas (media 21mm, rango 19–25mm; DE 0,23).
Se escogió como prueba de imagen para el estudio la eco-doppler. Todos los estudios fueron efectuados por un único experto (para evitar el posible sesgo interexplorador) con un ecógrafo Vivid 4, General Electrics Healthcare, programa vascular abdominal. Se realizó una única exploración a cada paciente para la recogida de datos al final del periodo de inclusión, por lo que el momento del seguimiento en el que se realizó la prueba tras la cirugía fue muy diferente entre los pacientes. Se hicieron mediciones del diámetro de la AIC en su zona media tanto en proyección transversal como longitudinal, y se escogió para el análisis el valor más alto.
Se definió crecimiento iliaco como el aumento en el tamaño de AIC mayor o igual a 5mm determinado por ecografía respecto al observado en la TAC preoperatoria.
El análisis estadístico se realizó usando el programa SPSS 16 para Windows® mediante tablas de supervivencia, análisis de Kaplan-Meier, prueba de la t de Student y de Chi2. Se definió la significación estadística como p<0,05.
ResultadosLa media de edad fue de 69 años. El tiempo medio transcurrido entre ambas mediciones (TAC y ecografía) fue de 4,5 años (rango 1,2-8,7 años; DE 1,84). Observamos un crecimiento mayor o igual a 5mm en 17 (19 %) arterias iliacas. Este crecimiento fue unilateral en 7 pacientes (8 %) y bilateral en 10 (11 %). El diámetro iliaco medio preoperatorio era de 13mm (rango 7–25mm; DE 0,45) y el hallado en el seguimiento de 17mm (rango, 8–40mm; DE 0,52) con significación estadística (p=0,001).
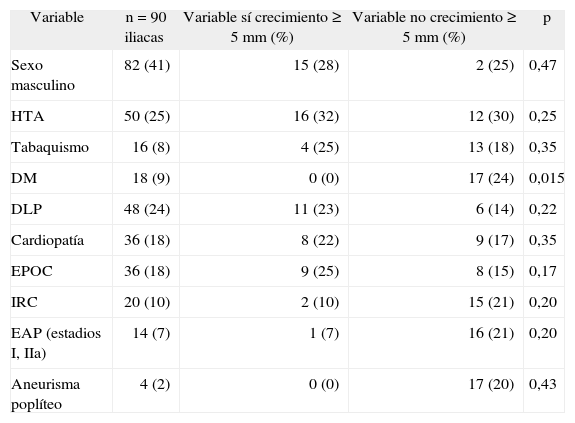
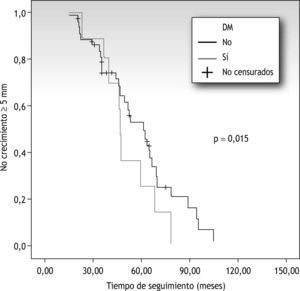
En la tabla 2 se reflejan la relación entre cada variable analizada, las arterias iliacas con crecimiento mayor o igual a 5mm y la significación estadística correspondiente. De todas las variables analizadas tan solo encontramos significación estadística en la diabetes, donde los pacientes con esta patología tenían un riesgo relativo (RR) de 0,76 frente a los que no la padecían (0 y 24 %, respectivamente, RR 0,76; intervalo de confianza [IC] 95 %: 0,7-0,9), siendo considerada esta un factor protector.
Relación entre las variables y el crecimiento de las arterias iliacas
| Variable | n=90 iliacas | Variable sí crecimiento≥5mm (%) | Variable no crecimiento≥5mm (%) | p |
| Sexo masculino | 82 (41) | 15 (28) | 2 (25) | 0,47 |
| HTA | 50 (25) | 16 (32) | 12 (30) | 0,25 |
| Tabaquismo | 16 (8) | 4 (25) | 13 (18) | 0,35 |
| DM | 18 (9) | 0 (0) | 17 (24) | 0,015 |
| DLP | 48 (24) | 11 (23) | 6 (14) | 0,22 |
| Cardiopatía | 36 (18) | 8 (22) | 9 (17) | 0,35 |
| EPOC | 36 (18) | 9 (25) | 8 (15) | 0,17 |
| IRC | 20 (10) | 2 (10) | 15 (21) | 0,20 |
| EAP (estadios I, IIa) | 14 (7) | 1 (7) | 16 (21) | 0,20 |
| Aneurisma poplíteo | 4 (2) | 0 (0) | 17 (20) | 0,43 |
Cardiopatía: cualquier tipo de cardiopatía (valvular, isquémica y/o arrítmica); DLP: dislipidemia; DM: diabetes mellitus; EAP (estadios I, IIa): enfermedad arterial periférica en estadio I o IIa de la clasificación de Fontaine; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IRC: insuficiencia renal crónica definida como creatinina sérica>1,3mg/dl.
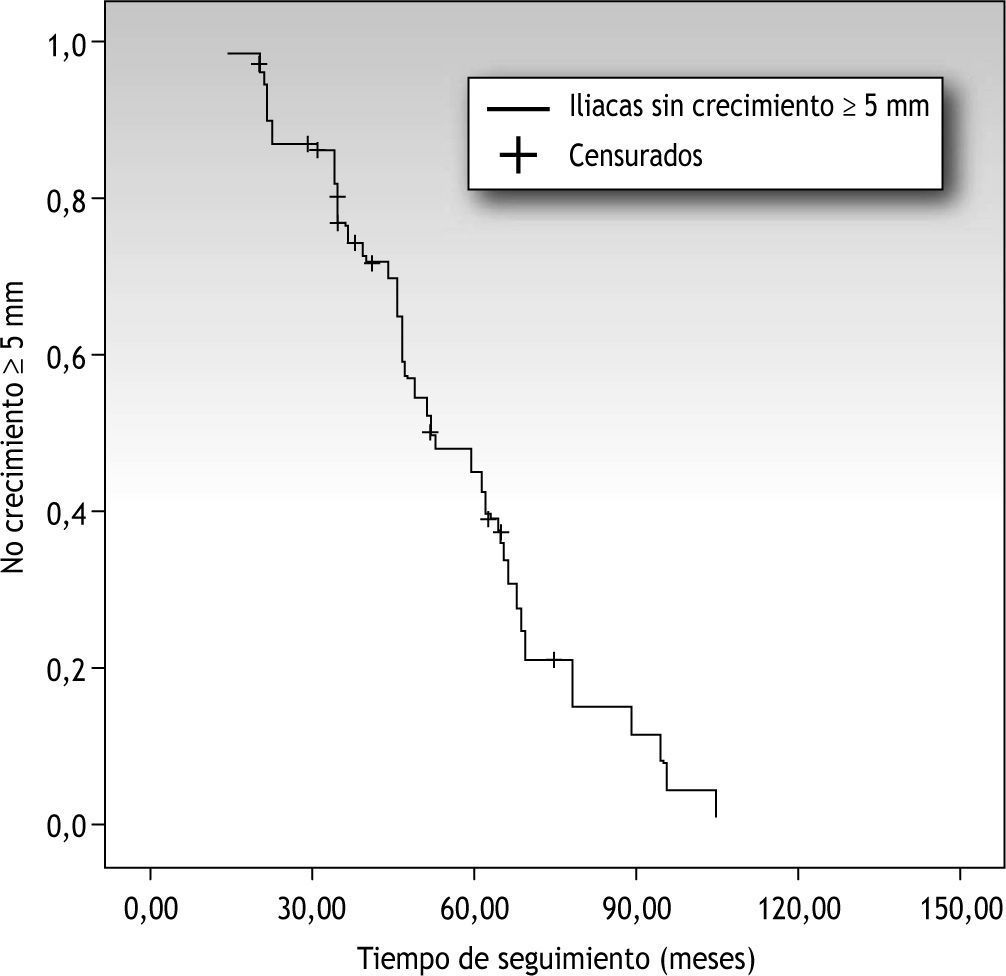
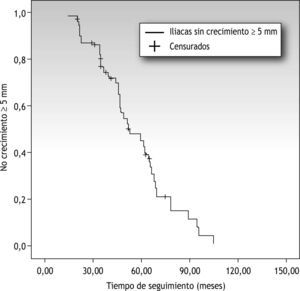
No se demostró correlación entre tiempo de seguimiento y crecimiento del diámetro arterial, es decir, no hemos podido establecer un límite en el tiempo a partir del cual exista mayor riesgo de crecimiento (a partir del primer año postoperatorio, a los 5 años, etc.) (fig. 1).
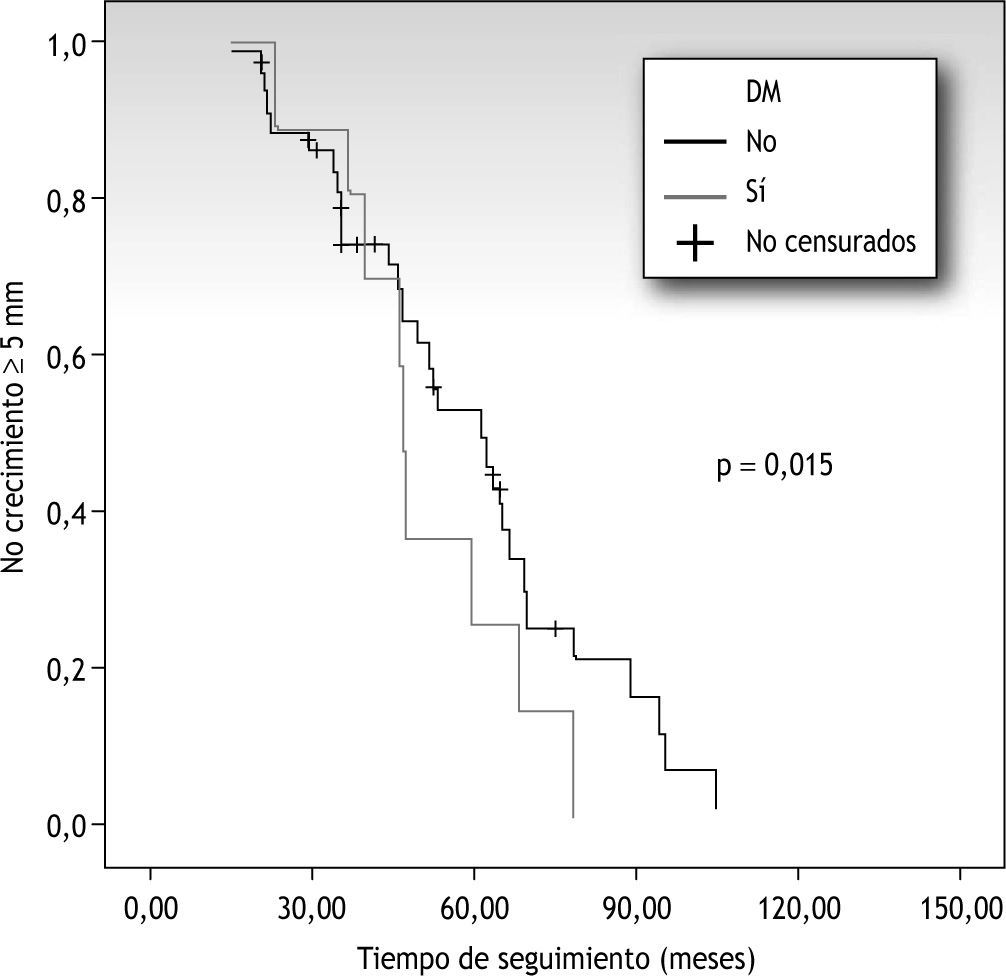
Entre las variables analizadas, la DM fue la única que presentó significación estadística, así, a los 5 años, el 22 % de los pacientes con DM presentará crecimiento arterial frente al 52 % de aquellos sin DM (p=0,015) (fig. 2).
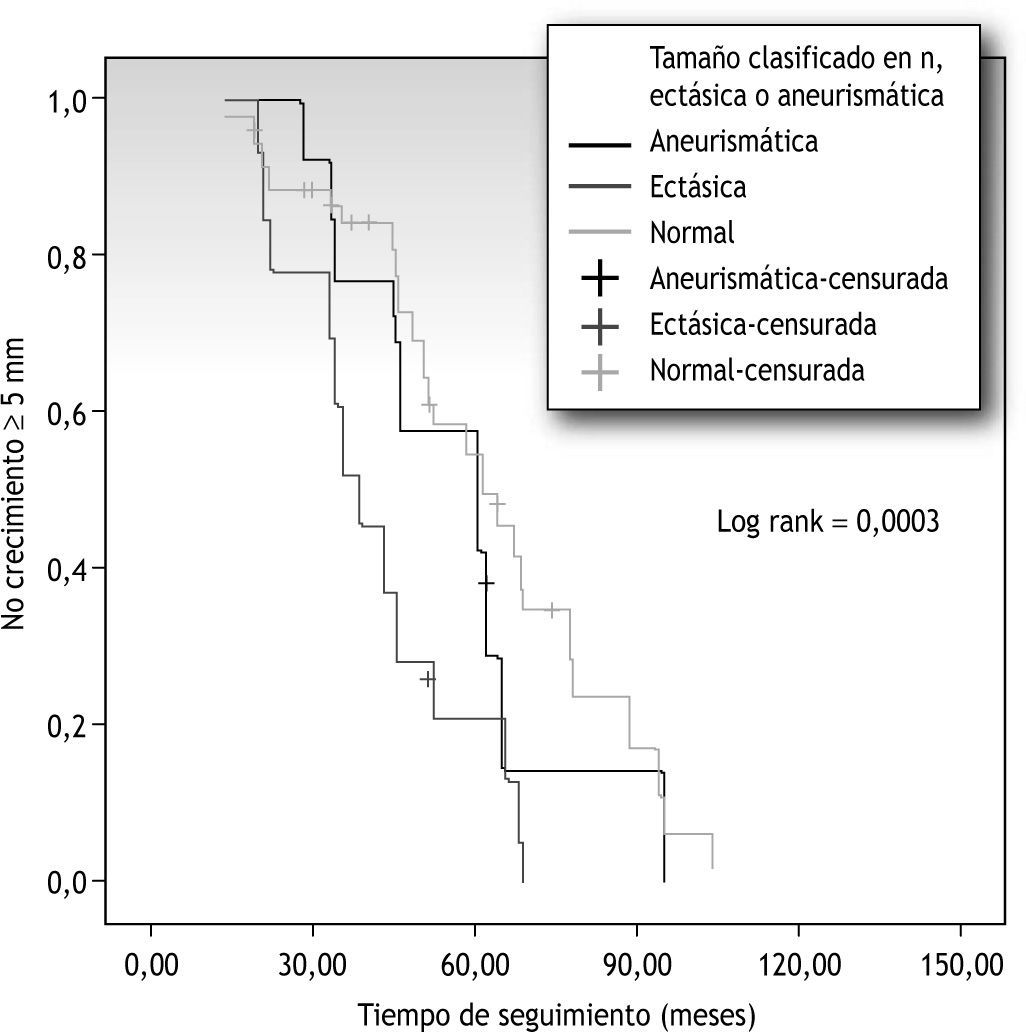
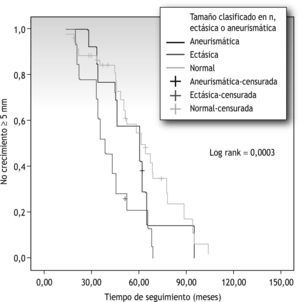
Presentó crecimiento el 28 % de las arterias iliacas clasificadas inicialmente como normales, el 4,3 % de las arterias clasificadas como ectásicas y el 7,7 % de las clasificadas como aneurismáticas (tabla 3). Al analizar las curvas de supervivencia, a 5 años crecerá el 53 % de las arterias iliacas clasificadas como normales, lo hará el 21 % de las clasificadas como ectásicas y el 54 % de las clasificadas como aneurismáticas (fig. 3). Relacionándolas entre ellas, solo se estableció significación estadística entre las arterias iliacas clasificadas como normales y aquellas clasificadas como ectásicas (p=0,0000).
Relación entre el crecimiento arterial y el diámetro preoperatorio de las arterias iliacas comunes
| Tamaño AIC | n=90 iliacas | Crecimiento>5mm (%) | No crecimiento>5mm (%) |
| Normal | 54 | 15 (28) | 39 (72) |
| Ectásica | 23 | 1 (4) | 22 (96) |
| Aneurismática | 13 | 1 (8) | 12 (92) |
Coeficiente de correlación de Pearson 0,03. Rango logarítmico (log rank) 0,0003. AIC: arterias iliacas comunes.
Relación entre el tiempo de seguimiento y el crecimiento de las arterias iliacas teniendo en cuenta el diámetro basal (tamaño arterial clasificado en normal, ectásico y aneurismático según los criterios citados en el texto). Coeficiente de correlación de Pearson 0,03. Rango logarítmico (log rank) 0,0003.
En el seguimiento, tan solo el paciente con un aneurisma iliaco de 40mm precisó reparación quirúrgica, la cual rechazó por presentar otras patologías asociadas que conllevaban un elevado riesgo quirúrgico.
DiscusiónLos aneurismas iliacos generalmente son una prolongación distal de los AAA (33 % de los AAA), asentando más frecuentemente en iliaca primitiva. Suelen ser asintomáticos debido a su localización intrapélvica9, y su hallazgo es fortuito al realizar un estudio de imagen por otra patología (generalmente urológica), aunque en algunas series se ha encontrado una alta tasa de presentación del aneurisma con sintomatología específica15.
Tienen una alta tasa de rotura16-20. En la serie publicada por Richardson et al19, hasta en el 33 % de los casos la rotura fue su forma de presentación, lo que conlleva a su vez una alta tasa de mortalidad. Minato et al21 indican una tasa de mortalidad operatoria en torno al 50 % en caso de cirugía urgente frente al 1–5 % en cirugía programada.
Por todo lo expuesto anteriormente estaría justificado el seguimiento del diámetro iliaco en aquellos pacientes sometidos a interposición de injerto recto para el tratamiento de AAA. Para realizarlo se escogió la ecografía porque es un método inocuo para el paciente, repetible, poco costoso y que, al no precisar de ayuda por parte de otros servicios, evitaría sobrecarga asistencial y la posible demora que ello podría conllevar. Tiene, por otro lado, el inconveniente de ser operador-dependiente y de ser técnicamente difícil al estar las arterias localizadas profundamente en la pelvis, en pacientes obesos, con cirugía abdominal previa o con presencia de gas intestinal interponiéndose en la imagen. Por esta razón las mediciones las realizó un único explorador y, en caso de existir duda, el tamaño arterial era confirmado por otro explorador.
La tasa de crecimiento es impredecible. Así, el grupo de la Clínica Mayo8 en 1983 registró una tasa media de expansión de 4mm al año, mientras que Dosluoglu et al1, al comparar el crecimiento de las arterias iliacas aneurismáticas de un grupo de pacientes con reparación de AAA previa (n=9; media 2,7±0,8cm de diámetro basal) frente a un grupo sin dicha reparación (n=4; 2,6±0,9cm de diámetro basal), no encontraron diferencias significativas en el crecimiento arterial, encontrando una incidencia de aneurisma de arteria iliaca (AAI) tras reparación de AAA del 1,2 %, similar a la incidencia de los AAI aislados. Además descubrieron que el tiempo requerido para la formación de un AAI tras reparación de AAA es mayor de 5 años en la mayoría de sus casos. Otros autores22 predijeron una tasa de crecimiento medio de las AIC de 5,7 % anual, afirmando que tenían mayor tendencia a la expansión aquellas arterias con diámetro basal mayor de 16mm. En nuestro estudio no hemos podido establecer un límite temporal a partir del cual se incremente el riesgo de crecimiento arterial, si bien encontramos que casi la mitad de las arterias iliacas crecerá más de 5mm a los 5 años del diagnóstico. Al ser un estudio transversal no hemos podido conocer la tasa de crecimiento ya que al haber realizado una única medición sería una tasa aproximada, no real. Calculando un crecimiento medio de 4mm en 51 meses de seguimiento podríamos establecer una tasa de 0,94mm al año, aunque esta sería aproximada y no sabemos qué tasa real tendríamos si hubiéramos realizado una medición secuencial protocolizada.
Según Buckley et al23 el incremento del diámetro iliaco depende del diámetro basal de la AIC y afirman que la tasa media de expansión es casi imperceptible (0,11mm/año) para aneurismas menores de 30mm y 2,5-3mm/año en caso de AIC con diámetro mayor a 30mm; esto es similar a lo que demostraron Santilli et al2: tasa media de crecimiento de 0,5-1,5mm/año en AIC menores o iguales a 30mm y de 2,6mm/año en AIC de 30–50mm de diámetro (p<0,003). Estos autores coinciden con el estudio multicéntrico de Hassen-Khodja et al11, quienes al analizar el diámetro iliaco de 147 pacientes sometidos a reparación de AAA e interposición de injerto recto encontraron tras casi 5 años de seguimiento que la mayor tasa de crecimiento ocurre en las arterias iliacas con mayor diámetro preoperatorio (p<0,01). También Ballotta et al3 demostraron que las AIC con un diámetro normal crecen con una tasa de 0,16mm/año; las AIC ectásicas con una tasa de 0,25mm/año y las AIC aneurismáticas con una tasa de crecimiento de 0,32mm/año. En este mismo trabajo hallaron que la mayoría de las arterias iliacas no se expanden después de la inserción de un injerto aorto-aórtico para la reparación de AAA, y si lo hacen, el grado de dilatación es mínimo. En nuestro estudio crecen en mayor proporción las arterias clasificadas como normales que las ectásicas o aneurismáticas; quizá podría estar debido al control exhaustivo de los factores de riesgo vascular en aquellos pacientes con mayor concienciación al conocer la existencia de una anomalía en sus arterias.
Observamos crecimiento en el 19 % de las arterias iliacas, que a su vez tuvo escasa relevancia clínica, ya que tan solo un paciente presentó un diámetro superior a 30mm durante el seguimiento y el paciente estaba asintomático en el momento del hallazgo. El tratamiento quirúrgico electivo en este tipo de patología está indicado en pacientes con aneurismas iliacos mayores de 30mm de diámetro19,24, aunque algunos autores como Ballotta3 implantan de forma rutinaria injertos bifurcados si el AAA se asocia con AIC de diámetro igual o superior a 25mm.
Es conocido que existen diversos factores que contribuyen a la expansión arterial y, por tanto, a incrementar el riesgo de rotura. Estos factores son el sexo femenino, la enfermedad pulmonar obstructiva crónica, la hipertensión arterial, etc. En nuestra serie encontramos significación estadística únicamente en pacientes con DM, los cuales presentaban menor riesgo de crecimiento arterial. Este hecho podría estar relacionado con la asociación de DM y calcificación arterial, la cual contribuiría más a la enfermedad oclusiva que la aneurismática. Nuestro estudio coincide con el de Vega de Céniga et al25. Los AAA se asocian a aneurismas de arteria femoral o poplítea en un 3,5 % de los casos, similar a lo que ocurre en nuestra serie (3,8 % de los casos).
Este estudio tiene diversos inconvenientes: el primero es el pequeño tamaño muestral, lo cual podría estar relacionado con las diferencias encontradas con respecto a los estudios publicados en relación al crecimiento arterial respecto del diámetro basal arterial, y el segundo, es que al ser un estudio transversal y al haberse realizado una única medición en el seguimiento, no hemos podido conocer la tasa de crecimiento real de las arterias iliacas.
ConclusionesDe acuerdo con lo citado anteriormente podemos concluir que, a pesar de haber encontrado en nuestra serie un crecimiento significativo del diámetro de las arterias iliacas durante el seguimiento, este ha tenido escasa o nula repercusión clínica y, por lo tanto, podemos afirmar que la interposición de un injerto recto aorto-aórtico en pacientes con AAA es una técnica duradera y segura, y no está justificado un protocolo de seguimiento de las arterias iliacas en este contexto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.