El momento óptimo para realizar la endarterectomía carotídea (EAC) tras un ictus es controvertido. Aunque estudios preliminares sugirieron que un período de 6 semanas tras el ictus era recomendable, el hallazgo en estudios recientes de un alto riesgo de recurrencia de ictus tras un primer episodio sustenta la EAC precoz. Revisamos nuestra experiencia para examinar los resultados perioperatorios según el momento quirúrgico de la EAC en pacientes sintomáticos.
Material y métodosRevisión retrospectiva de una base de datos prospectiva con 349 EAC llevadas a cabo en nuestro servicio de Cirugía Vascular en el período 2002-2014, de las cuales 226 se realizaron en pacientes sintomáticos (64,7%). La EAC fue considerada «precoz» si se realizaba en los primeros 14 días tras el ictus, y «diferida» cuando se efectuaba después de 14 días. Revisamos nuestra experiencia para analizar resultados perioperatorios según el momento de la EAC.
ResultadosDe 226 EAC, las indicaciones fueron: accidente isquémico transitorio en el 46% de los casos e ictus en el 45,1%. La tasa global de ictus-muerte perioperatoria es del 3,9%. La proporción de pacientes sometidos a EAC precoz (≤14 días) es del 34,1%, siendo los pacientes en los que se realiza EAC diferida (>14 días) el 65,9%. Los factores demográficos y de comorbilidad son similares en ambos grupos. En el grupo EAC precoz fue más frecuente el «signo de la cuerda» que en aquellos intervenidos de forma diferida (5,2% vs. 0,7%; p<0,05). Los resultados inmediatos (<30 días) en la cohorte EAC precoz fueron: 0 (0%) complicaciones cardiológicas; 0 (0%) accidentes isquémicos transitorios; 2 (2,6%) ictus ipsilaterales; ningún ictus contralateral; y 2 casos de mortalidad (2,6%). En la cohorte tardía, 2 (1,3%) complicaciones cardiológicas; 2 (1,3%) accidentes isquémicos transitorios; 4 (2,7%) ictus ipsilaterales; ningún ictus contralateral; y 2 fallecimientos (1,3%); p>0,05.
ConclusionesPuesto que no hay diferencias estadísticamente significativas en los resultados perioperatorios entre ambos grupos consideramos que la EAC precoz dentro de los primeros 14 días tras el evento neurológico puede llevarse a cabo con seguridad.
The optimal timing of carotid endarterectomy (CEA) after ipsilateral hemispheric stroke is controversial. Although early studies suggested that an interval of about 6 weeks after a stroke was preferred, more recent data support early carotid endarterectomy. A review of our experience is presented in order to examine perioperative outcome as regards the timing of CEA in symptomatic patients.
Material and methodsA retrospective review of a prospective database of all CEAs performed in our Vascular Surgery Department from 2002 to 2014 showed that 349 CEAs were performed, of which 226 (64.7%) were on symptomatic patients. CEA was considered «early» if performed ≤14 days from symptom onset, and «delayed» if performed after >14 days following the symptoms.
ResultsOf 226 CEAs, 46% had a transient ischemic attack and 45.1% had stroke as indications for surgery. The 30-day death/stroke rate was 3.9%. Early CEA (≤14 days) was performed on 34.1% of patients, with delayed CEA (>14 days) being performed on 65.9%. Demographics and comorbidity were similar between groups. Patients who underwent early CEA were significantly more likely to have the «string sign» than patients in the delayed group (5.2% vs 0.7%, P<.05). For 30-day outcomes, in the early CEA cohort: cardiological complications: 0 (0%); transient ischemic attack: 0 (0%); ipsilateral stroke: 2 (2.6%), contralateral stroke: 0%; deaths: 2 (2.6%), and in the delayed CEA cohort: cardiological complications: 2 (1.3%); transient ischemic attack: 2 (1.3%); ipsilateral stroke: 4 (2.7%), contralateral stroke: 0 (0%); deaths: 2 (1,3%), P>.05.
ConclusionsThere were no differences in 30-day adverse outcome rates between the early and delayed CEA cohorts. On the basis of these results it appears that early carotid endarterectomy (<14 days) can be safely performed.
El papel de la endarterectomía carotídea (EAC) en pacientes sintomáticos con enfermedad carotídea extracraneal ha sido firmemente establecido desde la publicación, en la década de los 90, de los clásicos estudios North American Symptomatic Carotid Endarterectomy Trial (NASCET)1 y European Carotid Surgery Trial (ECST)2. Sin embargo, el período de tiempo hasta la realización de la EAC tras un evento neurológico («timing») se ha convertido, actualmente, en tema de controversia. Históricamente, la literatura había sugerido que tras un accidente cerebrovascular (ACV) la EAC debía efectuarse una vez transcurridas 6 semanas desde el evento isquémico cerebral3, con objeto de minimizar el riesgo de ictus perioperatorio. La publicación, en el año 2004, de un reanálisis por subgrupos de los estudios NASCET y ECST (CETC)4 marcó el punto de inflexión, cuestionando el paradigma histórico consistente en diferir la EAC 6 semanas tras el ictus. Este estudio había concluido que los pacientes con una estenosis carotídea≥70% sintomática se beneficiaban más si eran intervenidos dentro de las 2 primeras semanas tras el ictus. Como consecuencia de este hallazgo, las guías clínicas5–7 han sido revisadas, recomendándose la cirugía de revascularización carotídea en el período de 2 semanas post-ACV. Con todo, el escenario actual es que no existe unanimidad sobre cuándo es el mejor momento para realizar la EAC, y el «timing» óptimo e ideal para llevarla a cabo es objeto de un encendido debate.
El objetivo de este estudio es aportar nuestra experiencia en EAC en pacientes sintomáticos y analizar los resultados perioperatorios según el «timing».
Pacientes y métodosSe lleva a efecto una revisión retrospectiva de una base de datos prospectiva que recoge la cirugía de revascularización carotídea por enfermedad carotídea extracraneal efectuada en nuestro hospital entre el 1 de enero de 2002 y el 31 de diciembre de 2013.
En este período son realizadas 349 EAC de las cuales 226 (64,7%) corresponden a pacientes sintomáticos, definiéndose como sintomáticos, siguiendo las directrices del NASCET y ECST, aquellos que han presentado un evento isquémico cerebral en los 6 meses previos a la cirugía (superado el período de 6 meses el paciente es incluido en la categoría de asintomático).
En todos los casos existía estenosis carotídea≥70% en el lado sintomático diagnosticada mediante arteriografía o con la combinación de 2 pruebas no invasivas (eco-doppler+angio-RM o angio-TAC).
Se excluyen los procedimientos de revascularización carotídea tipo bypass.
La base de datos consta de las siguientes variables: 1) Edad. 2) Sexo. 3) HTA. 4) Diabetes mellitus. 5) Dislipidemia. 6) Cardiopatía isquémica (angina, IAM). 7) Enfermedad arterial periférica: patología isquémica de miembros inferiores, patología aneurismática o ambas. 8) Tabaco (exfumador, fumador, no fumador). 9) Fibrilación auricular. 10) Clínica neurológica: AIT (défict neurológico de duración inferior a las 24h, puede ser hemisférico o retiniano [amaurosis fugax]); infarto cerebral o «stroke», definido como déficit neurológico de duración superior a las 24horas confirmado por la presencia de lesión en TAC; síntomas inespecíficos: mareos, vértigos, síncope…, en el contexto de una estenosis carotídea crítica superior al 90% con compromiso hemodinámico severo, siendo el neurólogo el que establece el origen carotídeo de los mismos. 11) Pruebas diagnósticas. 12) Signo de la cuerda: hallazgo arteriográfico consistente en una estenosis carotídea del 95-99% con «infrallenado», colapso o no visualización de la arteria carótida interna distal. 13) Oclusión contralateral. 14) Antiagregante perioperatorio, si este se mantiene perioperatoriamente. 15) Empleo de puntos de Kunlin, para la fijación de la íntima distal a la zona endarterectomizada. 16) Empleo de shunt intraoperatorio. 17) Cierre con parche (sintético o de vena). 18) Complicaciones locales. 19) Hematoma cervical (severo: si requiere reintervención o transfusión de concentrados de hematíes; leve: si no necesita revisión quirúrgica ni transfusión sanguínea. 20) Lesión de pares craneales. 21) Complicaciones sistémicas. 22) Complicaciones cardiológicas: síndrome coronario agudo o insuficiencia cardíaca congestiva. 23) Complicaciones neurológicas: AIT, infarto (ictus) ipsilateral o infarto contralateral. 24) Síndrome de reperfusión cerebral, definido por la presencia clínica de cefalea, convulsiones y/o focalidad neurológica en ausencia de isquemia cerebral en el tac y presencia de HTA mantenida, con aumento del flujo sanguíneo cerebral en doppler transcraneal. 25) Reestenosis. 26) ACV en el seguimiento. 27) Mortalidad precoz: si se produce dentro de los primeros 30 días. 28) Mortalidad tardía.
Se define «timing» como el tiempo transcurrido entre los síntomas neurológicos (AIT, infarto cerebral o síntomas inespecíficos) y la EAC; se expresa en días. Cada cirujano de forma individualizada y según su criterio, apoyado en factores clínicos y diagnósticos, es quien decide el momento quirúrgico.
La EAC fue categorizada como precoz, si se lleva a cabo dentro de los primeros 14 días desde los síntomas neurológicos; o como diferida o tardía, si se retrasa, efectuándose una vez transcurridos 14 días desde la clínica. En este estudio la elección de un período de 14 días para clasificar la cirugía en precoz o diferida se hace fundamentada en 2 hechos: primero, la recomendación actual de las guías clínicas de intervenir a los pacientes con una estenosis carotídea sintomática en ese intervalo, y segundo, la mediana del tiempo entre la clínica y la EAC en nuestra cohorte de pacientes.
La decisión de mantener la antiagregación en el perioperatorio para reducir el riesgo embolígeno, depende del cirujano vascular.
Factores quirúrgicos, como el empleo de shunt o el cierre de la arteria con parche, están subordinados al criterio del cirujano. Una reducción mayor del 20% en la saturación de oxígeno medida con oximetría cerebral INVOS® es indicación de shunt.
El análisis estadístico fue ejecutado con el paquete estadístico IBM SPSS Statistics para Macintosh, versión 20, empleándose el test chi-cuadrado o el test exacto de Fisher en el análisis de variables categóricas y el de la t de Student para variables continuas. Los resultados son considerados estadísticamente significativos para un valor de p<0,05.
ResultadosDe un total de 349 EAC consecutivas realizadas en el período, 226 se efectúan en pacientes sintomáticos (64,7%). La edad media de estos es 71,04±8,1 años (47-90 años). Mediana: 72 años. El 83,6% son varones y el 16,4% mujeres.
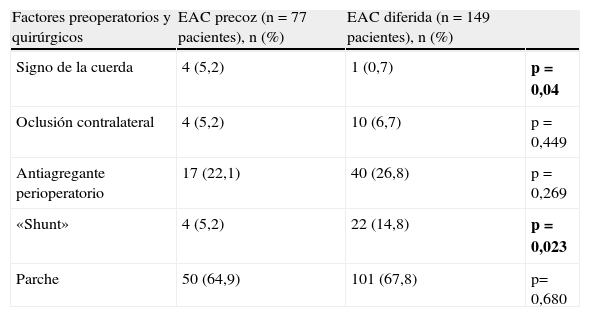
La clínica neurológica determinante de la indicación quirúrgica es: AIT en el 46% de los casos (n=104), infarto cerebral en el 45,1% (n=102) y sintomatología inespecífica en el 8,9% (n=20).
La tasa de complicaciones neurológicas en nuestros pacientes sintomáticos (estenosis carotídea sintomática≥70%) es del 3,5% (8 pacientes: 2 AIT y 6 ictus ipsilaterales), siendo la mortalidad precoz del 1,8% (4 pacientes, 3 de ellos por infarto cerebral y uno por un tromboembolismo pulmonar). Hubo síndrome de reperfusión en el 2,2% (5 pacientes). Las complicaciones cardiológicas representan el 0,9% (2 pacientes: un síndrome coronario agudo y una insuficiencia cardíaca congestiva).La tasa combinada de ictus-muerte perioperatoria (≤30 días) fue del 3,9%.
La EAC se lleva a cabo de forma precoz (≤14 días) en 77 pacientes (34,1%) y de forma diferida (>14 días) en 149 pacientes (65,9%). El tiempo medio que transcurre entre el evento isquémico neurológico y la cirugía («timing») es 39,15 días, con un rango 1-180 días; la mediana del «timing» son 22 días.
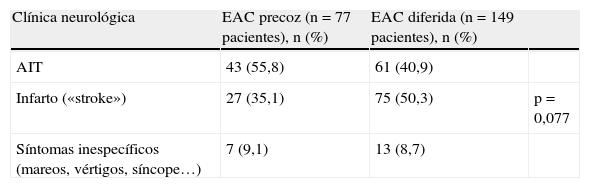
Se comparan los factores demográficos entre la cohorte precoz y la cohorte diferida, sin hallarse diferencias estadísticamente significativas entre ambos grupos (tabla 1).
Factores demográficos en ambos grupos (EAC precoz y EAC diferida)
| Factor | EAC precoz (n=77 pacientes), n (%) | EAC diferida (n=149 pacientes), n (%) | |
| Sexo (% varones) | 62 (80,5) | 127 (85,2) | NS |
| HTA | 55 (71,4) | 110 (73,8) | NS |
| Diabetes mellitus | 24 (31,2) | 50 (33,6) | NS |
| Dislipidemia | 52 (67,5) | 91 (61,1) | NS |
| Cardiopatía isquémica | 13 (16,9) | 33 (22,1) | NS |
| Tabaquismo | 49 (63,6) | 85 (57) | NS |
| AC×FA | 5 (6,5) | 8 (5,4) | NS |
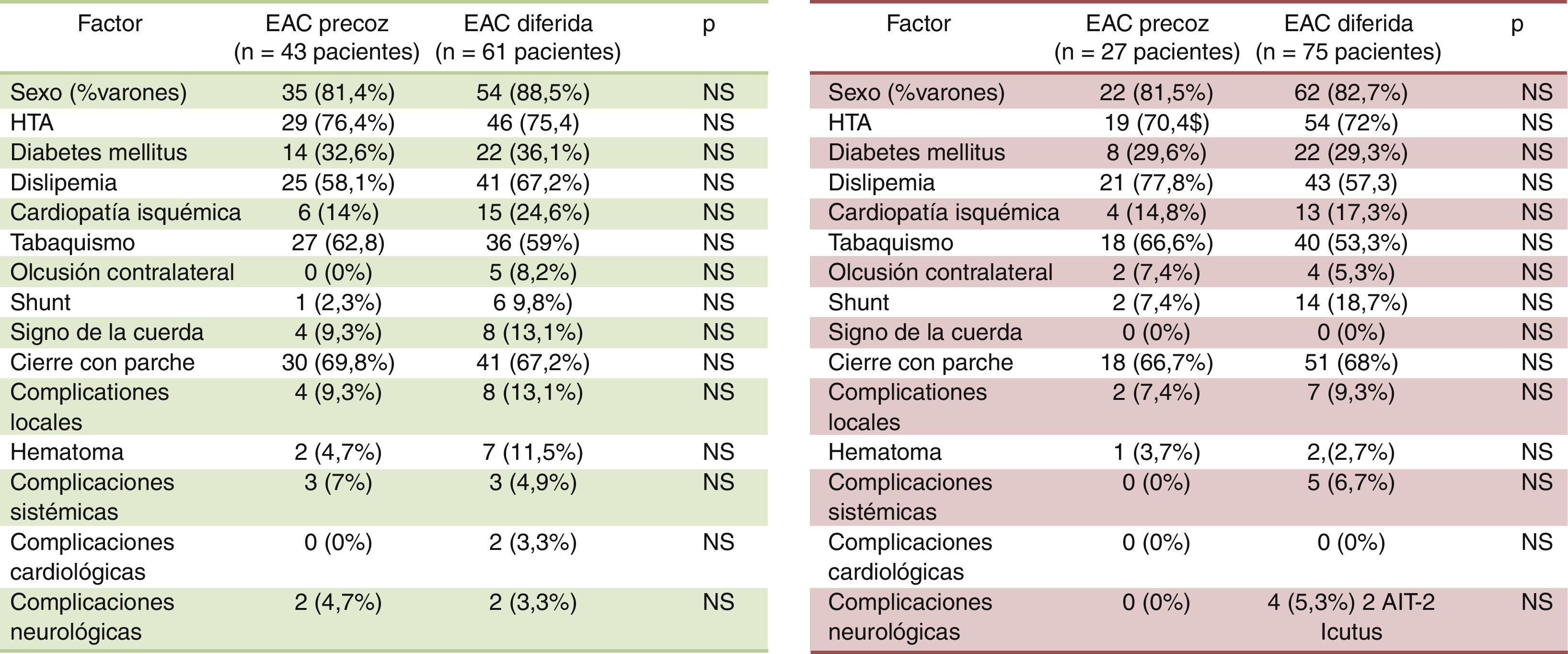
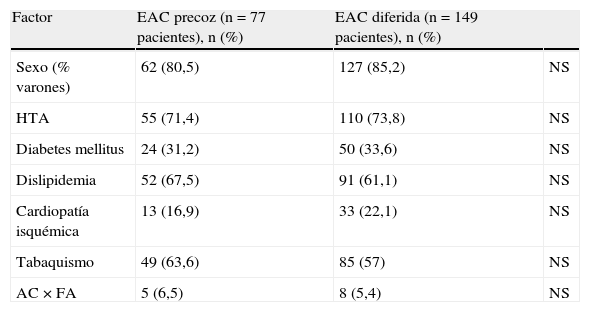
El 41,3% de los pacientes con AIT se sometieron a una EAC precoz y el 58,7% a una EAC diferida. En tanto que, refiriéndonos a los casos con antecedente de infarto cerebral, esto es, a los pacientes «stroke», el 73,5% fue intervenido tardíamente y un 26,5% lo hizo de forma precoz. Sin embargo, no se ha encontrado asociación estadísticamente significativa entre la clínica neurológica determinante de la indicación quirúrgica, AIT, infarto («stroke»), o síntomas inespecíficos (mareos, vértigos, inestabilidad…), y el momento de realizar la EAC; p>0,05. La composición de la cohorte precoz y la cohorte diferida según la clínica neurológica se muestra en la tabla 2.
Clínica neurológica determinante de la indicación de EAC por grupos (EAC precoz y EAC diferida)
| Clínica neurológica | EAC precoz (n=77 pacientes), n (%) | EAC diferida (n=149 pacientes), n (%) | |
| AIT | 43 (55,8) | 61 (40,9) | |
| Infarto («stroke») | 27 (35,1) | 75 (50,3) | p=0,077 |
| Síntomas inespecíficos (mareos, vértigos, síncope…) | 7 (9,1) | 13 (8,7) |
En cuanto a los factores preoperatorios y factores quirúrgicos, existe asociación estadísticamente significativa entre:
- •
El signo de la cuerda y el «timing» de la EAC. Dentro de los pacientes que se operan de forma precoz, el 5,2% presenta el signo de la cuerda («string sign»), frente a un 0,7% en el grupo de pacientes intervenidos de forma diferida (p=0,047).
- •
El empleo de shunt y el «timing». Se emplea shunt en un 5,2% de los pacientes intervenidos pronto, siendo mayor el empleo de shunt entre los que se operan tardíamente (14,8%) (p=0,023).
La proporción de oclusión contralateral, antiagregación perioperatoria y cierre con parche es equivalente entre los 2 grupos (tabla 3).
Factores perioperatorios y quirúrgicos por grupos (EAC precoz y EAC diferida)
| Factores preoperatorios y quirúrgicos | EAC precoz (n=77 pacientes), n (%) | EAC diferida (n=149 pacientes), n (%) | |
| Signo de la cuerda | 4 (5,2) | 1 (0,7) | p=0,04 |
| Oclusión contralateral | 4 (5,2) | 10 (6,7) | p=0,449 |
| Antiagregante perioperatorio | 17 (22,1) | 40 (26,8) | p=0,269 |
| «Shunt» | 4 (5,2) | 22 (14,8) | p=0,023 |
| Parche | 50 (64,9) | 101 (67,8) | p=0,680 |
En negrita los resultados estadísticamente significativos (p<0,05).
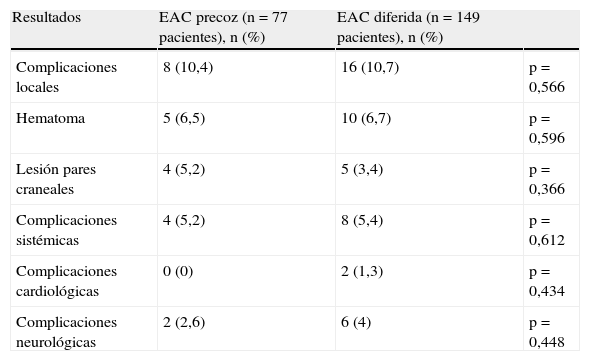
Estratificando los resultados según el momento quirúrgico, no se encuentran diferencias estadísticamente significativas al comparar los 2 grupos (tablas 4 y 5).
Resultados quirúrgicos inmediatos por grupos (EAC precoz y EAC diferida)
| Resultados | EAC precoz (n=77 pacientes), n (%) | EAC diferida (n=149 pacientes), n (%) | |
| Complicaciones locales | 8 (10,4) | 16 (10,7) | p=0,566 |
| Hematoma | 5 (6,5) | 10 (6,7) | p=0,596 |
| Lesión pares craneales | 4 (5,2) | 5 (3,4) | p=0,366 |
| Complicaciones sistémicas | 4 (5,2) | 8 (5,4) | p=0,612 |
| Complicaciones cardiológicas | 0 (0) | 2 (1,3) | p=0,434 |
| Complicaciones neurológicas | 2 (2,6) | 6 (4) | p=0,448 |
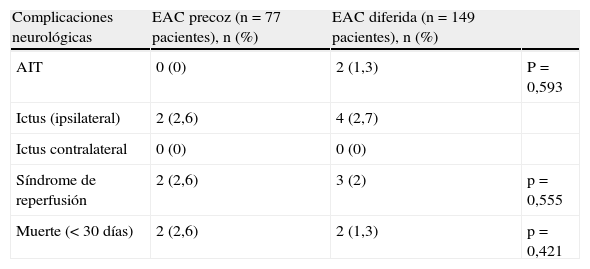
Complicaciones neurológicas y mortalidad precoz en ambos grupos (EAC precoz y EAC diferida)
| Complicaciones neurológicas | EAC precoz (n=77 pacientes), n (%) | EAC diferida (n=149 pacientes), n (%) | |
| AIT | 0 (0) | 2 (1,3) | P=0,593 |
| Ictus (ipsilateral) | 2 (2,6) | 4 (2,7) | |
| Ictus contralateral | 0 (0) | 0 (0) | |
| Síndrome de reperfusión | 2 (2,6) | 3 (2) | p=0,555 |
| Muerte (<30días) | 2 (2,6) | 2 (1,3) | p=0,421 |
De las 226 EAC en pacientes sintomáticos, tienen lugar 8 ACV perioperatorios; 2 corresponden a EAC precoz, en forma de 2 infartos ipsilaterales (2,6%), y un total de 6 ACV postoperatorios a EAC diferida (4%), en forma de 2 AIT y 4 infartos ipsilaterales. No se registró ningún ictus contralateral. A pesar de las diferencias, con una mayor tasa de ictus en el segundo grupo, estas no alcanzan la significación estadística. En cuanto a la mortalidad precoz, en los primeros 30 días se producen 4 exitus, 2 en cada grupo, lo que equivale a una mortalidad precoz del 2,6% y del 1,3% para la EAC precoz y diferida respectivamente (p=NS).
Analizando de forma separada e independiente los casos según la clínica que estableció la indicación quirúrgica, AIT o infarto cerebral, tampoco se hallaron diferencias estadísticamente significativas entre ambas cohortes(fig. 1).
DiscusiónA finales del siglo xx, coincidiendo con el apogeo y espectacular desarrollo de la EAC como estrategia terapéutica para reducir el riesgo de ictus de origen carotídeo, la literatura aconsejaba sobre la conveniencia de diferir la cirugía de revascularización carotídea, en pacientes sintomáticos, al menos 6 semanas desde el evento cerebrovascular. Las principales razones argumentadas eran el riesgo de transformación de un infarto cerebral isquémico en hemorrágico o de extensión del infarto, así como la posibilidad de edema periinfarto (síndrome de hiperperfusión cerebral), determinantes de una excesiva morbimortalidad asociada a la cirugía, si esta se realizaba en la fase aguda del ictus3,8. Sin embargo, posteriormente un análisis más sosegado de los estudios que alertaban sobre los riesgos de la EAC precoz reveló importantes fallos metodológicos (procedimientos efectuados sobre arterias carótidas ocluidas, inclusión de pacientes con déficits neurológicos inestables y severos, la ausencia de pruebas de imagen caracterizando el infarto, nulo control de la tensión arterial perioperatoria).
En 2004 Rothwell et al.4, a partir de un reanálisis del NASCET y ECST, aseveran que el máximo beneficio de la EAC, en términos de prevención secundaria de ictus, se obtiene en los pacientes intervenidos dentro de las 2 primeras semanas tras el ictus. Este hecho, junto con la evidencia de un alto riesgo de recurrencia de ictus tras un primer episodio (mayor de lo estimado previamente9,10) ha supuesto que, en la actualidad, el momento óptimo de la revascularización carotídea tras un ACV sea motivo de acusada controversia. Así las cosas, las guías han modificado sus directrices, estableciéndose, a día de hoy, que la EAC en pacientes sintomáticos con estenosis carotídea≥70% ha de efectuarse en las 2 primeras semanas tras el ACV.
Nuestros resultados en pacientes sintomáticos muestran una tasa de ictus-muerte perioperatoria del 3,9%, claramente por debajo de los estándares determinados, a partir de los resultados de los estudios NASCET y ECST, como límite aceptable y exigible de morbimortalidad de la cirugía carotídea, los cuales presentaron unas cifras de riesgo combinado de ictus-muerte del 6,5-7%. La cirugía de revascularización carotídea está justificada, demostrando su superioridad frente al tratamiento médico, siempre y cuando la morbimortalidad sea inferior al 6% en pacientes sintomáticos, y al 3% en pacientes asintomáticos.
La incidencia de complicaciones cardiológicas hallada es baja (0,9; por debajo de las cifras que aporta el estudio Carotid Revascularization Endarterectomy versus Stenting Trial (CREST)11, con una incidencia de IAM en el grupo endarterectomía del 2,3%. Esta diferencia es debida a que en el estudio CREST se solicitaba de forma sistemática en el postoperatorio enzimas cardíacas y ECG. Al no formar parte de nuestro protocolo quirúrgico perioperatorio, es probable que algún IAM silente pueda haber pasado desapercibido.
Aunque la mediana del tiempo que transcurre desde la clínica hasta el momento de la intervención es de 22 días y está próxima a los 14 que recomiendan las guías actuales, la proporción de pacientes que se operan de forma diferida es superior (65,9% vs. 34,1%). Probablemente, el origen de este hecho esté no solo en factores logísticos condicionantes del retraso quirúrgico (tiempo transcurrido hasta la realización de las pruebas diagnósticas, derivación al servicio de cirugía vascular, valoración anestésica…), sino también en el peso de la recomendación original, firmemente arraigada en nuestro servicio durante años, alertando sobre el riesgo de la EAC realizada precozmente.
Dada la no significación estadística para la mayoría de variables, se considera que ambos grupos son homogéneos.
A diferencia de otros estudios12, puede excluirse un sesgo de selección consistente en que los pacientes con un evento cerebrovascular leve se orientarían a la EAC precoz, en tanto que los pacientes con un infarto cerebral establecido («stroke») se revascularizarían tardíamente, una vez superado el período de, teóricamente, mayor riesgo quirúrgico. La ausencia de diferencias estadísticamente significativas en la composición de ambos grupos, según el tipo de ACV, permite afirmar este hecho y asumir que los pacientes con un riesgo quirúrgico inherente se distribuyen homogéneamente.
La mayor proporción, estadísticamente significativa, de «signo de la cuerda» en pacientes intervenidos en los primeros 14 días, está en línea con la idea previa de que este hallazgo constituía un factor de alto riesgo de ictus con indicación de cirugía inmediata. Varios estudios recientes13–15 han demostrado que la EAC con lesiones preoclusivas y «signo de la cuerda» no confiere ningún beneficio, por lo que estos pacientes han de ser tratados médicamente. Actualmente, esta es la pauta que se sigue en nuestro servicio. Sorprendentemente, el empleo de shunt fue significativamente más frecuente en los casos intervenidos de modo diferido, a diferencia de otras series, en las que el shunt es un imperativo en caso de infarto cerebral agudo clínico o radiológico16. Al no existir consenso en esta cuestión, nuestra postura es utilizar shunt selectivamente en función del reflujo del muñón carotídeo y de la saturación de oxígeno cerebral tras el pinzamiento medido con NIRS.
Los resultados de nuestro estudio, en términos de complicaciones neurológicas, cardiológicas o mortalidad precoz, así como de restantes complicaciones, son equivalentes en ambos grupos, sin diferencias estadísticamente significativas, de modo que, en los pacientes intervenidos precozmente no se ha hallado un incremento del riesgo quirúrgico. La EAC dentro de las 2 primeras semanas tras el ACV es segura y efectiva en el tratamiento del ictus, en concordancia con la mayoría de los estudios actuales que arrojan resultados en este sentido16–25.
La interpretación de los resultados no significativos ha de hacerse con cautela, ya que se podría incurrir en un error tipo ii y aceptar que las diferencias entre la EAC precoz y la diferida son atribuibles al azar cuando realmente sí existen. Por eso, cuando el grado de significación de p no es muy alto y está próximo a 0,05 sería deseable aumentar la potencia del contraste. En nuestro caso, un mayor tamaño muestral aumentaría la potencia del estudio reduciendo la probabilidad de este tipo de error.
Aunque consideramos que la fortaleza de nuestro trabajo se basa en el reclutamiento consecutivo de pacientes, reflejando una situación real, y en la ausencia del sesgo de selección intrínseco a los estudios controlados aleatorizados, al mismo tiempo su principal limitación es su naturaleza retrospectiva con casos derivados de un único centro y sin aleatorizar. Además, el tamaño muestral y la baja tasa de complicaciones actúa restringiendo el análisis estadístico, lo que podría restar potencia a los resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.