El uso de los dispositivos de cierre arterial percutáneo (DCAP) se ha generalizado en los últimos años, lo implica riesgo de complicaciones específicas derivadas de la falta de efectividad hemostática y de su liberación inadecuada. La evidencia disponible referente a los CDAP está basada en datos de procedimientos coronarios, no extrapolares al intervencionismo periférico.
ObjetivosDemostrar que la hemostasia del acceso arterial con DCAP tras procedimientos percutáneos arteriales periféricos es más rápida que con compresión manual (CM) sin disminuir la efectividad hemostática inicial y seguridad.
Material y métodosRealizamos un ensayo clínico aleatorizado reclutando a todos los pacientes tratados mediante procedimientos percutáneos arteriales a través de introductores entre 4 y 8 French. Se asignó mediante aleatorización un sistema hemostático: CM, Angioseal®, StarClose® o Proglide®, registrándose la eficacia, el tiempo de hemostasia y la ocurrencia de complicaciones en el acceso arterial pasados 1 y 30 días de la intervención.
ResultadosSe incluyó a 40 pacientes por grupo. La eficacia hemostática resultó igual en los 4 grupos (CM: 87,5%; Angioseal®: 87,5%; StarClose®: 85%; Proglide®: 85% [p: 0,97]). CM (767,50±153,89 s) resultó más lenta que Angioseal® (134,95±102 s), StarClose®: (171,30±134,56 s) y Proglide® (224,78±205,90 s [p <0,01]). CM presentó mayor ocurrencia de hematoma menor al compararla frente Proglide® (11 vs. 2; p <0,01), StarClose® (11 vs. 3; p <0,01) y Angioseal® (2 vs. 11; p <0,01).
ConclusionesLa hemostasia con DCAP en procedimientos arteriales periféricos es más rápida que con CM, sin disminuir la efectividad hemostática ni la seguridad.
Percutaneous Arterial Closure Devices (PACD) have become increasingly used in the last few years. This involves a risk of specific complications arising from the failure to achieve effective haemostasis and their inadequate release. The available evidence on these devices is scarce, and is mainly based on data from coronary procedures that cannot be extrapolated to peripheral interventions.
ObjectivesTo compare 3 different types of PACD with different mechanisms of action compared to manual compression (MC) in percutaneous peripheral arterial interventions.
Material and methodsA Randomized Control Trial was designed, recruiting all patients undergoing percutaneous arterial interventions using 4 to 8 French arterial sheaths. One of the following haemostatic procedures was randomly assigned: MC, Angioseal®, StarClose®, or Proglide®. A record was made of the haemostatic efficacy, time to haemostasis, and occurrence of access-related complications at 1 and 30 days after the procedure.
ResultsA total of 40 patients were included in each group. There were no differences observed, as regards haemostatic effectivity, between groups (MC: 87.5%; Angioseal®: 87.5%; StarClose®: 85%; and Proglide®: 85%; [P=.97]). MC (767.50±153.89 secs) was slower than Angioseal® (134.95±102 secs), StarClose®: (171.30±134.56 secs) and Proglide® (224.78±205.90 secs) (P<.01). Minor haematomas occurred significantly more frequently with MC than with Proglide® (11 vs. 2; P<.01), StarClose® (11 vs. 3; P<.01), and Angioseal® (2 vs. 11; P<.01).
ConclusionsHaemostasis with PACDs in peripheral arterial interventions is faster than MC, without decreasing haemostatic effectivity or safety.
Idealmente, el dispositivo de cierre arterial percutáneo (DCAP) debe ser fácil de usar, proporcionar una hemostasia rápida y segura independientemente del estado de coagulación y posibilitar la utilización repetida del acceso arterial. Además, su uso no debe generar más complicaciones que la compresión manual. Si bien la evidencia actual no nos permite afirmar que exista ningún DACP que reúna todas estas características, sí es cierto que la mejora técnica que han experimentado estos sistemas en las últimas 2 décadas ha sido continua, lo que ha propiciado la generalización progresiva de su utilización.
Los DCAP disponibles actualmente pueden clasificarse en 3 grupos fundamentales: sistemas basados en tapón extravascular (de colágeno y otros materiales), grapas o «clips» y mediados por sutura arterial. Además, existe un grupo heterogéneo de dispositivos de última generación que emplean otras tecnologías y materiales para lograr la hemostasia.
El uso de los DCAP se ha generalizado en los últimos años, lo que implica riesgo de complicaciones específicas derivadas de la falta de efectividad hemostática y de su liberación inadecuada. La gran mayoría de los ensayos clínicos aleatorizados (ECA) ha seleccionado alguno o varios de los 3 DCAP incluidos en el ensayo clínico que presentamos, comparando generalmente 2de estos sistemas entre sí o frente a la compresión manual. Hasta la fecha, 2 ECA han comprado Angioseal® frente a Perclose®1,2, un ECA comparando Angioseal® frente a StarClose®3, y no existen ECA que hayan comparado Perclose® frente a StarClose®, Perclose® y StarClose®. Tampoco se ha publicado ningún estudio aleatorizado comparando los 3 dispositivos entre sí. Además, todos los pacientes incluidos en los ECA mencionados fueron tratados mediante procedimientos coronarios, no extrapolables al intervencionismo periférico por los siguientes motivos:
- –
El grado de enfermedad arterial en el lugar de punción es presumiblemente mayor en pacientes con EAP.
- –
En los procedimientos endovasculares terapéuticos para enfermedad periférica se administra medicación anticoagulante para evitar complicaciones trombóticas intraprocedimiento, permaneciendo el paciente anticoagulado en la mayoría de los casos en el momento de conseguir la hemostasia.
- –
Los cateterismos cardiacos realizados a través de acceso arterial femoral se realizan por punción en sentido retrógrado de la AFC en todos los casos, al contrario que los procedimientos de revascularización de miembros inferiores (MMII), en los que la punción es más frecuentemente anterógrada y, en muchas ocasiones, fuera de la arteria femoral común (AFC).
En cuanto a los metaanálisis, 6 han estudiado la eficacia y seguridad de los DCAP frente a compresión manual, incluyendo también comparaciones entre los pares de dispositivos más empleados4-8. El más reciente de ellos, publicado en 2016 por Robertson et al. para la base de datos Cochrane de revisiones sistemáticas9, concluyó que se necesitan trabajos adicionales para evaluar la eficacia de los DCAP actualmente en uso y para compararlos con otros dispositivos y con la compresión extrínseca.
En este contexto presentamos un ensayo clínico aleatorizado (ECA) con el objetivo de comparar la eficacia y seguridad de los 3 DCAP con mayor experiencia de uso entre sí y frente a compresión manual.
ObjetivoComparar la eficacia y la seguridad de 3 DCAP con más diferentes mecanismos de acción entre sí y frente a compresión manual en procedimientos percutáneos sobre territorio arterial periférico.
Material y métodosDiseñoSe trata de un ECA.
Pacientes y materialSe realizó un muestreo de casos consecutivos de todos los pacientes tratados mediante procedimientos arteriales periféricos percutáneos en el Servicio de Angiología y Cirugía Vascular de Toledo entre junio del 2012 y junio del 2014, reclutando a cualquier individuo que cumpliera todos los criterios de inclusión:
- –
Haber cumplido los 18 años de edad.
- –
Ser sometido a procedimiento endovascular percutáneo que precise acceso femoral con introductor de entre 4 y 8 Fr de diámetro. Los pacientes que requirieron accesos arteriales de mayor diámetro quedaron excluidos del estudio para posibilitar la aleatorización de los procedimientos hemostáticos, puesto que uno de los dispositivos comparados (StarClose®) no presenta indicación para cerrar arteriotomías mayores de 8 French.
- –
Haber firmado un consentimiento informado específico para el estudio.
Se consideraron como criterios de exclusión:
- –
Presentar contraindicaciones conocidas para alguno de los 3DCAP testados en el estudio.
- –
Haberse realizado el procedimiento a través de acceso arterial con punción en AFP o bifurcación femoral.
El sistema hemostático utilizado en los pacientes incluidos en el estudio se seleccionó de forma aleatoria con ayuda de una sintaxis ejecutada en el programa SPSS que generó, al inicio de estudio, un listado de 160 números comprendidos entre 1 y 4, habiendo sido asignado cada sistema hemostático a uno de esos números previamente. La sintaxis incluyó un comando que aseguraba la distribución equitativa de los pacientes a razón de 40 por grupo. Al final del procedimiento se consultaba el listado y se empleaba el sistema de cierre correspondiente en orden correlativo. Ni paciente ni intervencionista fueron cegados para el sistema hemostático.
Considerando la proporción de referencia de un 95% de éxito hemostático según la bibliografía disponible actualmente, el número de punciones necesarias para cada brazo del estudio se calculó en 30, ampliándose a 40 en previsión de pérdida de un 5% de pacientes por grupo, lo que generó un tamaño muestral total de 160 pacientes.
Descripción de los DCAP incluidos en el estudio- 1.
Angioseal®(Terumo Medical Corporation): se compone de un ancla intraarterial plana y bioabsorbible de 2×10mm, unida mediante una sutura de ácido poliglicólico a un tapón de colágeno bovino. El ancla permanece en localización intraarterial una vez liberado el dispositivo, que es completamente reabsorbible.
- 2.
StarClose®(Abbott Vascular, Redwood City, California): este DCAP consigue la hemostasia mediante el implante extravascular de un clip de 4mm de diámetro compuesto por nitinol. El único componente que permanece una vez liberado es completamente extraarterial y no reabsorbible.
- 3.
Perclose Proglide®(Abbott Vascular, Redwood City, California):consiste en una sutura de polipropileno con un nudo preformado que se inserta a través de guía intraarterial. El mecanismo hemostático es completamente mecánico, muy similar al cierre arterial quirúrgico empleado en accesos no percutáneos.
Se realizaron por protocolo estudio de hemograma y de coagulación en todos los pacientes incluidos. Las analíticas fueron extraídas de sangre venosa periférica dentro de las 24h previas a la intervención, dentro del minuto previo a la retirada del último introductor arterial y entre las primeras 16 a 32h postintervención. La anticoagulación intraoperatoria se realizó en todos los casos mediante la administración de heparina sódica intravenosa a razón de 80-100 UI/kg de peso. La administración de sulfato de protamina al finalizar el procedimiento para revertir el efecto anticoagulante se decidió en cada caso individual según preferencia del cirujano responsable. Se registró en todos los casos el uso medicación antiagregante en el momento de la punción arterial, en el postoperatorio inmediato y durante el seguimiento. El encontrarse bajo tratamiento antiagregante simple o doble no fue considerado criterio de exclusión. Dada la posible influencia del estado de antiagregación o anticoagulación sobre la hemostasia, se analizaron las posibles diferencias entre los grupos en lo relativo al estado de la coagulación y al uso de fármacos pro y anticoagulantes.
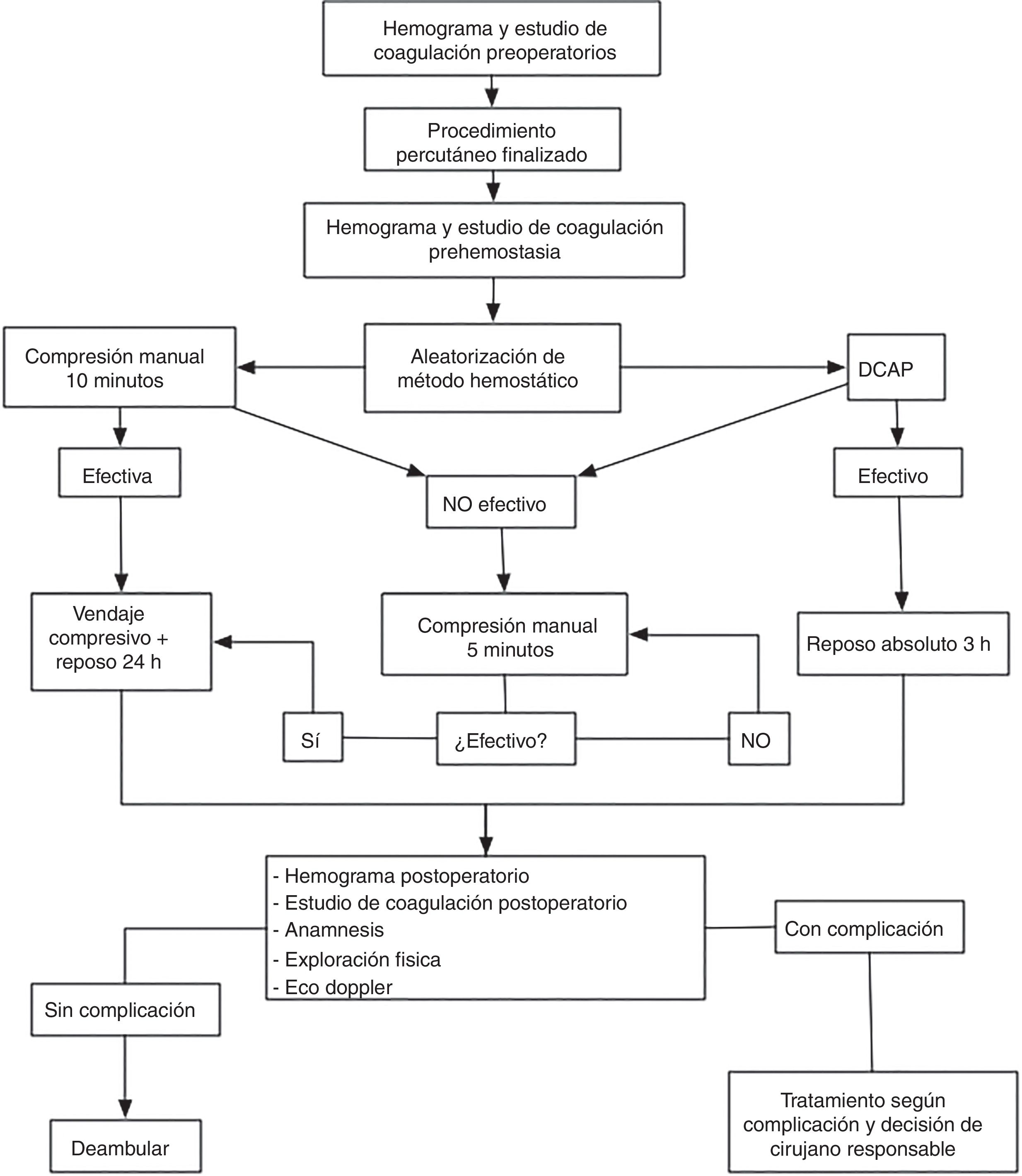
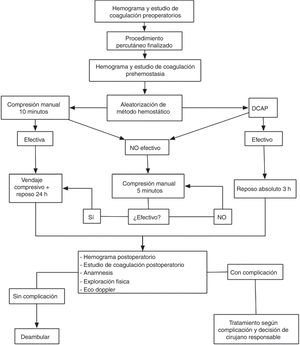
Proceso de consecución de la hemostasia y manejo postoperatorio del acceso arterialEn los pacientes asignados a cualquiera de los DCAP se procedió a la liberación del dispositivo inmediatamente después de la retirada del introductor arterial. Tras la colocación del dispositivo según las instrucciones de uso, se objetivó el éxito hemostático (ausencia de hematoma expansivo o sangrado activo significativo procedente del orificio de punción). Los pacientes en los que el DCAP obtuvo éxito hemostático completo permanecieron en reposo absoluto durante las 3 primeras horas posprocedimiento, sin aplicarse compresión adicional y sin colocarse vendaje compresivo. En aquellos pacientes que presentaron ausencia de eficacia hemostática del DCAP se aplicó compresión manual adicional durante 10 min, con reevaluación posterior cada 5 min hasta la consecución de la hemostasia completa. En los pacientes que presentaron fallo del dispositivo, se aplicó vendaje compresivo y se ordenó reposo absoluto durante 24h. Todos los DCAP colocados durante el estudio fueron liberados por un cirujano vascular con experiencia en la liberación de DCAP de al menos 10 casos.
En los pacientes asignados al grupo de compresión manual la hemostasia del acceso arterial se consiguió mediante aplicación de presión con ambas manos sobre la zona de máximo pulso, con ausencia de hematoma expansivo y sangrado activo significativo desde el orificio de punción. La duración de la compresión inicial fue establecida por protocolo en 10 min, con compresión adicional cada 5 min y reevaluación en caso de no ser efectiva la compresión inicial. Tras lograrse la hemostasia completa, se estableció reposo absoluto durante 24h y se colocó vendaje compresivo con venda elástica autoadherente (fig. 1).
Evaluación postoperatoria de complicaciones relacionadas con la punción arterialTodos los pacientes incluidos en el estudio fueron evaluados entre 18 y 24 h después de la intervención. La evaluación postoperatoria realizada por protocolo incluyó en todos los casos anamnesis, exploración física y exploración con ecografía Doppler de la zona de punción.
Durante la evaluación en el postoperatorio inmediato y en la visita de revisión al mes de la intervención, el paciente fue interrogado acerca de dolor en la zona de punción, con la utilización de la escala visual analógica (EVA) para la gradación del dolor subjetivo percibido por el paciente, consistente en una línea graduada del 0 al 10 en la que el paciente marca de forma física el grado de dolor experimentado, siendo 0 la «ausencia de dolor» y 10 «el dolor más intenso que he percibido». La escala mide 10 cm exactos y el grado de dolor se expresa con un número equivalente a la distancia entre la línea del 0 y la marca realizada por el paciente10.
Se registró la aparición de las siguientes complicaciones relacionadas con el acceso arterial: seudoaneurisma, fístula arterio-venosa, oclusión arterial, estenosis arterial, hemorragia mayor (según criterios REPLACE-2)11 y hematoma (mayor o menor). Se consideró hematoma grave todo aquel que cumpliera alguna de las siguientes características:
- –
Mayor de 3cm de diámetro.
- –
Requirió tratamiento quirúrgico.
- –
Requirió transfusión de concentrados de hematíes.
- –
Provocó una disminución de la hemoglobina mayor o igual a 3g/dl respecto al hemograma realizado inmediatamente antes de aplicar la técnica hemostática asignada.
La adquisición de datos se realizó mediante soporte informático, utilizando formularios con campos controlados creados específicamente para el estudio con el programa informático Microsoft Access 2007®, registrándose variables demográficas y antecedentes clínicos de los pacientes, así como variables relacionadas con el procedimiento y el acceso arterial empleado. Se definió eficacia hemostática a la ausencia de signos de sangrado (sangrado a través del orificio de punción, hematoma expansivo o signos clínicos de sangrado intraabdominal) en el acceso arterial inmediatamente después de la aplicación del procedimiento hemostático asignado. Se registró la presencia de la alguna de las complicaciones asociadas al acceso arterial listadas previamente. La sensación subjetiva de dolor en la zona de punción se graduó según la escala EVA.
Se establecieron comparaciones directas en la distribución de variables demográficas y patológicas basales, de procedimiento y relacionadas con la exploración postoperatoria tanto clínica como ecográfica de los pacientes. El contraste de hipótesis de la diferencia se realizó mediante la prueba de la t en el caso de las variables cuantitativas continuas con distribución normal, y con la prueba de la χ2 en el caso de las variables categóricas, utilizando la corrección de Yates en los casos pertinentes. La normalidad de las variables fue testada previamente mediante la aplicación de la prueba de Kolgomorov-Smirnoff. En las comparaciones múltiples entre los grupos se aplicó la corrección de Bonferroni. Se consideraron significativas aquellas relaciones con probabilidad de error tipo i menor de 5.
Se diseñaron 2modelos de regresión logística binomial utilizando el procedimiento LOGISTIC REGRESSION del software IBM SPSS Statistics V 21.0®. En ambos se utilizó el método de exclusión de variables independientes por pasos para disponer del grado de significación, calculado con la prueba de la razón de verosimilitud (se excluyeron del modelo las variables con significación p> 0,10 y se incluyeron aquellas con significación <0,05).
En uno de los modelos se utilizó como variable dependiente la presencia o ausencia de fallo del sistema hemostático para conseguir la hemostasia. Se consideraron como variables independientes potencialmente incluibles a aquellas consideradas en la literatura como factores de riesgo de fallo en la hemostasia. De estas, fueron incluidas en el modelo aquellas que demostraron asociación estadísticamente significativa con la efectividad hemostática en el análisis bivariante:
- 1.
Obesidad (IMC <30 o IMC> 30).
- 2.
Arteria puncionada.
- 3.
Grado de enfermedad de la arteria puncionada (sana/calcificación en cara anterior/calcificación en cara posterior/calcificación en 3/4 de la circunferencia).
- 4.
Dirección de la punción (anterógrada/retrógrada).
- 5.
Método de guiar la punción (ecográfico/radiográfico/palpación de pulso).
- 6.
Diámetro externo máximo del introductor arterial.
- 7.
Recuento de plaquetas dentro del minuto previo a la hemostasia.
- 8.
INR dentro del minuto previo a la hemostasia.
- 9.
TTPa dentro del minuto previo a la hemostasia.
- 10.
Sistema hemostático utilizado.
En el otro modelo se utilizó como variable dependiente la presencia o la ausencia de alguna complicación mayor relacionada con el acceso arterial. Se consideraron como variables independientes potencialmente incluibles aquellas consideradas en la literatura como factores de riesgo de aparición de complicaciones. De estas, fueron incluidas en el modelo aquellas que demostraron asociación estadísticamente significativa con el riesgo de complicaciones en el análisis:
- 1.
Obesidad (IMC <30 o IMC> 30).
- 2.
IMC (valor absoluto).
- 3.
Arteria puncionada.
- 4.
Grado de enfermedad de la arteria puncionada (sana/calcificación en cara anterior/calcificación en cara posterior/calcificación en 3/4 de la circunferencia).
- 5.
Dirección de la punción (anterógrada/retrógrada).
- 6.
Método de guiar la punción (ecográfico/radiográfico/palpación de pulso).
- 7.
Diámetro externo máximo del introductor arterial.
- 8.
Recuento de plaquetas dentro del minuto previo a la hemostasia.
- 9.
INR dentro del minuto previo a la hemostasia.
- 10.
TTPa dentro del minuto previo a la hemostasia.
- 11.
Sistema hemostático utilizado.
- 12.
Fallo de la hemostasia inicial (presencia/ausencia).
Todos los cálculos estadísticos han sido desarrollados con el software IBM SPSS 21.0® bajo licencia de IBM (Armonk, Nueva York, EE. UU.).
Para el desarrollo de este estudio se ha contado con la aprobación del Comité Ético de Investigación Clínica del Complejo Hospitalario de Toledo.
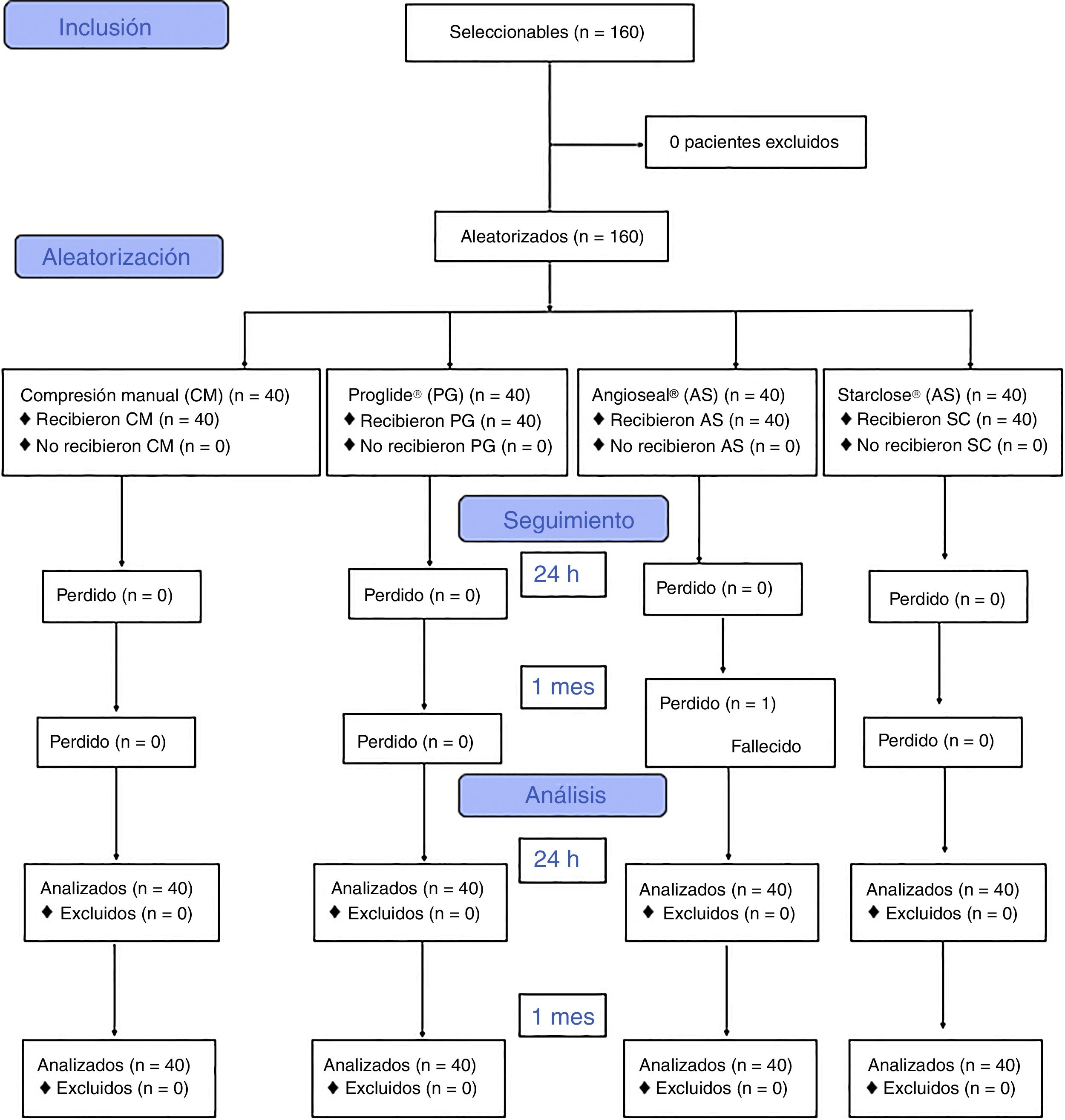
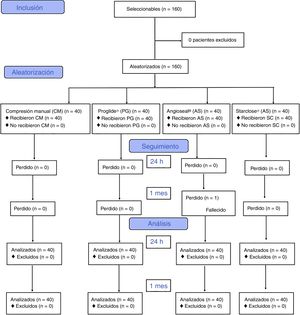
ResultadosEntre junio del 2012 y junio del 2014 se reclutaron para el estudio 160 accesos arteriales, asignándose 40 casos a cada grupo de sistema hemostático. Todos los pacientes completaron el seguimiento a 24h del procedimiento. No se completó el seguimiento al mes del procedimiento de un paciente del grupo Angioseal®, que falleció por causa no relacionada con el acceso arterial (fig. 2).
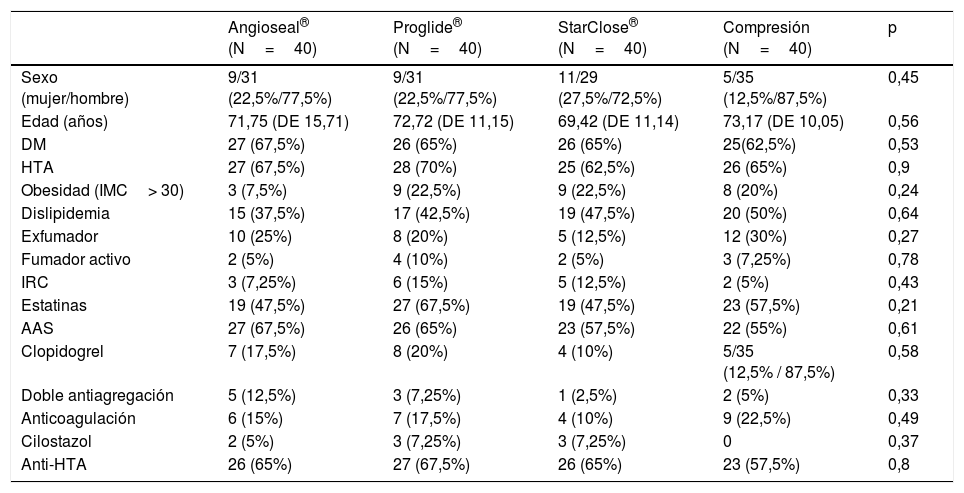
Distribución de variables basales y relacionadas con el procedimientoEn la tabla 1 se detalla la distribución de variables basales, comorbilidades y tratamientos crónicos en los 4grupos de pacientes, y la ausencia de significación estadística de la diferencia en todas y cada una de las variables basales analizadas. Tampoco se encontraron diferencias significativas para estas variables al comparar por pares de sistemas hemostáticos.
Distribución global de variables basales
| Angioseal® (N=40) | Proglide® (N=40) | StarClose® (N=40) | Compresión (N=40) | p | |
|---|---|---|---|---|---|
| Sexo (mujer/hombre) | 9/31 (22,5%/77,5%) | 9/31 (22,5%/77,5%) | 11/29 (27,5%/72,5%) | 5/35 (12,5%/87,5%) | 0,45 |
| Edad (años) | 71,75 (DE 15,71) | 72,72 (DE 11,15) | 69,42 (DE 11,14) | 73,17 (DE 10,05) | 0,56 |
| DM | 27 (67,5%) | 26 (65%) | 26 (65%) | 25(62,5%) | 0,53 |
| HTA | 27 (67,5%) | 28 (70%) | 25 (62,5%) | 26 (65%) | 0,9 |
| Obesidad (IMC> 30) | 3 (7,5%) | 9 (22,5%) | 9 (22,5%) | 8 (20%) | 0,24 |
| Dislipidemia | 15 (37,5%) | 17 (42,5%) | 19 (47,5%) | 20 (50%) | 0,64 |
| Exfumador | 10 (25%) | 8 (20%) | 5 (12,5%) | 12 (30%) | 0,27 |
| Fumador activo | 2 (5%) | 4 (10%) | 2 (5%) | 3 (7,25%) | 0,78 |
| IRC | 3 (7,25%) | 6 (15%) | 5 (12,5%) | 2 (5%) | 0,43 |
| Estatinas | 19 (47,5%) | 27 (67,5%) | 19 (47,5%) | 23 (57,5%) | 0,21 |
| AAS | 27 (67,5%) | 26 (65%) | 23 (57,5%) | 22 (55%) | 0,61 |
| Clopidogrel | 7 (17,5%) | 8 (20%) | 4 (10%) | 5/35 (12,5% / 87,5%) | 0,58 |
| Doble antiagregación | 5 (12,5%) | 3 (7,25%) | 1 (2,5%) | 2 (5%) | 0,33 |
| Anticoagulación | 6 (15%) | 7 (17,5%) | 4 (10%) | 9 (22,5%) | 0,49 |
| Cilostazol | 2 (5%) | 3 (7,25%) | 3 (7,25%) | 0 | 0,37 |
| Anti-HTA | 26 (65%) | 27 (67,5%) | 26 (65%) | 23 (57,5%) | 0,8 |
Anti-HTA: tratamiento con antihipertensivos; DE: desviación estándar; IMC: índice de masa corporal;
No se detectaron diferencias estadísticamente significativas entre los grupos para las variables relacionadas directamente con la técnica intervencionista y el acceso arterial empleado. Tampoco se encontraron diferencias al comparar por pares de procedimientos hemostáticos en este aspecto. El diámetro externo de introductor arterial más utilizado en todos los procedimientos fue 6 Fr (128 procedimientos [80%]) con una media de 6,23 Fr de diámetro para todos los casos. No se encontraron diferencias estadísticamente significativas entre los grupos en la distribución de diámetros de introductor empleados ni en la media de French de los mismos.
Variables relacionadas con la capacidad de coagulación sanguínea periprocedimientoEl análisis de los parámetros relacionados con la coagulación (INR, TTPa, recuento de plaquetas) analizados en los períodos peripunción (dentro de las 24 h previas a la punción y dentro del minuto previo a la aplicación del procedimiento hemostático asignado) no ha arrojado diferencias estadísticamente significativa, al comparar cada sistema hemostático frente a los otros 3 ni al realizar comparaciones múltiples por parejas de dispositivos.
Efectividad hemostáticaSe consiguió la hemostasia completa de forma inicial con el método hemostático asignado en el 86,3% de las intervenciones. No se encontraron diferencias estadísticamente significativas en cuanto a porcentaje de procedimientos en los que se consiguió la hemostasia completa de forma inicial en la comparación global (CM: 87,5%; Angioseal®: 87,5%; StarClose®: 85%; Proglide®: 85% [p: 0,97]). Tampoco se han encontrado diferencias estadísticamente significativas en cuanto a porcentaje de consecución inicial de hemostasia completa al realizar comparaciones de cada dispositivo frente al conjunto de los otros tres. Las comparaciones múltiples por pares de dispositivos no arrojaron tampoco diferencias estadísticamente significativas en cuanto a porcentaje de consecución de hemostasia inicial completa.
La media ± DE de tiempo necesario para la consecución de la hemostasia completa para todos los procedimientos fue de 302 ± 295,09 s. Al comparar de forma global los 4 grupos de pacientes se hallaron diferencias estadísticamente significativas en cuanto al tiempo de hemostasia (CM: 767,50±153,89 s; Angioseal®: 134,95±102 s; StarClose®: 171,30±134,56 s; Perclose Proglide®: 224,78±205,90 s [p <0,01]). Considerando únicamente los procedimientos con hemostasia inicial efectiva, y que por tanto no requirieron compresión manual adicional, los tiempos de hemostasia para cada dispositivo fueron de 608,57±50,507 s para CM, 76,17±46,95 s con Angioseal®, 126,13±83,61 s con Proglide® y 105,50±71,22 s con StarClose®, encontrándose diferencias estadísticamente significativas en la comparación global (p <0,01).
La comparación múltiple por pares de dispositivos arrojó tiempos de hemostasia significativamente más largos para la CM comparado con cada uno de los 3 dispositivos, siendo además Angioseal® significativamente más rápido que Proglide® (76,17±46,95 s vs. 126,13±83,61 s [p <0,01]) y que StarClose® (76,17±46,95 s vs. 114,74±68,66 s [p <0,01]) en los procedimientos con eficacia hemostática inicial completa (tabla 2).
Diferencias entre las medias de tiempo de hemostasia (en segundos) por pares de procedimientos hemostáticos
| PG vs. AS | PG vs. CM | PG vs. SC | SC vs. AS | SC vs. CM | AS vs. CM | |
|---|---|---|---|---|---|---|
| Incluyendo casos con compresión adicional | 89,82±42,04 p=0,037 | –442,72±43,8 p <0,01 | 45,62±43,25 p=0,29 | 44,20±38,97 p=0,26 | –488,35±40,92 p <0,01 | –532,55±39,64 p <0,01 |
| Excluyendo casos con compresión adicional | 49,95±16,45 p <0,01 | –482,44±16,8 p <0,01 | 11,39±18,91 p=0,54 | 38,56±14,12 p <0,01 | –493,83±14,50 p <0,01 | –532,40±11,68 p <0,01 |
AS: Angioseal®; CM: compresión manual; PG: Perclose Proglide®; SC: StarClose®.
En negritas, las comparaciones con diferencias estadísticamente significativas.
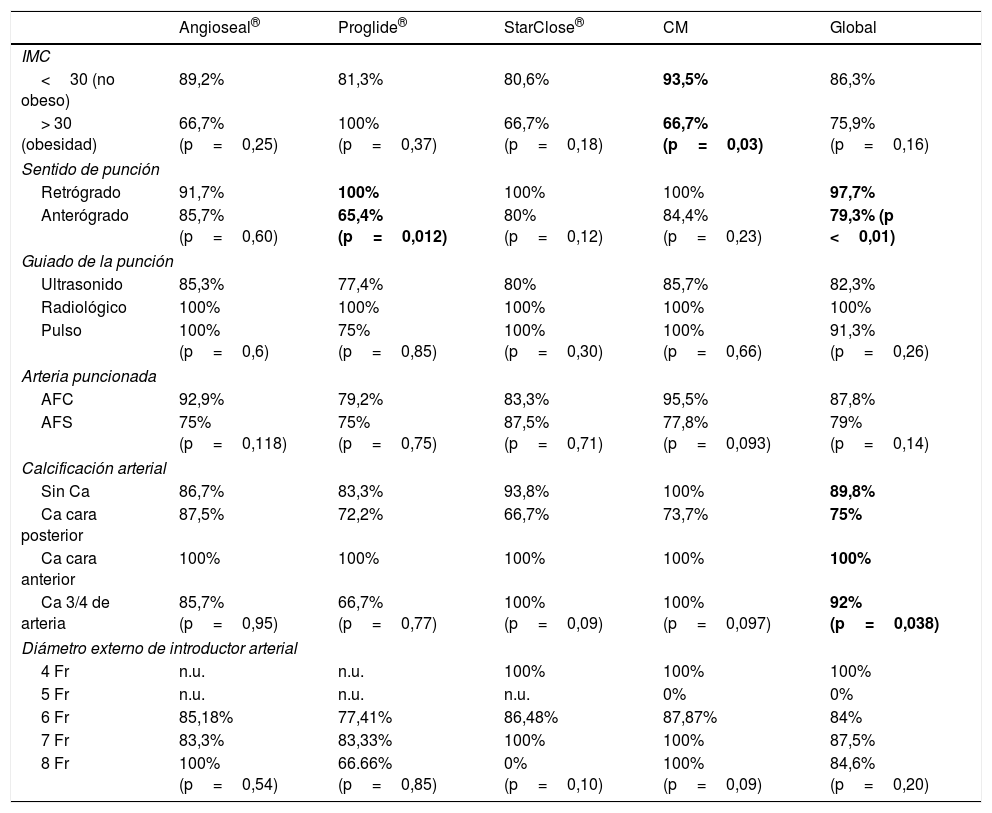
No se han encontrado diferencias estadísticamente significativas en cuanto a eficacia hemostática inicial, comparando a los pacientes según el método de guiar la punción, el grado de calcificación de la arteria puncionada, la localización de la punción en arteria femoral superficial (AFS) o AFC o la presencia o no de obesidad (IMC> 30), ni en el análisis global de los datos ni para cada procedimiento hemostático individual, salvo en el caso de la CM, que ha sido significativamente menos efectiva en pacientes con obesidad (tabla 3).
Porcentaje de eficacia hemostática inicial según características del acceso arterial e IMC
| Angioseal® | Proglide® | StarClose® | CM | Global | |
|---|---|---|---|---|---|
| IMC | |||||
| <30 (no obeso) | 89,2% | 81,3% | 80,6% | 93,5% | 86,3% |
| > 30 (obesidad) | 66,7% (p=0,25) | 100% (p=0,37) | 66,7% (p=0,18) | 66,7% (p=0,03) | 75,9% (p=0,16) |
| Sentido de punción | |||||
| Retrógrado | 91,7% | 100% | 100% | 100% | 97,7% |
| Anterógrado | 85,7% (p=0,60) | 65,4%(p=0,012) | 80%(p=0,12) | 84,4% (p=0,23) | 79,3% (p <0,01) |
| Guiado de la punción | |||||
| Ultrasonido | 85,3% | 77,4% | 80% | 85,7% | 82,3% |
| Radiológico | 100% | 100% | 100% | 100% | 100% |
| Pulso | 100% (p=0,6) | 75% (p=0,85) | 100% (p=0,30) | 100% (p=0,66) | 91,3% (p=0,26) |
| Arteria puncionada | |||||
| AFC | 92,9% | 79,2% | 83,3% | 95,5% | 87,8% |
| AFS | 75% (p=0,118) | 75% (p=0,75) | 87,5% (p=0,71) | 77,8% (p=0,093) | 79% (p=0,14) |
| Calcificación arterial | |||||
| Sin Ca | 86,7% | 83,3% | 93,8% | 100% | 89,8% |
| Ca cara posterior | 87,5% | 72,2% | 66,7% | 73,7% | 75% |
| Ca cara anterior | 100% | 100% | 100% | 100% | 100% |
| Ca 3/4 de arteria | 85,7% (p=0,95) | 66,7%(p=0,77) | 100% (p=0,09) | 100% (p=0,097) | 92% (p=0,038) |
| Diámetro externo de introductor arterial | |||||
| 4 Fr | n.u. | n.u. | 100% | 100% | 100% |
| 5 Fr | n.u. | n.u. | n.u. | 0% | 0% |
| 6 Fr | 85,18% | 77,41% | 86,48% | 87,87% | 84% |
| 7 Fr | 83,3% | 83,33% | 100% | 100% | 87,5% |
| 8 Fr | 100% (p=0,54) | 66.66% (p=0,85) | 0% (p=0,10) | 100% (p=0,09) | 84,6% (p=0,20) |
AFC: arteria femoral común; AFS: arteria femoral superficial; Fr: French de diámetro; IMC: índice de masa corporal; n.u.: no utilizado.
En negritas figuran los resultados estadísticamente significativos.
La efectividad hemostática ha sido significativamente mayor para las punciones retrógradas en comparación con las punciones anterógradas en el análisis global, siendo Perclose Proglide® el único sistema hemostático con disminución significativa de la tasa de efectividad en punciones anterógradas (tabla 3).
La eficacia hemostática ha presentado diferencias estadísticamente significativas al comparar los pacientes según el grado de calcificación arterial en el análisis global, siendo la calcificación en la cara posterior de la pared arterial la asociada a menor porcentaje de procedimientos hemostáticos efectivos. Estas diferencias no se han reproducido al analizar cada sistema de cierre arterial por separado (tabla 3).
En el análisis multivariante, la única variable que alcanzó significación para comportarse como predictora global del fallo del sistema hemostático, incluyendo a los pacientes de todos los grupos, fue la dirección de la punción, presentando peores resultados la punción anterógrada (riesgo relativo 21,402, IC del 95% 1,647-278,018; p=0,019). En el análisis ajustado por sistema hemostático utilizado, ninguna variable fue predictora de fallo para ninguno de los sistemas hemostáticos por separado.
SeguridadEl 20,6% del global de pacientes incluidos en el estudio presentó alguna complicación postoperatoria, de las cuales la más frecuente fue la aparición de hematoma menor en el lugar de punción. Al considerar únicamente la aparición de complicaciones mayores, el porcentaje de complicaciones descendió al 10,6%, sin encontrarse diferencias significativas entre los grupos.
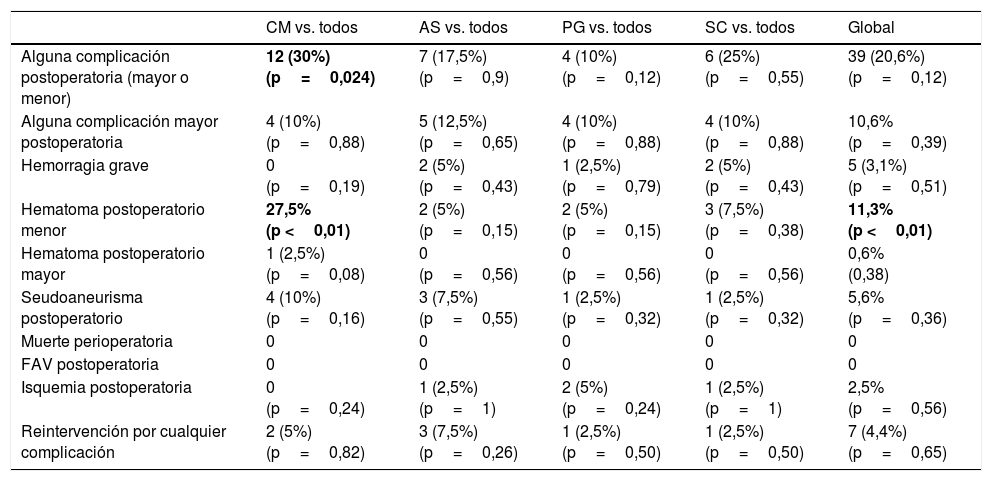
Únicamente se ha encontrado una diferencia estadísticamente significativa entre los diferentes sistemas hemostáticos, comparados globalmente, en el porcentaje de pacientes que presentaron hematoma menor postoperatorio (11,3% [p <0,01]). Al comparar de individualmente cada sistema hemostático frente al conjunto de los otros 3, únicamente se ha encontrado una mayor incidencia de complicaciones postoperatorias (mayores y menores) para CM (30% [p=0,024]), a expensas de un aumento en la proporción de hematoma menor postoperatorio para ese grupo (27,5% [p <0,01]) (tabla 4).
Distribución de las complicaciones perioperatorias. Se incluye la significación estadística de las diferencias encontradas
| CM vs. todos | AS vs. todos | PG vs. todos | SC vs. todos | Global | |
|---|---|---|---|---|---|
| Alguna complicación postoperatoria (mayor o menor) | 12 (30%) (p=0,024) | 7 (17,5%) (p=0,9) | 4 (10%) (p=0,12) | 6 (25%) (p=0,55) | 39 (20,6%) (p=0,12) |
| Alguna complicación mayor postoperatoria | 4 (10%) (p=0,88) | 5 (12,5%) (p=0,65) | 4 (10%) (p=0,88) | 4 (10%) (p=0,88) | 10,6% (p=0,39) |
| Hemorragia grave | 0 (p=0,19) | 2 (5%) (p=0,43) | 1 (2,5%) (p=0,79) | 2 (5%) (p=0,43) | 5 (3,1%) (p=0,51) |
| Hematoma postoperatorio menor | 27,5% (p <0,01) | 2 (5%) (p=0,15) | 2 (5%) (p=0,15) | 3 (7,5%) (p=0,38) | 11,3% (p <0,01) |
| Hematoma postoperatorio mayor | 1 (2,5%) (p=0,08) | 0 (p=0,56) | 0 (p=0,56) | 0 (p=0,56) | 0,6% (0,38) |
| Seudoaneurisma postoperatorio | 4 (10%) (p=0,16) | 3 (7,5%) (p=0,55) | 1 (2,5%) (p=0,32) | 1 (2,5%) (p=0,32) | 5,6% (p=0,36) |
| Muerte perioperatoria | 0 | 0 | 0 | 0 | 0 |
| FAV postoperatoria | 0 | 0 | 0 | 0 | 0 |
| Isquemia postoperatoria | 0 (p=0,24) | 1 (2,5%) (p=1) | 2 (5%) (p=0,24) | 1 (2,5%) (p=1) | 2,5% (p=0,56) |
| Reintervención por cualquier complicación | 2 (5%) (p=0,82) | 3 (7,5%) (p=0,26) | 1 (2,5%) (p=0,50) | 1 (2,5%) (p=0,50) | 7 (4,4%) (p=0,65) |
En negritas, las comparaciones con diferencias estadísticamente significativas.
Al realizar comparaciones múltiples por pares de sistemas hemostáticos, un número significativamente menor de pacientes presentó alguna complicación relacionada con la punción al recibir hemostasia con Perclose Proglide® frente a los tratados mediante CM (4 vs. 12 [p <0,05]). Además, la compresión manual presentó mayor ocurrencia de hematoma menor perioperatorio al compararla frente PG (11 vs. 2; p <0,01), SC (11 vs. 3; p=0,01) y Angioseal® (2 vs. 11; p <0,01). No se encontraron diferencias estadísticamente significativas para el resto de las complicaciones en este análisis.
En el análisis multivariante, ninguna variable independiente alcanzó significación para comportarse como predictora global de aparición de complicaciones mayores relacionadas con el acceso arterial, incluyendo a los pacientes de todos los grupos. En el análisis ajustado por sistema hemostático utilizado, ninguna variable fue predictora de aparición de complicaciones mayores para ninguno de los sistemas hemostáticos.
Bienestar y tiempo de ingreso postoperatoriosSe realizó una comparación entre todos los grupos del tiempo de ingreso postoperatorio, el tiempo de ingreso total, el tiempo de reposo absoluto y el grado de percepción subjetiva del dolor en el lugar de punción medido por EVA (de 0 a 10). La media de tiempo de reposo absoluto postoperatorio del global de pacientes fue de 15,51±14,36 h, presentando diferencias significativas entre los grupos (p <0,01). Las medias globales de tiempo de ingreso total (11,064±44,76 días; p=0,39) y de tiempo de ingreso postintervención (7,35±13,35 días; p=0,42) no presentaron diferencias significativas entre los grupos.
Al realizar un análisis ajustado por procedimiento hemostático, se observaron diferencias estadísticamente significativas únicamente para la compresión manual frente al conjunto de los 3 dispositivos para las variables tiempo de reposo absoluto pospunción (diferencia de medias 10,78±4,97h; p <0,01) y la percepción subjetiva de dolor (diferencia de medias 1,16±0,93; p=0,014).
Posteriormente, se realizó un análisis comparando las mismas variables por pares de sistemas hemostáticos, en el que se objetivaron tiempos de reposo absoluto significativamente mayores para compresión manual frente a Angioseal® (diferencia de medias: 9,89±3,60h; p <0,01), Perclose Proglide® (diferencia de medias: 10,11±2,25h; p <0,01) y StarClose® (diferencia de medias: 12,34±1,97h; p <0,01). La puntuación de percepción subjetiva del dolor pospunción fue significativamente mayor para CM frente a Angioseal® (diferencia de medias: 1,44±0,49 puntos; p <0,01) y Perclose Proglide® (diferencia de medias: 1,23±0,56 puntos; p=0,03). Ni el tiempo de ingreso total ni el tiempo de ingreso pospunción presentaron diferencias estadísticamente significativas entre los grupos. La presencia de complicaciones relacionadas con la punción no supuso un aumento significativo del tiempo de ingreso postintervención (diferencia de las medias 1,8±6,88 días; p=0,56).
SeguimientoTodos los pacientes incluidos fueron evaluados clínica y ecográficamente pasado el primer mes postintervención, excepto un paciente del grupo de Angioseal® falleció durante el seguimiento por causas no relacionadas con el acceso arterial (infarto agudo de miocardio). Se detectaron 2 oclusiones arteriales en el lugar de punción (una en el grupo de Angioseal® y una en el grupo de StarClose®). Dos pacientes del grupo StarClose® y uno del grupo Angioseal® presentaron sangrado menor en el lugar de punción. No se objetivaron diferencias estadísticamente significativas en la tasa de nuevas complicaciones relacionadas con el acceso arterial durante el primer mes de seguimiento en la comparación global de todos los grupos, al comparar cada grupo frente al conjunto de los otros ni en las comparaciones múltiples por pares de sistemas hemostáticos.
DiscusiónLos datos relativos a la eficacia hemostática obtenidos en nuestro estudio (tiempo de hemostasia, tiempo hasta deambulación) son consistentes en la bibliografía. Sin embargo, existen controversias en cuanto a la seguridad de estos dispositivos al compararlos con la compresión manual4,7. Los ECA publicados hasta la fecha tienen en general un tamaño muestral suficiente para detectar diferencias en cuanto a eficacia hemostática, que, sin embargo, no es suficiente para detectar diferencias en cuanto a número de complicaciones, dada la relativa baja incidencia de las mismas. Existe además una importante heterogeneidad en los resultados, que genera dudas en cuanto a la metodología de diseño de algunos estudios4,6,7,12.
La mayoría de los ECA sobre hemostasia en procedimientos con acceso arterial femoral han sido realizados con pacientes tratados mediante cateterización coronaria, tratándose además en muchos casos de procedimientos exclusivamente diagnósticos. Únicamente 7 estudios han incluido de forma exclusiva procedimientos en territorios extracoronarios y un único estudio incluyó procedimientos realizados en territorios coronario y periférico8. Existen importantes diferencias en las técnicas empleadas y en las características del paciente entre los procedimientos realizados en cardiología intervencionista y los realizados en territorios periféricos, muchas de ellas con gran influencia sobre el acceso arterial utilizado, presentando gran importancia 2variables: el sentido de la punción femoral, que en el caso de los procedimientos periféricos, al contrario que en los coronarios, es frecuentemente anterógrado, y el grado de enfermedad de los sectores arteriales aortoilíaco e infrainguinal, que es presumiblemente mayor en los pacientes con enfermedad arterial periférica.
En este ECA se ha incluido a pacientes tratados mediante procedimientos endovasculares arteriales de territorios exclusivamente periféricos en los que se utilizó acceso arterial femoral de entre 4 y 8 Fr de diámetro. Todos los pacientes fueron tratados mediante algún tipo de intervencionismo, no habiéndose realizado ningún procedimiento exclusivamente diagnóstico. Se trata, por tanto, del único ECA publicado hasta la fecha que compara los 3 DCAP de más experiencia de uso, incluyendo únicamente a pacientes tratados mediante procedimientos intervencionistas y en territorios periféricos.
El porcentaje de éxito en la consecución inicial de la hemostasia ha sido, para todos los sistemas analizados globalmente, del 86,3%, concordante con la reportada en la bibliografía, que varía entre un 81 y un 100%9.
Ningún DCAP ha mostrado ser inferior, en cuanto a éxito hemostático inicial, al compararlo frente a CM o frente al resto de DCAP testados.
Sí se han encontrado diferencias estadísticamente significativas en cuanto al tiempo necesario para conseguir la hemostasia completa. La confirmación, en concordancia con la bibliografía existente, de que los DCAP son mucho más rápidos que la CM es un hallazgo predecible a priori, dado que el protocolo del estudio define la compresión manual estándar como una compresión mantenida durante 10 min, y este tiempo supera de forma significativa al tiempo requerido de forma habitual para liberar cualquiera de los 3dispositivos testados. Sin embargo, la compresión adicional predefinida en el diseño del estudio en caso de fallo del DCAP fue también de 10 min y, por tanto, en caso de presentar una tasa de fallo hemostático significativa, los tiempos de hemostasia tenderían a igualarse con los de la compresión manual. Se puede afirmar, por tanto, que los DCAP disminuyen de forma significativa el tiempo de hemostasia cuando se comparan con la compresión manual.
En el 85% de los pacientes la enfermedad que motivó la intervención fue la enfermedad arterial de MMII, con un 72,5% de punciones con sentido anterógrado, lo que constituye un total de 116 punciones anterógradas. El cuerpo de evidencia científica referente a los resultados de la punción femoral anterógrada se limita a estudios retrospectivos diseñados para evaluar el uso de algún DCAP concreto, sin existir por el momento ECA comparando frente a compresión manual13-16. Pese a que la punción anterógrada ofrece numerosas ventajas técnicas para el tratamiento de la enfermedad arterial oclusiva de MMII, la preocupación por un posible mayor riesgo de complicaciones con respecto al acceso retrógrado mantienen a este como el acceso más utilizado para el intervencionismo sobre este territorio17. En este estudio no se ha aleatorizado el sentido de la punción por no ser este análisis un objetivo principal del mismo, pero dado que constituye la serie más larga de punciones femorales anterógradas publicada en un estudio comparativo prospectivo, resulta interesante la información extraíble de este subanálisis. El sentido anterógrado de la punción se ha asociado con menor porcentaje de eficacia hemostática inicial en el análisis global, siendo Perclose Proglide® el único procedimiento hemostático que presenta hallazgos consistentes con este resultado al analizar cada dispositivo por separado. Un dato destacable al respecto es que todos los fallos en la hemostasia observados con los DCAP se produjeron con punciones en sentido anterógrado, lo que implica que los DCAP presentaron una eficacia hemostática del 100% para cerrar punciones retrógradas. El hecho de que la punción anterógrada presente una mayor proporción de fallos en la hemostasia inicial puede deberse a problemas relacionados con el mecanismo de liberación del dispositivo en vasos de menor calibre y con mayor enfermedad aterosclerótica o en el territorio de la bifurcación femoral, aunque estas hipótesis no pueden ser confirmadas con los datos disponibles. La distinción de Perclose Proglide®, en concordancia con estudios previamente publicados14, como único dispositivo cuya eficacia se ve afectada de forma significativa por el sentido de la punción, podría explicarse por diferencias en los mecanismos intraarteriales desplegados por cada dispositivo en su liberación, que en el caso de Perclose Proglide® son más complejos y de mayor tamaño. En caso de no desplegarse completamente por falta de espacio, el sistema puede fallar tanto en la punción de la pared arterial como en la conformación del nudo preformado, aumentando el riesgo de fallo en la hemostasia. Se podría deducir, por tanto, que en punciones anterógradas, al liberarse el dispositivo en vasos de menor calibre o con placas ateroscleróticas, el despliegue del ancla de Perclose Proglide® tiene mayor riesgo de efectuarse de forma incorrecta, lo que explicaría los resultados observados. Esta hipótesis tampoco ha podido ser testada con los datos extraídos del estudio y el hallazgo podría deberse simplemente a la falta de potencia estadística para alcanzar resultados significativos en las comparaciones del sentido de punción intra grupo para los otros DCAP.
Pese a no tratarse de un objetivo principal del estudio, se debe mencionar la ausencia de influencia de la localización de la punción arterial (AFS o AFC) en la eficacia y seguridad de la hemostasia, dado que la punción fuera de la AFC se ha considerado históricamente una fuente de complicaciones relacionadas con el acceso arterial y que la AFS se está empleando con frecuencia creciente como acceso en intervencionismo sobre miembro inferior ipsolateral16, dadas las importantes ventajas técnicas que ofrece en el tratamiento endovascular de enfermedad arterial en MMII. En nuestro estudio, el 38,75% de las punciones (un total de 62) se realizaron sobre la AFS, empleándose un DCAP en 44 de ellas (70,4%), con un porcentaje de eficacia hemostática del 79,5%, y sin encontrarse diferencias en este aspecto con la CM (77,8%; p=0,88). Tampoco se encontraron diferencias en cuanto a aparición de complicaciones mayores (DCAP: 9,1% vs. CM: 5,6% [p=0,64]). El subgrupo de punciones realizadas sobre AFS constituye la serie más larga publicada en un estudio prospectivo comparativo, habiéndose obtenido datos consistentes con la literatura16,18 que sugieren que los DCAP pueden ser utilizados en punciones sobre AFS con efectividad y seguridad comparables con la CM. La baja incidencia de fallo en la hemostasia y de complicaciones relacionadas con el acceso y el reducido número de casos incluidos en el análisis (62 punciones) restan potencia estadística a este subanálisis, obligando a una interpretación cautelosa de estos resultados.
Otra variable que a priori podría considerarse determinante en la efectividad de los métodos hemostáticos, como es el diámetro de introductor arterial empleado, no ha demostrado asociación con la proporción de éxito inicial. La pequeña proporción de introductores de diámetro diferente de 6 Fr empleada (80% para 6 Fr, 20% para 4, 5, 7 y 8 Fr) genera grupos comparativos muy pequeños, restando potencia estadística al análisis de los datos.
El método de guiar la punción no ha constituido una variable capaz de predecir la eficacia o la del método hemostático en este estudio. Aunque algunos estudios recientes indican una mayor tasa de éxito con DCAP empleando la punción guiada por ultrasonido19, no hay ECA que comparen esta modalidad con la guiada por escopia o referencias anatómicas. En cualquier caso, dado que en nuestro estudio el 81,25% de las punciones se realizó bajo visualización directa por ultrasonido, el resto de las modalidades (palpación de pulso o guiado radiólogíco) genera grupos muy reducidos que limitan la potencia estadística de este subanálisis. Que el alto porcentaje de punciones ecoguiadas haya contribuido a mantener bajas tasas de fallo en la hemostasia, y de complicaciones relacionadas con el acceso, no puede concluirse con los datos obtenidos, aunque es un dato concordante con la bibliografía20.
El 18,1% de los pacientes incluidos en el estudio fueron obesos (IMC> 30). Únicamente en el grupo de pacientes que recibieron CM la proporción de procedimientos hemostáticos efectivos fue significativamente menor (96,5% vs. 66,7%; p=0,03). El aumento de tejido adiposo suprayacente a la arteria puncionada dificulta la localización exacta del pulso y, por tanto, la aplicación de la presión manual adecuada en el lugar de punción, además de entorpecer la compresión de la arteria contra la cabeza femoral, lo que puede derivar en una compresión menos efectiva o, al menos, en la generación de momentos de compresión subóptima durante el período de hemostasia. Sin embargo, al analizar el subgrupo de pacientes obesos no se encontraron diferencias estadísticamente significativas en cuanto a consecución de hemostasia inicial al comparar el grupo de CM frente al conjunto de DCAP. Pese a que en los grupos de DCAP la influencia de la obesidad sobre la efectividad hemostática no alcanzó significación estadística, existe una clara tendencia hacia la obtención de peores resultados para los pacientes obesos con cualquiera de los procedimientos hemostáticos analizados. El mayor trayecto de tejido celular subcutáneo, que deben atravesar tanto los sistemas de liberación como los agentes hemostáticos de los DCAP para llegar hasta su lugar de acción en la pared arterial (tanto el tapón de colágeno de Angioseal®, como la grapa de StarClose® y el nudo de la sutura de Proglide® deben estar en contacto con la cara externa de la pared arterial para ser efectivos), puede dificultar su correcta colocación y, por tanto, influir en su capacidad hemostática. La ausencia de significación se explica probablemente por falta de potencia del estudio al tratarse de una subpoblación de pacientes obesos reducida (29 pacientes).
La proporción de pacientes que presentaron alguna complicación relacionada con el acceso arterial ha sido de un 20%. Este dato, que podría considerarse elevado en comparación con las tasas de complicaciones publicadas, disminuye a un 10,6% si se consideran únicamente las complicaciones definidas como mayores, ya que en ese caso se excluye el hematoma menor en la zona de punción, que ha resultado ser la complicación más frecuentemente observada, con un 11,3% de incidencia global, y que asciende a un 27,5% en el grupo de CM. Considerando de forma aislada la incidencia de complicaciones mayores, no se han encontrado diferencias estadísticamente significativas entre los grupos comparados globalmente ni al comparar la CM frente al uso de DCAP. Ningún sistema hemostático ha demostrado ser más seguro que el resto en las comparaciones por pares de grupos. Esta ausencia de diferencias significativas podría deberse a la baja incidencia general de complicaciones mayores, que podría restar potencia estadística a un estudio con un tamaño muestral reducido como el nuestro.
La alta incidencia de hematoma menor asociada a la compresión manual podría explicarse por diversas variables. El estado de los parámetros de coagulación no mostró diferencias entre los grupos ni el momento de la realización de la hemostasia ni en las primeras 24h postoperatorias, por lo que no podemos indicar que tenga influencia en la aparición de hematomas en este estudio. Pese a que la técnica de compresión manual debe considerarse dependiente del operador, no se ha encontrado asociación estadísticamente significativa entre la aparición de hematoma menor y el cirujano que realizó la hemostasia, y tampoco se han encontrado diferencias en la distribución de sistemas de hemostasia entre los cirujanos que realizaron la hemostasia. El vendaje compresivo fue colocado en todos los pacientes tratados mediante CM por el cirujano encargado de la hemostasia, según la técnica estándar realizada por el departamento y empleando los mismos materiales en todos los casos. Los pacientes mantuvieron el reposo absoluto al menos 24h, manteniéndose el vendaje compresivo durante ese tiempo. El tiempo de reposo absoluto no ha mostrado diferencias estadísticamente significativas entre los pacientes tratados mediante CM que presentaron hematoma menor y los que no (diferencia de medias 4,00h [IC del 95%: –1,68h-9,69h; p=0,16]). Ninguna de las variables evaluadas que podrían relacionarse con un aumento de la aparición de hematomas ha demostrado una asociación estadísticamente significativa, por lo que se puede considerar que esta complicación es inherente a la CM y que su riesgo de aparición podría disminuirse con la utilización de DCAP. El hallazgo de diferencias estadísticamente significativas en cuanto a la aparición de esta complicación concreta, en un estudio diseñado para detectar diferencias en la aparición general de complicaciones, aumenta la potencia de esta asociación.
En este estudio se ha realizado una valoración subjetiva de la sensación de dolor postoperatoria mediante gradación con EVA. El único dato significativo al respecto ha sido un aumento de la gradación de dolor en relación con la zona de punción por los pacientes tratados mediante CM frente a todos los DCAP agrupados y por separado. El aumento de hematoma postoperatorio podría explicar esta asociación, dado que, al eliminar del análisis a los pacientes que no presentaron esta complicación, no se observan diferencias significativas en la percepción de dolor entre el uso de algún DCAP y la compresión manual.
El tiempo de reposo postoperatorio ha sido significativamente mayor en el grupo de CM, diferencia previsible a priori teniendo en cuenta el protocolo perioperatorio descrito en la figura 1. Sin embargo, se debe tener en cuenta que, en caso de fallo del DCPA, se estipuló un período de reposo absoluto de 24h, por lo que de haber resultado inefectivo el uso de DCAP no se hubiesen detectado diferencias significativas con la CM. Se puede deducir que los DCAP, debido a su elevada tasa de éxito, permiten disminuir el tiempo de reposo absoluto postoperatorio con respecto a la hemostasia por CM. Esta diferencia de tiempo de reposo absoluto no se ha traducido, sin embargo, en una disminución del tiempo de ingreso total ni del tiempo de ingreso postintervención. Dado que la presencia de complicaciones relacionadas con el acceso arterial tampoco ha presentado asociación estadísticamente significativa con el tiempo de ingreso postoperatorio, la prolongación del ingreso se ha debido a variables no relacionadas con el acceso arterial. Ninguno de los procedimientos se realizó en régimen ambulatorio. El 85% de los pacientes fue intervenido por enfermedad arterial de MMII, siendo complicaciones relacionadas con isquemia arterial crónica el motivo del ingreso en más del 90% de los casos, por lo que la prolongación del ingreso postoperatorio se debió en la mayoría de los pacientes a la presencia de complicaciones relacionadas con la enfermedad que motivó la intervención y no a la propia intervención.
Pese a que el diseño del estudio no incluyó análisis de coste/efectividad, consideramos pertinente hacer un comentario al respecto. El uso de los DCAP analizados en el estudio supone un incremento inicial del coste de procedimiento de entre 150 y 200 euros en nuestro medio. Si bien los resultados del estudio no permiten inferir un ahorro de costes secundario a la disminución de complicaciones con respecto a la compresión manual, la disminución drástica del tiempo de reposo absoluto postoperatorio necesario tras el uso de DCAP podría disminuir el tiempo de ingreso e incluso permitir en muchos casos el régimen ambulatorio, con la consiguiente disminución del coste del procedimiento. Existen publicaciones que con resultados concordantes con esta teoría, la mayoría en el ámbito del intervencionismo coronario21.
En resumen, la inclusión en este estudio exclusivamente de pacientes tratados mediante procedimientos en territorio periféricos, implicando un mayor porcentaje de punciones «de riesgo» (sentido anterógrado, mayor grado de aterosclerosis, punciones fuera de la AFC), aporta nuevos e interesantes datos al escaso cuerpo de evidencia disponible acerca de la hemostasia tras este tipo de intervenciones. Los resultados sugieren que los 3tipos de DCAP pueden utilizarse con seguridad en procedimientos endovasculares realizados sobre territorios periféricos, y que además podrían disminuir el número de complicaciones menores con respecto a la CM, disminuyendo además el tiempo requerido para la consecución de la hemostasia y el tiempo de reposo absoluto postintervención, lo que podría redundar en un mayor comodidad, bienestar percibido por el paciente y una gestión más eficiente de los recursos sanitarios al aumentar el número de procedimientos ambulatorios. Aunque se trata de un subanálisis que no forma parte de los objetivos principales de este trabajo, lo que impide emitir conclusiones firmes al respecto, los resultados obtenidos en punciones anterógradas o en AFS podrían ayudar a disipar las controversias en cuanto al empleo de este tipo de accesos y a la idoneidad del uso de DCAP en esos casos.
ConclusionesLa hemostasia con DCAP en procedimientos arteriales periféricos es más rápida que con compresión manual, sin disminuir la efectividad hemostática ni la seguridad. La hemostasia del acceso arterial femoral mediante CM aumenta el riesgo de presentar hematoma menor en comparación con la utilización de dispositivos de cierre arterial percutáneo. El uso de DCAP disminuye de forma significativa la sensación subjetiva de dolor por parte del paciente comparado con la compresión manual. La utilización de DCAP disminuye de forma significativa el tiempo de reposo absoluto postintervención en comparación con el protocolo de hemostasia por CM empleado en este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Información referente a este artículo ha sido presentada en los siguientes congresos: XXI Congreso Sociedad Española de Investigaciones Quirúrgicas, Madrid, 15-16 de octubre del 2015; 60.° congreso SEACV, 4-6 de junio del 2015, Madrid; Site Symposium 2017, 29-31 de marzo del 2017, Barcelona, España; Veith Symposium 2017, 13-17 de noviembre del 2017, Nueva York, Estados Unidos.
Este artículo ha sido presentado como memoria para optar al título de Doctor por el Departamento de Cirugía de la Facultad de Medicina de la Universidad Complutense de Madrid, obteniendo la calificación de sobresaliente cum laudem.
El artículo ha sido premiado con el premio Abbott a la mejor tesis doctoral del año 2016 otorgado por la Sociedad Española de Angiología y Cirugía Vascular.
Ensayo clínico registrado con número y nombre: ISRCTN55240225. Randomized trial comparing effectiveness and safety of 3percutaneous arterial closure devices vs. manual compression in peripheral interventions. https://doi.org/10.1186/ISRCTN55240225.