La endarterectomía carotídea (EAC) ha demostrado reducir el riesgo de ictus y muerte en pacientes sintomáticos con enfermedad carotídea extracraneal. Sin embargo, existe controversia con relación al momento de realizar la cirugía en pacientes con ictus previo. Históricamente, la literatura había sugerido que el momento óptimo era aproximadamente a las 6 semanas del ictus. A esta conclusión se llegó por la alta morbimortalidad si la EAC se realizaba demasiado pronto. Sin embargo, este abordaje ha sido puesto en duda, actualmente, por la indiscutible evidencia de que a) el riesgo precoz de ictus tras AIT/ictus minor es mayor de lo previamente enseñado y b) el beneficio a largo plazo de la cirugía cae rápidamente tras el evento. Este artículo discute la literatura de finales del siglo xx centrándose en la literatura más reciente del siglo xxi con relación al timing de la EAC tras un ictus.
Carotid endarterectomy (CEA) has been shown to reduce the risk of stroke and death in symptomatic patients with carotid occlusive disease. However there is controversy on the timing of surgery in patients who suffer a stroke. Historically, in the literature it has suggested that the optimal timing to perform CEA was approximately 6 weeks after an acute stroke. This conclusion was reached due to the high perioperative morbidity and mortality if CEA was performed too early. Notwithstanding, this approach has now been called into question because of indisputable evidence that a) the early risk of stroke after a patient suffers a transient ischemic attack (TIA)/minor stroke is significantly higher than previously taught, and b) the long term benefit of surgey diminishes rapidly following onset of the index event. This article discusses 20th Century literature and focuses on more recent 21st Century literature as regards the timing of CEA after acute stroke.
Aunque han transcurrido más de 20 años desde su publicación original, los emblemáticos estudios North American Symptomatic Carotid Endarterectomy Trial1 (NASCET) y European Carotid Surgery Trial2 (ECST) continúan siendo la piedra angular sobre la que se fundamenta el tratamiento de la estenosis carotídea sintomática.
En 2004, Rothwell et al.3 publicaron un análisis post-hoc con los datos de ambos estudios (Carotid Endarterectomy Trialists Collaboration [CETC]), demostrando la importancia del momento (timing) de la endarterectomía carotídea (EAC), con respecto al evento isquémico neurológico, y su impacto sobre la prevención de ictus. El mayor beneficio de la cirugía, en términos de prevención secundaria de ictus, se obtiene en los pacientes intervenidos dentro de las 2 primeras semanas tras el accidente cerebrovascular (ACV), declinando este beneficio bruscamente con el tiempo.
A partir de esta evidencia del CETC se ha producido un cambio en las directrices y guías clínicas actuales4–7 para pacientes con enfermedad carotídea extracraneal sintomática, recomendándose la cirugía dentro del período de 2 semanas tras el ictus. Sin embargo, frente a la recomendación, la EAC precoz está lejos de ser práctica habitual y muchos cirujanos vasculares prefieren diferir el procedimiento con objeto de minimizar el riesgo quirúrgico, lo que ha convertido la cuestión del timing de la EAC en un punto de controversia.
El objetivo de esta revisión es presentar los resultados de los estudios actuales que abordan el tema para establecer si el beneficio de la EAC precoz en la prevención de ictus compensa el riesgo de ictus/muerte inherente al procedimiento quirúrgico.
DesarrolloLos estudios NASCET y ECST constituyen el punto de arranque en el manejo de la enfermedad carotídea extracraneal sintomática; a pesar de los avances en el tratamiento médico y en la técnica quirúrgica sus conclusiones no se han modificado con el paso de 2 décadas. Una estenosis carotídea sintomática ≥ 70% constituye una indicación absoluta de cirugía en tanto que una estenosis carotídea ≥ 50% es una indicación relativa.
¿Por qué diferir la endarterectomía carotídea?A finales del siglo xx, debido a la excesiva morbimortalidad de la EAC en la fase aguda del ictus, la literatura8 recomendaba retrasar la cirugía un período arbitrario de 4-6 semanas, y en esta idea son instruidos, durante años, varias generaciones de cirujanos vasculares. Esta estrategia estaba fundamentada en el «miedo» a la conversión de un infarto cerebral isquémico en hemorrágico así como en el riesgo de extensión del mismo, de modo que una cirugía diferida permitiría su estabilización y «maduración».
Otro argumento era el riesgo de edema periinfarto y síndrome de hiperperfusión cerebral tras una EAC inmediata. Esta entidad constituye una complicación grave, aunque poco frecuente (0,0-2,1%) de la revascularización carotídea. Se desarrolla como consecuencia del aumento de la presión de perfusión postoperatoria sobre un lecho vascular cerebral con alteración de sus mecanismos de autorregulación y vasodilatación persistente. Puesto que la HTA postoperatoria es un factor necesario y clave para la aparición del síndrome de hiperperfusión cerebral, un control estricto de la misma es fundamental para evitar que se produzca. La aparición de hemorragia cerebral secundaria a una hiperperfusión descontrolada es excepcional (0,37%)9.
El estudio Joint Study of Extracranial Arterial Occlusion8 del año 1969 representa uno de los principales argumentos en los que se apoya la EAC diferida, recomendando un período de espera de 4-6 semanas tras el ictus, debido a la alta tasa de hemorragia cerebral asociada a la EAC precoz.
Giordano et al.10, en un estudio retrospectivo de 1985, presentaron una cifras de incidencia de stroke desmesuradas (18,5%) cuando la EAC se efectuaba dentro de las primeras 5 semanas, por lo que constituyó, en su época, otro argumento disuasorio de la EAC precoz.
Sin embargo, una revaluación de los estudios de los 60 y 70 reveló varios puntos débiles. Muchos procedimientos consistieron en revascularizaciones de arterias carótidas ocluidas o se realizaron en pacientes con infartos extensos y déficits neurológicos profundos o en coma. Por otra parte, son publicaciones obsoletas, dado que son anteriores a la era de la TAC/RMN, con inclusión de casos en los que se desconoce el tamaño o las características del infarto y, del mismo modo, previas a la creación de unidades de cuidados intensivos para el control estricto de la tensión arterial y monitorización del paciente en el postoperatorio.
Algunos análisis más recientes abordando el tema del timing de la EAC han aportado resultados consistentes con los de los estudios antiguos apoyando, al menos en parte, la necesidad de diferir la cirugía carotídea11-13.
En 2006, la publicación de una revisión retrospectiva de 2.537 carótidas intervenidas, entre los años 1992 y 2003, realizada por Rockman et al.11, mostró una tasa de ictus/muerte perioperatoria 3 veces mayor (5,1%) en las intervenciones llevadas a cabo en las 4 primeras semanas, en comparación con un 1,6% si la cirugía se posponía 4 semanas. El único factor predictivo hallado del riesgo de complicaciones neurológicas en la cirugía precoz fue el ictus franco, en oposición al AIT. Por otro lado, información referida a la severidad del déficit neurológico preexistente o al tamaño del infarto no se incluyó, en parte debido a que muchos de los casos son previos a la aparición y generalización de la TAC/RMN. En 2009 este grupo, a partir de un registro con pacientes del Medicare en Nueva York12, presentó una tasa combinada de ictus no fatal-muerte significativamente superior en la cohorte intervenida precozmente en las 2 primeras semanas, respecto a la cohorte diferida (7,1 vs. 5,1%; p = 0,04), no obstante, considerando como variable resultado cualquier ictus (fatal y no fatal) no se alcanzó la significación estadística. Además, para pacientes con antecedente de ictus major, no se encontró relación entre el timing y la aparición de complicaciones mayores.
Eckstein et al.13 publicaron un estudio multicéntrico prospectivo en el que se llevó a cabo EAC en 164 pacientes. Aquellos sin enfermedades concomitantes (ASA I, II) tuvieron un riesgo quirúrgico de 3,4% si la cirugía se llevaba a cabo dentro de las 3 primeras semanas. Solo los pacientes con múltiples factores de comorbilidad (ASA III, IV) mostraron un riesgo quirúrgico significativamente mayor con una cirugía precoz (< 3 semanas), por lo que concluyen que la EAC en pacientes de bajo riesgo es segura cuando se realiza antes de 3 semanas.
¿Por qué la endarterectomía carotídea precoz?: puntos de apoyo de la tendencia actualLos objetivos de la EAC en una fase temprana son: prevenir la recurrencia de ictus, evitar la progresión a oclusión carotídea y mejorar la perfusión cerebral, especialmente en el área de penumbra isquémica. Sin embargo, el papel de la EAC en la prevención de ictus solo está justificado si estos objetivos se alcanzan con una aceptable morbimortalidad, es decir, si la EAC es segura.
En la actualidad, 2 hechos han llevado a cuestionar la idea, históricamente asentada, de diferir la cirugía de revascularización carotídea. Por un lado, el alto riesgo de recurrencia de ictus en el período de espera y, en segundo lugar, los resultados de CETC, publicados por Rothwell et al3, demostrando que el beneficio de la cirugía disminuye rápidamente tras el evento cerebrovascular.
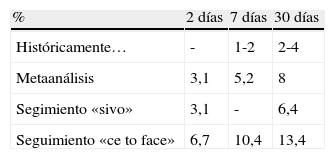
El riesgo de ictus recurrente es alto, con cifras muy superiores a las estimadas en el pasado (de 1-2% en la primera semana y 2-4% en el primer mes), con un riesgo a los 30 días 4-6 veces más alto de lo que se pensaba previamente. Dos metaanálisis del 200714,15 revisaron el riesgo precoz de ictus tras un AIT y señalaron que, a los 2 días el riesgo era 3,1%, incrementándose al 5,2% a los 7 días y al 8% a los 30 días (tabla 1). Los estudios que utilizaron «pasivamente» bases de datos infravaloraron la verdadera incidencia de ictus de repetición al excluir pacientes que tras un primer evento no ingresaban, eran atendidos en otro centro, no solicitaban atención médica, presentaban un ictus el mismo día que un AIT previo inadvertido…
Recurrencia de ictus
| % | 2 días | 7 días | 30 días |
| Históricamente… | - | 1-2 | 2-4 |
| Metaanálisis | 3,1 | 5,2 | 8 |
| Segimiento «sivo» | 3,1 | - | 6,4 |
| Seguimiento «ce to face» | 6,7 | 10,4 | 13,4 |
Fuente: Naylor20.
Considerando estas cifras actuales, retrasar la revascularización coloca al paciente con un riesgo de ictus recurrente del 10-20% en el primer mes, siendo, con frecuencia, más incapacitante que el anterior, lo que excede al del propio procedimiento16.
El CETC, publicado por Rothwell17, combina los datos del NASCET, ECST y Veterans’ Affairs (VA), midiendo de nuevo las estenosis carotídeas, previamente a la aleatorización, según el método de medida NASCET. La base de datos resultante incluye a más de 6.000 pacientes. Según sus resultados, la EAC no está justificada en pacientes sintomáticos con estenosis carotídea 0-50%, y confiere un beneficio modesto (pero significativo) en pacientes recientemente sintomáticos (< 6 meses) con estenosis 50-69%. La EAC aporta el mayor beneficio en estenosis carotídeas sintomáticas 70-99% (exceptuando las lesiones preoclusivas con signo de la cuerda o strign sign en las que no produce ningún beneficio).
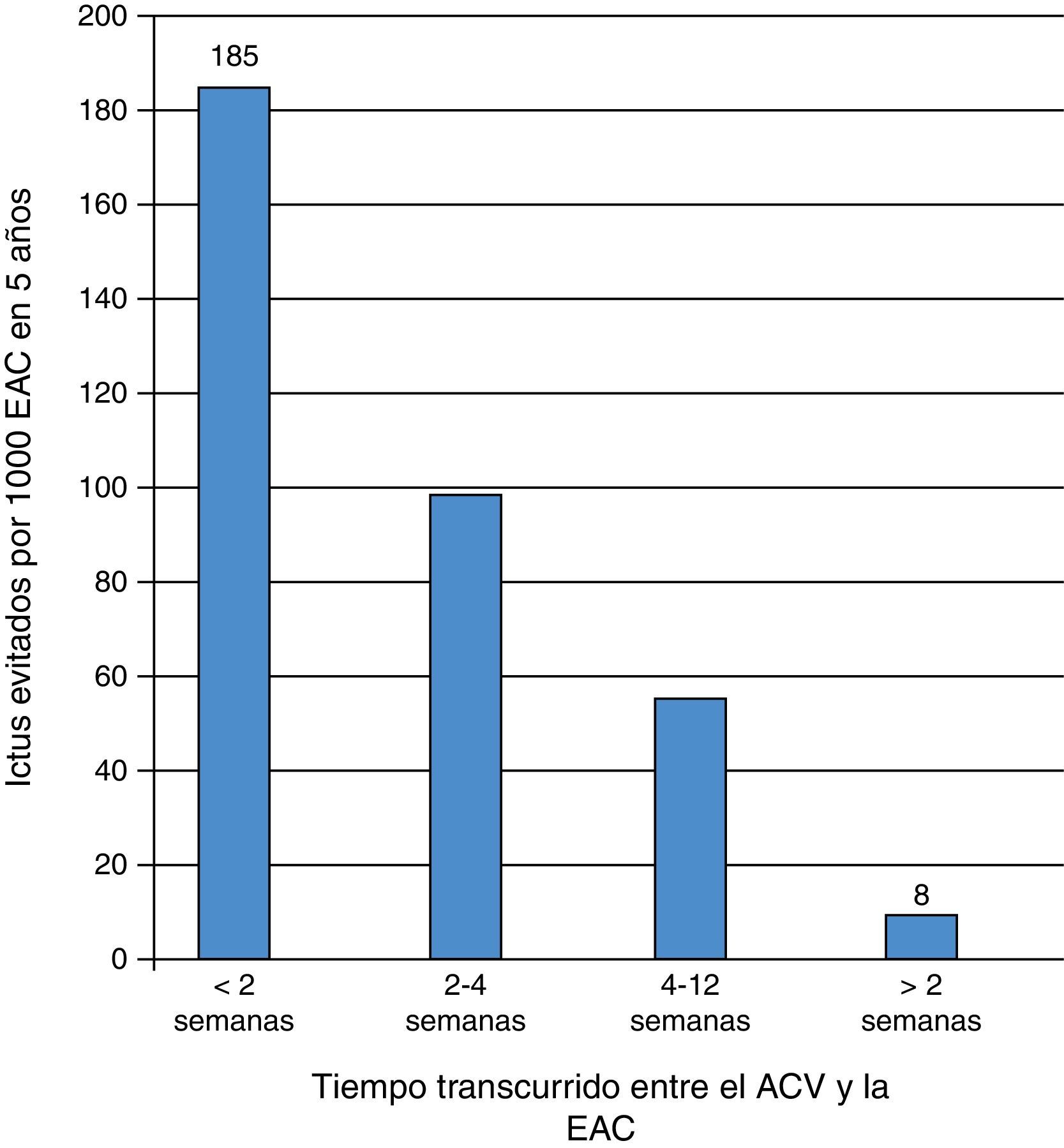
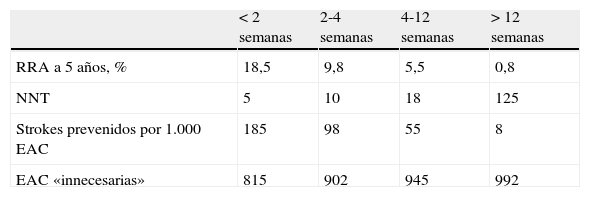
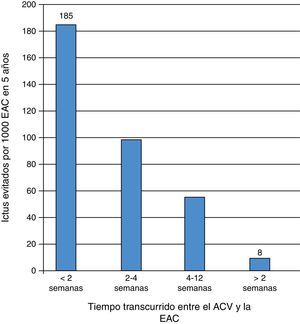
Una segunda publicación CETC3 combinó todos los pacientes sintomáticos con estenosis carotídea 50-99% NASCET (70-99% ECST), estratificándolos por grupos según el retraso de la cirugía desde el evento cerebrovascular (timing) (fig. 1 y tabla 2).
Número de ictus evitados por 1.000 TEA carotídeas a los 5 años (Naylor19).
Efecto del retraso de la cirugía sobre la prevención de ictus ipsilateral en estenosis carotídea NASCET 50-99%
| < 2 semanas | 2-4 semanas | 4-12 semanas | > 12 semanas | |
| RRA a 5 años, % | 18,5 | 9,8 | 5,5 | 0,8 |
| NNT | 5 | 10 | 18 | 125 |
| Strokes prevenidos por 1.000 EAC | 185 | 98 | 55 | 8 |
| EAC «innecesarias» | 815 | 902 | 945 | 992 |
EAC: endarterectomía carotídea; NNT: número de pacientes que es necesario tratar; RRA: reducción del riesgo absoluto.
Fuente: Rothwell et al.3.
Este análisis por subgrupos reveló que el mayor beneficio de la TEA carotídea se obtiene, en términos de prevención secundaria de ictus, en los aleatorizados dentro de las 2 primeras semanas (RRA a los 5 años de 18,5%, previniéndose 185 ictus por 1.000 TEA; NNT: 5). Por el contrario, si la cirugía se realiza después de 12 semanas el beneficio es insignificante (RRA 0,8%, se previenen 8 ictus por 1.000 TEA; NNT: 125), y la estenosis puede ser considerada como asintomática. Esto es, la inmensa mayoría de estos pacientes operados tardíamente no obtiene ningún beneficio pero se enfrenta a los mismos riesgos de la cirugía. Por tanto, a mayor retraso, menor beneficio en términos de prevención de ictus a largo plazo, que en definitiva, es la finalidad de la EAC18. No obstante, es importante señalar que los pacientes con síntomas en las 48 h previas a la cirugía o con AIT in crescendo fueron excluidos de este análisis.
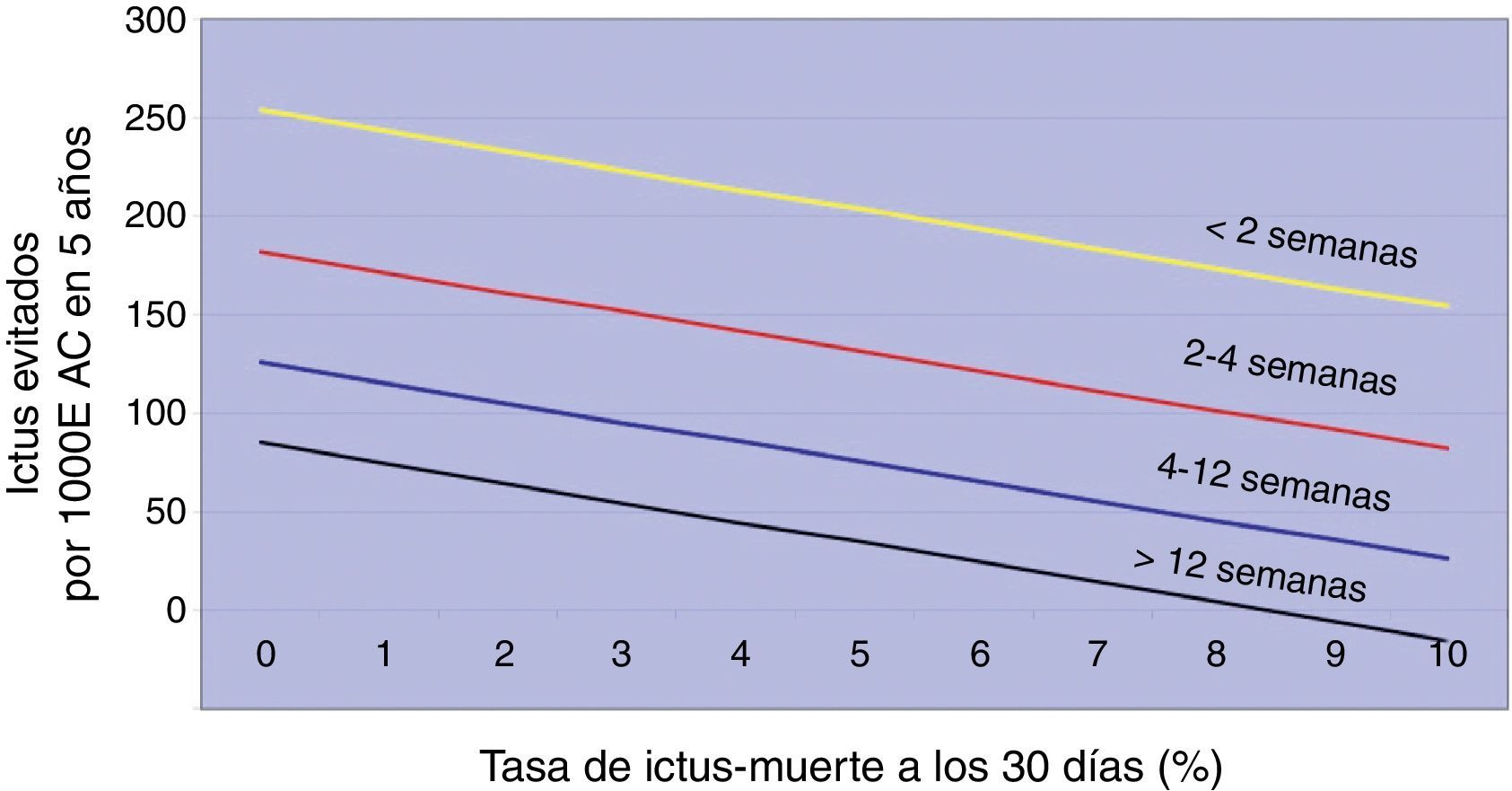
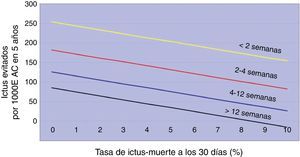
Naylor et al.19–21 desarrollaron una interpretación alternativa adicional, en defensa de la EAC precoz, a partir de la tasa de ictus/muerte perioperatoria a los 30 días que aporta CETC. Valorando, para cada grupo estratificado según el timing, la relación riesgo quirúrgico-prevención de ictus, podría ser razonable asumir un nivel de riesgo quirúrgico mayor (cuando se interviene pronto) si eso implica prevenir más ictus (fig. 2). Si un cirujano interviene en la fase aguda del ictus con un riesgo quirúrgico del 10%, aun siendo más alto, está evitando más ACV que si difiere el procedimiento 12 semanas con un riesgo quirúrgico 0%. Sin embargo, este argumento entra en confrontación con la máxima morbimortalidad establecida para justificar la EAC (< 6% en pacientes sintomáticos) y con el cirujano, quien tendría que asumir el alto precio de peores resultados individuales en aras de un potencial beneficio sobre la prevención de ictus a largo plazo.
Tomado de Naylor19. Ictus prevenidos por 1.000 EAC según el retraso entre el evento neurológico y la aleatorización y el riesgo quirúrgico.
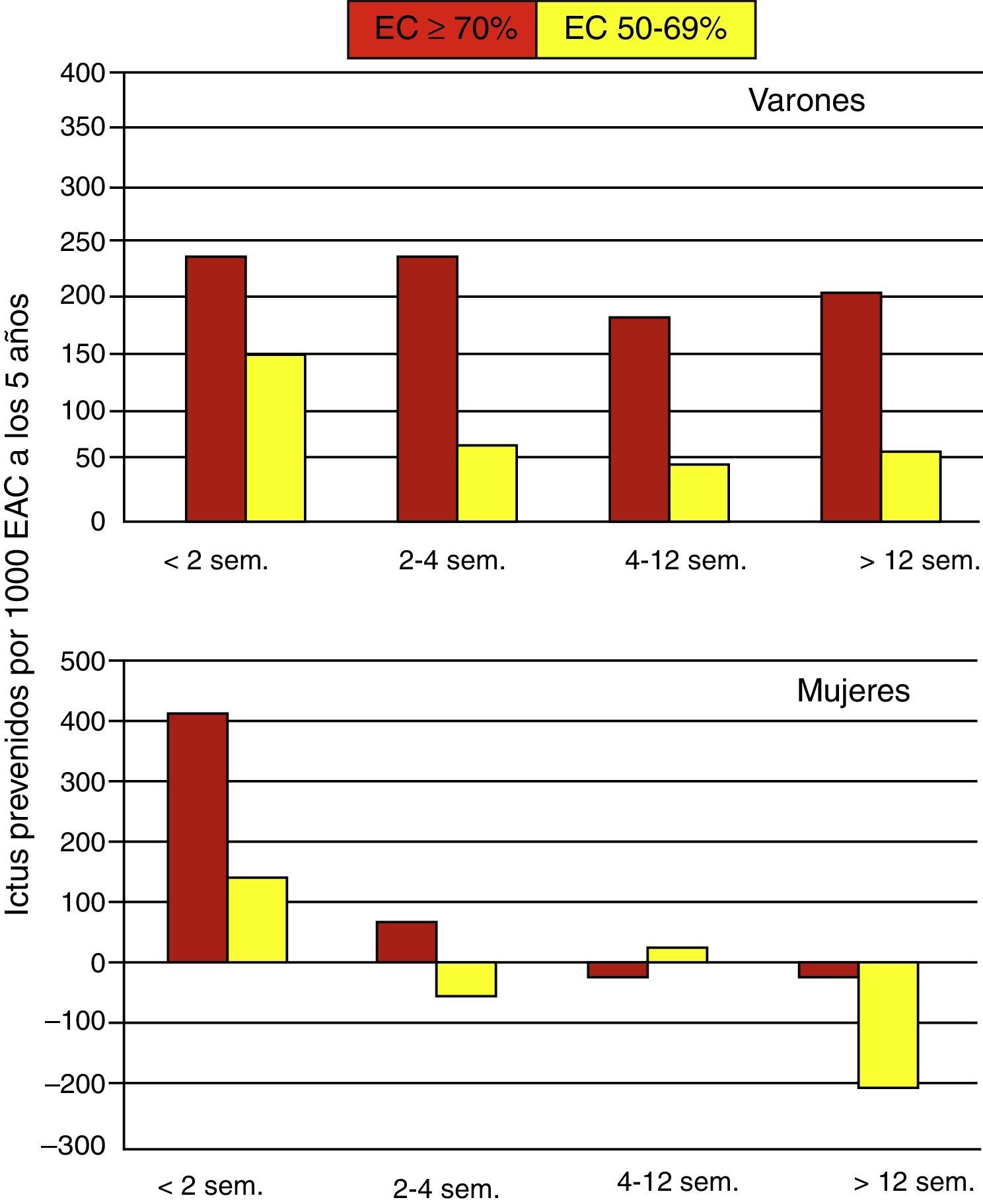
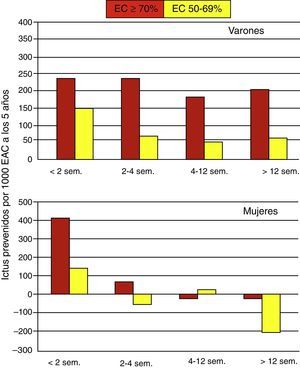
El CETC realizó un tercer análisis para determinar el efecto del sexo y del timing en la prevención de ictus22 (fig. 3).
Efecto del timing por sexos sobre la prevención de ictus a largo plazo (tomado de Naylor19).
En varones, el beneficio de la cirugía es considerable y, además, se mantiene en el tiempo, con el máximo número de ictus evitados para la estenosis carotídeas 70-99%. Por el contrario, en el caso de las mujeres, existe un beneficio importante en estenosis carotídeas ≥ 70% (NASCET) intervenidas dentro de las 2 primeras semanas (se previenen más de 400 ictus a los 5 años por 1.000 EAC), y un beneficio modesto en estenosis carotídeas ≥ 70% intervenidas dentro de las 4 primeras semanas (se previenen 66 ictus a los 5 años por 1.000 EAC), sin embargo, transcurrido este período no existe beneficio. Para las estenosis carotídeas no severas 50-69% (NASCET) solo existe beneficio en las mujeres si son intervenidas antes de 2 semanas (se previenen 138 ictus); posteriormente, la EAC no aporta ningún beneficio.
El beneficio que confiere la cirugía se reduce con el tiempo porque es en las primeras semanas tras un evento cerebrovascular cuando la placa es vulnerable, con disrupción de la misma, trombo suprayacente y riesgo de embolización, en relación con un aumento de las LDL oxidadas y activación de las metaloproteasas de la matriz (MMP-9). Superada esta fase, la placa se estabiliza, desapareciendo el trombo y reduciéndose el riesgo de ictus embólico23–25.
Múltiples estudios26-47, prospectivos y retrospectivos, se han llevado a cabo en un intento de dilucidar si el potencial beneficio de la EAC precoz en la prevención de ictus recurrente compensa el riesgo de ictus/muerte de la intervención. La inmensa mayoría de ellos no ha encontrado diferencias estadísticamente significativas entre los resultados de la EAC precoz y diferida, por lo que la mayor parte de la literatura contemporánea apoya la cirugía carotídea precoz.
Ballota et al.26 realizaron un estudio prospectivo aleatorizado sobre el papel de la EAC precoz (< 30 días) versus la EAC diferida (> 30 días), con 86 pacientes. No se produjo ningún fallecimiento, siendo la tasa de ictus perioperatorio en ambos grupos del 2%. Concluye que la EAC realizada dentro de las primeras 4 semanas tras un ictus minor es segura, con resultados comparables a los de la EAC tardía.
Una publicación más reciente de Ballota16 de diseño prospectivo y aleatorizado con 102 pacientes, mostró excelentes resultados para la cirugía precoz (dentro de las primeras 2 semanas), con una tasa de ictus y muerte del 0%.
Wolfle et al.27 no encontraron diferencias en los resultados en función del timing en 66 pacientes revascularizados dentro de los primeros 28 días tras el ictus isquémico. Sin embargo, encontraron que la severidad del ictus inicial es factor predictivo de complicaciones.
Gasecki et al.28 efectuaron un análisis por subgrupos del NASCET, examinando 100 pacientes con estenosis carotídea severa sintomática: 42 operados de EAC precoz versus 58 de EAC diferida. El intervalo de tiempo para definir ambos grupos fue 30 días. La tasa de ictus perioperatorio fue de 4,8 y 5,2% para los grupos EAC precoz y diferida respectivamente. Basados en el riesgo de recurrencia de ictus, la cirugía en fase temprana está justificada porque no implica peores resultados.
Una tasa de ictus/muerte perioperatoria más que aceptable (2,8%) se obtuvo en un estudio prospectivo realizado por Ricco et al.29 en 72 pacientes con ictus minor, estenosis carotídea ≥ 70% NASCET, y un intervalo de tiempo de 15 días para la EAC precoz, por lo que este grupo defiende la cirugía expeditiva tras un ictus minor en pacientes seleccionados.
Una revisión efectuada por Pritz et al.30, subrayando la importancia de la selección de los pacientes, concluye que si el déficit neurológico es estable, con nivel de consciencia normal y sin desviación de línea media en TAC, la EAC tiene un riesgo asumible en la fase subaguda del ictus.
Paty et al.31 realizaron un análisis retrospectivo con 228 pacientes, intervenidos en el período 1980-2001, estratificándolos según que la EAC fuera realizada en la primera, segunda, tercera o cuarta semana del ACV. Los resultados fueron equivalentes en los diferentes grupos, por lo que consideraron que la EAC precoz es segura. Además, señalaron el tamaño del infarto en TAC como factor asociado a las complicaciones.
La EAC urgente (< 48 h) se comparó con la EAC precoz (2-14 días) en un estudio prospectivo alemán llevado a cabo por Aleksic et al.32 en el que se reclutaron 130 pacientes. Sus excelentes resultados reforzaron la factibilidad de la cirugía carotídea tan pronto como sea posible para reducir el riesgo de recurrencia de ACV, si bien es cierto que el tamaño muestral es escaso.
Rerkasem y Rothwell33 son los autores de un metaanálisis constituido por 47 estudios de los años 1980-2008. En su revisión sistemática investigaron potenciales factores de riesgo de complicaciones neurológicas de la cirugía en pacientes recientemente sintomáticos. No hallaron diferencias en la tasa de ictus/muerte en las revascularizaciones carotídeas realizadas en las 2 primeras semanas, y el riesgo quirúrgico en la primera semana en pacientes neurológicamente estables no fue sustancialmente mayor.
La cuantificación del riesgo de ictus recurrente podría ayudar a la selección de los pacientes que más se beneficiarían de una cirugía en fase temprana. Ehsan et al.34 crearon una escala de puntos (ABCD scoring) para identificar tales pacientes y optimizar la EAC precoz (tabla 3).
Escala de puntos para cuantificar el riesgo de ictus de repetición
| Escala de puntos ABCD | ||
| A. Edad (age) | > 60 años | 1 punto |
| B. Presión arterial (blood presure) | PAS ≥ 140 o PAD ≥ 90 | 1 punto |
| C. Clínica | Déficit motorAlteraciones del lenguaje (sin déficit motor) | 2 puntos1 punto |
| D. Duración AIT | > 60min1-59 min | 2 puntos1 punto |
| Diabetes | 1 punto | |
Puntuación: 1-3: riesgo bajo; 4-5: riesgo moderado; 6-7: alto riesgo.
Fuente: Ehsan et al.34.
Rantner et al.35 publicaron una tasa de complicaciones perioperatorias de 3,4% en los pacientes intervenidos dentro de las primeras 4 semanas tras el ictus isquémico, siendo esta proporción comparable al 4,8% en el grupo intervenido tras 4 semanas. El 12% de los pacientes experimentaron un ictus recurrente en el período de espera, la mayoría en la tercera o cuarta semana tras el ACV inicial.
Además, en otra de sus publicaciones36, definieron parámetros predictivos de riesgo quirúrgico, a partir de una cohorte de 226 pacientes intervenidos dentro de los primeros 28 días tras el evento neurológico. La tasa de ictus/muerte presentada fue del 8,4% (cohorte no NASCET). Concluyeron que pacientes con ASA ≤ 2 o Rankin ≤ 2 (discapacidad leve: para realizar algunas de sus actividades habituales previas pero atiende sus asuntos sin ayuda), pueden ser intervenidos pronto de forma segura.
Brinjikji et al.37, en 2010, afirmaron que aun existiendo un riesgo de complicaciones perioperatorias ligeramente superior con la EAC precoz (< 14 días), esta pequeña diferencia, no estadísticamente significativa, no niega los beneficios del procedimiento, especialmente a la luz del riesgo mucho mayor de ictus recurrente si la cirugía se retrasa.
Salem et al.38, en un estudio de 2011, tampoco han hallado diferencias en las complicaciones perioperatorias en aquellos que son intervenidos mediante EAC dentro de los primeros 14 días tras el ACV. Capoccia et al.39,40 demuestran que el 93,5% de los pacientes intervenidos antes de 2 semanas experimenta una mejoría de su estado neurológico (según la escala National Institutes of Health Stroke [NIHS]).
Para Annambothla41 et al., la ausencia de diferencias significativas en la tasa de eventos adversos, en el perioperatorio y a largo plazo, entre los intervenidos antes y después de 30 días, implica la recomendación de la EAC precoz para todas las estenosis carotídeas sintomáticas sin evidencia de hemorragia cerebral, oclusión carotídea o déficit neurológico persistente.
Un estudio sueco de 2012, prospectivo, liderado por Strömberg42, que incluye 2.596 pacientes, ha demostrado que el principal determinante del riesgo de ictus/muerte es el tiempo transcurrido hasta la EAC. La tasa combinada de ictus/muerte fue del 11,5% para la EAC realizada en los 2 primeros días, comparada con un 3,6 y un 4% en los pacientes intervenidos entre los días 3-7 y entre los días 8-14, respectivamente, tras el evento cerebrovascular. La EAC muy precoz, en el día del ictus o al día siguiente, tiene un efecto deletéreo; sin embargo, la cirugía entre los días 3 y 14 es segura y debe ser el intervalo diana. La solidez de este estudio y su superioridad respecto a todas las publicaciones previas reside en su tamaño muestral (> 2.000 pacientes que engloban > 93% de las EAC realizadas en Suecia en un período de 3 años), y en su diseño prospectivo.
ConclusionesTeniendo en cuenta el estudio CETC3, catalizador del debate y determinante del cambio en las directrices actuales acerca del timing de la EAC, y por otro lado, la inmensa mayoría de estudios actuales, se puede concluir que la EAC precoz, dentro de las primeras 2 semanas tras el evento, es segura. Sin embargo, es esencial una correcta selección de los pacientes, ya que el riesgo quirúrgico debe sopesarse para cada caso con la historia natural del ACV sin cirugía43. Por su parte, el excesivo riesgo de la cirugía llevada a cabo en las primeras 48 h desaconseja su realización.
La severidad y estabilidad del déficit neurológico, el tamaño del infarto en la TAC (< 3cm)44 y el nivel de consciencia son factores críticos condicionantes del riesgo quirúrgico que han de valorarse. Esto determina que la TAC y la RMN adquieran un papel crucial en la indicación de la endarterectomía en la fase aguda-subaguda del ictus45, y que, presumiblemente, los avances y la mejora en las pruebas de imagen cerebral permitirán una mejor selección de los pacientes46. Además, la mejor caracterización de la placa carotídea con ecodoppler o RMN, identificándose las más vulnerables, constituye otro factor en la detección de los individuos de mayor riesgo47–49, que más se beneficiarán de la EAC precoz.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.