Puntos clave
- •
El síndrome de Guillain-Barré (SGB) se caracteriza por debilidad muscular simétrica rápidamente progresiva y generalmente ascendente, acompañada de hipo o arreflexia
- •
El diagnóstico se basa en las manifestaciones clínicas y se confirma con la disociación albúmino-citológica en el líquido cefalorraquídeo y las alteraciones neurofisiológicas encontradas en los estudios de velocidad de conducción nerviosa
- •
Todo paciente con sospecha de SGB debe ser ingresado con el objetivo de estudiar la progresión de la enfermedad y vigilar la posible afectación de la musculatura respiratoria.
- •
El tratamiento específico se basa en la administración de gammaglobulina por vía intravenosa, con una dosis total de 2g/kg
- •
La severidad del cuadro clínico es importante como factor pronóstico del SGB. Las formas desmielinizantes (polirradiculoneuropatía desmielinizante inflamatoria aguda), como en la variante Miller-Fisher, son, en general, de buen pronóstico.
El síndrome de Guillain-Barré (SGB) es un trastorno adquirido de los nervios periféricos descrito como una polineuropatía aguda inflamatoria de inicio súbito y de etiología generalmente autoinmunitaria. Se caracteriza por una debilidad muscular simétrica o parálisis motora flácida rápidamente progresiva y generalmente ascendente, acompañada de disminución o ausencia de reflejos osteotendinosos1,2. Actualmente, el SGB es considerado la causa más común de parálisis flácida aguda y subaguda en niños en la era pospolio. En pediatría, es frecuente la afectación de los nervios sensitivos y autónomos, produciendo dolor y parestesias.
El proceso inflamatorio afecta normalmente a las vainas de mielina, desencadenando una polirradiculoneuropatía desmielinizante, pero también puede llegar a afectar al axón, pudiendo producir una degeneración nerviosa y desencadenando una neuropatía axonal3. El diagnóstico se realiza a través del análisis del líquido cefalorraquídeo (LCR), observando una disociación albúmino citológica (hiperproteinorraquia sin pleocitosis) y signos neurofisiológicos indicativos de neuropatía aguda, generalmente desmielinizante. En la tabla 1 se explican los criterios diagnósticos de SGB4.
Criterios de Rashbury y Cornblath modificados por Roper para el diagnóstico de síndrome de Guillain-Barré
| Rasgos requeridos para el diagnóstico |
| Debilidad motora progresiva en más de una extremidad |
| Arreflexia |
| Rasgos que apoyan fuertemente el diagnóstico |
| Progresión de los síntomas hasta un máximo de 4 semanas |
| Simetría relativa de los síntomas (la simetría absoluta es rara, pero si un miembro está afectado, es muy probable que el otro también lo esté en mayor o menor grado) |
| Síntomas o signos sensitivos leves |
| Afectación de nervios craneales, en especial parálisis facial bilateral |
| Comienzo de la recuperación entre 2 y 4 semanas después de cesar la progresión |
| Difteria reciente |
| Disfunción autonómica |
| Ausencia de fiebre al comienzo de la enfermedad |
| Elevación de la concentración de proteínas en el líquido celaforraquídeo, con < 10células/mm3 |
| Hallazgos habituales en los estudios neurofisiológicos |
| Rasgos dudosos para el diagnóstico |
| Presencia de un nivel sensitivo importante o persistente asimetría de los síntomas o de los signos |
| Disfunción esfinteriana persistente y grave |
| 50células/μl en el líquido cefalorraquídeo |
| Rasgos que excluyen el diagnóstico |
| Diagnóstico de botulismo, miastenia gravis, poliomielitis o neuropatía tóxica |
| Trastornos en el metabolismo de las porfirinas |
| Síndrome sensitivo puro sin debilidad |
El SGB puede ocurrir a cualquier edad, siendo más frecuente en adultos que en niños y extremadamente raro por debajo de los 2 años de edad. La incidencia en niños se estima entre 0,4 y 1,3 casos y 100.000 niños menores de 14 años3.
La forma clásica de SGB es la polirradiculoneuropatía desmielinizante inflamatoria aguda (PDIA), en la que se afecta la vaina de mielina, siendo la forma clínica de presentación más frecuente en Europa y Estados Unidos. Pero existen otras variantes clínicas en las que se afecta fundamentalmente el axón, como son la neuropatía axonal motora aguda (NAMA) y la neuropatía axonal sensitiva y motora aguda (NASMA), siendo la primera de ellas la forma clínica más frecuente de presentación en China y Sudamérica. Así mismo, también se describe otra variante caracterizada por oftalmoplejía, ataxia y arreflexia que se denomina síndrome de Miller-Fisher (SMF), en el cual la debilidad muscular es escasa o está ausente2,3(tabla 2).
Formas clínicas predominantes del síndrome de Guillain-Barré en pediatría por sus características clínicas y electrofisiológicas
| 1. Polirradiculoneuropatía desmielinizante inflamatoria aguda |
| 2. Neuropatía axonal motora aguda |
| 3. Neuropatía axonal sensitivo-motora aguda |
| 4. Síndrome de Miller-Fisher |
La patogénesis de la forma desmielinizante (PDIA) se basa en la unión de anticuerpos específicos pecíficos a la célula de Schwann que activan el sistema de complemento y lesionan la vaina de mielina a través de los macrófagos, produciendo una degeneración vesicular de la vaina. En las formas de NAMA y NASMA, el mecanismo etiopatogénico es diferente: Anticuerpos tipo inmunoglobulina G (IgG) dirigidos contra los gangliósidos GM1 y GD1A del axón producen una activación del sistema de complemento y se unen a las fibras motoras del axón a nivel de los nódulos de Ranvier, desencadenando la formación de un complejo de ataque de la membrana que desemboca en una degeneración axonal5.
Lectura rápida
El síndrome de Guillain- Barré (SGB) se caracteriza por debilidad muscular simétrica rápidamente progresiva y generalmente ascendente, acompañada de disminución o ausencia de reflejos osteotendinosos.
El proceso inflamatorio afecta normalmente a las vainas de mielina, desencadenando una polirradiculoneuropatía desmielinizante, pero también puede llegar a afectar al axón, desencadenando una neuropatía axonal sensitiva-motora o motora exclusivamente, por lo que la presencia de parestesias o dolor localizado no descarta el diagnóstico de SGB.
Existen 4 formas clínicas: la forma clásica de SGB es la polirradiculoneuropatía desmielinizante inflamatoria aguda (PDIA); neuropatía axonal motora aguda (NAMA); neuropatía axonal sensitiva y motora aguda (NASMA), y la variante Miller-Fisher, que se caracteriza por oftalmoplejía, ataxia y arreflexia, con escasa debilidad muscular.
La enfermedad se instaura progresivamente y puede llegar a afectar la musculatura respiratoria, llegando a precisar ventilación mecánica en el 13% de los pacientes, por lo que el paciente debe permanecer monitorizado desde el inicio de los síntomas.
Se pueden afectar los nervios craneales, como el VII par o el nervio glosofaríngeo, produciendo disfagia como sintomatología acompañante a la parálisis flácida simétrica y ascendente. Rara vez pueden afectarse solo los pares craneales, denominándose polineuritis craneal.
En las dos terceras partes de los pacientes diagnosticados de SGB existen antecedentes de una infección respiratoria o intestinal de 2 a 6 semanas previas al inicio de los síntomas. Diversos virus y bacterias han sido implicados, pero ha sido el Campylobacter jejuni la bacteria que más se ha asociado, llegando a pensar que es la causa etiológica en el 25% de los casos de SGB en Europa y EE. UU., y un alto porcentaje de NAMA en China y Sudamérica6. También se han implicado a algunas vacunas como desencadenantes de SGB, sin llegar a determinar de forma definitiva una relación causa-efecto. También el SGB se ha considerado un síndrome paraneoplásico en determinados linfomas en fase adulta o una manifestación de enfermedades sistémicas, como el lupus eritematoso sistémico3.
ClínicaLa enfermedad se desarrolla en 3 fases: fase aguda o de instauración, fase de estado y fase de recuperación.
La fase aguda, que puede durar de horas a semanas, se caracteriza por la instauración súbita y progresiva de los síntomas. El síntoma de presentación más habitual es la debilidad muscular simétrica, generalmente ascendente, o parálisis flácida, que suele presentarse en su inicio como una alteración de la marcha: dificultad para correr, subir escaleras, andar o incluso permanecer en bipedestación. Esta debilidad muscular comienza generalmente de forma distal en las piernas y asciende de forma progresiva afectando a brazos, cara y músculos respiratorios, llegando a precisar, en ocasiones, soporte ventilatorio. La velocidad de ascenso es variable, por lo que resulta imprescindible monitorizar al paciente hospitalizado para tomar las medidas oportunas en el caso de que los músculos respiratorios se vean afectados. Un estudio prospectivo reciente realizado en 95 niños afectados de SGB detecta un 28% de pacientes con compromiso respiratorio del cual un 13% precisó ventilación mecánica7. Es poco frecuente que la debilidad muscular sea proximal, planteándose el diagnóstico diferencial con otras entidades, como por ejemplo, una miositis aguda. La disminución o la ausencia de reflejos osteotendinosos suele acompañar a la debilidad muscular desde el inicio de la enfermedad, pero unos reflejos normales o incluso aumentados no excluyen su diagnóstico si el resto de los signos y síntomas es compatible. Un autor reporta hasta un 10% de pacientes diagnosticados de SGB con normo o hiperrreflexia8. Se pueden afectar los nervios craneales, siendo la afectación bilateral del VII par la más frecuente, produciendo una queratitis por lagoftalmos. La afectación del nervio glosofaríngeo produce disfagia, en primer lugar a líquidos y después a sólidos, llegando a precisar soporte nutricional externo. En algunos casos, pueden afectarse solo los pares craneales produciendo una polineuritis craneal, siendo una variable atípica y poco frecuente de SGB.
La afectación sensitiva no es infrecuente y se encuentran parestesias o dolor poco localizado. Algunas series reportan dolor en más del 50% de los pacientes diagnosticados de SGB en la fase de estado4,7,9. Si aparecen alteraciones pupilares, hay que plantearse otros diagnósticos, como el botulismo.
Alrededor del 50% presenta alteraciones del sistema nervioso autónomo que requieren monitorización del paciente: arritmias, hipotensión ortostática, hipertensión, íleo paralítico o disfunciones esfinterianas (vesical o anal). En la tabla 3 se exponen los criterios de gravedad10. Todos estos síntomas se instauran de forma subaguda y pueden progresar hasta un máximo de 4 semanas del inicio de la enfermedad con una duración variable en su fase de estado, terminando en una fase de recuperación que puede durar meses. El comienzo de la recuperación es entre 2 y 4 semanas después de cesar la progresión. El diagnóstico precoz, así como una respuesta positiva al tratamiento, puede acortar la duración de los síntomas, así como su recuperación.
Escala de gravedad del síndrome de Guillain-Barré según Paradiso et al9
| 0: normal |
| 1: síntomas y signos menores |
| 2: camina sin ayuda |
| 3: camina solamente con ayuda |
| 4: no se puede levantar solo de la cama o de la silla |
| 5: ventilación mecánica necesaria |
En el SMF la oftalmoplejía se traduce en diplopía y es el primer signo clínico en aparecer. La ataxia, más que por afectación cerebelosa, se produce por alteración propioceptiva debido a la alteración periférica sensorial, desencadenando alteraciones en la marcha o simplemente aumento en la base de sustentación. La arreflexia está presente siempre en el SMF y la debilidad es mínima o está ausente.
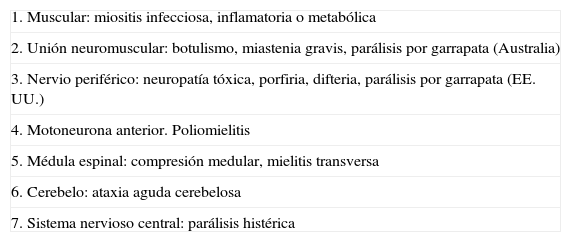
Diagnóstico diferencialExisten muchas enfermedades que pueden plantear dudas a la hora de realizar un diagnóstico de SGB (tabla 4), pero los trastornos más importantes que debemos excluir son: compresión del canal medular, botulismo, mielitis transversa y ataxia cerebelosa. La lesión de la médula por compresión, así como una mielitis transversa de etiología infecciosa o autoinmunitaria, pueden producir una parálisis flácida simétrica de inicio súbito, acompañada de arreflexia. Es importante realizar el diagnóstico adecuado, ya que la compresión medular requerirá cirugía descompresiva urgente y la mielitis transversa se puede beneficiar de un tratamiento corticoideo. La presencia de parálisis asimétrica, un nivel sensitivo, dolor lumbar localizado o disfunción vesical o intestinal persistente son síntomas que plantean dudas a cerca del diagnóstico de SGB. El botulismo infantil es un trastorno de transmisión neuromuscular debido a la colonización intestinal de esporas botulínicas procedentes de la comida o las heces. Predomina en lactantes menores de un año, en que el diagnóstico de SGB resulta muy poco frecuente. En el botulismo, la parálisis suele ser descendente y la afectación de nervios craneales precoz, presentando dificultad para tragar y anomalías pupilares en fases iniciales de la enfermedad. La parálisis producida por garrapata puede desencadenar una neuropatía aguda periférica y está causada por 2 especies diferentes: Dermacentor en EE. UU. e Ixodes holocyclus en Australia. La sintomatología clínica es una parálisis ascendente acompañada o no de ataxia aguda de instauración más rápida que en el SGB. Es un diagnóstico que se debe tener en cuenta si el paciente proviene de estos países y existe el antecedente de una picadura de garrapata.
Diagnóstico diferencial de síndrome de Guillain-Barré
| 1. Muscular: miositis infecciosa, inflamatoria o metabólica |
| 2. Unión neuromuscular: botulismo, miastenia gravis, parálisis por garrapata (Australia) |
| 3. Nervio periférico: neuropatía tóxica, porfiria, difteria, parálisis por garrapata (EE. UU.) |
| 4. Motoneurona anterior. Poliomielitis |
| 5. Médula espinal: compresión medular, mielitis transversa |
| 6. Cerebelo: ataxia aguda cerebelosa |
| 7. Sistema nervioso central: parálisis histérica |
La ataxia producida por cerebelitis aguda suele presentar tanto fuerza como reflejos conservados. La miastenia gravis, un trastorno de la unión neuromuscular, produce ptosis y la pérdida de fuerza es fluctuante. La poliomielitis suele ir acompañada de fiebre y meningismo, y actualmente, según datos de la Organización Mundial de la Salud, solo hay 3 países en el mundo que reportan casos nuevos de poliomielitis producida por el virus salvaje3,9,11.
DiagnósticoEl diagnóstico de SGB se basa en las manifestaciones clínicas ya descritas previamente, datos del laboratorio y estudios neurofisiológicos.
- 1.
Laboratorio: el análisis del LCR es un criterio indispensable para el diagnóstico de SGB. Se produce un incremento característico en la concentración de proteínas, además de un recuento celular inferior a 10 células. Generalmente, esta disociación albúmino-citológica se observa a final de la primera semana del inicio de los síntomas y puede persistir hasta la tercera semana. Si el recuento de leucocitos es superior a 50células/μl, el diagnóstico de SGB resulta dudoso.
En el LCR se pueden estudiar también los autoanticuerpos antigangliósidos GM1, GD1a, GT1a y GQ1b. Sin embargo, no se utilizan como criterios diagnóstico de rutina, ya que no son indispensables para decidir la farmacoterapia a utilizar. Generalmente, el resultado de los antigangliósidos se obtiene a posteriori de la etapa aguda de la enfermedad.
- 2.
Estudios neurofisiológicos: desde el punto de vista neurofisiológico, el SGB se clasifica en:
- –
PDIA.
- –
NAMA
- –
NASMA.
Los hallazgos neurográficos y electromiográficos durante la primera semana de la enfermedad pueden ser normales.
- –
Lectura rápida
Alrededor del 50% de los pacientes presentan alteraciones del sistema nervioso autónomo.
La presencia de parálisis asimétrica, un nivel sensitivo, dolor lumbar localizado o disfunción vesical o intestinal persistente son síntomas que plantean dudas a cerca del diagnóstico de SGB.
El diagnóstico se basa en la disociación albúmino-citológica que se observa a final de la primera semana del inicio de los síntomas y puede persistir hasta la tercera semana, así como en las alteraciones neurofisiológicas específicas de cada forma clínica.
El tratamiento general se basa en: preservación de la capacidad ventilatoria y la vía aérea, monitorización cardiovascular y tratamiento de trastornos autonómicos, prevención y tratamiento precoz de infecciones, así como nutrición e hidratación adecuadas.
El tratamiento específico es: inmunoglobulina por vía intravenosa (IgIV) a dosis total de 2g/kg, cuando la debilidad impide la deambulación. La plasmaféresis se recomienda cuando fracasan las IgIV o están contraindicadas.
El pronóstico de la forma desmielinizante (PDIA), así como de la variante Miller-Fisher, es, en general, bueno, con recuperación ad íntegrum en el 90% de los casos, siendo la severidad del cuadro clínico un factor pronóstico desfavorable. En las formas de neuropatía axonal (NAMA y NASMA) el pronóstico es más reservado.
A continuación, se describen los criterios neurofisiológicos según los diferentes subtipos de SGB:
- –
PDIA: al menos uno de los siguientes en 2 o más nervios o, al menos 2 de los siguientes en 1 nervio:
- •
Velocidad de conducción motora inferior del 90% del límite inferior de la normalidad.
- •
Latencia distal motora mayor del 110% del límite superior de lo normal.
- •
Cociente entre amplitud del potencial de acción motor después de estimulación proximal/amplitud del potencial de acción motor después de estimulación distal: menor del 0,5%. Amplitud del potencial de acción motor después de estimulación distal, mayor del 20% del límite inferior de la normalidad.
- •
Respuesta de latencia F, mayor del 120% del límite superior de la normalidad.
- •
- –
NASMA:
Amplitud del potencial de acción motor después de estimulación distal < 10% del límite inferior de la normalidad.
Amplitud de los potenciales de acción sensoriales por debajo del límite inferior de la normalidad.
- –
NAMA: similar a la anterior, pero sin afectación sensitiva en los estudios electrofisiológicos.
Todo paciente con SGB debe ser ingresado con el objetivo de estudiar la progresión de la enfermedad, valorar la administración de tratamiento y estar atento a las complicaciones, principalmente disautonomías cardiovasculares.
Tratamiento general- –
Preservación de la capacidad ventilatoria, así como de la vía aérea.
- –
Monitorización cardiovascular.
- –
Tratamiento de trastornos autonómicos (arritmias, hipertensión/hipotensión arterial).
- –
Prevención y/o tratamiento precoz de las infecciones.
- –
Nutrición e hidratación adecuadas.
- –
Prevención de escaras cutáneas.
- –
Gammaglobulina intravenosa (IgIV): dosis total de 2g/kg.
- –
Plasmaféresis.
- –
Neurorrehabilitación: estabilización motora, ortesis, férulas, etc.
El análisis de ensayos aleatorizados muestra que las IgIV y la plasmaféresis mejoran y aceleran la recuperación respecto al tratamiento conservador en niños y adultos, aunque no disminuyen la mortalidad12–14.
La plasmaféresis presenta mayores complicaciones y requiere un equipo tecnológico y humano especializado, por lo que, en general, es recomendable comenzar con las Ig y dejar a la plasmaféresis como una alternativa en caso de fracaso o de recaída13.
En aquellos pacientes que preservan la marcha y presentan una debilidad de carácter leve, no se recomienda el uso de IgIV; sin embargo, siempre es necesario el ingreso para observar la evolución.
La pauta habitual de IgIV es 0,4 g/kg de peso y día durante 5 días (2g/kg en total). Los efectos adversos más comunes son: cefalea, fiebre, mialgias, vómitos y rash cutáneo12.
Los corticoides en la actualidad no están indicados como fármaco de primera elección en SGB, ya que en múltiples en ensayos en adultos se ha demostrado mejor eficacia de la gammaglobulina por vía intravenosa (GGIV) y la plasmaféresis respecto a los corticoides12,14.
PronósticoEl pronóstico del SGB en niños es generalmente bueno. Más del 90% de los casos de PDIA y casi la totalidad de los casos de SMF se recuperan íntegramente. La severidad del cuadro clínico es importante como factor pronóstico del SGB. El 40% de los niños afectados pierde la marcha durante la fase aguda de la enfermedad y alrededor de un 15% necesita soporte ventilatorio.
Los niños con las formas más severas de SGB tardarán entre 6 meses y un año en alcanzar la recuperación completa. Un 5–10% queda con secuelas sensitivas y/o motoras menores, generalmente distales en las extremidades inferiores. La mortalidad publicada en la literatura es de 1–5%. En los casos de neuropatía axonal motora pura (NAMA) hay mayor porcentaje de secuelas, pero suele presentar una rápida mejoría en los casos en los cuales se produjo solo bloqueo de conducción en los nódulos de Ranvier sin degeneración axonal, lo que permite la rápida reversibilidad del cuadro. Los casos de neuropatía axonal motora sensitiva (NASMA), excepcionales en el niño, son los que tienen un pronóstico más reservado.