El conocimiento de la función de los oligosacáridos de la leche materna como prebióticos –es decir, nutrientes no digeribles que estimulan el crecimiento y la actividad de microorganismos beneficiosos en el colon, que repercuten positivamente sobre la salud– ha llevado a su incorporación a las fórmulas para lactantes. Los estudios iniciales permitieron demostrar que determinadas mezclas de prebióticos consiguen aumentar el recuento de bifidobacterias en heces hasta valores semejantes a los de niños con lactancia materna. Aunque los ensayos clínicos publicados son escasos, sus resultados muestran su eficacia en la disminución de infecciones banales durante los primeros 2 años de vida (fundamentalmente infecciones respiratorias, infecciones del tracto urinario, y necesidad de tratamiento antibiótico), así como en el número de enfermedades alérgicas (para la dermatitis atópica [13,6 frente a 27,9], para las sibilancias de repetición [7,6 frente a 20,6] y para la urticaria [1,5 frente a 10,3]) cuando se comparan las fórmulas con prebióticos frente a las no suplementadas. Se precisa estudiar con profundidad el mecanismo que explique este efecto y si es reproducible con otras combinaciones de prebióticos.
Puntos clave
Cuando el recién nacido abandona el ambiente estéril del seno materno y se encuentra con un mundo lleno de bacterias, se produce una rápida colonización de su piel y membranas mucosas. De entre todos esos ecosistemas bacterianos la microflora intestinal es la más compleja. El conocimiento de la composición de la microflora intestinal se remonta a algo más de un siglo. En las últimas décadas se ha visto acompañado por un interés creciente por determinar la relación que existe entre la microbiota, el desarrollo de la inmunidad y las propiedades que para la salud del individuo tienen las modificaciones en esa microflora. Revisamos en este trabajo los estudios clínicos más recientes sobre los efectos de la adición de prebióticos a las fórmulas para lactantes (tabla 1)*.
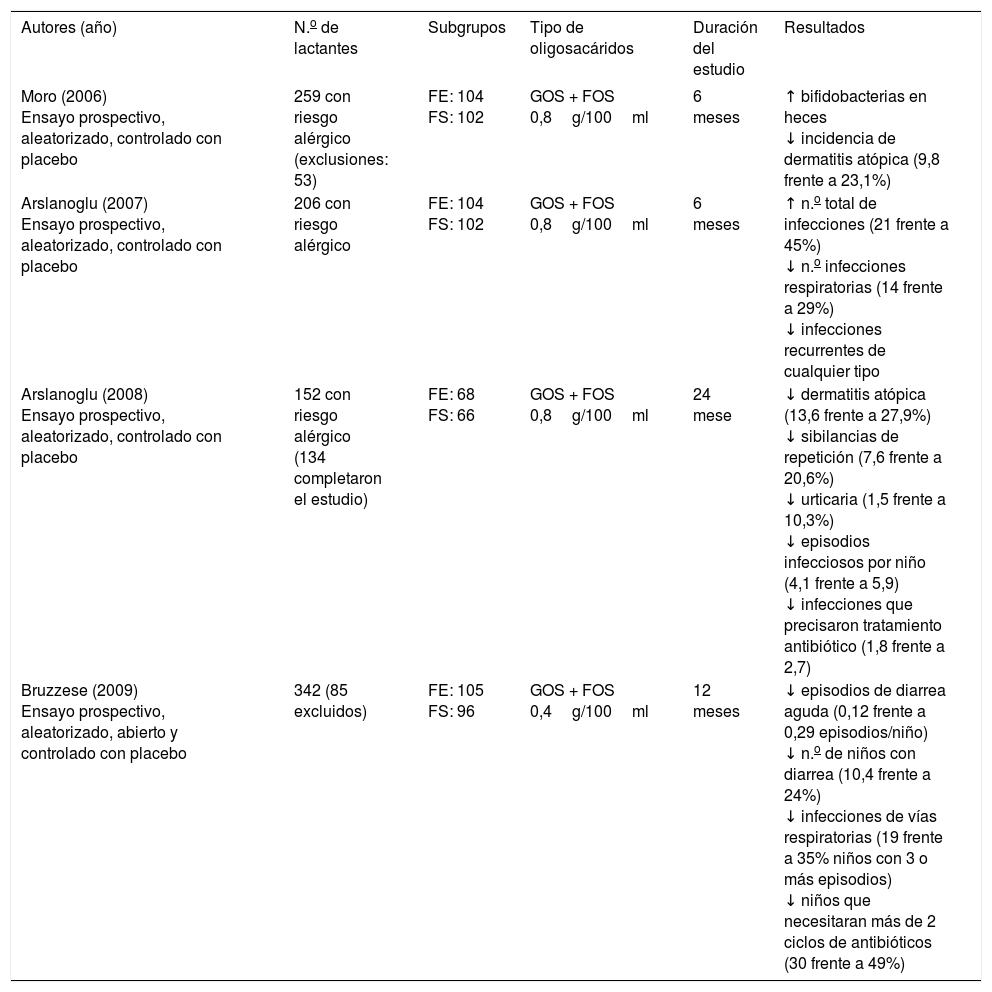
Ensayos clínicos sobre fórmulas suplementadas con oligosacáridos
| Autores (año) | N.o de lactantes | Subgrupos | Tipo de oligosacáridos | Duración del estudio | Resultados |
|---|---|---|---|---|---|
| Moro (2006) Ensayo prospectivo, aleatorizado, controlado con placebo | 259 con riesgo alérgico (exclusiones: 53) | FE: 104 FS: 102 | GOS + FOS 0,8g/100ml | 6 meses | ↑ bifidobacterias en heces ↓ incidencia de dermatitis atópica (9,8 frente a 23,1%) |
| Arslanoglu (2007) Ensayo prospectivo, aleatorizado, controlado con placebo | 206 con riesgo alérgico | FE: 104 FS: 102 | GOS + FOS 0,8g/100ml | 6 meses | ↑ n.o total de infecciones (21 frente a 45%) ↓ n.o infecciones respiratorias (14 frente a 29%) ↓ infecciones recurrentes de cualquier tipo |
| Arslanoglu (2008) Ensayo prospectivo, aleatorizado, controlado con placebo | 152 con riesgo alérgico (134 completaron el estudio) | FE: 68 FS: 66 | GOS + FOS 0,8g/100ml | 24 mese | ↓ dermatitis atópica (13,6 frente a 27,9%) ↓ sibilancias de repetición (7,6 frente a 20,6%) ↓ urticaria (1,5 frente a 10,3%) ↓ episodios infecciosos por niño (4,1 frente a 5,9) ↓ infecciones que precisaron tratamiento antibiótico (1,8 frente a 2,7) |
| Bruzzese (2009) Ensayo prospectivo, aleatorizado, abierto y controlado con placebo | 342 (85 excluidos) | FE: 105 FS: 96 | GOS + FOS 0,4g/100ml | 12 meses | ↓ episodios de diarrea aguda (0,12 frente a 0,29 episodios/niño) ↓ n.o de niños con diarrea (10,4 frente a 24%) ↓ infecciones de vías respiratorias (19 frente a 35% niños con 3 o más episodios) ↓ niños que necesitaran más de 2 ciclos de antibióticos (30 frente a 49%) |
FE: fórmula convencional; FOS: fructooligosacáridos; FS: fórmula suplementada; GOS: galactooligosacáridos.
La flora intestinal procede de la propia microflora fecal materna (enterococos, bifidobacterias, bacteroides, lactobacilos), de la piel o del medio ambiente (estafilococo, Escherichia coli, otras enterobacterias) o, incluso, de la propia leche materna (bifidobacterias y lactobacilos). La composición de la microflora está, en estas edades tempranas, influida fuertemente por la dieta, de tal forma que alrededor de los 10 días de vida podemos encontrar una flora bacteriana heterogénea, con predominio de bifidobacterias en el lactante alimentado al pecho, y una flora más diversificada, parecida a la que encontramos en el individuo adulto, en los lactantes que reciben fórmula.
Una explicación acerca del diferente patrón de colonización de bacterias intestinales se basa en el contenido en hidratos de carbono de la leche materna. Además de lactosa, la leche materna tiene más de 130 oligosacáridos complejos distintos en una cantidad apreciable (12–13g/l), lo que significa que constituyen el tercer mayor soluto después de la lactosa y los lípidos, por encima del contenido proteico. La mayoría de esos oligosacáridos no se absorbe, llega a colon y es fermentada por la flora intestinal. Así, su función no es exclusivamente energética o formar parte de las glucoproteínas o glucolípidos de las membranas celulares, sino que compiten con los receptores de membrana para las bacterias y virus patógenos en el epitelio intestinal y, además, ejercen su acción bifidogénica al convertirse en la principal fuente de energía para las bacterias del género Bifidobacterium bifidus.
El término “prebiótico” se refiere a un ingrediente alimentario no digerible que afecta beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o actividad de un número limitado de bacterias en el colon. La eficacia de los prebióticos está ligada a su capacidad de resistir la digestión en el intestino delgado y alcanzar el colon, donde un grupo restringido de microorganismos, fundamentalmente bifidobacterias y lactobacilos, los utilizaría de un modo selectivo. Sólo algunos oligosacáridos pueden considerarse prebióticos. La inulina y sus derivados, los fructooligosacáridos (FOS) han demostrado actividad prebiótica. Entre los oligosacáridos de origen lácteo destacan los galactooligosacáridos (GOS), la lactulosa, el lactitol y la lactosacarosa.
Prebióticos en fórmulas para lactantesA la vista de las propiedades funcionales de los prebióticos en la leche materna es probable que la inclusión de cantidades moderadas de prebióticos pudiera ayudar a los lactantes con lactancia artificial a adquirir una flora intestinal con más bifidobacterias y menor número de clostridios, coliformes y bacteroides.
La composición de los oligosacáridos de la leche materna es bastante compleja, por lo que no se dispone todavía de oligosacáridos similares para su uso en fórmulas infantiles. Por lo tanto, se han buscado mezclas de oligosacáridos de origen distinto que produzcan un efecto bifidogénico similar. Los FOS utilizados son de alto peso molecular, derivados de la inulina, en combinación con GOS. La combinación más habitual es 9:1 (GOS/FOS), tratando de conseguir un peso molecular semejante a los oligosacáridos de la leche materna.
Numerosos estudios han confirmado el efecto bifidogénico de los prebióticos, tanto en el recién nacido pretérmino como en los lactantes a término. El efecto bifidogénico de la suplementación es dependiente de la dosis, encontrando los mejores resultados cuando la concentración de GOS + FOS estaba alrededor de 0,8-1g/dl. Ese efecto beneficioso se acompañaba de una mejoría en las características de las deposiciones (más blandas y suaves). El efecto de la mezcla de prebióticos sobre la flora intestinal se acompaña de una reducción en el recuento de microorganismos patógenos.
El Scientific Committee on Food de la Unión Europea y la directiva de la Comisión Europea relativa a los preparados para lactantes y preparados de continuación, de diciembre de 2006, señalan que pueden añadirse FOS y GOS a los preparados para lactantes, en una cantidad no superior a 0,8g/100ml según una combinación de 90% de oligogalactosil lactosa y 10% de oligosil sacarosa de elevado peso molecular1.
El Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátricas (ESPGHAN) publicó en 2004 que con los escasos estudios realizados hasta entonces no podía hacerse ninguna recomendación sobre su uso con fines terapéuticos o preventivos. Sin embargo, encontraban que ocasionaban un aumento en el número de bifidobacterias en heces y que tenían un efecto positivo sobre la consistencia de las heces; que no se habían demostrado efectos adversos con su uso y recomendaban, por una parte, la realización de estudios prospectivos, aleatorizados y bien diseñados, encaminados a demostrar beneficios clínicos; y, por otra, una evaluación más exhaustiva para el caso de los prematuros y para lactantes con condiciones clínicas especiales, por ejemplo, situaciones de inmunodeficiencia2.
Con posterioridad a este documento se han publicado varios ensayos clínicos aleatorizados cuyos resultados se comentan en este trabajo.
Estudio prospectivo, aleatorizado y controlado, doble ciego, en 259 lactantes con riesgo de enfermedad atópica (historia de eccema atópico, rinitis alérgica o asma en uno o ambos padres). Todos eran lactantes a término y habían recibido lactancia materna exclusiva menos de 2 semanas. Los lactantes recibieron un hidrolizado extenso de proteínas del suero suplementado o no con una mezcla de GOS/FOS de 0,8g/100ml o dextrinomaltosa en la misma cantidad. Podían recibir lactancia materna hasta las 6 semanas y el período de intervención se prolongaba hasta los 6 meses de edad. El diagnóstico de dermatitis atópica se basó en la existencia de prurito, afectación de la cara, el cuero cabelludo y/o la superficie de extensión de las extremidades, con una duración superior a las 4 semanas. La gravedad de la dermatitis atópica se valoró con la escala SCORAD (extensión e intensidad de los síntomas cutáneos). Se valoró además la intensidad de los vómitos y regurgitaciones si las hubiera y las características de las deposiciones.
Abandonaron el estudio 53 de los lactantes por mantener leche materna por encima de las 6 semanas. A los 6 meses, 10 lactantes (9,8%; intervalo de confianza [IC] del 95%: 5,4 a 17,1) del grupo con prebióticos desarrollaron dermatitis atópica frente a los 24 del grupo control (23,1%; IC del 95%: 16,0 a 32,1). La gravedad del cuadro fue similar en ambos grupos.
Los autores concluyen que una mezcla de prebióticos reduce la incidencia de dermatitis atópica en lactantes de riesgo.
Dos años después se publicaron los resultados de un estudio se seguimiento de esta cohorte de pacientes.
De los 206 pacientes del estudio inicial, 152 estuvieron de acuerdo en participar en un estudio de seguimiento a 2 años. La incidencia acumulada a los 24 meses de dermatitis atópica, sibilancias de repetición y urticaria fue menor en el grupo que recibió una fórmula suplementada con prebióticos que en el grupo control, tanto para la dermatitis atópica (13,6 frente a 27,9) como para las sibilancias de repetición (7,6 frente a 20,6) y para la urticaria (1,5 frente a 10,3) (p < 0,05). Estos resultados apoyarían la hipótesis de que la administración de prebióticos en el lactante de riesgo tiene un efecto protector frente al desarrollo de manifestaciones alérgicas, lo cual sugiere un papel inmunomodulador a través de la flora intestinal que perdura más allá del período de intervención.
El objetivo secundario del ensayo clínico al que se refieren los 2 trabajos anteriores era demostrar una diferencia en el número de infecciones entre ambos grupos.
A los 6 meses la incidencia de todo tipo de infecciones era significativamente inferior en el grupo con prebióticos (21 episodios) frente al grupo control (47) (p = 0,01). También en el número de infecciones respiratorias del tracto superior (14 frente a 30 episodios). Asimismo había un menor número de infecciones que precisaron tratamiento antibiótico (11 frente a 22 episodios, p = 0,10). La incidencia acumulada de infecciones respiratorias del tracto superior a los 2 años continuaba siendo significativamente inferior en el grupo que recibió prebióticos y una tendencia a padecer menos infecciones del tracto urinario.
En el estudio de seguimiento hasta los 2 años, el número de infecciones (p < 0,01), el número de episodios febriles (p < 0,001) y el empleo de antibióticos (p < 0,05) también era menor.
Se trata de un ensayo multicéntrico, prospectivo, aleatorizado, controlado con placebo y abierto realizado en 342 lactantes que habían recibido al menos 2 semanas de lactancia materna desde el nacimiento. A los niños seleccionados se les asignó aleatoriamente a uno de los 2 grupos de estudio: fórmula estándar (n = 173) o una fórmula con prebióticos (0,4g/100ml de una mezcla GOS:FOS de 9:1, n = 169). Los lactantes recibían la fórmula del estudio durante los 12 primeros meses de edad. Completaron el estudio 201 niños.
La tasa de episodios de diarrea por niño fue significativamente inferior en aquellos que recibieron la fórmula suplementada con GOS/FOS (0,12 ± 0,004 frente a 0,29 ± 0,05) (p = 0,015). Además, el número de niños con al menos un episodio de diarrea aguda fue significativamente menor en aquellos que recibieron la fórmula con prebióticos (10,4 frente a 23,8%). Se observó también una tendencia a menos episodios de infección respiratoria de vías altas. La administración de la fórmula con prebióticos se asoció a una menor prescripción de antibióticos
Una revisión sistemática de la Biblioteca Cochrane que recoge todos los estudios de intervención publicados hasta febrero de 2007 en los que se emplean prebióticos añadidos a las fórmulas infantiles valorando el efecto de éstos en la prevención de la alergia sólo encontró 2 estudios de suficiente calidad. El análisis de los datos acumulados no pudo demostrar diferencias en la incidencia de eccema aunque reconoce la gran heterogeneidad entre los estudios.
Sólo se han publicado 4 ensayos clínicos que valoren el efecto de la suplementación con prebióticos en prematuros. Los resultados muestran que la suplementación aumenta el recuento de bifidobacterias en heces, reduce el número de bacterias patógenas, acelera el tránsito gastrointestinal y produce unas heces más blandas y ácidas, similares a las de la lactancia materna, sin afectar negativamente el crecimiento. Sin embargo, con los estudios publicados no es posible valorar ningún efecto clínico.
ComentarioLos estudios clínicos iniciales permitieron demostrar que la alimentación de lactantes con una fórmula suplementada con prebióticos conseguía aumentar el recuento de bifidobacterias y lactobacilos, principalmente los primeros, en las heces. Este aumento era dependiente de la dosis, obteniendo los mejores resultados con dosis alrededor de 1g/dl. En los últimos años se han publicado algunos ensayos clínicos en los que se valora la eficacia clínica de esta suplementación, sobre todo sobre las infecciones y las enfermedades alérgicas. Los estudios muestran una diferencia significativa en la incidencia de infecciones y problemas alérgicos durante el período de suplementación (6 meses) y hasta los 2 años de vida. Los pocos ensayos publicados utilizan la misma mezcla de prebióticos, patentada por una casa comercial. Tres de los trabajos publicados hacen referencia al mismo ensayo clínico, el de mayor calidad, y fueron realizados en lactantes con riesgo de alergia utilizando una fórmula de proteína de suero extensamente hidrolizada.
No se han descrito efectos adversos con el uso de los prebióticos añadidos a las fórmulas, cuando no se sobrepasa la cantidad citada. La valoración del número de infecciones se realizó mediante la comunicación por parte del pediatra, incluyendo el número de ocasiones en las que precisaron tratamiento antibiótico, y por la descripción de los padres. Los resultados de ambos métodos coincidieron.
Aunque se apuntan algunos datos sobre los posibles mecanismos que expliquen el efecto de la administración de prebióticos (por ejemplo, la disminución del recuento de Bifidobacterium adolescentis en heces o la modificación en las subpoblaciones de inmunoglobulina G), se desconoce el mecanismo íntimo de actuación. Se necesitan ensayos clínicos bien diseñados realizados en población de lactantes sanos que no reciban leche materna y con el uso de fórmulas para lactantes sanos que confirmen estos resultados. También sería deseable disponer de resultados con otras mezclas de prebióticos, además de profundizar en los mecanismos de actuación.
Se denominan preparados para lactantes los productos alimenticios destinados la alimentación especial de los lactantes durante los primeros meses de vida, que satisfagan por sí mismos las necesidades nutritivas de estos lactantes hasta la introducción de una alimentación complementaria apropiada (RD 867/2008, de 23 de mayo, por el que se aprueba la reglamentación técnico-sanitaria específica de los preparados para lactantes y de los preparados de continuación).