Puntos clave
- •
La transición fetal’ neonatal supone un paso de la presión parcial de oxígeno (paO2) de 25–30mmHg a 85–90mmHg en cuestión de minutos. La saturación arterial de oxígeno preductal pasa de 50%–60% a 90% en varios minutos.
- •
La hipoxia/ reoxigenación o hiperoxia causan la formación de especies reactivas de oxígeno que ocasionan un estrés oxidativo con consecuencias negativas, como son displasia broncopulmonar, retinopatía de la prematuridad, enterocolitis necrosante, persistencia del conducto arterioso o hemorragia intraperiventricular.
- •
El nomograma de saturación de oxígeno arterial es el referente más fiable para ajustar individualmente la fracción inspiratoria de oxígeno inicial (iFiO2) y evitar situaciones de hipoxia o hiperoxia.
- •
La reanimación del nacido a término se debe iniciar con una iFiO2 del 21%.
- •
La reanimación del nacido pretérmino se debe iniciar con una iFiO2 del 21–30%.
- •
Los prematuros con edad gestacional ≤ 28 semanas que precisen oxígeno en el período posnatal deberán mantenerse dentro de un rango de saturación de 90–95%.
El oxígeno es posiblemente el fármaco más utilizado en neonatología, ya que los problemas relativos a la insuficiencia respiratoria ocupan un primer lugar en la enfermedad neonatal. La utilización clínica del oxígeno requiere que se tengan conocimientos de aspectos inherentes al metabolismo oxidativo y de las consecuencias patológicas derivadas de su utilización con objeto de lograr un adecuado equilibrio. El balance entre hipoxemia e hiperoxemia es necesario para evitar consecuencias negativas en tejidos especialmente sensibles, como el sistema nervioso central, la retina, el pulmón o el aparato digestivo. Es más, las fluctuaciones frecuentes de la concentración de oxígeno son especialmente dañinas y deben ser evitadas1. La incorporación de la pulsioximetría a la práctica clínica ha permitido un control mucho más preciso de la oxigenoterapia. Sin embargo, el clínico y la enfermería deberían conocer a fondo las limitaciones de estos dispositivos y la incapacidad que todavía existe en la actualidad para mantener de forma continuada a los pacientes dentro del rango prescrito2.
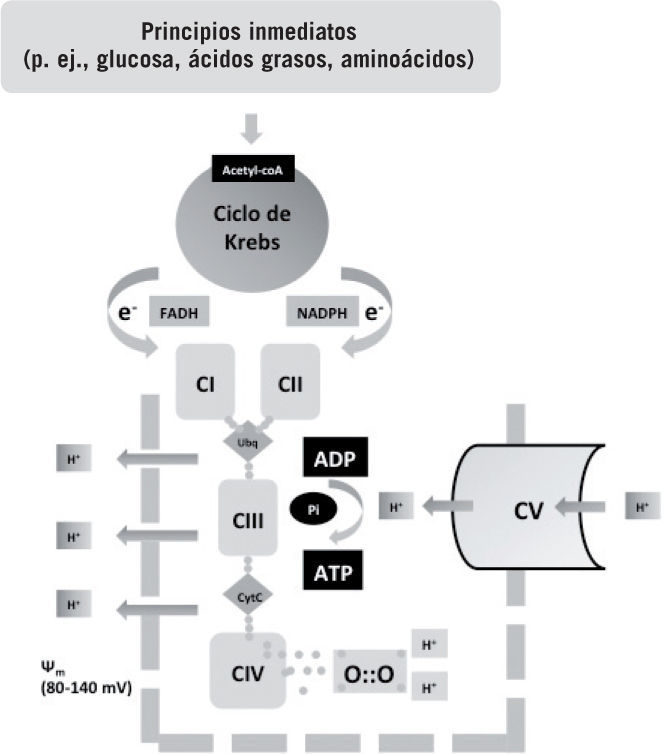
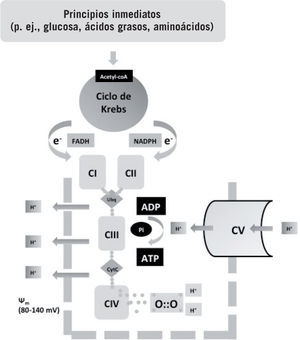
Metabolismo oxidativo: aspectos básicosEl oxígeno se presenta en la naturaleza como dioxígeno y tiene como función fisiológica fundamental aceptar electrones provenientes de la fosforilación oxidativa, que básicamente consiste en el acoplamiento del ciclo de Krebs a la cadena de transporte respiratorio (fig. 1). Los principios inmediatos convergen en la molécula de acetil-coA, que en la mitocondria es metabolizada en el ciclo de Krebs, donde se liberan electrones con alta carga energética que son transportados a la cadena respiratoria. La energía es utilizada para establecer un potencial de transmembrana, que es utilizado para la síntesis de trifosfato de adenosina (ATP). Los electrones son aceptados al final de la cadena respiratoria por el oxígeno y junto con 2 protones se forma agua. El metabolismo oxidativo es 20 veces más eficiente que el no oxidativo en la obtención de energía de los principios inmediatos. Así, una molécula de glucosa en combustión aeróbica produce 36–38mol de ATP, mientras que de forma anaeróbica (vía lactato) solo produce 2 mol de ATP. Tejidos especialmente sensibles a la falta de oxígeno, como el sistema nervioso central, carecen de reservas o alternativas energéticas por lo que solo pueden sobrevivir pocos minutos en ausencia de oxígeno antes de que su maquinaria enzimática se paralice1–6.
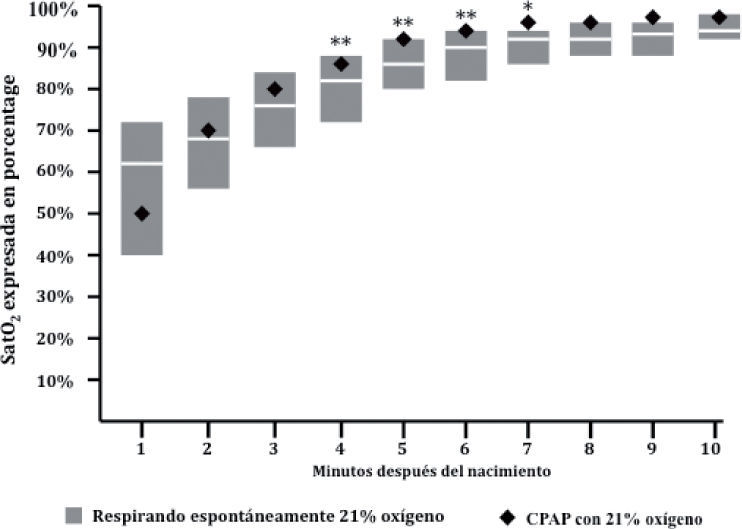
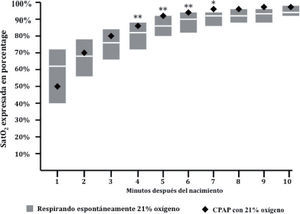
La utilización de presión positiva en la vía respiratoria en prematuros (normalizada en las más recientes recomendaciones de reanimación neonatal, véase Vento y Saugstad13) provocan un incremento más rápido de la saturación de oxígeno arterial que la respiración espontánea reflejada en el nomograma de Dawson et al9. La figura muestra cómo en los minutos sucesivos al nacimiento los prematuros que recibieron presión positiva continua y aire alcanzaron saturaciones significativamente más elevadas minuto a minuto comparativamente con el nomograma (adaptado de Vento et al15).
El dioxígeno molecular precisa de 4 electrones para su reducción completa y la formación de agua. Sin embargo, en circunstancias normales, hasta un 2% del mismo solo es parcialmente reducido con un electrón formando anión superóxido, con 2 electrones formando peróxido de hidrógeno, o con 3 electrones dando lugar a la formación del radical hidroxilo. Algunas de estas especies reactivas, y otras intermedias que no se comentan, son radicales libres. Un radical libre es una especie química que precisa uno o más electrones para estabilizar sus orbitales más externos, para lo cual reacciona con las moléculas más próximas «robándoles» los electrones que precisa y transformándolas a su vez en radicales libres en una típica reacción en cadena. De este modo, los radicales libres pueden causar alteraciones estructurales y funcionales a proteínas, lípidos, ADN, ARN, glúcidos, etc. Sin embargo, recientemente se ha podido demostrar que algunas de estas especies reactivas de oxígeno y que no son radicales, como el peróxido de hidrógeno, actúan como señalizadores intra e intercelulares activando y desactivando vías metabólicas necesarias para el normal funcionamiento celular. Por lo tanto, la formación de especies reactivas de oxígeno dentro de unos límites cumple una importante función fisiológica.
Lectura rápida
El oxígeno es imprescindible para el metabolismo aeróbico, que es el único capaz de proporcionar al ser humano la energía necesaria para las funciones celulares, crecimiento, desarrollo y reproducción.
Durante la adaptación posnatal se produce un incremento paulatino de las cifras de saturación de oxígeno (SatO2), que vienen reflejadas en el nomograma de saturación para nacidos a término y pretérmino de Dawson et al.
El nomograma de saturación de oxígeno arterial de Dawson et al constituye en la actualidad la guía más precisa y basada en la evidencia para la vigilancia de la oxigenación del recién nacido a término y pretérmino en la sala de partos.
En situaciones de asfixia, la reanimación recomendada tradicionalmente del recién nacido a término con 100% de oxígeno causa estrés oxidativo, que se acompaña de un incremento significativo de la mortalidad, por lo que los organismos internacionales recomiendan el uso inicial de una iFiO2 del 21%, que se ajustará de acuerdo con la respuesta del paciente.
Los prematuros tienen dificultades para establecer una respiración eficaz, por lo que precisan a menudo ventilación con presión positiva y suplementación con oxígeno. La presión positiva continuada o la presión positiva intermitente con presión positiva espiratoria constituyen las maniobras esenciales para el establecimiento de una aireación alveolar y una capacidad residual funcional esenciales para el intercambio gaseoso. La suplementación con oxígeno de los nacidos pretérmino en la sala de partos debe iniciarse con FiO2 de 21–30%.
El ajuste ulterior de la FiO2 se realizará de forma individualizada según la evolución de la SatO2, la frecuencia cardiaca y el tono.
La utilización de un exceso de oxígeno puede causar estrés oxidativo y daño pulmonar.
Los prematuros extremos precisan a menudo suplementos de oxígeno durante períodos prolongados después de la estabilización posnatal.
Estudios aleatorizados, controlados y enmascarados para la saturación de oxígeno arterial han demostrado cómo los rangos bajos de saturación (85–89%) producen mayor mortalidad y enterocolitis necrosante que los rangos elevados (91–95%). En cambio, los rangos elevados producen mayor incidencia de retinopatía de la prematuridad.
Se recomienda la utilización de rangos de 90–95% de SatO2 en prematuros extremos que precisen suplementación con oxígeno en el período posnatal.
Se recomienda una extremada vigilancia del cumplimiento de los rangos establecidos para evitar excesivas fluctuaciones de la SatO2.
Para regular el equilibrio celular existe un sistema antioxidante formado por enzimas específicas, como las superóxido dismutasas, catalasas y glutatión peroxidasas, que neutralizan el exceso de radicales libres y cuyo nivel de expresión génica y actividad enzimática está regulado por el estado pro o antioxidante existente en las células. Además, existen antioxidantes no enzimáticos que constituyen la primera barrera de defensa antioxidante y cuyo nivel no puede ser rápidamente modificado. Los más importantes son el complejo del glutatión (GSH), transportadores de metales de transición como ferritina, transferrina, ceruloplasmina, o metabolitos como bilirru-bina, ácido úrico, melatonina, o vitaminas C, A y E. En situaciones de hipoxia o hiperoxia, se van a generar un exceso de radicales libres de oxígeno que, si son capaces de superar la capacidad antioxidante del individuo, darán lugar a un estrés oxidativo que puede ser altamente dañino para las estructuras celulares provocando remodelación estructural (así en el tejido pulmonar), inducción de la apopto-sis o de la autofagia, o alteración funcional, todo lo cual conduce indefectiblemente a patología oxidativa neonatal, como retino-patía de la prematuridad (ROP), la displasia broncopulmonar (DBP), la persistencia del conducto arterioso (DAP), la enterocolitis necrosante (ECN) o la hemorragia intraperi-ventricular (HIPV)1–6.
Suplementación con oxígeno en la adaptación posnatalLa vida intrauterina transcurre en un ambiente de hipoxemia relativa comparada con la atmosférica. El feto, a lo largo de la gestación, mantiene una presión parcial de oxígeno (paO2) de unos 25–30 mmHg (3–3,5kPa) y una saturación en torno a 50–60% en el circuito cardiaco. La presencia de hemoglobina fetal, el gasto cardiaco elevado, el ahorro energético por el ambiente térmico neutro y la discreta acidemia en la periferia tisular permiten que haya una actividad metabólica oxidativa adecuada7. Con el nacimiento, el recién nacido experimenta unos cambios respiratorios y circulatorios extraordinarios. Como consecuencia de estos cambios fisiológicos, la paO2 pasa a 80–90mmHg (10–12,5kPa) y la saturación medida a 90–95%. Estos valores se estabilizan a los pocos minutos y ya se mantienen estables en lo sucesivo8.
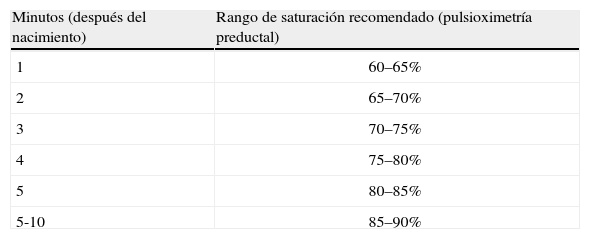
Nomograma de saturación arterial en los primeros minutos de vidaEn la década de los noventa se realizaron numerosos estudios sobre la saturación del recién nacido a término y pretérmino en los primeros minutos después del nacimiento, pero con una metodología diversa y sin un adecuado tratamiento estadístico2. En 2010 se publicaron los primeros nomogramas de saturación arterial de oxígeno preductal medidos en recién nacidos a término y prematuros, respectivamente. Se trató de un proyecto conjunto de los servicios de neonatología del Royal Women's Hospital (Melbourne) y el Hospital Universitario y Politécnico La Fe (Valencia) en el que se juntaron 3 bases de datos en las que se recogían saturaciones preductales de oxígeno arterial en nacidos a término y pretérmino que no habían precisado reanimación en la sala de partos ni suplementación de oxígeno, por lo que se consideraba que habían tenido una adaptación fisiológica. Se utilizaron pulsioxímetros con máxima sensibilidad, promediando cada 2 s de la medida, y sistema de detección de artefactos por movimiento. La monitorización se inició inmediatamente después del nacimiento y, en la mayoría de los casos, la medición fue fiable alrededor de los 60 s posnatales. Mediante complejos cálculos estadísticos se elaboraron 2 curvas de percentiles (10%–90%) para nacidos con ≥ 37 semanas y < 37 semanas de gestación. Al mismo tiempo, el mismo equipo de investigadores confeccionó unas tablas de normalidad para la frecuencia cardiaca durante los primeros 10 min posnatales en recién nacidos a término y pretérmino. Las curvas han sido adoptadas universalmente y sirven como referente al neonatólogo práctico para la utilización del oxígeno en la sala de partos9,10. Los rangos de normalidad que sirven de guía terapéutica han sido adoptados por la Academia Americana de Pediatría y vienen detallados en la tabla 111.
Objetivo de saturación de oxígeno arterial preductal medido por pulsioximetría minuto a minuto después del nacimiento recomendado por la Academia Americana de Pediatría.
| Minutos (después del nacimiento) | Rango de saturación recomendado (pulsioximetría preductal) |
| 1 | 60–65% |
| 2 | 65–70% |
| 3 | 70–75% |
| 4 | 75–80% |
| 5 | 80–85% |
| 5-10 | 85–90% |
Los investigadores que confeccionaron los nomogramas destacan un hecho muy importante que debe servir de guía y orientación. Los recién nacidos, tanto a término como pretér-mino normales, pueden tardar varios minutos en alcanzar una saturación > 90%. Es más, cuanto más inmaduro es un recién nacido, más tiempo va a tardar en estabilizar su saturación de oxígeno (SatO2). Así, prematuros de 27–28 semanas pueden tardar 8–10min en alcanzar SatO2 del 90%. Mientras la frecuencia cardiaca aumente progresiva y consistentemente y el neonato se muestre activo, no hay que tener prisa en suplementar con oxígeno para acelerar el proceso. Este hallazgo es de extraordinaria importancia para evitar el daño por hiperoxia en un momento de exquisita sensibilidad9,10.
En el momento actual se ha introducido un nuevo factor de cambio en la oxigenación posnatal debido al retraso en el pinzamiento del cordón umbilical. Estudios previos han venido a demostrar que aparentemente las saturaciones en neonatos con > 1min de retraso en el pinzamiento podrían ser algo distintas, por lo que el nomograma requeriría una cierta actualización. Sin embargo, hasta que eso se produzca, sigue siendo el mejor referente en la sala de partos según se indica en las recientes recomendaciones de consenso europeas12.
Oxígeno en la reanimación del recién nacido a términoLa reanimación del recién nacido a término con pérdida de bienestar fetal y, especialmente, con asfixia moderada a severa requiere un cuidadoso manejo de la suplementación con oxígeno. La utilización de una excesiva cantidad de oxígeno tras un prolongado período de hipoxia produce una eclosión de radicales libres de oxígeno capaces de aumentar la lesión inicial mediante mecanismos de apoptosis1,3. El reanimador siempre debe recordar que el establecimiento de una adecuada ventilación y de una capacidad residual funcional son las piedras angulares de la reanimación. Hasta que no hay eliminación del fluido pulmonar y expansión alveolar, no hay un intercambio gaseoso eficiente13. Por lo tanto, una ventilación adecuada es el paso inicial. Las normas del International Liaison Committee on Resusci-tation 2010 recomiendan iniciar la ventilación con aire ambiente (fracción inspiratoria de oxígeno [FiO2]: 21%)14. La actitud que se debe seguir cuando hay signos centinela o alteraciones bioquímicas sería estabilizar la vía respiratoria, colocar un pulsioxímetro preductal (mano o muñeca derechas) inmediatamente tras el pinzamiento del cordón y ajustar la FiO2 de acuerdo con la respuesta que se medirá: a) evaluando el incremento de la frecuencia cardiaca como respuesta más fiable e inmediata; b) evaluando el ascenso de la SatO2, y c) evaluando recuperación de la actividad y tono del neonato. Los ascensos/descensos de la FiO2 se deberán realizar en intervalos de un 10% y cada 15–30s para permitir observar la respuesta del paciente a los cambios. Evitar cambios bruscos de la FiO2 que pudieran ocasionar una reacción brusca del tono arteriolar de los vasos pulmonares e inducir una hipertensión pulmonar con hipoxemia grave. Una vez estabilizado el paciente, se ajustará la FiO2 y se trasladará a la Unidad de Cuidados Intensivos Neonatales, donde se continuará el tratamiento. En pacientes muy graves con bradicardia muy intensa, no reactiva, será preciso la intubación y administración de FiO2 inicial más elevada (50%–100%), masaje cardiaco y tal vez adrenalina intracardiaca13.
Estabilización del recién nacido prematuroDebido, principalmente, a la inmadurez que afecta al aparato respiratorio y los cambios circulatorios inherentes a la transición fetal-neo-natal, el prematuro tiene dificultades en realizar la estabilización a la vida posnatal. La debilidad muscular, la excesiva compliancia de la caja torácica y la falta de surfactante, entre otros factores, condicionan una enorme dificultad para lograr una adecuada expansión alveolar, así como el establecimiento de una capacidad residual funcional. Todos estos factores favorecen la insuficiencia respiratoria, que afecta especialmente a los prematuros extremos (< 32 semanas de gestación)1. En el nomograma de Dawson (fig. 2) se aprecia cómo los prematuros situados en el P50 tardan 7 a 8min en alcanzar una SatO2 de 90%, mientras que aquellos situados en el P10 pueden llegar a tardar más de 10min. La estabilización del prematuro requiere: a) retraso en el pinzamiento del cordón de al menos 1 min; b) colocación del pulsioxímetro en mano/ muñeca derechas (preductal) inmediatamente después de la extracción fetal; c) aplicación ante el menor signo de dificultad respiratoria en el neonato de > 29 semanas y siempre en el < 29 semanas de una presión positiva continuada de 5–6cmH2O en la vía respiratoria con mascarilla o piezas nasales, y si hay distrés más importante o pausas respiratorias, aplicar una presión positiva intermitente de 20–25cmH2O con frecuencias en torno a 50–60 respiraciones por minuto y presión espiratoria de unos 5–6cmH2O; d) suplementación con oxígeno ajustada de forma individualizada según la lectura del pulsioxímetro teniendo en cuenta los valores de SatO2 pero también la evolución de la frecuencia cardiaca13.
Esquema del metabolismo aeróbico. Los principios inmediatos son metabolizados por distintas vías a un elemento común, la acetil-coenzima A, que entra en el ciclo de Krebs en la mitocondria. Durante el proceso del ciclo del ácido tricarboxílico, electrones altamente energéticos son liberados y transportados por transportadores específicos (NAD y FADH) a la cadena respiratoria. La energía de estos electrones se utiliza para crear un potencial de transmembrana mitocondrial (\\fm). Los protones (H+) extruidos son luego introducidos por acción de la trifosfato de adenosina (ATP)-sintasa, lo que libera de nuevo energía, que es utilizada para la síntesis de ATP a partir de bifosfato de adenosina (ADP). El oxígeno capta4 electrones liberados por la cadena respiratoria, evitando la formación de especies reactivas. El metabolismo aeróbico es 18 veces más eficiente que el anaeróbico e indispensable para la vida multicelular. Fuente: Vento et al1, Saugstad3, Maltepe y Saugstad4, Auten y Davis5 y Bartz y Piantadosi6.
La utilización de presión positiva en la vía respiratoria acelera la adquisición de valores de SatO2 más elevados más precozmente, como ha demostrado recientemente nuestro grupo (fig. 2). Por lo tanto, cuando apliquemos presión positiva en la vía respiratoria deberemos estar muy atentos a la evolución de la SatO2, ya que es posible que se produzca un rápido ascenso de la saturación y debamos ajustar a la baja la FiO2. Aparentemente, también los prematuros del género femenino lograr más fácilmente una expansión pulmonar y, por ende, un ascenso más rápido de la SatO215.
La cuestión es: ¿cuál es la FiO2 inicial (iFiO2) deseable en la sala de partos en el prematuro extremo? Los estudios realizados hasta ahora aconsejan que se utilice una iFiO2 del 21–30%. En recientes metaanálisis se ha podido evidenciar que no hay diferencia en cuanto a enfermedades neonatales en el prematuro (DBP; ROP; DAP; HIPV), independientemente de que la iFiO2 fuese < 50% o > 50%. Sin embargo, en ambos metaanálisis se ha detectado una tendencia a una menor mortalidad en prematuros que fueron inicialmente suplementados con iFiO2 < 50%, por lo que las recientes guías europeas de tratamiento del distrés respiratorio se aconseja comenzar con una iFiO2 de 30%16,17.
Rangos de seguridad de la saturación de oxígeno en la época posnatal en el prematuroLa utilización de rangos elevados de SatO2 en el inicio de la oxigenoterapia llevó a una epidemia de retinopatía de la prematuridad en los años cuarenta. Sin embargo, la reacción ulterior con limitación de la suplementación de oxígeno condujo a un incremento sustancial de las muertes neonatales por hipoxemia3. La determinación de un rango de seguridad para la Sa-tO2 es fundamental para evitar las consecuencias negativas de la hipoxemia, como son una mortalidad más elevada, parálisis cerebral, hipertensión pulmonar o apnea, o de la hiperoxe-mia como DBP o ROP. Con objeto de llegar a conclusiones avaladas por un número suficiente de pacientes (poder estadístico adecuado), se proyectó una serie de estudios multicéntricos bajo el paraguas de NeoProM18. Todos los estudios han tenido como características comunes que eran aleatorizados, controlados y enmascarados para la lectura de la SatO2 mediante modificaciones de los pulsioxímetros utilizados. Las saturaciones se registraron y almacenaron durante todo el período neonatal hasta cumplidas las 36 semanas posconcepcionales. Los pacientes reclutados fueron prematuros extremos (edad gestacional < 28 semanas) que precisaron suplementación de oxígeno en el período posnatal. Los pacientes fueron aleatorizados dentro de las primeras 24h a alta saturación (91%–95%) o baja saturación (85%–89%). En total, se han realizado 5 estudios, SUPPORT trial (EE. UU.), COT trial (Canadá) y BO-OST II trial (Australia, Reino Unido, Nueva Zelanda), que han reclutado a un total de 5.000 pacientes19–21. Los resultados de estos estudios indican globalmente que el mantenimiento de los prematuros extremos en rangos de baja saturación (85–89%) aumenta la mortalidad y la ECN de forma significativa, mientras que reduce la incidencia de retinopatía de la prema-turidad, no teniendo influencia sobre la DBP. En cambio, los pacientes mantenidos en rangos elevados (91–95%) tienen menos mortalidad y menor incidencia de ECN, mientras que presentan retinopatía de la prematuridad con una incidencia significativamente mayor22. Por lo tanto, las recientes recomendaciones europeas recomiendan que los prematuros extremos que precisen suplementos de oxígeno más allá del período de adaptación posnatal se mantengan en un rango del 90–95%, advirtiendo de que hay tener un cuidado extremo en evitar la hi-peroxemia, que es la tendencia natural cuando se intentan mantener rangos elevados de saturación. En situaciones especiales, como DBP, cardiopatía, sepsis etc., los rangos se ajustarán a las circunstancias individuales de cada paciente y serán prescritas por el neonatólogo responsable12. Conviene de todos modos recordar que incluso en estudios aleatorizados con un máximo control de la situación clínica los pacientes han permanecido solo un 50–60% del tiempo dentro del rango prescrito, por lo tanto, es esencial recalcar a los médicos, pero sobre todo al personal de enfermería, la necesidad de vigilar estrechamente la SatO2 y evitar, en la medida de lo posible, que los períodos de hipoxemia o hiperoxemia se prolonguen en exceso23,24.
El autor declara no tener ningún conflicto de intereses.