Puntos clave
Lectura rápida
La fiebre es uno de los motivos de consulta más habituales en urgencias sobre todo en menores de 3 años.
Habitualmente, la fiebre está ocasionada por procesos virales autolimitados aunque un porcentaje considerable de lactantes con fiebre, buen aspecto y exploración anodina pueden padecer una infección bacteriana potencialmente grave (IBPG).
La IBPG más frecuente es la infección del tracto urinario. Ésta debe ser descartada en todos los lactantes febriles menores de 3 meses y, por encima de esta edad, si el lactante tiene una temperatura > 39°C y es una niña menor de 2 años o un varón menor de 12 meses.
La fiebre es uno de los principales motivos de consulta en urgencias. La mayoría de los niños que consultan por fiebre son menores de 3 años. A pesar de que suele tratarse en su mayoría de cuadros virales autolimitados, el riesgo de presentar una infección grave es mayor en los lactantes. Además, la expresividad de estas infecciones puede ser menor, sobre todo en procesos poco evolucionados. Alrededor de un tercio de los lactantes febriles consulta en las primeras 6h de evolución. Esto, junto al menor desarrollo del sistema inmunitario de los lactantes, justifica que la aproximación al lactante febril sea en general más cauta y más intervencionista que en el niño mayor y que, cuanto más joven sea el niño, más pruebas se le practiquen.
En general, es suficiente una buena anamnesis y una exploración física detalladas pero, en ciertos grupos de pacientes, es aconsejable realizar diferentes pruebas complementarias1–6.
Anamnesis y exploración físicaAparienciaÉste siempre debe ser el primer aspecto que se debe valorar. La evaluación y el registro de los signos vitales, color de la piel, exantemas y estado de hidratación son esenciales. Tras esta valoración el lactante se clasifica como paciente con buen aspecto, aspecto “enfermo” o aspecto tóxico.
Un aspecto anormal también se define como la alteración del triángulo de evaluación pediátrico (TEP) de la American Academy of Pediatrics (AAP). La alteración de cualquier lado del TEP (apariencia, respiración y circulación) incrementa el riesgo de que un lactante tenga un problema grave y obliga a actuar de manera más diligente.
Los niños con buen aspecto presentan menos de un 3% de posibilidad de tener una infección bacteriana potencialmente grave (IBPG) (tabla 1), aquellos con aspecto “enfermo” alrededor del 25% y en torno al 90% si el aspecto es tóxico.
La gran mayoría de los lactantes presentan buen aspecto, por lo que el reto consiste en identificar aquellos con un mayor riesgo de tener una evolución tórpida.
TemperaturaLa gran mayoría de los autores hablan de fiebre a partir de 38°C. El mejor lugar para registrar la temperatura en un lactante febril es el recto. Otros lugares, como la axila, la boca o el tímpano, son poco fiables. Aquellos pacientes con fiebre en el domicilio y afebriles en urgencias deben ser tratados como el resto de lactantes febriles. Aunque infecciones graves pueden presentarse con pequeñas elevaciones de la temperatura, especialmente en los lactantes más jóvenes, el riesgo de presentar una IBPG se relaciona con mayores elevaciones de la temperatura.
FocalidadAlrededor del 20% de los niños febriles tendrán fiebre sin focalidad aparente (FSF) después de que una anamnesis y exploración física detallada (incluyendo la ausencia de signos de otitis media aguda, infección osteoarticular o de tejidos blandos y auscultación pulmonar normal) no permitan identificar el origen de la fiebre. Un porcentaje de éstos, variable en relación con la edad, tendrá una IBPG.
EdadEl sistema inmunitario de los lactantes está menos desarrollado y, por ello, tienen un mayor riesgo de presentar una IBPG o de desarrollarla a partir de una infección focal. Esto es más frecuente por debajo de los 3 meses, grupo en el que la práctica de ciertas pruebas es inexcusable independientemente del grado de fiebre.
Hasta el 20% de los menores de un mes con FSF tienen una IBPG, el 5-9% de los que tienen entre 1 y 3 meses y el 3-5% de los mayores de 3 meses. Este riesgo es menor en niños mayores.
En los menores de un mes (y especialmente en los primeros 15 días) debe recabarse información acerca de incidencias en el parto (rotura prolongada de bolsa amniótica, fiebre materna, madre portadora de estreptococo B, etc.). Ciertas infecciones adquiridas en el canal del parto (herpes, estreptococos) son típicas de esta edad.
Infecciones bacterianas potencialmente gravesUna infección invasiva se asocia con el aislamiento de un germen en un líquido habitualmente estéril (sangre, líquido cefalorraquídeo [LCR], líquido articular o líquido pleural).
Las IBPG abarcan un grupo un poco más amplio (tabla 1) y en los lactantes con FSF están causadas mayoritariamente por Streptococcus pneumoniae, Streptococcus agalactiae, Neisseria meningitidis, Listeria monocytogenes y Escherichia coli. Las causadas por Haemophilus influenzae tipo b son excepcionales hoy en día.
No existe una prueba que permita identificar todas las IBPG, la prevalencia de alguna de ellas ha cambiado en los últimos años y el valor de las diferentes pruebas también.
Lectura rápida
La prevalencia de otras infecciones potencialmente más graves como la bacteriemia o la meningitis en los lactantes febriles ha variado en los últimos años.
Lactantes mayores de 3 meses de edadEn los lactantes febriles mayores de 3 meses de edad la tasa de bacteriemia oculta y meningitis ha variado enormemente con la introducción de ciertas vacunas conjugadas.
La vacunación frente a Haemophilus influenzae tipo b (Hib) ha erradicado prácticamente las infecciones invasivas por este germen.
La IBPG más frecuente en el lactante con FSF es la infeccfión del tracto urinario (ITU). Las ITU se presentan en muchas ocasiones exclusivamente como FSF.
Son más frecuentes en niñas, salvo en los 3 primeros meses de vida cuando son más frecuentes en niños no circuncidados. La incidencia de ITU es máxima entre las niñas menores de un año y es mínima entre varones circuncidados mayores de 6 meses.
El diagnóstio tardío de una ITU conlleva un mayor riesgo de desarrollar afección renal posterior. Esta probabilidad se relaciona con el número de ITU febriles y la tardanza en realizar el diagnóstico. Por otra parte, en un lactante pequeño es más probable que se desarrolle una infección metastásica. Un porcentaje elevado de aislados bacterianos en sangre en los lactantes febriles se asocian con ITU, sobre todo en los menores de 3 meses.
Un lactante con una ITU febril puede ser tratado ambulatoriamente con cefixima7 o amoxicilina-ácido clavulánico oral8. La AAP recomienda el tratamiento hospitalario sólo si presentan uno o más de los siguientes: edad inferior a 2 meses, mal aspecto, evidencia analítica de una sepsis urológica, deshidratación, vómitos que impidan el tratamiento oral o si hay dudas acerca del cumplimiento del tratamiento9.
Bacteriemia ocultaLa detección de los lactantes con bacteriemia oculta (BO) es uno de los grandes retos cuando se evalúa un lactante febril con buen aspecto por la posibilidad de que desarrolle una infección metastática o una sepsis. Ésta es la principal razón para practicar una analítica sanguínea al lactante febril.
El neumococo es la primera causa de BO. La BO neumocócica se cura de manera espontánea en más del 70% de los casos, si bien hasta un 3-4% puede desarrollar una meningitis. El riesgo de tener una BO se incrementa a partir de una temperatura > 39°C y con un recuento leucocitario ≥ 15.000/μl. Los valores elevados de procalcitonina (PCT) también se asocian con un riesgo aumentado de BO.
La vacunación conjugada neumocócica heptavalente (VCN-7) ha cambiado radicalmente la aproximación a estos pacientes10. En los menores de 36 meses, la tasa de enfermedad invasiva neumocócica disminuyó drásticamente tras la introducción de la VCN-711–15. Hoy en día, la incidencia de BO neumocócica en lactantes con FSF elevada y una cobertura vacunal antineumocócica adecuada es inferior al 0,5%, a expensas de un descenso de los serotipos vacunales. De hecho, ciertos autores ya han referido la disminución de los aislamientos neumocócicos en sangre en los lactantes febriles y algunos encuentran otros gérmenes con mayor frecuencia en poblaciones vacunadas. El efecto de la VCN-7 también se ha descrito en personas no vacunadas o en diferentes edades, por el efecto “rebaño”. Recientemente, se ha descrito un incremento de enfermedades invasivas neumocócicas por serotipos no vacunales16,17. El impacto de las nuevas vacunas conjugadas (frente a 10 o 13 serotipos) no se ha analizado aún.
Otras causas menos frecuentes de BO son N. meningitidis, E. coli, S. aureus y Salmonella sp.
SepsisLa causa más frecuente de sepsis es la infección meningocócica, en cuya exploración física es frecuente la aparición de petequias, razón por la que un lactante febril debe ser desnudado. Entre el 2 y el 8% de los niños con fiebre y un exantema petequial pueden tener una IBPG, generalmente causada por N. meningitidis. La ausencia de petequias bajo la línea intermamilar hace menos probable la meningococemia. Clásicamente, los niños con enfermedad meningocócica y exantema petequial no suelen presentar un buen aspecto, si bien el consultar con más rapidez pueda hacer que el niño tenga un aspecto saludable y el exantema no esté presente aún.
MeningitisLa meningitis en la infancia es habitualmente aséptica y, cuando la causa es identificada, en más del 90% de los casos están implicados enterovirus no-polio, sobre todo en meses cálidos. Cuando en urgencias el diagnóstico de sospecha de meningitis viral es firme, diversos grupos optan por el manejo ambulatorio de estos pacientes, dada su buena evolución clínica. En alrededor del 5% la causa es bacteriana18, sobre todo por neumococo y meningococo. La prevalencia de la meningitis neumocócica ha disminuido de manera importante en poblaciones con VCN-7 a expensas de los serotipos vacunales19. Recientemente, se ha registrado un incremento de las meningitis producidas por serotipos no vacunales, fundamentalmente el 19A19.
Lectura rápida
Las infecciones neumocócicas invasivas han disminuido drásticamente tras la introducción de la vacunación conjugada neumocócica heptavalente (VCN-7). Esto ha variado el rendimiento de las pruebas utilizadas clásicamente para identificar el lactante febril con mayor riesgo de bacteriemia oculta, sobre todo el hemograma. La aparición de nuevos biomarcadores, como la procalcitonina sérica, la prueba de diagnóstico rápido de enfermedades virales, la reacción en cadena de polimerasa para virus y bacterias y nuevas técnicas de investigación están desplazando al hemograma en el manejo de estos pacientes.
Es excepcional en lactantes con FSF salvo en aquellos con más de 20.000 leucocitos/μl20–22.
Pruebas complementariasLa realización de pruebas en el lactante febril con buen aspecto depende de aspectos como el grado de fiebre, la edad, la cobertura vacunal o el contacto con otro niño con una infección invasiva.
Análisis de orina y urocultivoEs recomendable descartar la ITU en:
- —
Todos los menores de 3 meses con FSF, independientemente del grado de fiebre.
- —
Niñas menores de 2 años con FSF > 39°C.
- —
Niños menores de un año que presentan FSF > 39°C.
La tira reactiva de orina para detectar la presencia de esterasa leucocitaria o nitritos o la visión de la muestra de orina al microscopio para detectar leucocitos o gérmenes son herramientas que permiten identificar pacientes con mayor riesgo de ITU.
La prueba de la esterasa leucocitaria puede sustituir a la búsqueda microscópica de piuria. La leucocituria muestra una gran sensibilidad (70-80%) para el diagnóstico de ITU con una menor especificidad, mientras que la nitrituria es muy específica pero menos sensible. Los nitritos son producidos por la mayoría de los gérmenes gramnegativos que causan ITU, no así muchos gérmenes grampositivos.
La mayoría de las ITU se acompañan de alteraciones del sedimento e, incluso, hay autores que cuestionan la ITU en ausencia de leucocituria. En caso de dudas, la tinción de Gram de una orina fresca puede facilitar el diagnóstico dado el gran rendimiento de esta técnica.
De entrada, para descartar la ITU es suficiente, en los mayores de 3 meses, practicar una tira reactiva. La prueba de referencia para realizar el diagnóstico de una ITU es el urocultivo. Si se inicia un tratamiento antibiótico debe recogerse antes un urocultivo. Si se detecta leucocituria y/o nitrituria se debe recoger una muestra para urocultivo por un método estéril (mitad del chorro miccional en micción espontánea, sondaje vesical o punción suprapúbica). Salvo excepciones, no debe cultivarse una orina recogida en bolsa perineal porque alrededor del 30% de los urocultivos positivos recogidos por bolsa son falsos positivos. En un lactante que no controla la micción la manera ideal de recoger un urocultivo es el sondaje vesical.
En los menores de 3 meses la leucocituria es menos sensible para ITU23. Además, la presencia de leucocituria en la tira reactiva se relaciona con una mayor probabilidad de tener un hemocultivo positivo24.
Recuento leucocitario y número absoluto de neutrófilosEn la época previa a la VCN-7, hasta el 6% de los lactantes con FSF superior a 39°C y más de 15.000 leucocitos/μl tenían una BO neumocócica, porcentaje que se elevaba hasta el 8% de los que tenían un número absoluto de neutrófilos > 10.000/μl.
En la época de la VCN-7, con la disminución de la prevalencia de BO, el valor predictivo del recuento leucocitario y la cifra de neutrófilos ha disminuido considerablemente (por debajo del 2-3% en poblaciones vacunadas)25, de manera que diferentes autores ya cuestionan la aplicabilidad de estas pruebas en el lactante febril10.
En muchos pacientes con meningococemia la cifra de leucocitos se encuentra dentro de los límites de la normalidad.
Proteína C reactiva séricaLa PCR sérica es útil en el diagnóstico diferencial de ciertas infecciones (neumonía bacteriana frente a neumonía viral, meningitis bacteriana frente a meningitis viral, ITU alta frente a baja). Una elevación de la PCR se relaciona con una mayor probabilidad de tener una IBPG y los puntos de corte propuestos varían según los autores entre 10 y 70mg/l, pero su valor en la identificación del lactante febril con riesgo de BO es limitado.
El rendimiento del recuento leucocitario, número absoluto de neutrófilos y PCR sérica para detectar una IBPG es mayor en cuadros de más de 12h de duración, con las limitaciones que este aspecto tiene en nuestro medio.
Procalcitonina séricaLa PCT se eleva muy discretamente en los procesos virales pero se eleva mucho y con gran rapidez en infecciones bacterianas. Esta elevación puede ser hasta mil veces superior que en los procesos virales. La PCT puede detectarse en plasma 2–3h después de una inyección de una endotoxina y tiene un pico alrededor de 12h más tarde del inicio de la infección.
La PCT es un gran marcador de IBPG26–28, sobre todo en cuadros poco evolucionados incluso por debajo de los 3 meses de edad29,30. Valores por encima de 0,5ng/ml deben aumentar la cautela en el manejo del lactante.
La PCT es muy útil en la valoración del niño con fiebre y exantema, con mejor rendimiento que la PCR y el recuento leucocitario. Valores por encima de 2ng/ml son muy indicativos de meningococemia31.
La PCT también es útil en el diagnóstico diferencial meningitis bacteriana frente a viral32. Valores elevados de PCT indican una meningitis bacteriana.
La PCT tiene un papel importante en la valoración inicial del lactante con una ITU febril. El nivel de la PCT se correlaciona con posibilidad de formación de cicatrices renales33. La PCT identifica los niños con riesgo de complicaciones y con necesidad de un seguimiento estrecho incluso con un primer episodio de ITU febril y podría ser utilizada para evitar exploraciones complementarias innecesarias (hasta un tercio de cistouretrografías en un primer episodio de ITU febril)34.
Lectura rápida
Por otro lado, el reciente aumento detectado de infecciones invasivas ocasionadas por serotipos neumocócicos no incluidos en la VCN-7 obliga a mantener sistemas de vigilancia de estas enfermedades.
Lactantes menores de 3 meses de edadEn los lactantes febriles menores de 3 meses las infecciones invasivas por estreptococo han disminuido desde la introducción de la profilaxis antibiótica intraparto. Aun así, los lactantes febriles menores de 3 meses tienen una tasa de IBPG mucho más elevada que los mayores de esta edad. De todas maneras, en urgencias es posible identificar pacientes de bajo riesgo para infección grave utilizando herramientas clásicas, la proteína C reactiva y la procalcitonina séricas y las pruebas de diagnóstico rápido para enfermedades virales. Estos pacientes de bajo riesgo pueden ser manejados de una manera más conservadora sin requerir un examen sistemático de líquido cefalorraquídeo (LCR) o ingreso en el hospital.
La disminución de la tasa de BO neumocócica ha hecho que la práctica sistemática de un hemocultivo los lactantes febriles mayores de 3 meses con buen aspecto y una adecuada cobertura vacunal esté hoy en día abiertamente cuestionada35. Aun así, el hemocultivo es la prueba de referencia para el diagnóstico de una BO y no se debe administrar un antibiótico empíricamente a un lactante con FSF sin recogerlo antes.
Radiografía de tóraxLa radiografía de tórax en lactantes con FSF, con exploración normal (incluida ausencia de taquipnea), no está indicada dado su escaso rendimiento. La excepción la constituyen los lactantes con buen aspecto y FSF con una más de 20.000 leucocitos/μl, sobre todo por encima de los 12 meses, con un elevado número de neutrófilos y una PCR sérica elevada36.
Líquido cefalorraquídeoLa práctica sistemática de punción lumbar en lactantes con FSF y buen aspecto está indicada en los menores de 2 semanas y debe considerarse en aquellos menores de 2 meses que van a recibir antibióticos empíricamente. Salvo estas situaciones, la realización de la punción lumbar no debe basarse en resultados analíticos sino en la impresión clínica del paciente37.
Test de diagnóstico rápidoOfrecen una serie de ventajas sobre las pruebas utilizadas tradicionalmente en el manejo del lactante febril (tabla 2).
Ventajas de las pruebas de diagnóstico rápido en el manejo del lactante febril
| Rapidez de realización |
| Ayudar a identificar el paciente de bajo riesgo para IBPG |
| Evitar pruebas innecesarias |
| Incrementar el rendimiento de las pruebas |
| tradicionales |
| Evitar tratamientos innecesarios |
IBPG: infecciones bacterianas potencialmente graves.
Los test de diagnóstico rápido (TDR) para virus respiratorios realizados mediante inmunofluorescencia se realizan a la cabecera del paciente sobre una muestra de secreciones respiratorias. El resultado se obtiene en 15–30min, muestra una elevada especificidad y, en el caso de los TDR para virus respiratorio sincitial e Influenza, la sensibilidad ronda el 90%.
Las infecciones virales como la gripe pueden presentarse como FSF en los lactantes.
El TDR para Influenza es especialmente aplicable en lactantes con FSF que consultan durante la epidemia de gripe38. El riesgo de IBPG en este grupo de pacientes con TDR para Influenza positivo es significativamente menor que en los que tienen un TDR negativo. Aun así, en los pacientes con TDR para Influenza positivo es posible la IBPG, por lo general una ITU. Los lactantes con FSF y TDR para Influenza positivo deben ser manejados de una manera más conservadora, incluso los menores de 3 meses39,40.
Reacción en cadena de polimerasaLa reacción en cadena de polimerasa para enterovirus es una herramienta muy útil en el manejo de los lactantes con sospecha de meningitis viral, ya que facilita un diagnóstico rápido y más exacto41,42. Esta técnica incrementa el pobre rendimiento del cultivo de LCR para enterovirus y su resultado está disponible en pocas horas, lo cual se asocia a la reducción y acortamiento de hospitalizaciones innecesarias.
La reacción en cadena de polimerasa para meningococo y neumococo permite en unas pocas horas identificar estos gérmenes en sangre y LCR. El diagnóstico inicial de una meningococemia se basa a menudo en hallazgos clínicos y se confirma mediante el aislamiento e identificación de N. meningitidis en sangre, LCR u otros fluidos. Los cultivos de sangre y de LCR son negativos en muchas ocasiones en pacientes con enfermedad invasiva meningocócica, sobre todo si han recibido un antibiótico antes de extraer las muestras. Además, la punción lumbar en ocasiones está contraindicada ya que puede ocasionar un deterioro clínico. La reacción en cadena de polimerasa ha demostrado ser más rápida y más sensible que el cultivo para el diagnóstico y serogrupado de la enfermedad meningocócica invasiva43. Esto también es aplicable a la reacción en cadena de polimerasa para neumococo.
TratamientosAntitérmicosLa respuesta de la fiebre al antitérmico no sirve para identificar pacientes con mayor riesgo de IBPG. La disminución de la fiebre puede permitir evaluar mejor al niño. El lactante con IBPG con frecuencia sigue teniendo un aspecto enfermo después de bajar la temperatura.
AntibióticosExiste controversia en cuanto a la eficacia de la antibioterapia profiláctica (ceftriaxona intramuscular) en un lactante con sospecha de BO, aunque sí parece disminuir el riesgo de desarrollar complicaciones, incluida la meningitis.
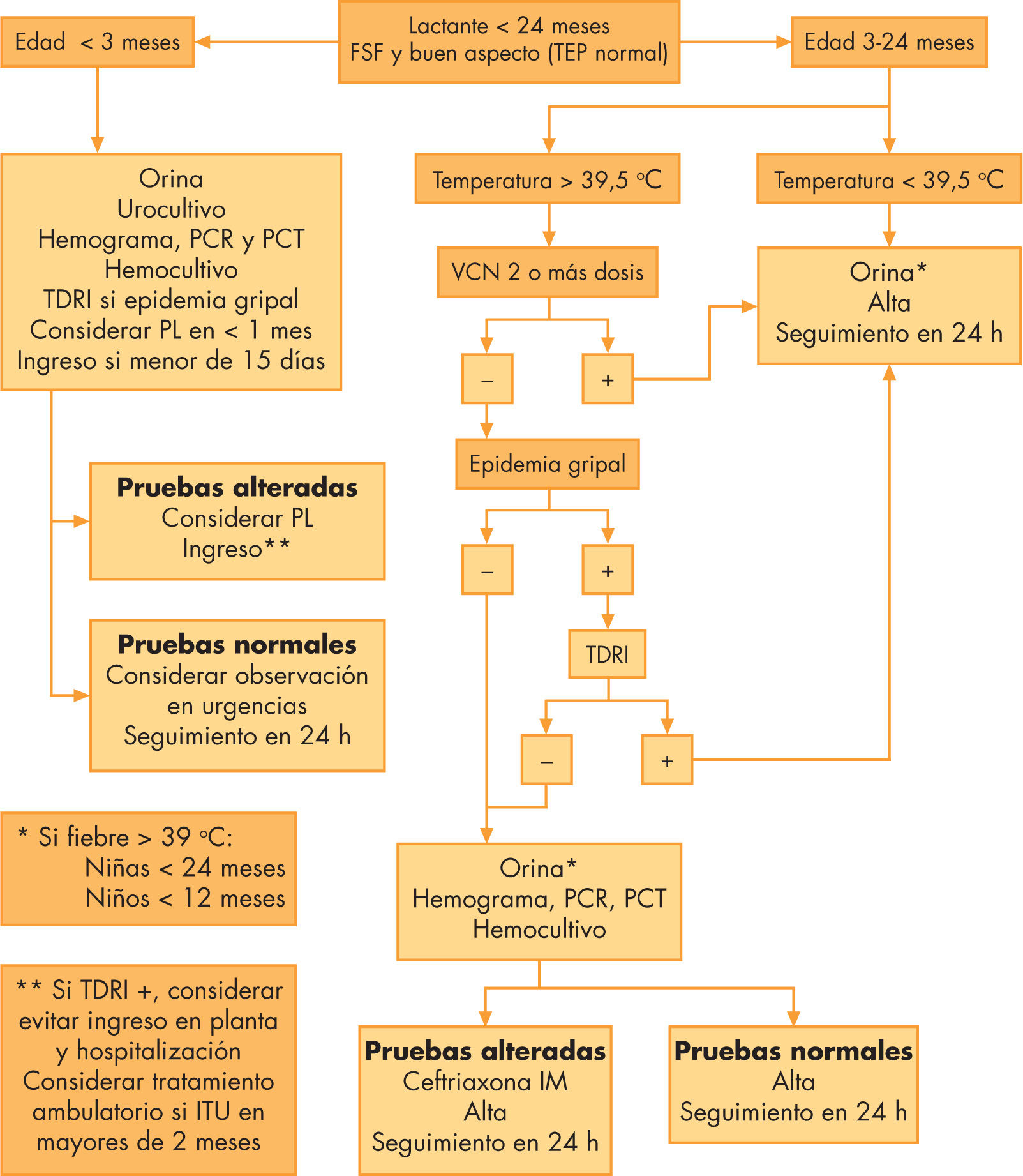
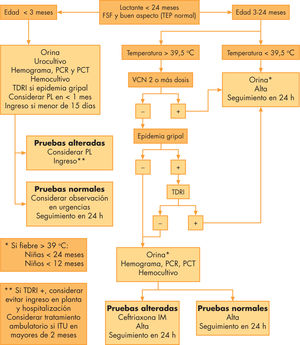
ProtocolosSe dispone de muchos protocolos (fig. 1). Los más utilizados son las recomendaciones del American College of Emergency Physicians44, y los denominados criterios de Rochester y criterios de Philadelphia.
Esquema general de manejo del lactante con fiebre sin focalidad. IM: intramuscular; ITU: infección del tracto urinario; PCR:proteína C reactiva; PCT: procalcitonina; PL:punción lumbar; TDRI:prueba de diagnóstico rápido del virus Influenza; TEP: triángulo de evaluación pediátrico; VCN: vacunación antineumocócica.
Estas guías tienen, en general, un mayor seguimiento en los niños menores de 3 meses aunque se han cuestionado por el supuesto exceso de pruebas y antibióticos en niños de 3–36 meses.
Las recomendaciones y los protocolos de actuación han sufrido cambios sustanciales desde la introducción de la VCN-7, si bien siguen diferenciando 2 grupos de edad: los menores y los mayores de 3 meses.
Lactante febril menor de 3 mesesEn este grupo las IBPG son más prevalentes, si bien la incidencia no es homogénea y aumenta en relación inversa con la edad. En estos niños siempre es conveniente cultivar la orina y practicar analítica sanguínea y hemocultivo. La tasa de hemocultivos positivos en este grupo de pacientes ronda el 2%24.
Según los criterios de Rochester se pueden identificar una serie de pacientes de bajo riesgo para IBPG, que serían los que cumplieran todos los siguientes: buen aspecto, previamente sano, sin signos de infección focal, 5.000-15.000/leucocitos/μl, ≤ 1500 bandas/μl, análisis de orina con menos de 10 leucocitos/campo y, si hay diarrea, menos de 5.000 leucocitos/ campo en las heces. Estos criterios mostraron un VPN de 98,9% para IBPG y del 99,5% para bacteriemia. Baker et al desarrollaron los denominados criterios de Philadelphia, en los que incluyeron la punción lumbar. Los pacientes de bajo riesgo pueden ser manejados de manera más conservadora y sin necesidad de ser hospitalizados. Muchos estudios han incluido cohortes de menores de 3 meses que cumplían criterios de bajo riesgo, incluyendo siempre un buen aspecto y un recuento leucocitario inferior a 15.000/μl, con/sin punción lumbar. Si bien la prevalencia de IBPG es muy pequeña en el grupo de bajo riesgo, un 0,5-1% de éstos tendrá una IBPG. Este hecho ha llevado a los diferentes grupos a buscar nuevos marcadores de IBPG. De esta manera, marcadores como la PCR, y sobre todo la PCT, parecen ser más útiles que los tradicionales. Valores de PCT por encima de 0,5ng/ml deben hacer extremar la cautela en el manejo de estos pacientes.
Es recomendable practicar una punción lumbar en los menores de un mes, especialmente en los menores de 2 semanas. Conviene recordar que las infecciones invasivas por estreptococo del grupo B han disminuido desde la introducción de la profilaxis antibiótica intraparto45. La incidencia de meningitis aséptica en este grupo de pacientes es de aproximadamente el 10% y su evolución habitualmente benigna.
El TDR para influenza también es aplicable en estos niños.
Para que el manejo ambulatorio de estos pacientes sea posible los padres deben ser fiables y debe garantizarse el seguimiento médico.
Lactante febril de 3–36 mesesDe manera general, un lactante mayor de 3 meses con FSF < 39°C, buen aspecto y sin factores de riesgo no precisa pruebas complementarias si los padres entienden las recomendaciones y se garantiza un seguimiento pediátrico2,44,46.
Si la tasa de BO es mayor de 1,5% la mejor estrategia coste-efectividad para manejar un lactante con FSF ≥ 39°C es practicar un hemograma y, según el resultado, solicitar un hemocultivo y administrar antibiótico. Con cifras de BO inferiores a 0,5%, la estrategia más adecuada es la observación del paciente, tras la valoración clínica de un pediatra sin practicar pruebas47.
La tasa de BO neumocócica en los lactantes febriles ha disminuido. En poblaciones con una buena cobertura vacunal antineumocócica la tasa de BO neumocócica no llega al 1% y en otras es menor del 0,5%. Según esto, la práctica de hemograma en lactantes correctamente vacunados debiera desterrarse, e incluso se cuestionaría en los no vacunados por el efecto “rebaño”.
Si se decide extraer una analítica, además del hemocultivo, debe considerarse la posibilidad de que la PCT o nuevos marcadores puedan complementar la información que proporciona el hemograma o, incluso, sustituirlo.
ObservaciónNingún protocolo ni ninguna prueba descartan totalmente la posibilidad de que un lactante desarrolle una IBPG. Es por esto que la observación estrecha de los lactantes siempre es mandatoria.
El pediatra debe constatar que los padres entienden la naturaleza del proceso que presenta el niño y que son capaces de observar lo que se les indica. El tratamiento antibiótico no sustituye a la observación por parte de los padres ni al seguimiento por parte del pediatra. El proporcionar una hoja explicativa ayuda a los padres a la hora de tener una referencia en casa.