Puntos clave
- •
La hipotermia terapéutica (HT) es el «patrón oro» de tratamiento en neonatos con encefalopatía hipóxico-isquémica neonatal. Sin embargo, no es eficaz en todos los pacientes ni en todos los ámbitos, siendo necesarias terapias coadyuvantes.
- •
La eritropoyetina es un tratamiento conocido y seguro en neonatos, con efectos pleiotrópicos. Sin embargo, no siempre es neuroprotector en modelos animales y no ha probado aún potenciar la HT.
- •
Existe experiencia con el uso de xenón y topiramato en neonatos. Son antiexcitotóxicos, potenciando el efecto y prolongando la ventana terapéutica de la HT. El inconveniente del xenón es su elevado precio.
- •
Melatonina y cannabidiol son tratamientos pleiotrópicos, neuroprotectores por varías vías de administración y con efectos proproliferativos. La melatonina potencia la HT. El cannabidiol muestra efectos beneficiosos extracerebrales.
Secularmente, la encefalopatía hipóxico-isquémica neonatal (EHIN) se ha considerado imposible de prevenir o tratar. Su compleja fisiopatología, en la que las propias características del cerebro en desarrollo lo hacen particularmente vulnerable al devastador círculo vicioso conocido como «la tríada mortal» (excitotoxicidad, inflamación y estrés oxidativo)1, determina que solo tratamientos pleiotrópicos, actuando simultáneamente sobre esos factores, puedan ser eficaces1 (fig. 1). Este hecho, junto con la dificultad intrínseca de definir con certeza los reales beneficiarios de un tratamiento neuroprotector, así como la heterogeneidad de los pacientes (en la intensidad, duración y cronología del episodio hipóxico-isquémico [HI]), hacen difícil no ya solo la obtención, sino siquiera el simple estudio de eficacia de tratamientos neuroprotectores.
Fisiopatología de la encefalopatía hipóxico-isquémica neonatal. En gris se resalta la «tríada mortal». Se destaca en qué punto actuarían las diversas estrategias neuroprotectoras. CBD: cannabidiol; EPO: eritropoyetina; HT: hipotermia terapéutica; MT: melatonina; TOP: topiramato; Xe: xenón.
Tras toda una historia de resignación, la hipotermia terapéutica (HT) ofreció la primera posibilidad real de tratamiento2,3. Sin embargo, la HT no es, y probablemente no será, el tratamiento definitivo, de modo que aún es pertinente la búsqueda de tratamientos que potencien y, llegado el caso, puedan sustituir a la HT1. En el presente texto se revisan algunos de los más prometedores para neonatos a término, cercanos o incluso inmersos ya en ensayos clínicos aleatorizados (ECA) (tabla 1).
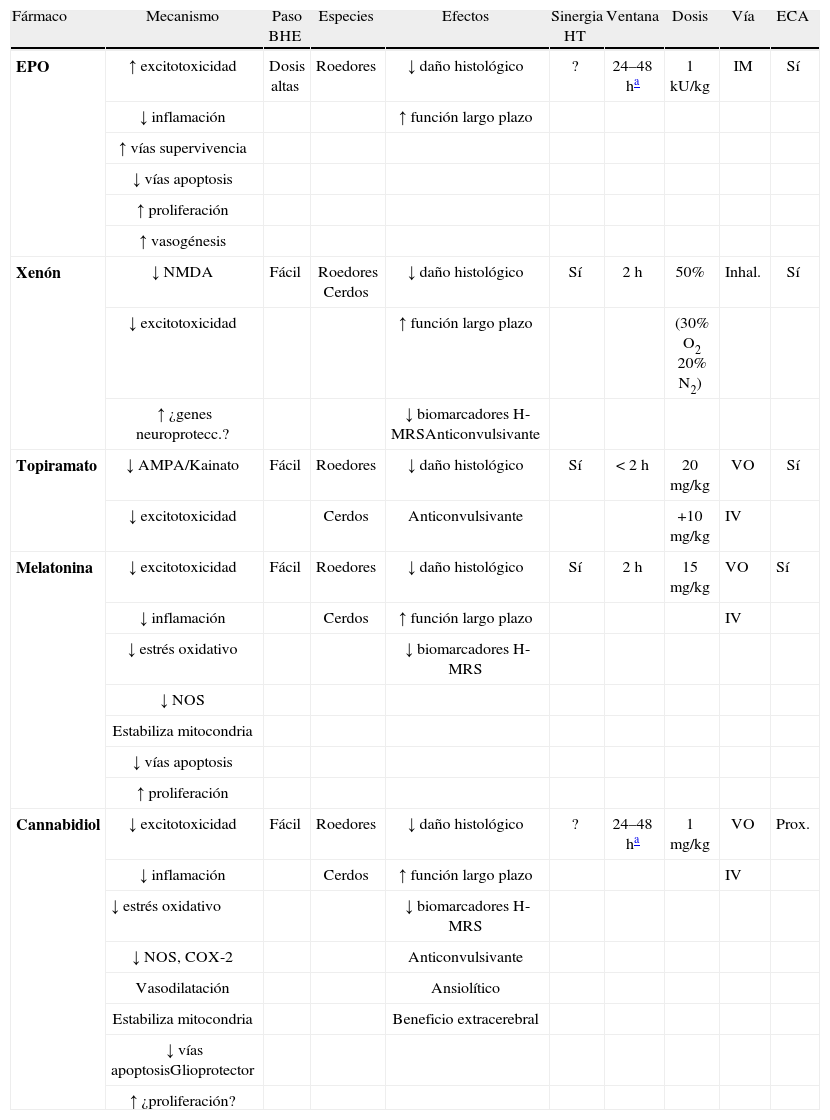
Datos de estudios preclínicos con fármacos neuroprotectores.
| Fármaco | Mecanismo | Paso BHE | Especies | Efectos | Sinergia HT | Ventana | Dosis | Vía | ECA |
| EPO | ↑ excitotoxicidad | Dosis altas | Roedores | ↓ daño histológico | ? | 24–48ha | 1kU/kg | IM | Sí |
| ↓ inflamación | ↑ función largo plazo | ||||||||
| ↑ vías supervivencia | |||||||||
| ↓ vías apoptosis | |||||||||
| ↑ proliferación | |||||||||
| ↑ vasogénesis | |||||||||
| Xenón | ↓ NMDA | Fácil | Roedores Cerdos | ↓ daño histológico | Sí | 2h | 50% | Inhal. | Sí |
| ↓ excitotoxicidad | ↑ función largo plazo | (30% O2 20% N2) | |||||||
| ↑ ¿genes neuroprotecc.? | ↓ biomarcadores H-MRSAnticonvulsivante | ||||||||
| Topiramato | ↓ AMPA/Kainato | Fácil | Roedores | ↓ daño histológico | Sí | < 2h | 20mg/kg | VO | Sí |
| ↓ excitotoxicidad | Cerdos | Anticonvulsivante | +10mg/kg | IV | |||||
| Melatonina | ↓ excitotoxicidad | Fácil | Roedores | ↓ daño histológico | Sí | 2h | 15mg/kg | VO | Sí |
| ↓ inflamación | Cerdos | ↑ función largo plazo | IV | ||||||
| ↓ estrés oxidativo | ↓ biomarcadores H-MRS | ||||||||
| ↓ NOS | |||||||||
| Estabiliza mitocondria | |||||||||
| ↓ vías apoptosis | |||||||||
| ↑ proliferación | |||||||||
| Cannabidiol | ↓ excitotoxicidad | Fácil | Roedores | ↓ daño histológico | ? | 24–48ha | 1mg/kg | VO | Prox. |
| ↓ inflamación | Cerdos | ↑ función largo plazo | IV | ||||||
| ↓ estrés oxidativo | ↓ biomarcadores H-MRS | ||||||||
| ↓ NOS, COX-2 | Anticonvulsivante | ||||||||
| Vasodilatación | Ansiolítico | ||||||||
| Estabiliza mitocondria | Beneficio extracerebral | ||||||||
| ↓ vías apoptosisGlioprotector | |||||||||
| ↑ ¿proliferación? | |||||||||
BHE: barrera hematoencefálica; COX-2: ciclooxigenasa-2; ECA: ensayo clínico aleatorizado; EPO: eritropoyetina; H-MRS: espectroscopia de protones por resonancia magnética; HT: hipotermia terapéutica; Inhal.: inhalatoria; NOS: sintasa de óxido nítrico; Prox.: próxima; VI: vía intravenosa; VO: vía oral.
La HT, es decir la reducción de la temperatura de las estructuras cerebrales profundas a 32–34°C, es un tratamiento pleio-trópico, que reduce el consumo metabólico en las neuronas, frena la excitotoxicidad y las vías proapoptóticas, y modera la inflamación y el estrés oxidativo2,3. Tras numerosas evidencias experimentales, dio el salto a la clínica, donde diversos ECA han ido demostrando su eficacia reduciendo la incidencia de muerte y/o las secuelas mayores en neonatos a término o pretérmino tardíos con EHIN moderada-severa2,3. Así, en una reciente revisión sistemática de la Cochrane, se confirma que la HT reduce en un tercio el riesgo de muerte o discapacidad grave en neonatos con EHIN moderada y en un quinto en los casos graves2. Abandonada ya la calificación de «experimental», y considerada el «patrón oro» de tratamiento, su uso se circunscribe por ahora a centros especializados, aunque muchos autores ya claman por su generalización3. Como se ha comentado, sin embargo, existen evidencias que aconsejan prudencia antes de proclamar la universal eficacia de este tratamiento:
- –
Hasta ahora solo se ha podido demostrar la eficacia de la HT fusionando en un único objetivo «muerte y/o discapacidad severa». Analizando estos por separado, no todos los estudios con HT han conseguido su reducción significativa, especialmente en casos graves2,3.
- –
Los resultados de esos estudios indican que aún muchos neonatos con EHIN moderada, y sobre todo con casos graves, no se benefician de la HT2.
- –
No está aún plenamente definidas la temperatura óptima, la duración e incluso la mejor manera de llevarla a cabo. Hay datos que indican que la HT global podría mostrar cierta superioridad en eficacia sobre la HT selectiva2.
- –
Su ventana terapéutica no es muy amplia. De hecho, recientes resultados experimentales en rata indican que la HT tardía (más de 12h) podría ser perjudicial4.
- –
Existen serias dudas sobre su eficacia y aplicabilidad en entornos desfavorecidos en tecnología, recursos humanos e incluso clima, como en el continente africano, donde incluso algunos estudios han mostrado un aumento de la mortalidad con HT5.
Existe una amplia experiencia en el uso de esta glucoproteí-na en neonatos, particularmente pretérmino, en virtud de su efecto estimulante de la eritropoyesis6. En relación con la EHIN, se sabe que la activación de los receptores EpoR, cuya expresión aumenta tras la hipoxia, pone en marcha diversas vías de señalización relacionadas con supervivencia y la proliferación de neuronas y glía (aumentando la síntesis de factores neurotróficos) y modera la expresión de factor nuclear kappa B (NFB), las respuestas proinflamatorias y la excitotoxicidad6. Además, tiene efectos vasoactivos y proangiogénicos. La eritropoyetina (EPO) atraviesa la barrera hematoencefálica (BHE), aunque a dosis 5–10 veces superiores a la utilizada habitualmente para el tratamiento de la anemia7. En modelos animales muestra eficacia incluso administrada 48–72h después de la HI8. Muchos trabajos, aunque no todos6,7, muestran que la EPO a 1–5kU/kg reduce el daño histológico en modelos en roedor de EHIN. Además, ha demostrado normalizar la función neurológica a largo plazo en ratas, aunque en ratones el efecto solo es significativo en hembras7. Por ahora, no se ha demostrado un efecto sinérgico con HT en modelos animales9. Hay 2 ECA publicados en los que los criterios de inclusión de pacientes no son los habituales (p. ej., no se valora EEG integrado en amplitud [aEEG]); en uno se muestra que la administración de EPO 0,5kU/kg no reduce la mortalidad pero sí la discapacidad grave, solo en casos de EHIN moderada y sobre todo en mujeres10, mientras en el otro la EPO 1kU/kg no reduce la mortalidad pero sí la aparición de convulsiones y mejora el desarrollo psicomotor medido mediante el test de Denver a los 6 meses11. Un reciente estudio colaborativo corrobora su seguridad en neonatos bajo HT y considera óptima la dosis de 1kU/kg a repetir 2–6 veces cada 1–2 días8. Podría aumentar el riesgo de retinopatía en uso crónico, pero no en agudo6. Hay más ECA en marcha.
XenónEs un gas noble, inerte, utilizado como anestésico. Es antagonista de receptores NMDA, aunque también parece reducir la liberación de neurotransmisores e inducir la expresión de genes relacionados con neuroprotección12–14. Atraviesa fácilmente la BHE y ha mostrado efectos anticonvulsivantes. Administrado al 50% inmediatamente después de la HI durante 3h a ratas recién nacidas, reduce de forma importante el daño histológico a corto12, aunque no a largo plazo13. En ese mismo modelo, ha demostrado efectos aditivos a la HT, de modo que la administración junto con HT de xenón durante 1h —en vez de 3h—, e iniciando la administración hasta 2h después de la HI, reduce en hasta un 70% el daño histológico cerebral y consigue una recuperación funcional total a largo plazo, con mejores resultados que HT sola13. En cerdos recién nacidos, xenón + HT reduce el daño cerebral tras HI, estudiado por histopatología y por espectroscopia de protones por resonancia magnética (H+-MRS), aunque en este caso xenón + HT no es superior a HT sola14. Existe controversia acerca de si el xenón induce apoptosis cerebral, al igual que otros anestésicos, aunque parece que en corta duración no sería relevante. Su principal problema es su elevado precio, aunque se investigan dispositivos de reinhalación que reducirían mucho el costo. Existen ECA en marcha.
TopiramatoEs un anticonvulsivante de amplia experiencia en niños. Es un inhibidor de los receptores glutamatérgicos AMPA y kainato15, reduciendo así la excitotoxicidad que afecta también a células gliales. En cerdos recién nacidos, el topiramato no es significativamente neuroprotector a 20mg/kg dosis de carga (1h después de la HI) más 10mg/kg durante 3 días; sí lo es a dosis de 50mg/kg carga más 20mg/kg/día durante 3 días, aunque con este régimen se comprueba un aumento de apoptosis en cerebro16. En ratas, topiramato a 20–50mg/kg es neuroprotector cuando se administra inmediatamente tras la HI17,18, pero no a los 15min17 o 2h18; en este modelo, muestra un efecto sinérgico cuando se asocia a HT17. Se ha demostrado la seguridad de topiramato en neonatos a dosis de hasta 5mg/kg, dosis inferior a la teóricamente neuroprotectora15. Es importante conocer que la hipotermia reduce el metabolismo del topiramato prolongando su vida media15. Existen ECA en marcha.
MelatoninaHormona natural, actúa sobre varios receptores intracelulares y al menos 2 de membrana (MT1 y MT2), inhibiendo la apertura de canales de calcio —y, por tanto, la liberación de neurotransmisores como glutamato—, la expresión de sintasa inducible de óxido nítrico y sintasa de óxido nítrico neuronal, la expresión de NFκBy la de varias enzimas proapoptóticas, y estabilizando la función mitocondrial19. Además, es un potente antioxidante, tanto por su estructura como por reducir la producción de radicales libres, reduciendo también así indirectamente la excitotoxicidad19. Finalmente, tiene efectos inmunomoduladores19. Además de reducir el daño, la melatonina estimularía también la reparación, ya que parece aumentar la síntesis de neurotrofinas19. En animales adultos, su efecto se pierde si se administra más de 2h después de la HI20. Puede administrarse por vía oral y parenteral y atraviesa sin problemas la BHE. Existe preocupación por los efectos secundarios neurohormonales de su administración crónica, pero esto no sería problema tras su administración aguda. En ratas recién nacidas, la administración de melatonina 15mg/kg 5min y 24 y 48h después de la HI reduce el daño histológico y normaliza la exploración neurológica a largo plazo21. En cerdos recién nacidos, la melatonina a 5mg/kg/h durante 6h, 10min y 24h después de la HI es bien tolerada, potenciando los efectos neuroprotectores de la hipotermia20. Ya existe un ECA en marcha.
CannabidiolEs el principal componente no psicoactivo de la Cannabis sativa. Es un potente antiinflamatorio y antioxidante, agonista de receptores de serotonina 5HT1A22,23. Por estos y otros mecanismos aún no bien conocidos, el cannabidiol además reduce la liberación de glutamato, la actividad de vías bioquímicas proapoptóticas y la expresión de NFB, sintasa de óxido nítrico y ciclooxigenasa-2, estabiliza la función mitocondrial, es vasodilatador aumentando el flujo sanguíneo intralesional, es inmunomodulador y un potente anticonvulsivante22–24. Es neuro y glioprotector22,23, y podría tener efectos proproliferativos25. Puede administrarse por vía oral e intravenosa y, dada su naturaleza lipídica, atraviesa la BHE sin problemas25. En animales adultos mantiene su efecto neuroprotector administrado hasta 48h después de un episodio isquémico22. En ratas recién nacidas, el cannabidiol a 1mg/kg administrado 15min tras la HI reduce el daño cerebral y normaliza la exploración neuroconductual a largo plazo25. En cerdos recién nacidos, el cannabidiol a esa misma dosis previene el deterioro de la actividad cerebral medida por aEEG, normaliza los biomarcadores de daño cerebral medidos por H+-MRS (incluido el aumento de excitotoxicidad), protege neuronas y astrocitos, y reduce el estrés oxidativo y la liberación de citocinas23. Un elemento importante es que, además de efectos neuroprotectores, el cannabidiol muestra efectos beneficiosos extracerebrales, particularmente respiratorios y cardiocirculatorios23. Está en preparación un ECA.
FinanciaciónInvestigación financiada por FIS-PS09/01900, S2010/BMD-2308 y GWCRI09119.
El autor tiene un convenio de colaboración con GW Pharín a, Ltd.