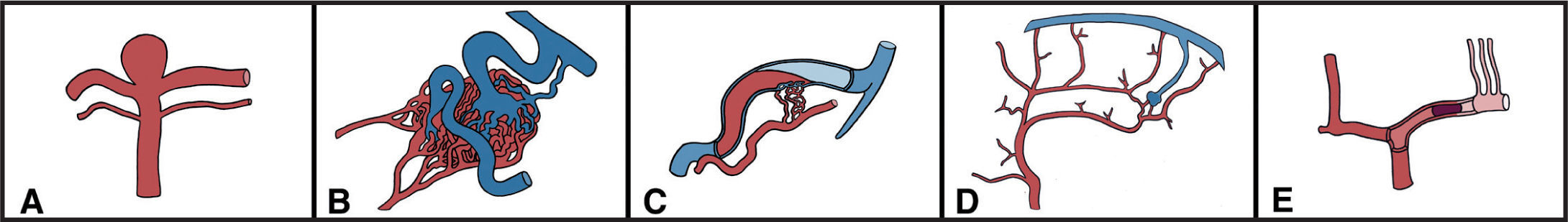
La neurorradiología vascular intervencionista se encarga del diagnóstico y el tratamiento de las enfermedades vasculares que afectan al sistema nervioso mediante técnicas intravasculares y/o percutáneas1 (fig. 1). Es una subespecialidad médica que ha experimentado un crecimiento muy importante en las últimas decadas2 y el constante desarrollo técnico en los materiales y dispositivos empleados ha posibilitado, que en las últimas décadas, sus indicaciones se hayan extendido al campo de la pediatría. En algunas patologías clásicas de la edad pediátrica, como las malformaciones de la vena de Galeno o las fístulas arteriovenosas, el tratamiento intravascular está claramente establecido desde hace años como una opción preferente, y en otras, como los aneurismas cerebrales o los ictus isquémicos, las indicaciones del tratamiento intervencionista cada vez son mayores3.
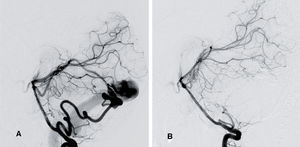
Aneurismas cerebrales (fig. 2)Los aneurismas cerebrales son poco frecuentes en edad pediátrica (0,5-4,6% del total de aneurismas)4, y presentan importantes diferencias respecto a los adultos. Se asocian a enfermedades genéticas que predisponen a defectos en el tejido arterial como la coartación aórtica, la poliquistosis renal, el síndrome de Ehlers-Danlos, la esclerosis tuberosa o el seudoxantoma elasticum, y la incidencia de un antecedente traumático relacionado es mayor que en adultos, llegando hasta un 40% en algunas series5. Los aneurismas fusiformes-disecantes son más frecuentes en que en adultos y la localización más frecuente es la porción terminal de la carótida interna y la cerebral media.
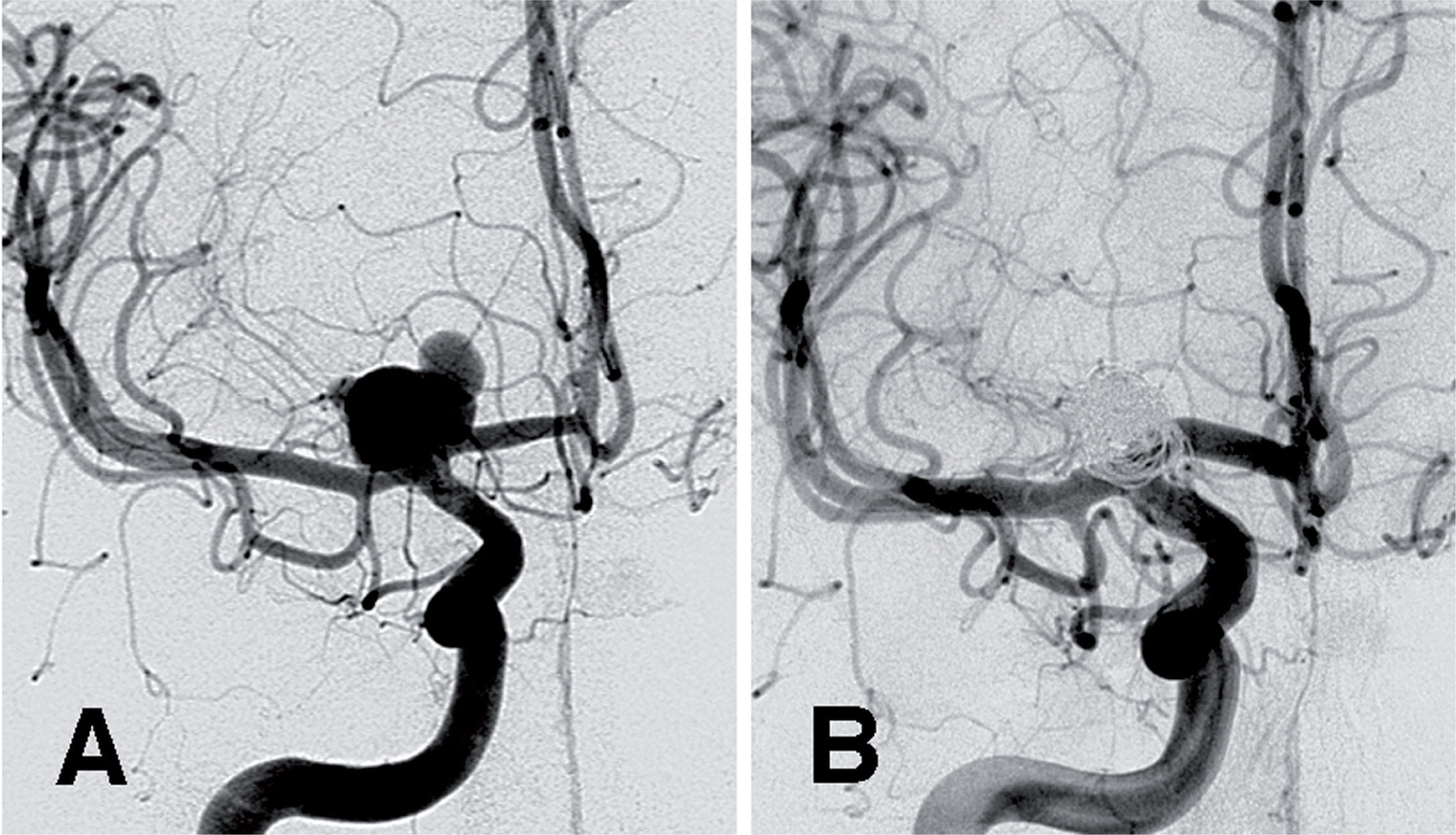
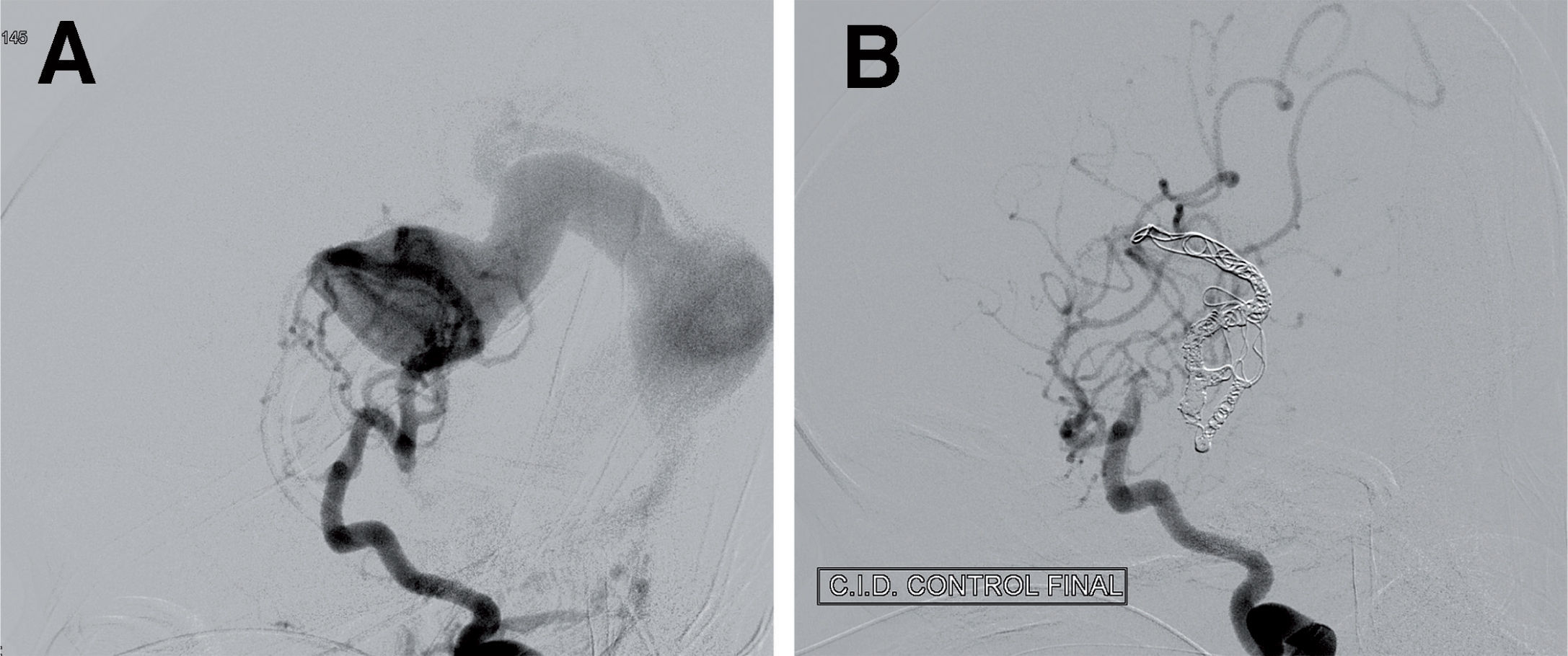
Aneurisma cerebral. Niño de 11 años en estudio por cefalea y con historia de traumatismo previo, al que se detectó un aneurisma sacular de la bifurcación intracraneal de la arteria carótida interna derecha. Angiografía por sustracción digital (ASD) cerebral, visión anteroposterior. A) La inyección selectiva desde la ACI derecha muestra un aneurisma sacular trimamelonado en la bifurcación intracraneal de la arteria carótida interna derecha de cuello favorable para el tratamiento intravascular del aneurisma mediante embolización con coils. B) En el control tras el tratamiento, se observa exclusión completa del aneurisma, y en su lugar se puede apreciar tenuemente una imagen correspondiente a la malla de coils desplegados para rellenar el saco durante la embolización.
La presentación clínica más frecuente es la hemorragia subaracnoidea (cefalea brusca asociada a disminución del nivel de consciencia), aunque también puede producir síntomas compresivos sobre estructuras adyacentes, déficits neurológicos focales o crisis epilépticas6. La presentación de la hemorragia subaracnoidea en niños suele ser más benigna que en adultos, siendo poco frecuente la focalidad neurológica inicial7. La detección incidental de un aneurisma sintomático es muy poco frecuente en niños8.
El diagnóstico de hemorragia subaracnoidea puede realizarse por tomografía axial computarizada simple (TC) en la mayoría de las ocasiones, observándose la presencia de sangre en surcos y cisternas basales, asociada en ocasiones a hematomas parenquimatosos o hemoventrículo. Si la TC es normal y existe una clara sospecha clínica, debe realizarse una punción lumbar, que mostrará la presencia de xantocromía en el líquido cefalorraquídeo.
Una vez confirmada la existencia de sangre subaracnoidea, debe realizarse una angio-TC o angiorresonancia magnética (angio-RM) del polígono de Willis para una valoración inicial de la existencia de aneurismas, aunque la técnica de elección en el diagnóstico y la planificación terapéutica de esta patología sigue siendo la arteriografía convencional, que permite conocer con precisión la localización, la morfología y las medidas del aneurisma, planificando así la mejor opción de tratamiento.
En los últimos años, especialmente desde la aparición del estudio ISAT9, la mayoría de los aneurismas cerebrales se tratan mediante técnicas intravasculares. Básicamente, el tratamiento intravascular de los aneurismas consiste en el acceso al interior del mismo con un microcatéter y el relleno del aneurisma con coils (espiras de platino muy finas). Existen muchos tipos de coils en el mercado, con diferentes tamaños, formas, grados de rigidez, presencia de materiales bioactivos asociados, etc., así como diferentes técnicas de embolización (simple con coils o con ayuda de balones, stents), pero todos están destinados a embolizar el aneurisma, excluyéndolo de la circulación intracraneal y evitando así el sangrado o resangrado. En el paciente pediátrico, diferentes series han comunicado buenos resultados con estas técnicas8,10,11, superponibles a los obtenidos con cirugía abierta10.
Malformaciones arterio-venosas cerebrales (fig. 3)Las malformaciones arterio-venosas (MAV) cerebrales son lesiones vasculares congénitas intracraneales que se localizan en el espacio subpial y consisten en comunicaciones entre arterias y venas cerebrales con una red vascular patológica intermedia. Son por ello sistemas de alto flujo y baja resistencia, proclives al sangrado. Están formadas por: 1) aferencias arteriales, que corresponden a arterias con segmentos irregulares, dilatados y que pueden presentar aneurismas en su trayecto; 2) nidus, formado por vasos displásicos agrupados, en ocasiones también con aneurismas en su interior, y 3) venas de drenaje, que así mismo presentan alteraciones en su pared que favorecen la formación de dilataciones y zonas estenóticas.
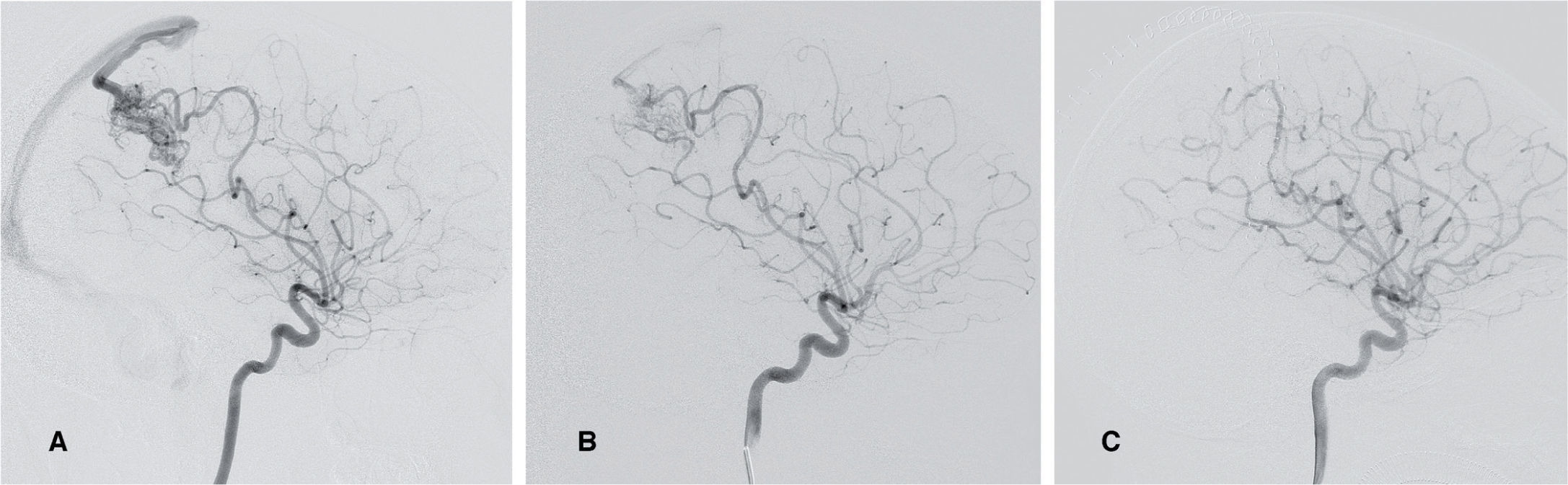
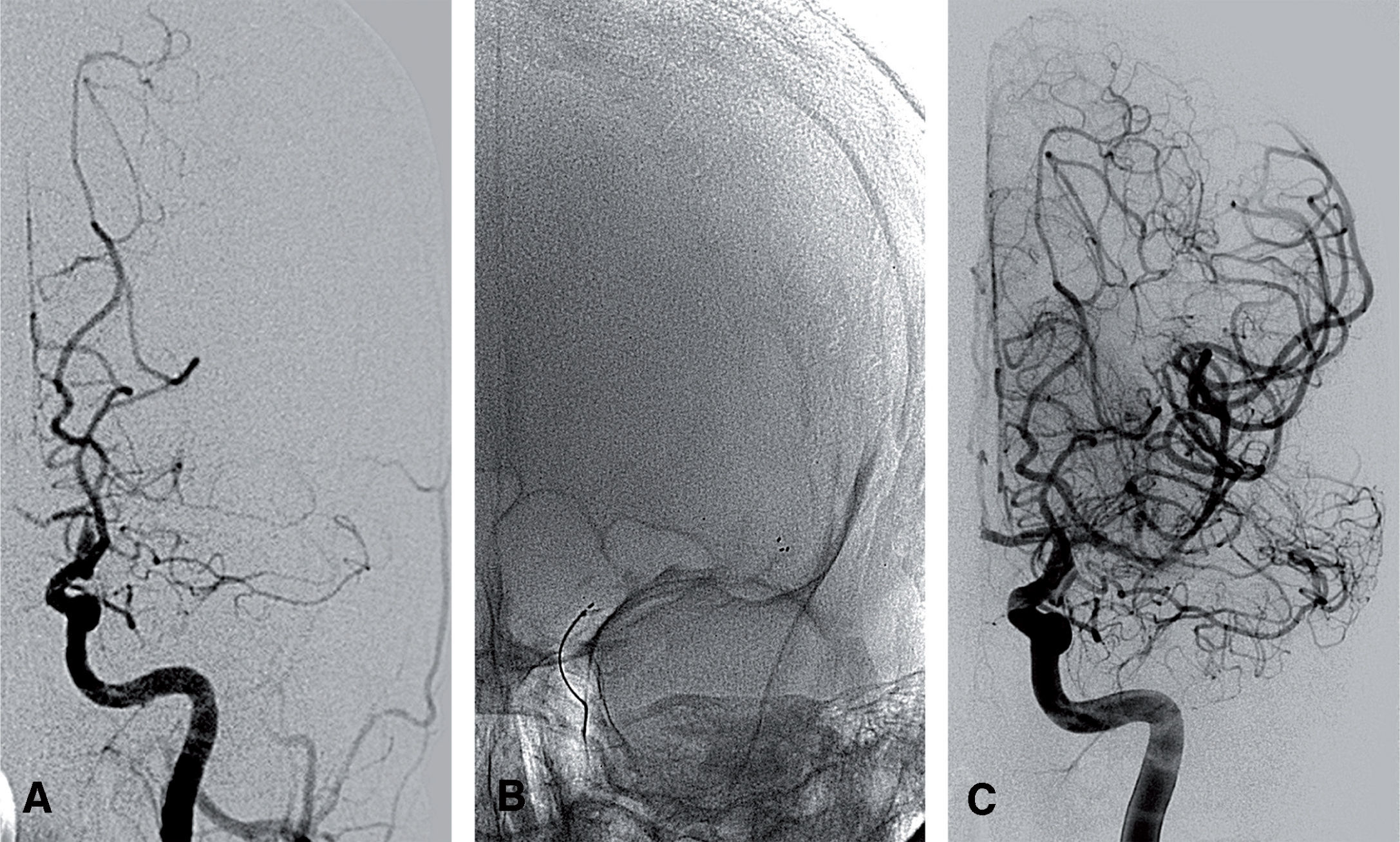
Malformación arteriovenosa. Niña de 3 años que comienza con hemorragia parietal derecha espontánea, secundaria a rotura de una malformación arterio-venosa. ASD cerebral visión lateral. A) La inyección desde la arteria carótida interna derecha muestra una malformación arterio-venosa con un nido de localización parietal, los aportes arteriales que nutren la lesión provienen de ramas de la arteria cerebral media derecha, y tiene un drenaje venoso único rápido al seno longitudinal superior. B) La angiografía de control tras una sesión de embolización prequirúrgica con pegamento muestra llamativa disminución del nido angiomatoso de la malformación y el enlentecimiento significativo del vaciado venoso. C) Control final posquirúrgico en el que se aprecia el cierre completo de la malformación.
Las MAV pediátricas constituyen del 5–20% del total de MAV y se asocian a diferentes afecciones, como el síndrome de Rendu-Osler-Weber (telangiectasia hemorrágica hereditaria12), el Sturge-Weber (angiomatosis encéfalo-trigeminal13) o el Wyburn-Mason (malformación vascular retino-cefálica14). Su prevalencia pediátrica es baja (alrededor del 0,02%) y la presentación clínica más frecuente es la hemorragia cerebral (63–75%), seguida de las crisis epilépticas (13%)15. La detección incidental de una MAV en edad pediátrica es poco frecuente.
El tratamiento de las MAV está indicado siempre que hayan sangrado y puede realizarse mediante cirugía, radiocirugía o técnicas intravasculares. La cirugía se prefiere para lesiones de pequeño tamaño (menores de 3–5cm), accesibles quirúrgicamente y en zonas cerebrales no elocuentes, y el riesgo quirúrgico de la intervención se puede valorar según el tamaño, la localización y el drenaje venoso de la MAV (clasificación de Spetzler-Martin16). Las series más importantes en niños reflejan una morbilidad perioperatoria cercana al 20% con una mortalidad alrededor del 5%15,17. La radiocirugía es especialmente efectiva en las MAV menores de 3cm, consiguiendo tasas de oclusión entre 75–95%18, pero presenta un periodo de latencia de 2 años durante el que persiste el riesgo de hemorragia.
El tratamiento intravascular puede estar destinado a conseguir la oclusión completa de la MAV o a disminuir el tamaño de la misma previamente a la resección quirúrgica. Durante el procedimiento, se accede al interior de la MAV mediante un microcatéter y se procede a la embolización de la MAV o parte de ella con diferentes agentes embólicos (coils, embosferas, copolímero de etilenvinilalcohol-«onyx», cianoacrilatos-«pegamento», etc.). En los últimos años, se han publicado varias series de pacientes pediátricos con MAV tratados con onyx o cianoacrilato, con buenos resultados19,20. El cierre total de las lesiones se consiguió en el 12–21% de los casos y el cierre parcial en el resto, con una reducción media en el volumen de las MAV de un 72–78% y un 7–20% de complicaciones angiográficas, la mayoría de ellas clínicamente silentes19,20.
Fístulas arterio-venosas durales y piales (fig. 4)Las fístulas arterio-venosas (FAV) durales se localizan en el espacio dural/epidural y consisten en una comunicación directa entre arterias y los grandes senos venosos. En la edad pediátrica, constituyen el 10% del total de malformaciones vasculares y se distinguen 3 grupos según la edad de presentación. En las FAV neonatales la comunicación arteriovenosa suele ser única y se establece con un gran seno venoso dilatado y malformado, que drena lentamente hacia el resto de lossenos cerebrales, los síntomas suelen ser secundarios a hipertensión intracraneal (por estasis venosa), y el pronóstico es malo, especialmente si el seno malformado se encuentra en la línea media. En las FAV infantiles las comunicaciones suelen ser múltiples y de alto flujo, cursando como insuficiencia cardiaca inicial y posterior retraso mental. Las FAV tipo adulto (2–18 años) se denominan así porque sus características son similares a las de adultos21,22 y el mayor riesgo es el sangrado.
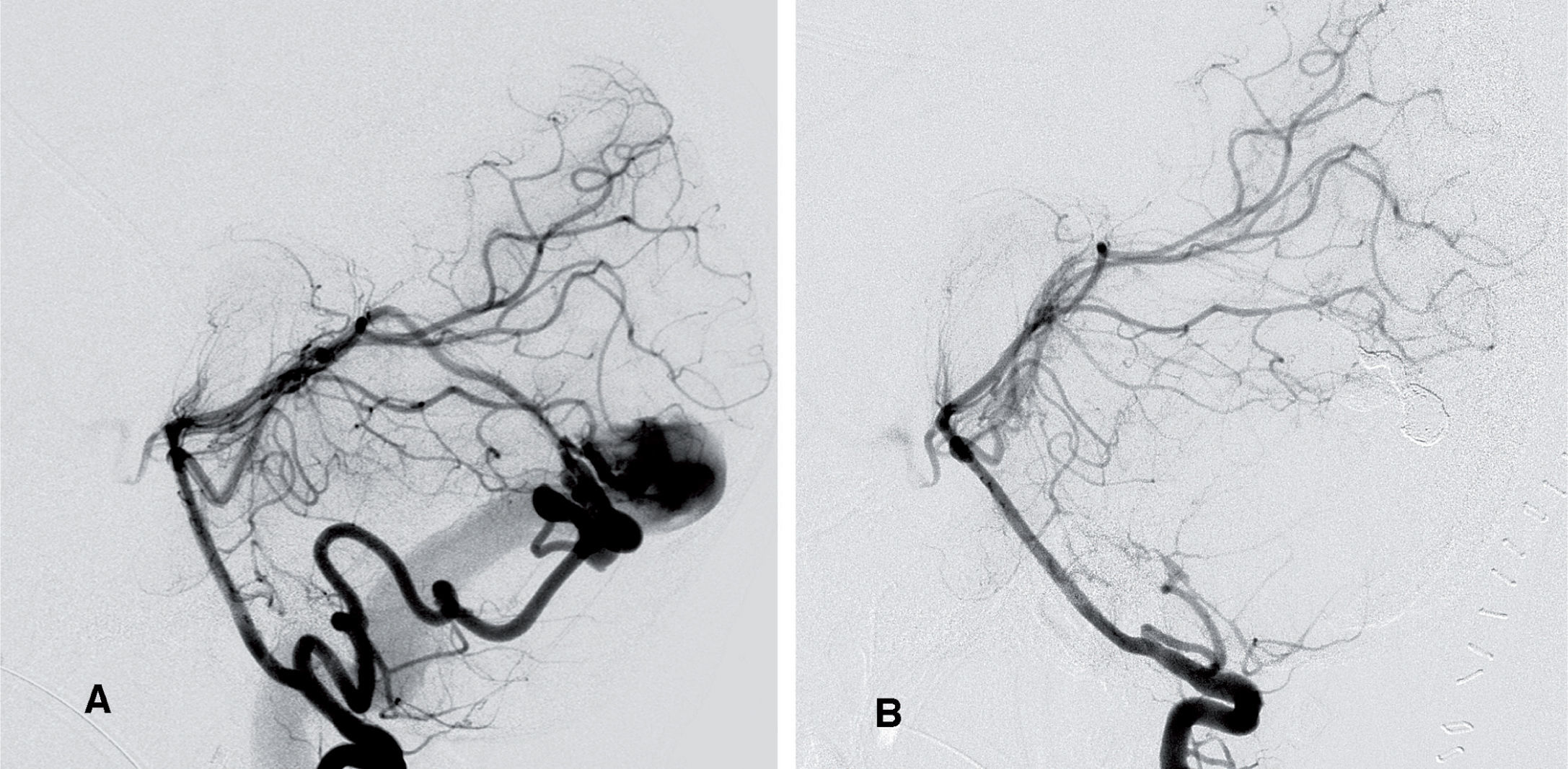
Fístula arteriovenosa pial. Niña de 2 años que comienza con hemorragia cerebelosa espontánea secundaria a rotura de una fístula arterio-venosa pial infratentorial. ASD cerebral, visión lateral. A) La inyección desde la arteria vertebral izquierda muestra una conexión anormal de ramas arteriales provenientes de las arterias cerebelosa superior y cerebelosa postero-inferior izquierdas con una vena supravermiana dilatada que drena muy rápido al seno transverso izquierdo. B) Control final tras el tratamiento de la fístula mediante embolización con coils y pegamento, en el que se aprecia el cierre completo de la lesión. La paciente fue intervenida previamente para evacuar el hematoma cerebeloso.
El tratamiento intravascular puede realizarse vía arterial o venosa, accediendo al pie de la fístula y ocluyéndola con alguno de los materiales embólicos citados previamente. En las pocas series de casos publicadas, las MAV pediátricas tienen un peor pronóstico que en adultos, especialmente en las FAV neonatales, incluso a pesar del tratamiento. En las infantiles, el cierre precoz de la FAV puede evitar el retraso mental en el 50% de los casos. El mejor pronóstico lo tienen las FAV tipo adulto, donde el cierre de las FAV por vía arterial puede conseguirse en la mayoría de los casos sin secuelas21,22.
En ocasiones, las FAV pueden localizarse en el espacio subpial, denominándose entonces fístulas piales. En estos casos, los aportes provienen de ramas distales (piales) de las principales arterias cerebrales y los principios del tratamiento son similares a los descritos previamente.
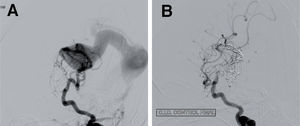
Malformación de la vena de Galeno (fig. 5)La malformación de la vena de Galeno (MVG) es una malformación vascular congénita poco frecuente, pero comprende el 30% de las malformaciones vasculares pediátricas y el 1% de todas las anomalías congénitas pediátricas, siendo causantes de gran morbimortalidad en neonatos, y en menor medida en niños y adolescentes.
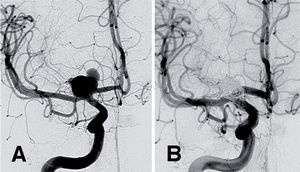
Malformación de la vena de Galeno. Neonato con inicio al nacimiento con fallo cardiaco congestivo e hipertensión pulmonar incontrolables, secundarios a una malformación de la vena de Galeno, siendo necesario un abordaje intravascular precoz de la lesión. ASD, visión oblicua. A) La inyección desde la arteria carótida interna derecha muestra múltiples conexiones arteriales anómalas con una única vena dilatada en la línea media (vena prosencefálica media). B) Control final tras embolización con coils y pegamento en el que se aprecia el cierre de las principales conexiones arteriales anómalas, ausencia de relleno de la vena prosencéfalica media y una redistribución del flujo arterial al resto de ramas arteriales normales dependientes de la arteria carótida interna.
Las MVG se localizan en la fisura coroidea y se caracterizan por múltiples conexiones arterio-venosas que drenan en una vena prosencefálica media dilatada (precursora embriológica de la vena de Galeno). La presentación clínica depende de la edad de comienzo. En neonatos, suele presentarse con insuficiencia cardiaca congestiva e hipertensión pulmonar, llegando incluso en casos más graves al fallo multiorgánico. En niños, es frecuente el comienzo como hidrocefalia, epilepsia o retraso neurocognitivo. En adolescentes y adultos jóvenes, lo habitual es la clínica de cefalea, pudiéndose dar casos de hemorragia intracraneal. Si existe afectación cardiaca fuera del periodo neonatal, esta suele ser leve o moderada, y habitualmente puede ser controlada con tratamiento médico.
El número de casos de MVG diagnosticados con ecografía prenatal o RM fetal es cada vez mayor, aunque hasta ahora lo más habitual es que el diagnóstico se realice durante el periodo neonatal. La RM cerebral confirma el diagnóstico y puede detectar cambios asociados en el parénquima cerebral (infartos, atrofia, o hidrocefalia), siendo junto con la angio-RM (o la angio-TC) las mejores técnicas no invasivas para hacer una evaluación pretratamiento. La angiografía convencional sigue siendo la modalidad de imagen «gold-standard» para evaluar la angioarquitectura de la MVG, aunque al tratarse de una técnica invasiva suele reservarse para el tratamiento y no con fines diagnósticos23.
El tratamiento definitivo de la MVG fue en sus inicios quirúrgico, pero esta modalidad se asociaba a una alta morbilidad y mortalidad. Debido a esto, y al desarrollo y los avances en el ámbito de la imagen y de las técnicas angiográficas, se introdujo el tratamiento intravascular, que mejoró significativamente el pobre pronóstico de estos pacientes. Actualmente, la modalidad intravascular se considera la primera opción de tratamiento definitivo para los pacientes con MVG.
Técnicamente, la embolización de la MVG puede realizarse mediante un abordaje transarterial o transvenoso. La mayoría de los especialistas defienden un abordaje primario transarterial (que técnicamente ofrece un control hemodinámico mayor), reservando el abordaje venoso para los casos en los que la vía transarterial se ha agotado. La ruta de acceso depende de la edad del paciente, siendo preferido el acceso femoral, aunque en casos en los que sea necesario es posible utilizar la arteria umbilical si se requiere el tratamiento en los primeros días de vida. Los agentes embolizantes utilizados preferentemente son el cianoacrilato y el etilen-vinil-alcohol copolímero (onyx) y, en algunas ocasiones, combinados con microcoils.
En la serie más larga de pacientes publicada24, 23 de 216 pacientes con MVG tratados fallecieron (10,6%), 10,4% de los supervivientes presentaron un retraso mental leve, 15,6% un retraso moderado y un 74% quedaron sin secuelas. En los neonatos la mortalidad a pesar del tratamiento fue mucho mayor, llegando hasta un 50%. En el 55% de los pacientes se consiguió un cierre del 90–100% de la MVG, aunque la mayoría de los casos con cierre incompleto se acompañó también de una mejoría clínica significativa.
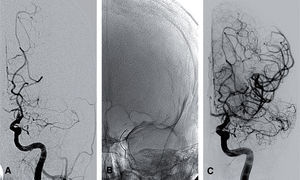
Ictus isquémicos (fig. 6)Los ictus isquémicos son poco frecuentes en la edad pediátrica (2,5–13/100.000 niños), pero ocasionan una gran morbimortalidad, ya que al menos un 50% de los pacientes quedan con graves secuelas neurológicas y/o epilepsia, y entre un 7–28% fallece. Hasta la aparición de la trombólisis intravenosa, el único tratamiento que se aplicaba a estos pacientes durante la fase aguda era la antiagregación y el destinado a manejar las posibles complicaciones (infecciones, aspiración, etc.), pero desde la aparición de esta terapéutica diferentes artículos han comunicado casos de ictus en niños de entre 8–16 años tratados de forma eficaz con activador tisular del plasminógeno en las 3 primeras horas desde el inicio de los síntomas25.
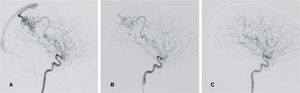
Ictus isquémico. Niño de 13 años con cuadro progresivo de disfasia y hemiparesia derecha, y cefalea pulsátil izquierda de 3 días de evolución, diagnosticado de infarto isquémico profundo de ACM izquierda, que inicialmente mejoró durante el ingreso y que posteriormente presenta empeoramiento clínico, con afasia fluente y paresia braquial derecha. ASD en proyección AP. A) La inyección desde la arteria carótida común izquierda confirma una oclusión de la arteria carótida interna intracraneal. B) Imagen tomada durante el procedimiento que muestra el dispositivo de extracción mecánica (stent-retriever) abierto en el interior de las arterias carótida interna y cerebral media izquierdas. C) Imagen de control final en la que se observa apertura y recuperación del calibre vascular de la arteria carótida interna intracraneal, cerebral media y todas sus ramas distales.
Así mismo, el gran desarrollo de los procedimientos intravasculares durante la última década ha permitido la utilización del tratamiento intraarterial en casos de ictus en niños, bien mediante administración directa de trombolíticos en el trombo (trombólisis intraarterial química), o bien mediante diferentes dispositivos mecánicos (trombectomía mecánica). En este sentido, la trombectomía mecánica es especialmente interesante, ya que los nuevos dispositivos que han aparecido en los últimos años permiten tasas de recanalización muy superiores a las obtenidas con fármacos y se asocian a un menor riesgo de complicaciones. En cualquier caso, y dada la escasa evidencia disponible en la literatura médica, la utilización de terapias trombolíticas en niños debe considerarse experimental en la actualidad, y debe restringirse a los centros en los que existe un equipo de neuropediatras con experiencia en patología vascular y neurointervencionistas con experiencia en el tratamiento intravascular del ictus26.