En la última década hemos sido testigos de la transformación del tratamiento de pacientes con vasculopatías. A medida que los cirujanos vasculares han adquirido habilidades cada vez más avanzadas basadas en la manipulación de catéteres, al igual que un mayor abordaje a dispositivos más sofisticados, ha tenido lugar una rápida transición hacia las técnicas mínimamente invasivas. Los pacientes que no son candidatos a una revascularización percutánea, o los considerados en riesgo prohibitivo para la corrección quirúrgica tradicional, pueden beneficiarse de un tratamiento híbrido, una combinación de cirugía abierta y endovascular con una disminución de la morbilidad y la mortalidad. En la presente revisión se examinan las aplicaciones de los procedimientos híbridos para tratar a pacientes con claudicación invalidante e isquemia crítica de la extremidad, patología del cayado aórtico, aneurismas toracoabdominales, estenosis de la carótida extracraneal y coronariopatía.
En la última década hemos sido testigos de una transformación del tratamiento de los pacientes con patología vascular. A medida que los cirujanos vasculares han adquirido habilidades cada vez más avanzadas basadas en la manipulación de catéteres, al igual que un mayor abordaje a dispositivos más sofisticados, ha tenido lugar una rápida transición hacia las técnicas mínimamente invasivas. No obstante, un número sustancial de pacientes no son candidatos a una revascularización endovascular percutánea debido a una anatomía compleja o a una localización subóptima de la lesión. El tratamiento híbrido, una combinación de cirugía abierta y endovascular, permite reducir el riesgo en aquellos pacientes cuyas comorbilidades, de otro modo, les impedirían someterse a un tratamiento quirúrgico abierto convencional.
En la presente revisión se examinan las aplicaciones de los procedimientos híbridos para tratar a pacientes con claudicación discapacitante e isquemia crítica de la extremidad, patología del cayado aórtico, aneurismas toracoabdominales, estenosis de la carótida extracraneal y coronariopatía.
Claudicación incapacitante e isquemia crítica de la extremidadDefinida clínicamente como isquemia de la extremidad con dolor en reposo de más de 2 semanas de evolución, úlceras o pérdida de tejido atribuida a vasculopatía oclusiva arterial, la isquemia crítica de la extremidad (ICE) afecta a alrededor de 500-1.000 nuevos pacientes/millón de individuos al año. Las mayores tasas se observan entre los individuos de edad avanzada, fumadores y diabéticos. Su coste, influencia negativa en la calidad de vida y mal pronóstico por lo que respecta al salvamento de la extremidad y supervivencia la han convertido en un problema sumamente importante1.
La revascularización para restablecer el flujo en el arco plantar representa el tratamiento de elección para lograr la resolución del dolor isquémico o la curación de las lesiones1. La revascularización quirúrgica está justificada para pacientes con lesiones complejas no subsidiarias de una intervención endovascular y para pacientes más jóvenes cuya esperanza de vida es mayor o que requieren una revascularización con garantías de permeabilidad a largo plazo. La estenosis aortoilíaca puede tratarse con un bypass anatómico o extraanatómico (p. ej. aortobifemoral, axilobifemoral o femorofemoral). Las tasas de permeabilidad primaria del bypass aortobifemoral y femorofemoral a los 5 años son del 93% y 70%, respectivamente. Las tasas de mortalidad perioperatoria son de alrededor del 3,5%1. El bypass para la arteriopatía oclusiva infrainguinal se asocia con tasas de salvamento de la extremidad>80%, y tasas de mortalidad del 0,97 al 2,0%2-4.
En la última década, la angioplastia ha suplantado a la cirugía como tratamiento de primera línea para muchos pacientes con ICE5-10. La revascularización endovascular es atractiva porque es una técnica mínimamente cruenta y se asocia con una morbilidad y mortalidad reducida, una disminución de los costes hospitalarios y una disminución de la duración de la hospitalización11. A pesar de la permeabilidad superior de la revascularización quirúrgica comparada con la angioplastia y la implantación de un stent12, desde 1996 a 2000, la utilización de estos últimos procedimientos en la arteria ilíaca ha aumentado un 850% mientras que la práctica de bypass aortobifemorales13 ha disminuido un 15%.
Un número cada vez mayor de pacientes con isquemia que amenaza la extremidad se somete a una combinación de cirugía endovascular y abierta para obtener una revascularización completa con un procedimiento quirúrgico menos extenso, una duración más breve de la intervención y una disminución del riesgo de complicaciones perioperatorias7,14,15.
La parte endovascular y abierta del procedimiento puede efectuarse simultáneamente o de forma secuencial. Antes del advenimiento de las salas quirúrgicas endovasculares modernas, que tienen la capacidad de un quirófano tradicional y fluoroscopia de alta calidad, con frecuencia, los procedimientos se efectuaban de forma secuencial porque las técnicas de imagen en la sala de radiología eran superiores a las obtenidas en el quirófano mediante una unidad radiológica portátil de brazo en C. En la actualidad, numerosos quirófanos están equipados con sistemas de fluoroscopia digital de última generación que incluyen intensificadores de amplias imágenes al igual que programas informáticos para un cartografiado y un análisis cuantitativo.
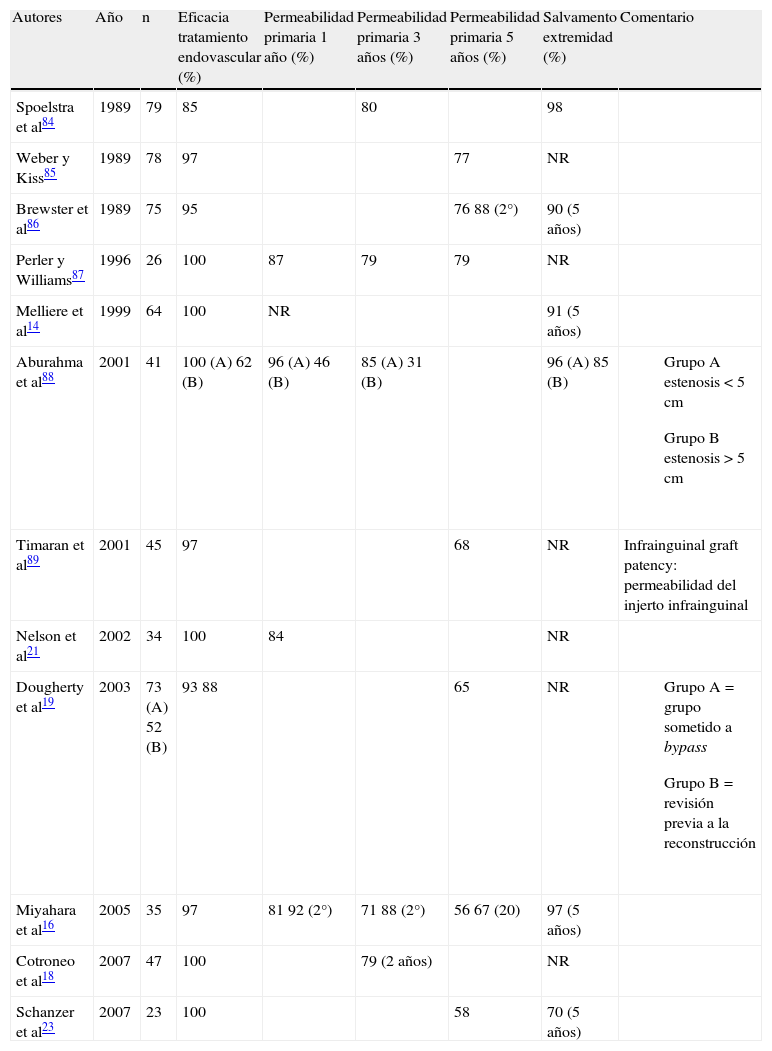
En un procedimiento híbrido, la parte endovascular puede consistir en flujo aferente16-18, flujo eferente18, una combinación de ambos19 o una revisión de un injerto de bypass20. La revascularización híbrida se asocia con tasas elevadas de resultado técnico, permeabilidad, y salvamento de la extremidad (tabla I).
Resultados de los procedimientos híbridos de revascularización de la extremidad inferior
| Autores | Año | n | Eficacia tratamiento endovascular (%) | Permeabilidad primaria 1 año (%) | Permeabilidad primaria 3 años (%) | Permeabilidad primaria 5 años (%) | Salvamento extremidad (%) | Comentario |
| Spoelstra et al84 | 1989 | 79 | 85 | 80 | 98 | |||
| Weber y Kiss85 | 1989 | 78 | 97 | 77 | NR | |||
| Brewster et al86 | 1989 | 75 | 95 | 76 88 (2°) | 90 (5 años) | |||
| Perler y Williams87 | 1996 | 26 | 100 | 87 | 79 | 79 | NR | |
| Melliere et al14 | 1999 | 64 | 100 | NR | 91 (5 años) | |||
| Aburahma et al88 | 2001 | 41 | 100 (A) 62 (B) | 96 (A) 46 (B) | 85 (A) 31 (B) | 96 (A) 85 (B) |
| |
| Timaran et al89 | 2001 | 45 | 97 | 68 | NR | Infrainguinal graft patency: permeabilidad del injerto infrainguinal | ||
| Nelson et al21 | 2002 | 34 | 100 | 84 | NR | |||
| Dougherty et al19 | 2003 | 73 (A) 52 (B) | 93 88 | 65 | NR |
| ||
| Miyahara et al16 | 2005 | 35 | 97 | 81 92 (2°) | 71 88 (2°) | 56 67 (20) | 97 (5 años) | |
| Cotroneo et al18 | 2007 | 47 | 100 | 79 (2 años) | NR | |||
| Schanzer et al23 | 2007 | 23 | 100 | 58 | 70 (5 años) |
1°: permeabilidad primaria; 2°: permeabilidad secundaria; NR: no referido.
El uso de un procedimiento endovascular de flujo aferente, con independencia de que sea en el sector aortoilíaco16,21-23 o en la arteria femoral superficial AFS17, confiere una mayor permeabilidad tardía de la revascularización mediante bypass. En una de las series a mayor escala efectuada hasta la fecha, 125 pacientes se sometieron a un tratamiento híbrido para la reconstrucción arterial de novo o una revisión del injerto de bypass19. En conjunto, la mortalidad perioperatoria fue<1% y la morbilidad fue del 15,4%. La permeabilidad primaria fue del 39,6%, la permeabilidad primaria asistida del 65,1% y la permeabilidad secundaria del 73,5% durante un seguimiento medio de 27,6 meses. Con un tratamiento híbrido, otros investigadores han descrito excelentes tasas de salvamento de la extremidad14,16,18.
La vena safena interna homolateral sigue siendo el conducto de elección para el bypass infrainguinal. No obstante, con una frecuencia cada vez mayor, en pacientes que requieren bypass distal no se dispone de vena suficiente o es inadecuada debido a un stripping venoso previo o al empleo para un injerto de bypass coronario o periférico. Puede usarse un conducto venoso alternativo, incluida la vena safena externa, vena basílica, cefálica o injertos combinados que incluyen vena autóloga o segmentos de material protésico unido a la vena, con tasas de permeabilidad aceptables24-27 pero con frecuencia no proporcionan una extensión suficiente para los bypass que requieren un origen en la arteria femoral común o profunda. El bypass protésico infragenicular y los injertos combinados autólogos proporcionan resultados inferiores16,27.
El tratamiento endovascular de las lesiones de flujo aferente disminuye la extensión de vena necesaria para completar la revascularización sin alterar el resultado a largo plazo. En una serie efectuada en pacientes diabéticos con gangrena de la extremidad inferior, las tasas de permeabilidad primaria y secundaria a los 2 años de seguimiento fueron similares para aquellos con injertos de bypass largos que se originaban a partir de la ingle, injertos de bypass cortos originados a partir de la arteria poplítea y angioplastia de la arteria femoral superficial combinada con injerto de bypass poplíteo17. El tratamiento endovascular de la AFS puede realizarse por vía percutánea mediante técnica cruzada a partir de la arteria femoral común contralateral a través de un abordaje sobre la arteria femoral común homolateral o retrógrada a través de la arteria poplítea.
Cirugía para el flujo aferenteLa arteria femoral común puede corregirse usando un injerto de interposición o una endarterectomía y angioplastia con parche21,22,28. En ocasiones también es más fácil realizar una endarterectomía femoral y, más tarde, efectuar la punción a través de la angioplastia con parche para proceder a la angioplastia ilíaca, AFS, y/o tibial. En una serie publicada por Kang et al29 se trataron con endarterectomía femoral 65 extremidades de 58 pacientes. Se efectuaron como procedimientos híbridos 37 casos (57%), en los que se procedió a tratamiento endovascular concomitante, incluida una intervención tanto ilíaca como de la AFS. Se obtuvo una eficacia hemodinámica en el 95% de los casos, y no se produjo mortalidad perioperatoria. Las tasas de permeabilidad primaria a 1 y 5 años fueron del 93% y del 91% respectivamente; la permeabilidad primaria asistida fue del 100% en ambos puntos de tiempo.
Los progresos en la habilidades del cirujano vascular y las mejoras del instrumental, como los dispositivos de reentrada, han aumentado el porcentaje de pacientes con ICE cuya anatomía es apropiada para el tratamiento endovascular desde<50% hasta el 84%5,7,9. Por ejemplo, la angioplastia subintimal ha emergido como un método eficaz para la recanalización de las oclusiones de segmentos largos y se asocia con tasas de salvamento de la extremidad comparables a las logradas con el bypass30. Las tasas de resultado técnico son altas pero, con frecuencia, los pacientes requieren la implantación de un stent, que, en las arterias infrainguinales, se ha asociado a un fracaso precoz del tratamiento30,31. Una de las principales limitaciones de la angioplastia subintimal es el fracaso de la reentrada en la luz verdadera tras el cruzado subintimal de la oclusión32. Los dispositivos de reentrada, como el catéter Pioneer (Volcano Therapeutics, Rancho Cordova, California) mejoran la capacidad del cirujano vascular para reentrar en la luz verdadera32. Es esencial una supervisión postoperatoria con eco-Doppler para mantener la permeabilidad a largo plazo de las reconstrucciones arteriales híbridas.
Aneurismas del arco aórticoEl tratamiento quirúrgico tradicional de los aneurismas y la disección del arco aórtico requiere paro circulatorio hipotérmico, circulación extracorpórea y perfusión cerebral selectiva. Incluso en hospitales con grandes volúmenes de pacientes, el tratamiento abierto se asocia con insuficiencia renal en el 0-17%, paraplejía en el 2-16%, y una mortalidad a los 30 días del 5-19%33. Las reintervenciones del arco aórtico, en particular para indicaciones urgentes, se asocian con tasas incluso más altas de morbilidad y mortalidad34.
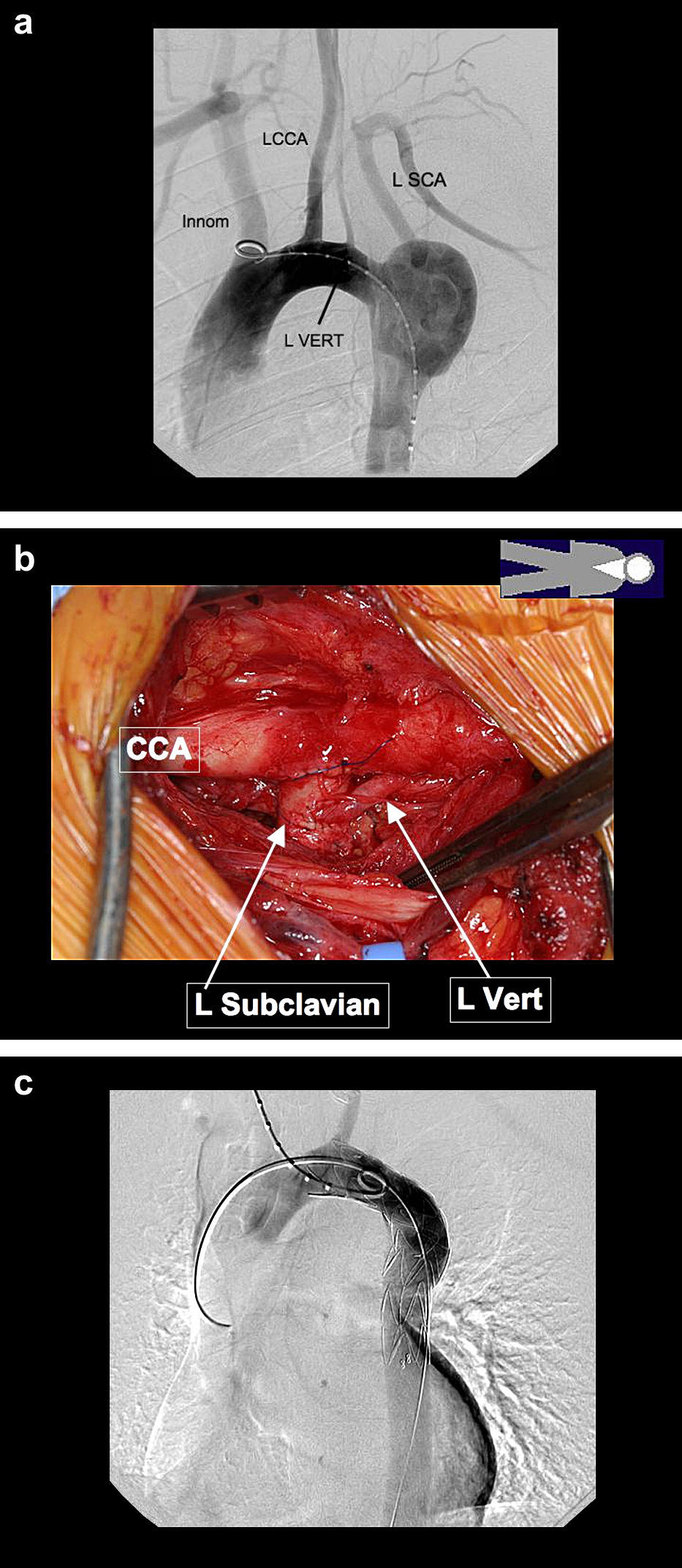
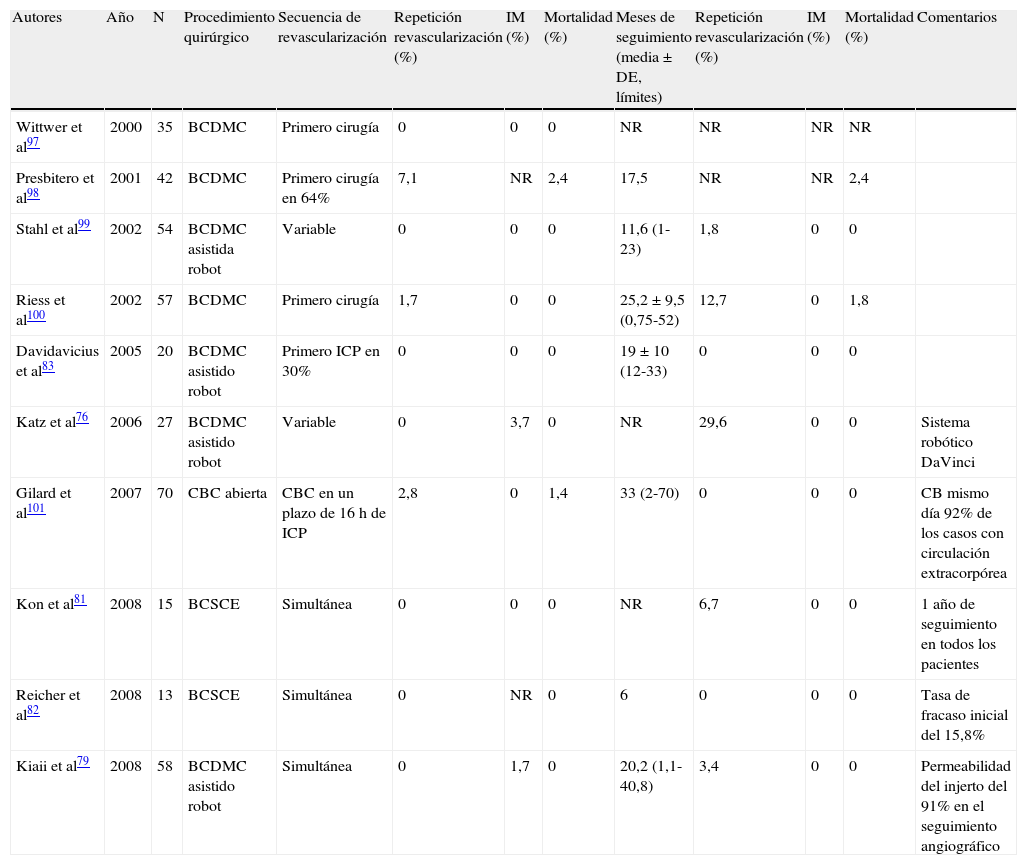
La introducción de stents endovasculares ha permitido que los pacientes considerados en riesgo alto para el tratamiento abierto tradicional se sometan a técnicas menos cruentas. El tratamiento híbrido de la patología del arco aórtico requiere una desramificación (debranching) y la reimplantación de los vasos supraaórticos para aumentar la extensión de la zona de anclaje proximal y conseguir un sellado adecuado. La transposición quirúrgica puede ser extraanatómica o intratorácica. Durante los procedimientos intratorácicos, es posible realizar una técnica de banding del segmento distal de la aorta para mejorar la fijación de la endoprótesis35. En la mayoría de los pacientes, si se cubre la arteria subclavia izquierda no se produce claudicación del brazo o la mano. Sin embargo, el bypass carótida izquierda a subclavia puede reducir el riesgo de paraplejía al proteger el riego sanguíneo colateral de la médula espinal36,37. Para pacientes en los que no se ha obtenido arteria mamaria interna izquierda como injerto, o que poseen una arteria vertebral izquierda dominante, también debe efectuarse un bypass carótida izquierda a subclavia (fig. 1).
a Pseudoaneurisma de la aorta torácica descendente proximal 20 años después de angioplastia con parche de una coartación aórtica. La arteria subclavia izquierda se origina del aneurisma. La arteria vertebral izquierda se origina como rama separada del arco aórtico. b El debranching del arco facilita el tratamiento endovascular del aneurisma. Se efectúa la transposición de la arteria subclavia izquierda en la arteria carótida común izquierda y la arteria vertebral izquierda se anastomosa a la subclavia izquierda transpuesta. c Después del tratamiento endovascular. En el seguimiento a los 4 años, el aneurisma se había resuelto por completo y los vasos transpuestos seguían permeables. CCA: arteria carótida común; Innom: tronco innominado; L SCA/L Subclavian: arteria subclavia izquierda; L VERT/L Vert: arterial vertebral izquierda.
Las endoprótesis pueden implantarse a través de un abordaje a través de la arteria femoral común o, para pacientes con arteria ilíaca externa de pequeño calibre (diámetro<6mm), un conducto ilíaco. Nunca se insistirá lo suficiente en la utilidad de los conductos ilíacos en pacientes con anatomía ilíaca desfavorable. En una serie de 312 pacientes sometidos a tratamiento endovascular de un aneurisma aórtico, 22 requirieron la implantación de un conducto que consistió en un injerto de Dacrón de 8 o 10mm anastomosado con la arteria ilíaca común38. De modo no sorprendente, el tiempo operatorio, pérdida hemática, tiempo en la unidad de cuidados intensivos y duración de la estancia hospitalaria fueron mayores en el grupo que requirió el conducto, en particular cuando el procedimiento no se programó. Las complicaciones cardíacas, renales y pulmonares fueron similares cuando se compararon con pacientes que no requirieron conducto. Las generaciones más recientes de stents torácicos son más flexibles, pueden colocarse con más facilidad a través de arterias ilíacas tortuosas y se adaptan mejor a los arcos aórticos muy angulados. Puede utilizarse adenosina para enlentecer o detener transitoriamente el corazón con el objetivo de facilitar la colocación y expansión precisa del stent.
La manipulación del arco aórtico durante la implantación del stent puede provocar un ictus. En el estudio principal sobre eficacia clínica de la endoprótesis TAG (Gore, Flagstaff, AZ, EE. UU.), se describió ictus como complicación en el 4% de los pacientes39. Cuatro de los cinco pacientes que experimentaron ictus se sometieron a un bypass carotídeo-subclavio debido a enfermedad aneurismática proximal. De los 28 pacientes que se sometieron a bypass carotídeo-subclavio, el 14% experimentaron ictus comparado con el 1% que no requirió debranching aórtico (p<0,001). Es de destacar que tres de los cinco ictus afectaron a la distribución de la arteria cerebral tanto anterior como posterior, un hallazgo que sugiere que en estos pacientes la etiología del proceso fue una embolia ateromatosa.
El grupo de Heidelberg adoptó los criterios siguientes para efectuar reconstrucciones híbridas del arco aórtico: edad>70 años, pacientes en riesgo con contraindicación de cirugía abierta, casos urgentes y reoperaciones, aorta ascendente sana con un diámetro suficiente para servir de lugar donante de la reimplantación de un vaso de gran calibre40. Antes del procedimiento, se efectuó una técnica de diagnóstico por la imagen, con angiografía por tomografía axial computarizada con reconstrucción multiplanar. En los 25 pacientes sometidos a tratamiento híbrido del arco aórtico la mortalidad perioperatoria fue del 25%. La causa de la muerte incluyó perforación del stent, ictus embólico e insuficiencia cardíaca40. En la tabla II se resumen los resultados de las reconstrucciones híbridas del arco aórtico. El resultado técnico global es del 86-100%, con tasas de ictus a los 30 días de hasta el 20% y una mortalidad del 0-13%.
Resultados de los procedimientos híbridos del arco aórtico
| Autores | Año | n | Eficacia técnica (%) | Endofuga de tipo I o II (%) | Paraplejía o AVC (%) | Mortalidad a 30 días | Comentario |
| Schumacher et al90 | 2003 | 8 | 100 | 0 | 0 | 12,5 | |
| Bergeron et al44 | 2005 | 29 | 96,3 | 0 | 7,7 | 7,7 | |
| Greenberg et al51 | 2005 | 22 | 100 | 4,5 | 13,6 | 0 | Trompa de elefante |
| Zhou et al46 | 2006 | 16 | 100 | NR | 0 | 6,2 | |
| Caronno et al91 | 2006 | 10 | 100 | 0 | 20 | 10 | Dos endofugas tardías |
| Saleh e Inglese35 | 2006 | 15 | 100 | 0 | 0 | 0 | |
| Szeto et al43 | 2007 | 8 | 100 | 0 | 25 | 12,5 | Dos ictus perioperatorios resueltos al alta |
| Melissano et al45 | 2007 | 64 | 85,9 | 12,5 | 6,2 | 6,3 | 9/10 endofugas resueltas espontáneamente |
| Baraki et al49 | 2007 | 39 | 100 | NR | 12,8 | 12,8 | Trompa de elefante |
| Chan et al92 | 2008 | 16 | 100 | 0 | 18,7 | 0 |
AVC: accidente vascular cerebral; NR: no referido.
La relación entre el anclaje proximal de la endoprótesis y los vasos supraaórticos se correlaciona con la eficacia del tratamiento y el resultado del paciente. Ishimaru et al41 propusieron un sistema de clasificación de las zonas de anclaje proximal: zona 0, proximal a todas las ramas del cayado aórtico; zona 1, proximal a la arteria carótida común izquierda y la arteria subclavia izquierda; zona 2, proximal a la arteria subclavia izquierda, y zona 4, distal a la arteria subclavia izquierda. Las tasas de endofugas son más altas cuando la endoprótesis se coloca proximal a la arteria subclavia izquierda42. En una serie que examinó los resultados de 37 pacientes tratados con un dispositivo Talent (Medtronic, Mineápolis, MN), la tasa de endofugas fue del 100% (3/3 pacientes) cuando el injerto se colocó proximal a la arteria carótida común izquierda y de un 0-11% cuando el injerto se colocó distal a esta arteria42. En comparación, otros investigadores han tratado satisfactoriamente los aneurismas y disecciones que afectan a la zona 043-46.
El tratamiento adicional de los aneurismas que afectan a la aorta ascendente, al arco aórtico y a la aorta torácica descendente incluye la reposición abierta de la aorta ascendente y el arco con una extensión “en trompa de elefante” del injerto del arco en la aorta descendente. La trompa de elefante se extiende hasta el nivel deseado en una segunda intervención efectuada a través de una toracotomía lateral. La mortalidad para el primer estadio es del orden del 10%, y para el segundo, del 7%47,48. Algunos pacientes fallecerán de rotura del aneurisma mientras esperan el segundo procedimiento47. La reconstrucción híbrida permite que todo el procedimiento se complete en un solo tiempo49 o escalonados con un tratamiento abierto del arco aórtico seguido de la implantación endovascular de un stent de la aorta torácica descendente50. Greenberg et al51 describen su experiencia en 22 pacientes que requirieron una técnica de “trompa de elefante” junto con tratamiento endovascular. Se obtuvo un resultado técnico del 100%; las tasas de mortalidad a 1, 12 y 24 meses fueron del 4,5%, 15,8% y 15,8%, respectivamente.
Tratamiento de los aneurismas aórticos toracoabdominalesEl tratamiento abierto de los aneurismas toracoabdominales (AATA) se asocia con isquemia de la médula espinal (18%), insuficiencia renal (18%), necesidad de diálisis (9%) y una tasa de mortalidad a los 30 días del 8%52. Después del tratamiento abierto de estos aneurismas son habituales resultados funcionales insatisfactorios; al año de seguimiento, el 47,6% de los pacientes habían fallecido, habían sido dados de alta a un centro de asistencia crónica y no deambulaban53. Se ha propuesto un tratamiento abierto y endovascular combinado como alternativa a la cirugía abierta convencional. Quinones-Baldrich et al54 describieron por primera vez la corrección híbrida de un AATA, efectuada en un paciente de 62 años de edad con un aneurisma de tipo IV y grandes aneurismas en el origen de cada vaso visceral, sometido en dos ocasiones a tratamiento para rotura de aneurisma aórtico abdominal. Los autores efectuaron un bypass extraanatómico abierto de las arterias renales, arteria mesentérica superior, y arteria celíaca, seguido de tratamiento endovascular con implantación de injerto stent de la aorta. En el seguimiento a los 6 meses, todos los injertos estaban permeables y sin indicios de endofuga54.
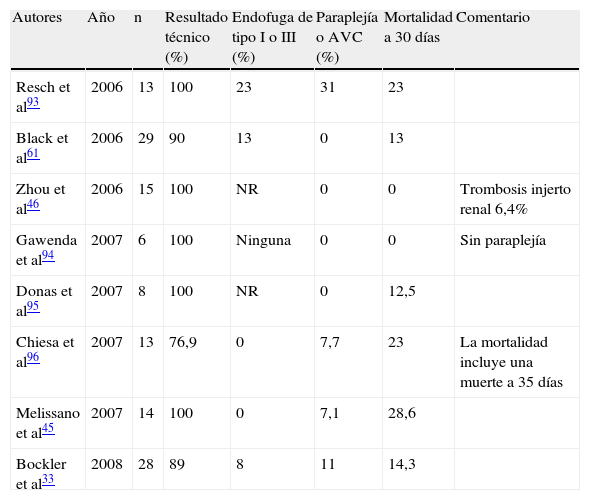
En la tabla III se presentan los resultados de las series descritas de tratamiento híbrido visceral de los AATA.
Resultados de los procedimientos toracoabdominales híbridos
| Autores | Año | n | Resultado técnico (%) | Endofuga de tipo I o III (%) | Paraplejía o AVC (%) | Mortalidad a 30 días | Comentario |
| Resch et al93 | 2006 | 13 | 100 | 23 | 31 | 23 | |
| Black et al61 | 2006 | 29 | 90 | 13 | 0 | 13 | |
| Zhou et al46 | 2006 | 15 | 100 | NR | 0 | 0 | Trombosis injerto renal 6,4% |
| Gawenda et al94 | 2007 | 6 | 100 | Ninguna | 0 | 0 | Sin paraplejía |
| Donas et al95 | 2007 | 8 | 100 | NR | 0 | 12,5 | |
| Chiesa et al96 | 2007 | 13 | 76,9 | 0 | 7,7 | 23 | La mortalidad incluye una muerte a 35 días |
| Melissano et al45 | 2007 | 14 | 100 | 0 | 7,1 | 28,6 | |
| Bockler et al33 | 2008 | 28 | 89 | 8 | 11 | 14,3 |
AVC: accidente vascular cerebral; NR: no referido.
La creación de una zona de anclaje distal adecuada para el tratamiento híbrido de los AATA requiere bypass de la arteria mesentérica y/o renales. Los bypass pueden originarse de la aorta supracelíaca, aorta infrarrenal, arteria ilíaca común o ilíaca externa. Una vez se ha restaurado la perfusión, se efectúa ligadura de las arterias viscerales proximalmente para reducir la posibilidad de una endofuga de tipo II. Como alternativa a la cirugía abierta, también puede practicarse un debranching laparoscópico asistido o laparoscópico total55. El empleo de injertos de Dacrón a medida proporciona flujo aferente a través de una sola anastomosis, lo que simplifica el debranching y permite completar la reconstrucción toracoabdominal en un solo procedimiento56 (fig. 2).
Para las reconstrucciones de los AATA, los factores pronóstico de paraplejía y parálisis incluyen el tiempo de clampaje aórtico total, la extensión de aorta reparada, la edad del paciente, rotura aórtica y antecedentes de disfunción renal52. El uso de una endoprótesis para excluir el AATA obvia la necesidad de clampaje aórtico pero sigue entrañando un riesgo de isquemia de la médula espinal porque el injerto puede ocluir colaterales decisivas de esta estructura57. El riego sanguíneo de la médula espinal deriva de las arterias del canal raquídeo, arterias intercostales y la arteria subclavia e hipogástrica37,58. Los pacientes en riesgo elevado de paraplejía, aquellos sometidos a tratamiento previo de un aneurisma o que requieren cobertura de un extenso segmento aórtico pueden beneficiarse de una monitorización de los potenciales evocados somatosensoriales, aumento de la presión arterial y drenaje del líquido cefalorraquídeo59. La reimplantación sistemática de las arterias segmentarias no reduce la incidencia de isquemia de la médula espinal60.
Aunque es mucho menos cruenta que la cirugía abierta convencional, una técnica híbrida para el AATA se asocia con una morbilidad y mortalidad sustancial. En una serie, las complicaciones mayores incluyeron necesidad de soporte respiratorio prolongado (34,6%), soporte inotrópico prolongado (15,4%), deterioro renal (15,4%), ictus (3,8%) y endofuga de tipo I (25%). La estancia mediana en la unidad de cuidados intensivos fue de 4 días, la estancia mediana hospitalaria de 27 días y la tasa de mortalidad a los 30 días del 13%61. En otra serie, la tasa de complicaciones mayores fue del 59%, la tasa de mortalidad a los 30 días del 14,3% y la de supervivencia global a los 3 años, del 70%33. Hasta que se determinen los resultados a largo plazo, sus riesgos y la permeabilidad del tratamiento híbrido de los AATA, una estrategia razonable es ofrecer tratamiento abierto convencional a los pacientes más jóvenes y reservar las técnicas híbridas para los de edad más avanzada y mayor riesgo.
La corrección endovascular de un AATA es posible utilizando endoprótesis fenestradas y ramificadas62-64. Muchos de estos dispositivos se siguen fabricando a medida y requieren sistemas de imagen especializados para que puedan efectuarse con precisión las fenestraciones. Una rotación inadecuada del injerto en el momento de la implantación puede asociarse a una oclusión de la rama lateral62. Sigue siendo desconocida la permeabilidad a largo plazo de las ramas laterales renales y viscerales. La tecnología de los injertos fenestrados sigue encontrándose en sus albores y no es viable para todos los pacientes.
Revascularización híbrida de la carótida extracranealEl tratamiento de pacientes con estenosis severa de la arteria carótida y coronariopatía coexistente sigue siendo controvertido. En una revisión de 97 estudios publicados sobre el seguimiento de 8.972 intervenciones escalonadas o sincrónicas se demostró mayor tasa de mortalidad operatoria (4,6%) cuando la endarterectomía carotídea (EAC) y el bypass coronario (BC) se efectuaron simultáneamente, mayor tasa de infarto de miocardio (6,5%) cuando la EAC se efectuó antes del BC y una mayor tasa de ictus (6,3%) cuando el BC se efectuó antes de la EAC65. La tasa de acontecimientos para la variable combinada de infarto de miocardio, ictus y mortalidad fue del 10-12%.
Para pacientes en “riesgo elevado”, como alternativa a la EAC ha emergido la colocación de un stent en la arteria carótida (SAC) con protección cerebral66,67. En Estados Unidos, alrededor del 3,3% de los pacientes con estenosis carotídea y coronariopatía coexistentes se someten a dicho procedimiento68. Tras un ajuste para la edad, sexo, estado sintomático y comorbilidades, en pacientes sometidos a EAC-BC se identificó un aumento del riesgo del 66% de ictus postoperatorio comparado con los sometidos a SAC-BC. La presencia de síntomas neurológicos aumentó sustancialmente el riesgo de ictus postoperatorio. La mortalidad hospitalaria fue similar (5,2% frente al 5,4%) para ambos grupos68.
Aunque en la práctica clínica es relativamente infrecuente, los pacientes con arteriopatía oclusiva significativa de la carótida común proximal y de la bifurcación carotídea representan un reto clínico considerable. Antes del advenimiento de la angioplastia y la implantación de stent, estos pacientes requerían transposición de carótida a subclavia o bypass junto con endarterectomía de la bifurcación. De los 14 procedimientos consecutivos de implantación de un stent en la arteria carótida común en la Cleveland Clinic, en uno se produjo conversión a transposición carótida-subclavia tras la disección yatrógena y otros dos procedimientos dieron lugar a un ictus secundario a trombosis de la arteria carótida interna69. En ambos casos, que se efectuaron junto con endarterectomías repetidas de la bifurcación, la carótida común era permeable en el momento de la nueva exploración quirúrgica y de la trombectomía de la carótida interna. Aunque la implantación de un stent en la carótida probablemente no fue responsable, se requiere precaución cuando se efectúan estos procedimientos de forma combinada. Otros investigadores han documentado la ausencia de riesgos y la permeabilidad de la EAC junto con la angioplastia e implantación de un stent de la arteria carótida común izquierda y el tronco innominado70,71.
Revascularización híbrida de la arteria coronariaEl bypass coronario sigue siendo el tratamiento óptimo para pacientes con estenosis de la arteria coronaria principal izquierda y de múltiples vasos72. La intervención percutánea (ICP) de múltiples vasos se asocia con una mayor incidencia de reestenosis en el lugar de implantación del stent y procedimientos repetidos de revascularización72. La revascularización coronaria híbrida mediante injerto de arteria mamaria interna (AMI) a arteria descendente anterior izquierda (LAD) e ICP de la arteria circunfleja y/o coronaria derecha se ha recomendado como un medio mínimamente cruento de obtener una revascularización coronaria en pacientes seleccionados. El injerto de AMI confiere un beneficio para la supervivencia73,74. La permeabilidad de los stents en la arteria circunfleja y coronaria derecha rivaliza con la del injerto de bypass de vena safena. En muchos centros, la revascularización de la LAD se consigue usando un bypass coronario directo mínimamente cruento (BCDMC), en el cual se obtiene la AMI a través de una minitoracotomía anterior izquierda y se sutura a corazón latiente sin bypass cardiopulmonar. A los 5 años después de BCDMC para revascularizar la LAD, la supervivencia fue del 95,8%, la supervivencia libre de acontecimientos cardíacos del 90,8% y la evitación de revascularización repetida de la LAD fue del 91,6%75. Los sistemas de manipulación robótica mejoran la facilidad de obtención de la AMI76. Las mejoras en la tecnología y en la técnica quirúrgica han permitido que algunos centros realicen bypass de AMI a LAD completamente endoscópico, asistido con robot76. Cuando la anastomosis de la AMI se efectúa “sin circulación extracorpórea” la aorta no se manipula, lo que reduce el riesgo de ictus perioperatorio75,77. En la tabla IV se presentan los resultados de diversas series de revascularización coronaria híbrida. Otro ejemplo de esta técnica incluye la práctica de una ICP junto con reposición de la válvula aórtica o mitral como alternativa a la CBC y valvuloplastia convencional78,79.
Resultados de los procedimientos coronarios híbridos: resultados de 30 días y a largo plazo
| Autores | Año | N | Procedimiento quirúrgico | Secuencia de revascularización | Repetición revascularización (%) | IM (%) | Mortalidad (%) | Meses de seguimiento (media±DE, límites) | Repetición revascularización (%) | IM (%) | Mortalidad (%) | Comentarios |
| Wittwer et al97 | 2000 | 35 | BCDMC | Primero cirugía | 0 | 0 | 0 | NR | NR | NR | NR | |
| Presbitero et al98 | 2001 | 42 | BCDMC | Primero cirugía en 64% | 7,1 | NR | 2,4 | 17,5 | NR | NR | 2,4 | |
| Stahl et al99 | 2002 | 54 | BCDMC asistida robot | Variable | 0 | 0 | 0 | 11,6 (1-23) | 1,8 | 0 | 0 | |
| Riess et al100 | 2002 | 57 | BCDMC | Primero cirugía | 1,7 | 0 | 0 | 25,2 ± 9,5 (0,75-52) | 12,7 | 0 | 1,8 | |
| Davidavicius et al83 | 2005 | 20 | BCDMC asistido robot | Primero ICP en 30% | 0 | 0 | 0 | 19 ± 10 (12-33) | 0 | 0 | 0 | |
| Katz et al76 | 2006 | 27 | BCDMC asistido robot | Variable | 0 | 3,7 | 0 | NR | 29,6 | 0 | 0 | Sistema robótico DaVinci |
| Gilard et al101 | 2007 | 70 | CBC abierta | CBC en un plazo de 16h de ICP | 2,8 | 0 | 1,4 | 33 (2-70) | 0 | 0 | 0 | CB mismo día 92% de los casos con circulación extracorpórea |
| Kon et al81 | 2008 | 15 | BCSCE | Simultánea | 0 | 0 | 0 | NR | 6,7 | 0 | 0 | 1 año de seguimiento en todos los pacientes |
| Reicher et al82 | 2008 | 13 | BCSCE | Simultánea | 0 | NR | 0 | 6 | 0 | 0 | 0 | Tasa de fracaso inicial del 15,8% |
| Kiaii et al79 | 2008 | 58 | BCDMC asistido robot | Simultánea | 0 | 1,7 | 0 | 20,2 (1,1-40,8) | 3,4 | 0 | 0 | Permeabilidad del injerto del 91% en el seguimiento angiográfico |
BCDMC: bypass coronario directo mínimamente cruento; BCSCE: bypass coronario sin circulación; CBC: cirugía de bypass coronario; DE: desviación estándar; extracorpórea; ICP: intervención coronaria percutánea; IM: infarto de miocardio.
El bypass puede efectuarse antes, al mismo tiempo o después de la ICP. Las ventajas de una estrategia quirúrgica en primer lugar incluyen la “protección” de la pared anterior y la capacidad para evaluar la calidad del bypass de la AMI durante la angiografía posterior80. La ICP puede efectuarse utilizando inhibidores de la glucoproteína plaquetaria IIb-IIIa y clopidogrel sin la preocupación de incrementar el riesgo de hemorragia perioperatoria. Las ventajas de la ICP previa incluyen la garantía de que la implantación del stent fue satisfactoria (es decir, sin la necesidad de un bypass de múltiples vasos en lugar de CBC de un solo vaso). Los procedimientos simultáneos logran una revascularización completa en un procedimiento individual, lo que es más conveniente para el paciente. Estos procedimientos requieren una unidad endovascular que sirve tanto como quirófano como de unidad intervencionista, al igual que la colaboración estrecha entre el cirujano cardiotorácico y los cardiólogos intervencionistas.
En dos series prospectivas, a pequeña escala, de casos-controles que compararon los resultados de la revascularización híbrida simultánea con CBC sin circulación extracorpórea (CBSEC) frente a CBC convencional, se encontró que los pacientes del grupo híbrido se caracterizaron por una estancia más breve en la unidad de cuidados intensivos y en el hospital, una extubación más rápida después de la revascularización, una reanudación más rápida de la actividad laboral, y una mayor satisfacción con el procedimiento81,82. A pesar del tratamiento antiagregante plaquetario con aspirina y clopidogrel, la hemorragia no aumentó en comparación con pacientes sometidos a CBC convencional82. Otra estrategia para pacientes con coronariopatía de múltiples vasos es efectuar CBCDMC asistida con robot y una ICP provisional de la arteria circunfleja izquierda o coronaria derecha si la reserva de flujo fraccional (RFF) es<0,8083. La RFF ofrece un medio ampliamente aceptado de determinar si una estenosis es sustancial desde un punto de vista hemodinámico. En un grupo de 20 pacientes tratados de acuerdo con este protocolo, no se produjeron mortalidad, infartos de miocardio, o revascularizaciones repetidas después de un seguimiento medio de 19 meses83.
La revascularización coronaria híbrida sigue siendo un procedimiento experimental. La exposición anterior necesaria para la CBCDMC limita el procedimiento a los pacientes con estenosis aislada de la LAD o de la arteria diagonal. La curva de aprendizaje para efectuar el procedimiento es excesiva. A pesar del desarrollo de dispositivos que estabilizan el campo operatorio, la anastomosis de la LAD puede ser difícil de efectuar, en particular si es de pequeño calibre, está muy calcificada o es intramiocárdica. Estos factores contribuyen a tasas iniciales de fracaso del injerto del 7,7%75. Los dispositivos robóticos para obtener la AMI siguen siendo demasiado costosos.
ConclusionesLos procedimientos quirúrgicos/endovasculares híbridos pueden ofrecer a los pacientes la oportunidad de una revascularización menos cruenta, con una disminución de la morbilidad y la mortalidad, en particular los considerados en riesgo prohibitivo para una reconstrucción quirúrgica convencional. Para aquellos con arteriopatía oclusiva de las extremidades inferiores la corrección endovascular aortoilíaca con frecuencia se combina con el tratamiento quirúrgico abierto de los vasos infrainguinales. Para pacientes con enfermedad aneurismática, en general, el tratamiento endovascular se combina con la reconstrucción quirúrgica de los troncos supraaórticos, las arterias mesentéricas o la construcción de un conducto ilíaco de abordaje. El conocimiento exhaustivo de todas las opciones potenciales permitirá al cirujano vascular determinar la mejor opción de revascularización (endovascular, quirúrgica abierta o híbrida) para cada paciente individual. La disponibilidad de un quirófano o sala endovascular específica facilita enormemente los procedimientos híbridos.