El objetivo del presente estudio fue examinar las repercusiones fisiológicas de tiempos de isquemia variables durante la cirugía aórtica laparoscópica. Tras cuarentena, se efectuó laparoscopia en 24 cerdos sanos, que fueron asignados aleatoriamente a uno de cuatro grupos de estudio: grupo I (n=6), cirugía aórtica abdominal infrarrenal laparoscópica con 30min de clampaje; grupo II (n=6) cirugía aórtica abdominal infrarrenal laparoscópica con 60min de clampaje; grupo III (n=6) cirugía aórtica abdominal infrarrenal laparoscópica con 120min de clampaje; grupo IV (n=6), 120min de neumoperitoneo en ausencia de clampaje aórtico (grupo de control). Durante y después de la cirugía, se efectuaron estudios hematológicos, bioquímicos, hormonales, hemodinámicos y ventilatorios, y, 10 días después de la cirugía, se procedió a una evaluación neurológica postoperatoria. En el grupo III se evidenció un aumento de la presión arterial y de la frecuencia cardíaca que fue significativamente mayor que los presentes en los otros grupos. En los grupos II y III se observó una disminución significativa del pH, mientras que, en los grupos I y IV, no se observaron cambios en este parámetro. Durante la cirugía, la concentración de catecolaminas fue similar en todos los grupos (en todos, inmediatamente después de crear el neumoperitoneo, se observó un aumento significativo [p<0,001] de su concentración plasmática). Entre la duración del clampaje aórtico y los valores hormonales obtenidos a los 30 y 60min después del desclampaje pero no después de 24h, se encontró una asociación positiva. Durante la laparoscopia, se evidenció un aumento significativo del índice de resistencia renal (IRR) y una disminución significativa de la diuresis, con valores significativamente más bajos del índice observados en el grupo IV inmediatamente después de la cirugía. Por lo tanto, en el presente estudio se evidenció un efecto sinérgico del neumoperitoneo y el clampaje aórtico. En conjunto, estos dos factores inducen un compromiso hemodinámico con una disminución de la perfusión renal y acidosis, lo que afecta negativamente al estado general del paciente durante este tipo de cirugía. A pesar de ser bien tolerado en cerdos sanos, un tiempo de clampaje aórtico laparoscópico>60min produce cambios hemodinámicos, metabólicos y hormonales sustanciales. Para evitar cualquier complicación grave, es obligada una selección cuidadosa de los pacientes.
La cirugía aórtica laparoscópica abdominal ha mejorado considerablemente durante los últimos años, y se ha convertido en la opción de elección en el tratamiento de la patología oclusiva aortoilíaca extensa1. Normalmente se considera que la laparoscopia abdominal se asocia con pocos riesgos anestésicos aunque ampliamente reconocidos que, no obstante, pueden aumentar los inherentes al clampaje aórtico, lo que representa un mayor riesgo quirúrgico en estos procedimientos. Por lo tanto, cuando se usa en el tratamiento de la patología aórtica, el abordaje laparoscópico se asocia a complicaciones y riesgos adicionales que deben abordarse, tal como el clampaje aórtico y los tiempos quirúrgicos prolongados2,3. Además, en sí mismo, el clampaje aórtico causa modificaciones hemodinámicas que han de tenerse en cuenta, junto con los cambios secundarios a la laparoscopia. Previamente, se han descrito tiempos de restablecimiento de la anestesia excesivamente prolongados y problemas graves durante el desclampaje2.
A pesar de los informes de publicación reciente que demuestran que la laparoscopia es un abordaje viable para el tratamiento de la patología oclusiva y aneurismática aórtica4-7, la mayoría de estos estudios se han centrado principalmente en la técnica quirúrgica y su viabilidad técnica, sin evaluar la estabilidad hemodinámica y ventilatoria durante ella o el restablecimiento del paciente a partir del procedimiento.
En una revisión, publicada por Gelman en 19958, los datos recopilados demostraron que el clampaje aórtico y el desclampaje se asocian con diversas alteraciones de la homeostasia en casi todos los sistemas orgánicos. En un ámbito experimental y clínico, las respuestas cardiovasculares al clampaje aórtico incluyen un aumento de la presión arterial proximal y de la resistencia vascular sistémica, al mismo tiempo que disminuye el gasto cardíaco8-11.
Byrne et al12 evaluaron las respuestas fisiológicas a la cirugía laparoscópica de bypass aortobifemoral, mientras que Alfonsi et al13 se centraron en la evaluación de la función cardíaca durante la insuflación intraperitoneal de CO2 para cirugía aórtica. No obstante, en estos estudios no se evaluaron los efectos combinados del clampaje aórtico y la creación del neumoperitoneo durante el procedimiento. Además, el protocolo anestésico usado por Byrne et al12 ha dejado de utilizarse clínicamente.
Una ventaja potencial de la laparoscopia para la cirugía aórtica podría ser la disminución del estrés fisiológico del paciente. El largo abordaje abdominal medio xifopúbico necesario para la exposición quirúrgica de la aorta abdominal se asocia con un deterioro de la función pulmonar secundario a una disminución del 50% de la capacidad respiratoria y con intenso dolor postoperatorio14. No obstante, la cirugía laparoscópica en sí se asocia a cierto grado de estrés fisiológico, según lo sugerido por la liberación de catecolaminas durante la inducción del neumoperitoneo15.
Se sabe que la duración del clampaje aórtico afecta al resultado de estas intervenciones16-18 pero los datos disponibles no establecen con claridad la duración que compromete el restablecimiento satisfactorio de los pacientes después de cirugía aórtica abdominal infrarrenal. Como se ha destacado previamente, la técnica muy compleja requiere tiempos de clampaje aórtico muy prolongados.
La insuficiencia renal aguda es una grave complicación de esta cirugía con tasas elevadas de mortalidad19 y una incidencia del 5% (que requiere diálisis) tras abordaje abierto de la aorta16. En los estudios publicados no se han encontrado datos sobre su incidencia durante la cirugía aórtica laparoscópica, aunque, en opinión de los autores del presente estudio probablemente es más alta que con la utilización de un abordaje convencional. En general, su causa es multifactorial pero el clampaje es el factor contribuyente más importante ya que induce cambios destacados de la hemodinámica renal, un aumento de la resistencia vascular renal y una disminución sustancial del flujo cortical19. Además, el aumento de la presión intraabdominal debido a la insuflación de CO2 agrava la disminución del flujo renal20 a través de la compresión vascular y parenquimatosa y una disminución del gasto cardíaco y también se asocia con cambios hormonales sistémicos, como un aumento de la renina, hormona antidiurética y catecolaminas. Por estas razones, consideramos que es importante establecer la duración del clampaje que determina un compromiso de la función renal.
No hemos encontrado estudios que evalúen los cambios fisiopatológicos secundarios a los diferentes tiempos del clampaje aórtico abdominal durante la cirugía laparoscópica vascular. Durante ésta, un clampaje prolongado podría inducir alteraciones fisiológicas graves que podrían comprometer los resultados y seguridad del procedimiento en pacientes con patología aórtica. Por lo tanto, una comprensión clara de estas alteraciones permitirá que los médicos mejoren la calidad de la anestesia durante la cirugía vascular laparoscópica.
Materiales y métodosAnimalesEl protocolo experimental fue aprobado por el comité de investigación de nuestro centro para investigación específica en animales. Se usaron 24 cerdos hembra, blancos, sanos, cuyo peso medio era de 32,2±3,2kg.
AnestesiaUn día antes del episodio anestésico experimental, cada cerdo se anestesió con sevoflurano y se implantó un catéter de 20G en la arteria carótida que se fijó a la piel. De forma parecida, en el mismo día se insertó un introductor vascular de 4F en la vena yugular externa utilizando la técnica de Seldinger. Los animales se asignaron aleatoriamente a uno de cuatro grupos de estudio.
Grupo I (n=6), cirugía aórtica abdominal infrarrenal laparoscópica con 30min de clampaje.
Grupo II (n=6), cirugía aórtica abdominal infrarrenal laparoscópica con 60min de clampaje.
Grupo III (n=6), cirugía aórtica abdominal infrarrenal laparoscópica con 120min de clampaje.
Grupo IV (n=6), 120min de neumoperitoneo en ausencia de clampaje aórtico (grupo de control o simulado).
Ocho horas antes de la cirugía se impidió a los animales acceso a la comida pero se permitió agua. La temperatura corporal se mantuvo estable a 37-38°C, utilizando una manta térmica (Astopad System; Stihler Electronic, Stuttgart, Alemania) y se administraron líquidos templados.
Los animales se premedicaron con diazepam (0,1mg/kg; Roche Farma, Madrid, España) y ketamina (10mg/kg; Pfizer, Madrid). La anestesia se indujo con propofol (4mg/kg), que se administró tras oxigenación mediante mascarilla facial con oxígeno al 100% durante 3min. Se efectuó intubación endotraqueal, conectando el tubo con un circuito anestésico circular semicerrado unido a un respirador (Ventilator 7800, Ohmeda, Madrid, España). La administración de sevoflurano se inició al 5%, lo que nos permitió obtener rápidamente una concentración alveolar mínima (CAM) de 1,2521 (1 CAM=2,66%) con una tasa de flujo de oxígeno de 3 l/min. Una vez se alcanzó una CAM de 1,25 (concentración espirada de sevoflurano de 3,3%), se ajustó el vaporizador según las necesidades para mantenerla. Se obtuvo relajación muscular con una dosis de 0,1mg/kg de vecuronio (Organon Española, Barcelona, España) administrado cada 30min. Se administró un bolo de fentanilo (5 μg/kg) (Roche Farma) cada 30min. Se inyectó heparina sistémica (laboratorios farmacéuticos Rovi, Madrid, España) (150 UI/kg) 5min antes del clampaje aórtico. La analgesia postoperatoria se garantizó con 10 μg/kg de buprenorfina IM (Schering Plough, Madrid, España) cada 8h.
Durante el procedimiento se utilizó ventilación de presión positiva intermitente para mantener una concentración espirada de CO2 de 35-45 mmHg con un volumen corriente de 13-15ml/kg en todos los grupos.
Durante la cirugía, se administró una infusión continua de solución de cloruro sódico compuesta (Ringer-Lactato; Braun, Barcelona, España) a una tasa de 10ml/kg/h. Antes del desclampaje, a cada animal se le administraron 500ml de una solución coloidal (hidroxietil almidón al 6%; Fresenius Kabi, Barcelona, España). Al término de la cirugía, se desconectó el vaporizador y se aumentó la tasa de flujo de gas fresco hasta 10 l/min de oxígeno al 100%. Cuando los cerdos recuperaron el reflejo faríngeo se les extubó y se les consideró restablecidos y conscientes cuando los anestesistas responsables registraron la capacidad para mantenerse de pie y de andar.
Procedimientos quirúrgicosSe insertaron tres puertos laparoscópicos de 10mm en todos los casos. Se creó un neumoperitoneo mediante insuflación de CO2 en la cavidad abdominal hasta alcanzar una presión intraabdominal de 12-14mm Hg. En el grupo IV, el neumoperitoneo con CO2 se mantuvo durante 120min, lo que se consideró el tiempo mínimo necesario para completar el clampaje en el grupo II.
En animales pertenecientes al grupo I, II y III, se efectuó disección aórtica desde el origen de las arterias renales hasta la arteria mesentérica caudal y todas las arterias lumbares del segmento aórtico objetivo se ocluyeron temporalmente. Acto seguido, se clampó la aorta inmediatamente por debajo del origen de la arteria renal caudal e inmediatamente craneal a la arteria mesentérica inferior. La oclusión aórtica se mantuvo durante 30 (grupo I), 60 (grupo II) o 120 (grupo III) min.
Efectuó todos los procedimientos el mismo equipo quirúrgico utilizando la misma técnica para obtener una estimulación reproducible.
MonitorizaciónUtilizando un montaje de electrodos descrito previamente22, se registró el índice biespectral mediante BIS (Bispectral Index) (A-1050 TM, versión 3.05.05; Aspect Medical Systems, Natick, MA). Se monitorizaron la electrocardiografía (modelo 86S, derivación II; Hewlett-Packard, Ginebra, Suiza) y la pulsioximetría con una sonda (sensor Clip Tip Oximeter Sensor, Datex-Ohmeda, Louisville, Estados Unidos), aplicada sobre la lengua. Otros parámetros registrados fueron la temperatura rectal, el volumen corriente, la concentración espiratoria de sevoflurano, concentración espiratoria de CO2 y frecuencia respiratoria (RGM 5250, Ohmeda). La relajación muscular se observó y monitorizó mediante un tren de cuatro (Train of Four [TOF]) (TOF-Guard; Biometer International, Odense, Dinamarca).
También se determinaron la presión arterial (PA), presión venosa central (PVC) y la frecuencia cardíaca utilizando un módulo de presión arterial (Press M 1006B, Hewlett Packard) conectado con un sistema de monitorización de variables hemodinámicas.
Mediante el sistema de monitorización continua del gasto cardíaco PulseCO™ (LiDCO, Cambridge, Reino Unido) se determinaron en tiempo real las variables hemodinámicas siguientes: gasto cardíaco (GC), volumen sistólico (VS) y resistencia vascular sistémica (RVS). El sistema se calibró usando la técnica de dilución del litio23 para determinación de CO con una dosis de litio de 0,04ml/kg. La SpO2 fue>97% y la concentración espirada de CO2 se mantuvo en 35-40 mmHg en todos los animales. Para todos los procedimientos la pérdida hemática fue mínima.
Análisis de gasometría en sangre arterialA través de la arteria carótida, se obtuvieron muestras de sangre arterial en diferentes momentos (v. más adelante). En cada intervalo, se obtuvieron 0,5ml de sangre usando una jeringa precargada con heparina. El pH, PaCO2 y el bicarbonato (HCO3–) se determinaron utilizando un analizador de gases en sangre arterial (modelo ABL77; Radiometer Medical, Copenhague, Dinamarca).
Pruebas de función renalLa diuresis se registró cada 30min junto con la concentración sérica de urea y creatinina. En estos tiempos también se determinó el índice de Pourcelot o índice resistivo renal (IRR) (IRR=[velocidad sistólica máxima – velocidad telediastólica]/velocidad sistólica máxima) en las arterias arqueadas de la unión corticomedular, utilizando un ecógrafo Panther 2002 (BK Medical, Herlev, Dinamarca) con una sonda laparoscópica de 9,8mm (6,5MHz).
Análisis hormonalesA través del introductor insertado en la yugular, se obtuvieron muestras de sangre venosa en momentos diferentes (v. más adelante). En cada intervalo, usando una jeringa fría se obtuvieron 5ml de sangre. Las muestras de sangre venosa se introdujeron en tubos que contenían ácido etilenodiaminotetraacético (EDTA).
La sangre se centrifugó de inmediato a 4°C, y el plasma se obtuvo, congeló y almacenó a –20°C hasta el análisis hormonal.
La concentración plasmática de cortisol se determinó utilizando radioinmunoanálisis (RIA). Para el cortisol plasmático la variación intraanálisis fue de 4,1-8,3% y la interanálisis, de 12,4-16%. Para la noradrenalina plasmática, la variación intraanálisis fue de 4,8-10% y la interanálisis, del 12-16,5%, con un límite de detección de 20pg/ml. Durante los 10 primeros días después de la cirugía, se efectuó una evaluación neurológica y clínica diaria, con la observación de la conducta, movimientos, postura y existencia o ausencia de reflejos bulbares (como rotuliano, flexor, panicular y anal).
Procesamiento de los datosLos datos se expresan como medias ± desviación estándar (DE) y se obtuvieron en los tiempos siguientes:
T1: basal (inmediatamente después de conectar al animal a los sistemas de monitorización antes de la cirugía).
T2: grupos I, II y III, 5min antes del clampaje; grupo IV, establecimiento del neumoperitoneo.
T3: grupos I, II y III, 30min después del clampaje; grupo IV, 60min después de la creación del neumoperitoneo.
T4: grupos II y III, 60min después del clampaje; grupo IV, 90min después de la creación del neumoperitoneo.
T5: grupo III, 120min después del clampaje; grupo IV, 120min después de la creación del neumoperitoneo.
T6: grupos I, II y III, 5min después del desclampaje; grupo IV, 5min después del término del neumoperitoneo.
T7: grupos I, II y III, 30min después del desclampaje; grupo IV, 30min después del término del neumoperitoneo.
T8: grupos I, II y III, 60min después del desclampaje; grupo IV, 60min después del término del neumoperitoneo.
T9: 24h después del término de la cirugía (sólo para los análisis hormonales).
Para garantizar que los datos tenían una distribución normal, se usó la prueba de Kolmogorov-Smirnov24. En cada punto de tiempo los cambios de las variables ventilatorias, metabólicas y hemodinámicas se analizaron con un análisis de la varianza (ANOVA) para medidas repetidas, seguido de una prueba de Tuckey para examinar la desviación intergrupo a partir de los valores de control. Los tiempos de restablecimiento se analizaron con un ANOVA siendo la variable independiente el grupo (laparoscopia con clampaje de diferentes tiempos o laparoscopia sola). Se consideraron significativos valores de p<0,05 (programa estadístico SPSS 14.0 para Windows; SPSS, Inc., Chicago, Estados Unidos).
ResultadosSegún lo determinado mediante BIS y la observación clínica, la profundidad anestésica concordó con el plano quirúrgico de anestesia.
En las figuras 1 a 12 se reflejan los cambios observados en todas las variables evaluadas. Estos cambios se resumen brevemente más adelante.
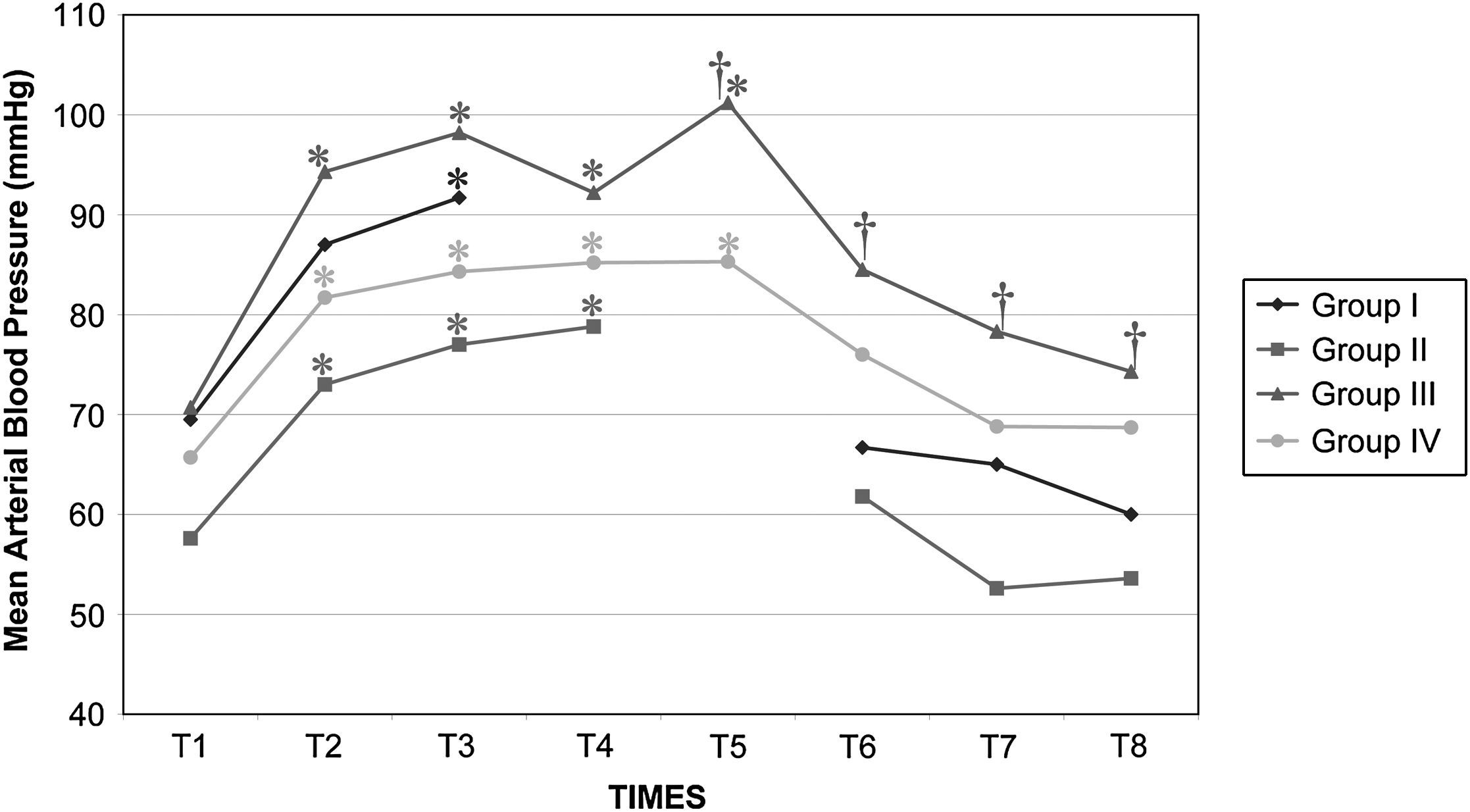
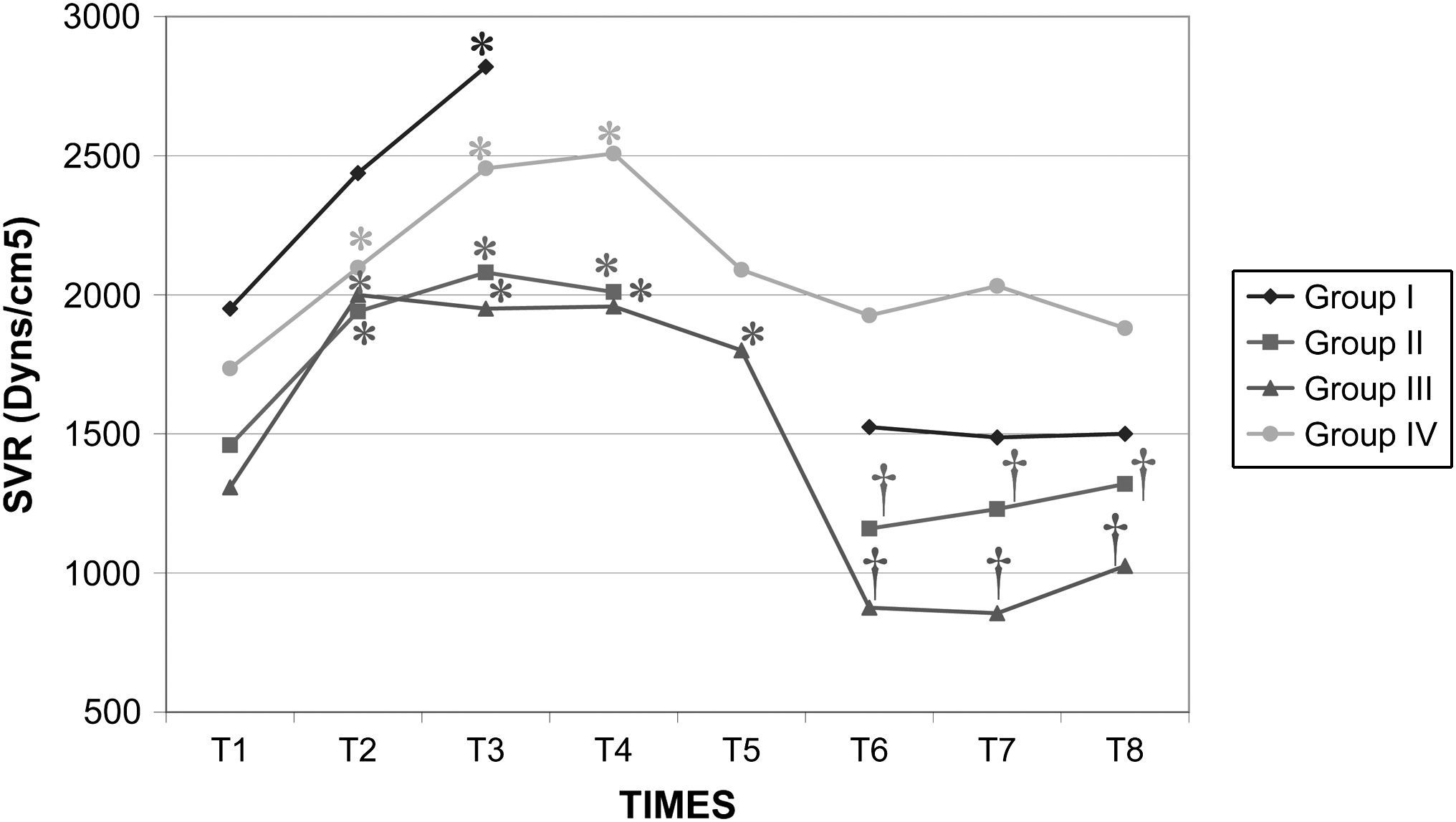
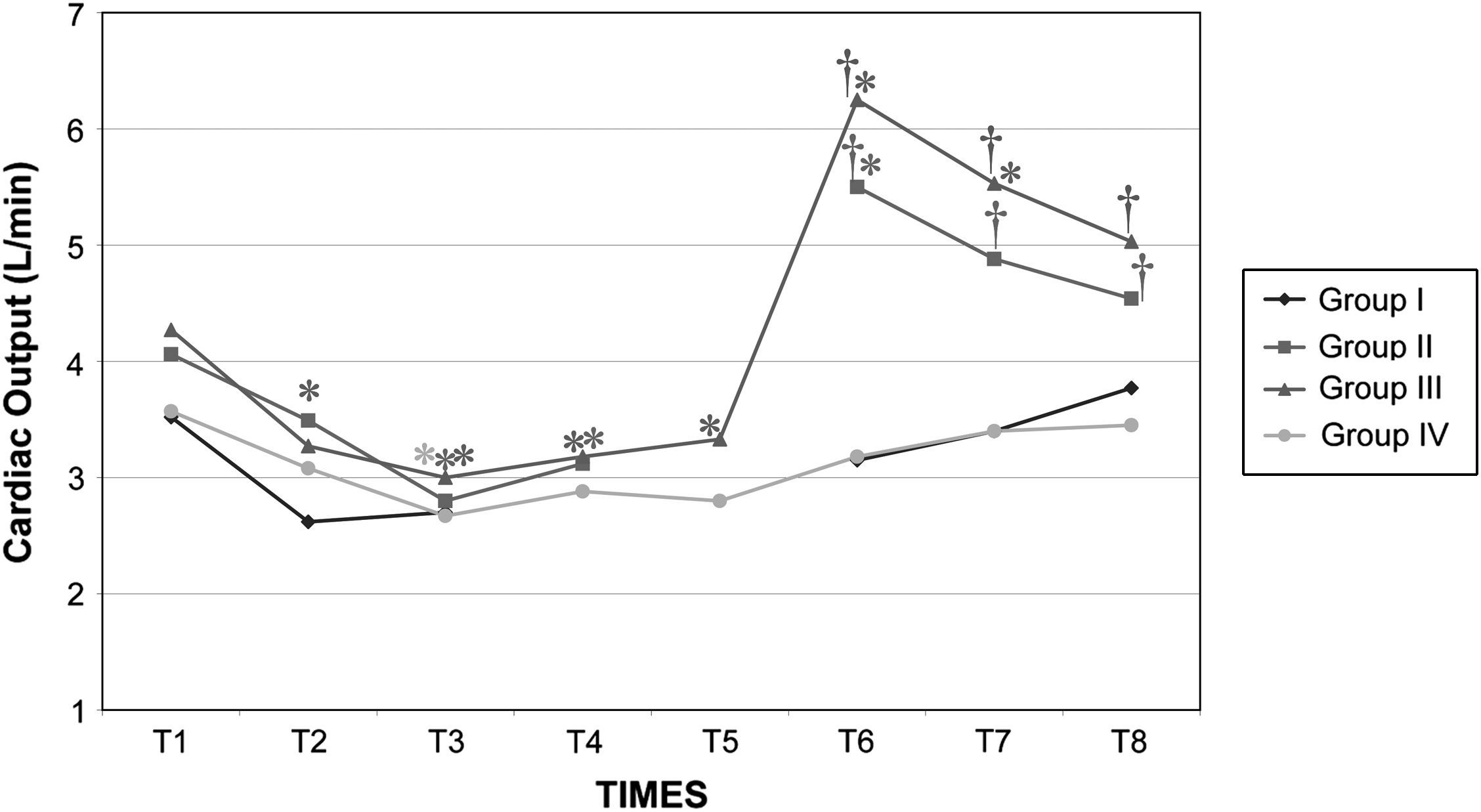
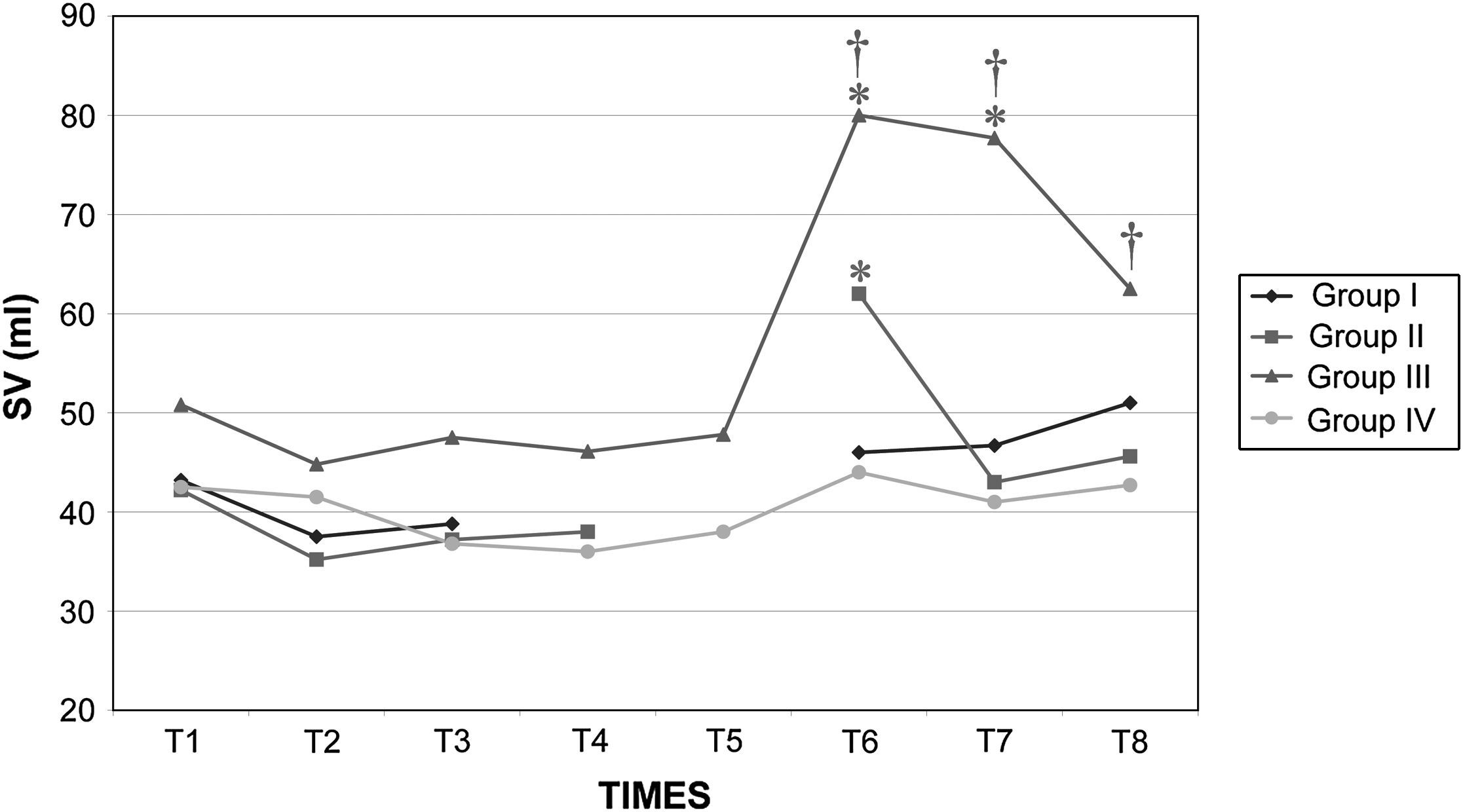
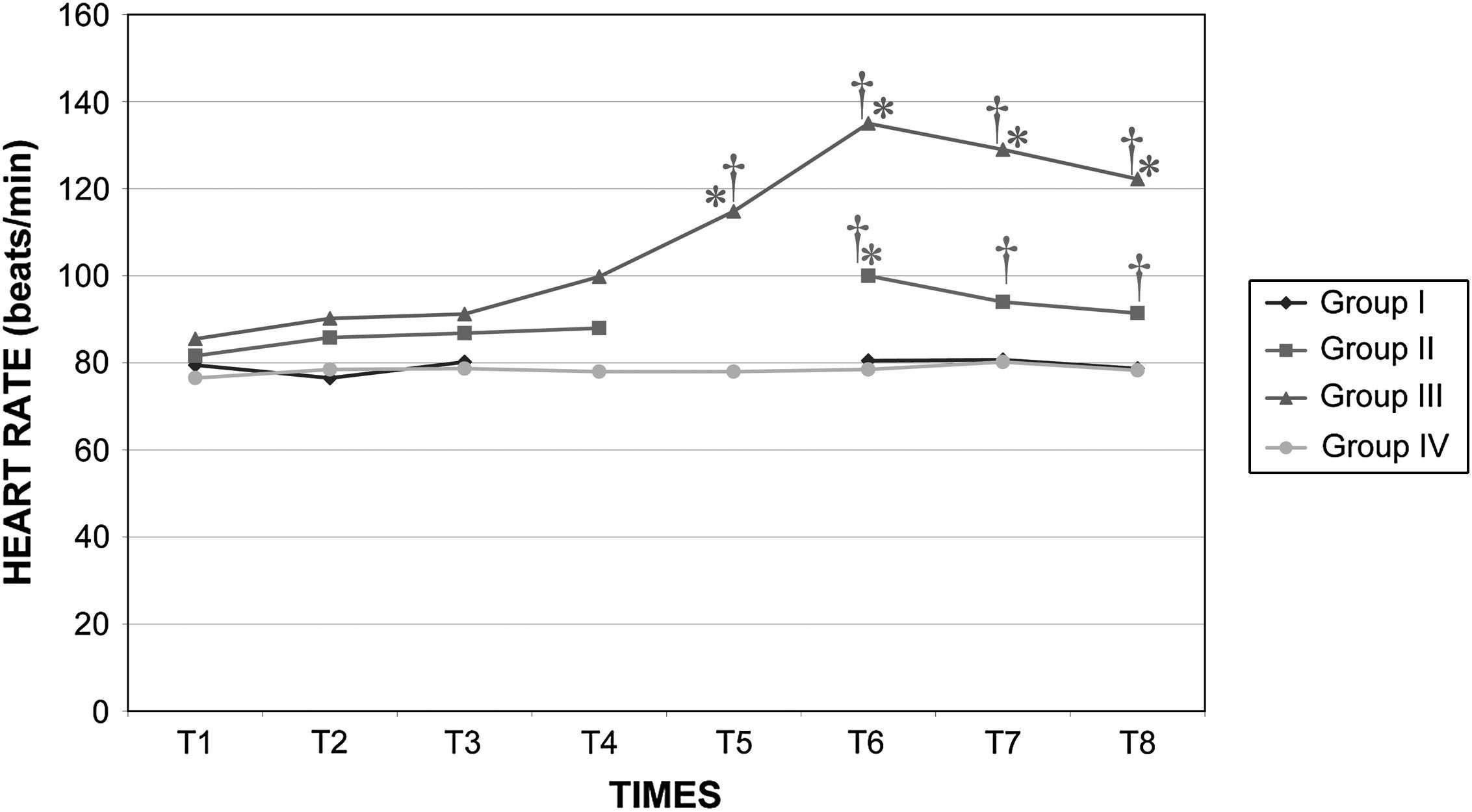
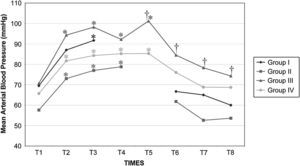
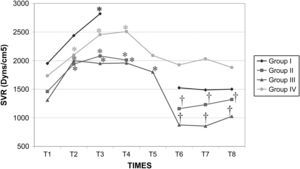
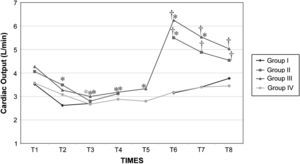
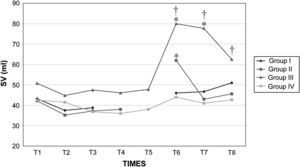
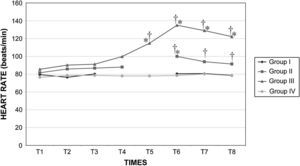
Después del clampaje aórtico, en todos los grupos se observaron aumentos inmediatos y significativos de la PA y la RVS y disminuciones del GC y VS, sin cambios significativos concurrentes de la PVC o la frecuencia cardíaca. Después del desclampaje (T6), en todos los grupos también se observaron un aumento significativo del GC y VS y una disminución significativa de la PA y RVS (figs. 1 a 5). En el grupo III (120min de clampaje) se observó un aumento significativo de la frecuencia cardíaca desde el minuto 60 en adelante, y este parámetro siguió siendo alto después del desclampaje. De forma parecida, la frecuencia cardíaca siguió siendo alta en el grupo II después del desclampaje (fig. 6). La PA fue significativamente más alta en el grupo III 120min después del clampaje que en el intervalo equivalente en el grupo IV. En todos los grupos, el neumoperitoneo causó aumentos significativos de la PVC, PA y RVS, junto con una disminución del GC.
Presión arterial media (PAM) en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; Mean Arterial Blood Pressure (mmHg): presión arterial media (mmHg).
Resistencia vascular sistémica (RVS) en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; SVR (Dyns/cm2): resistencia vascular sistémica (dynas/cm2); TIMES: tiempos.
Gasto cardíaco (GC) en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; Cardiac Output (L/min): gasto cardíaco (l/min); TIMES: tiempos.
Volumen sistólico (VS) en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; SV (ml): volumen sistólico (ml).
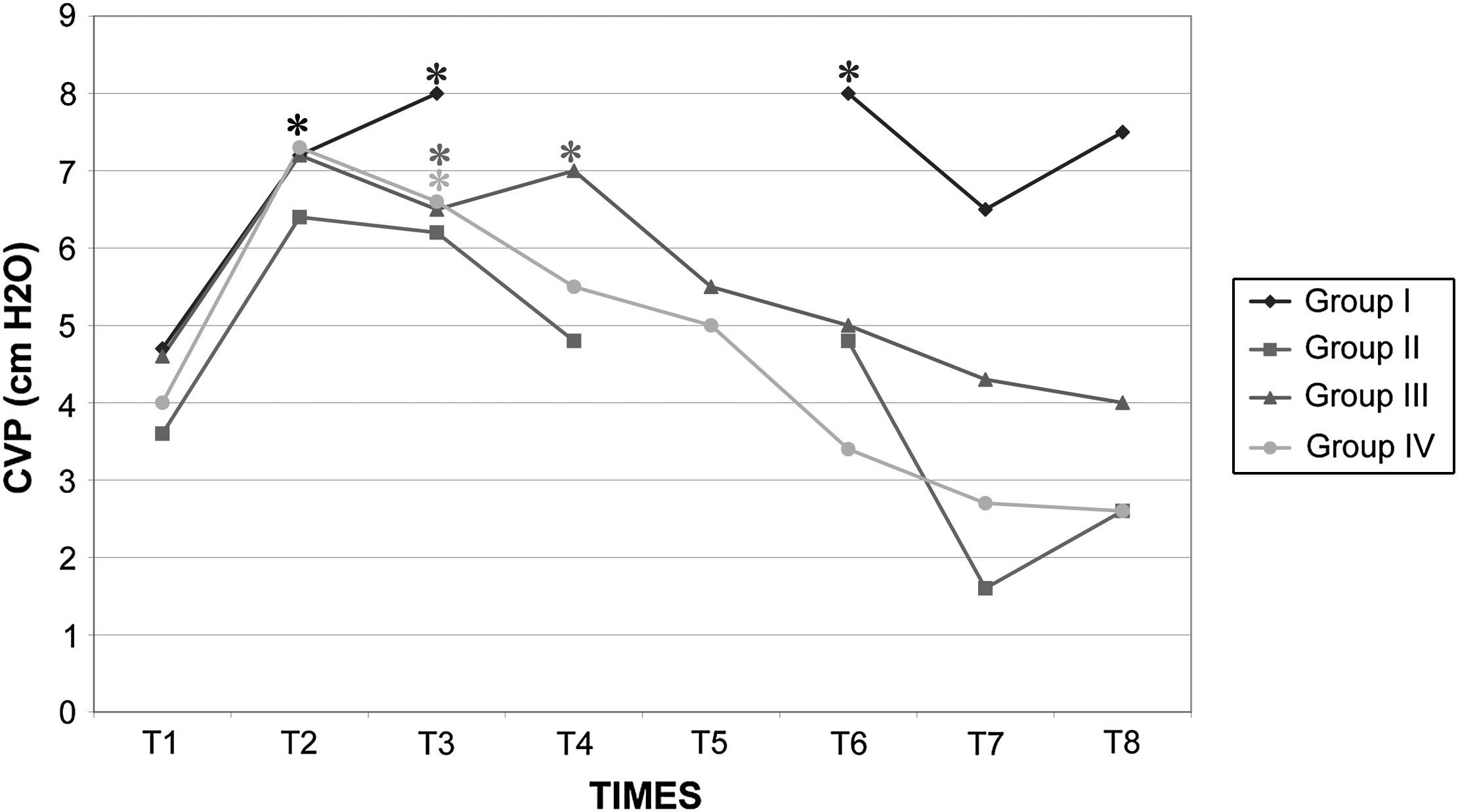
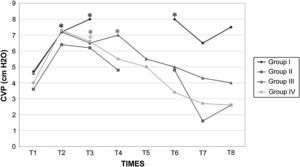
Presión venosa central (PVC) en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). CVP (cm H2O): presión venosa central (cm H2O); Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; TIMES: tiempos.
Frecuencia cardíaca en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; HEART RATE (beats/min): frecuencia cardíaca (latidos/min); TIMES: tiempos.
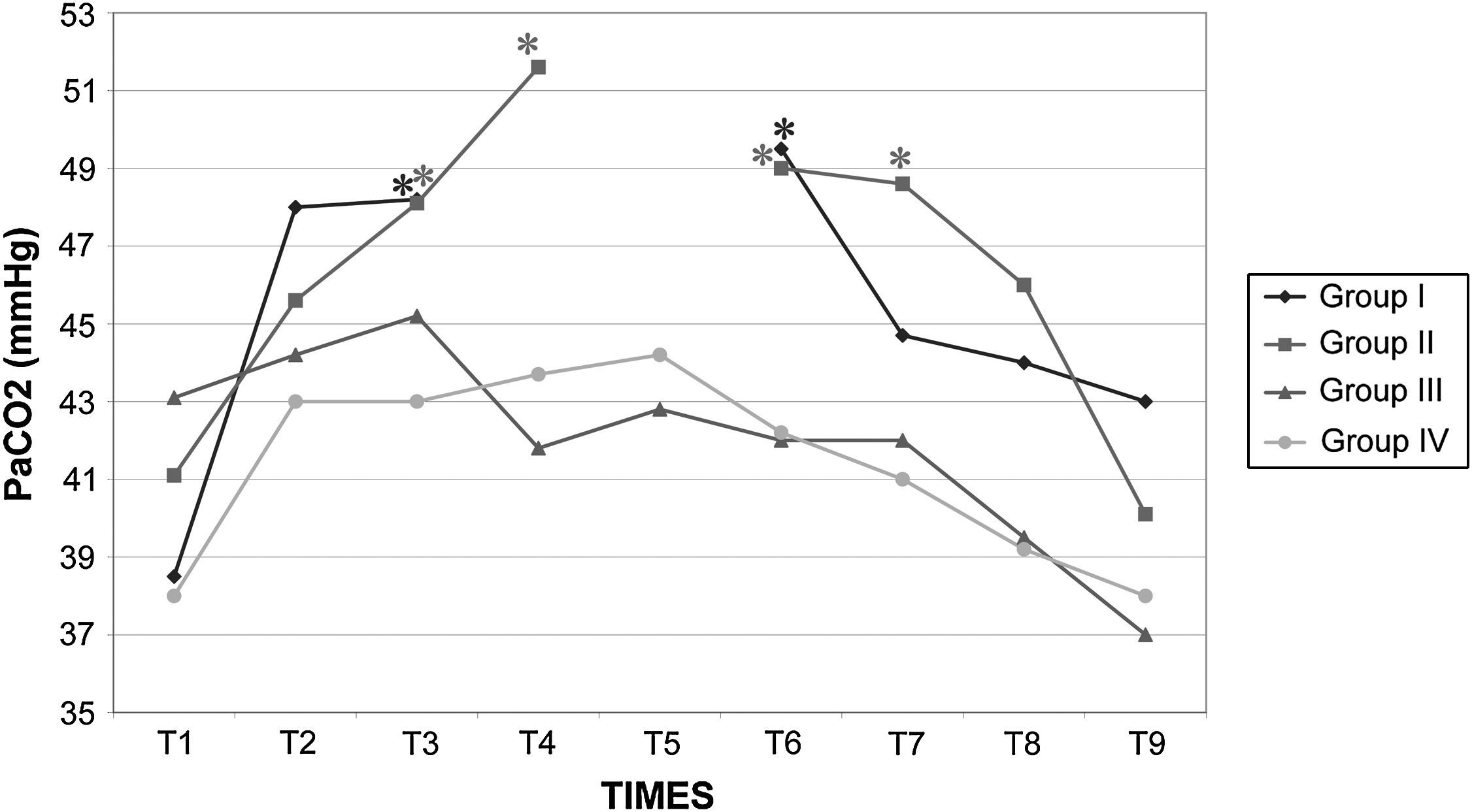
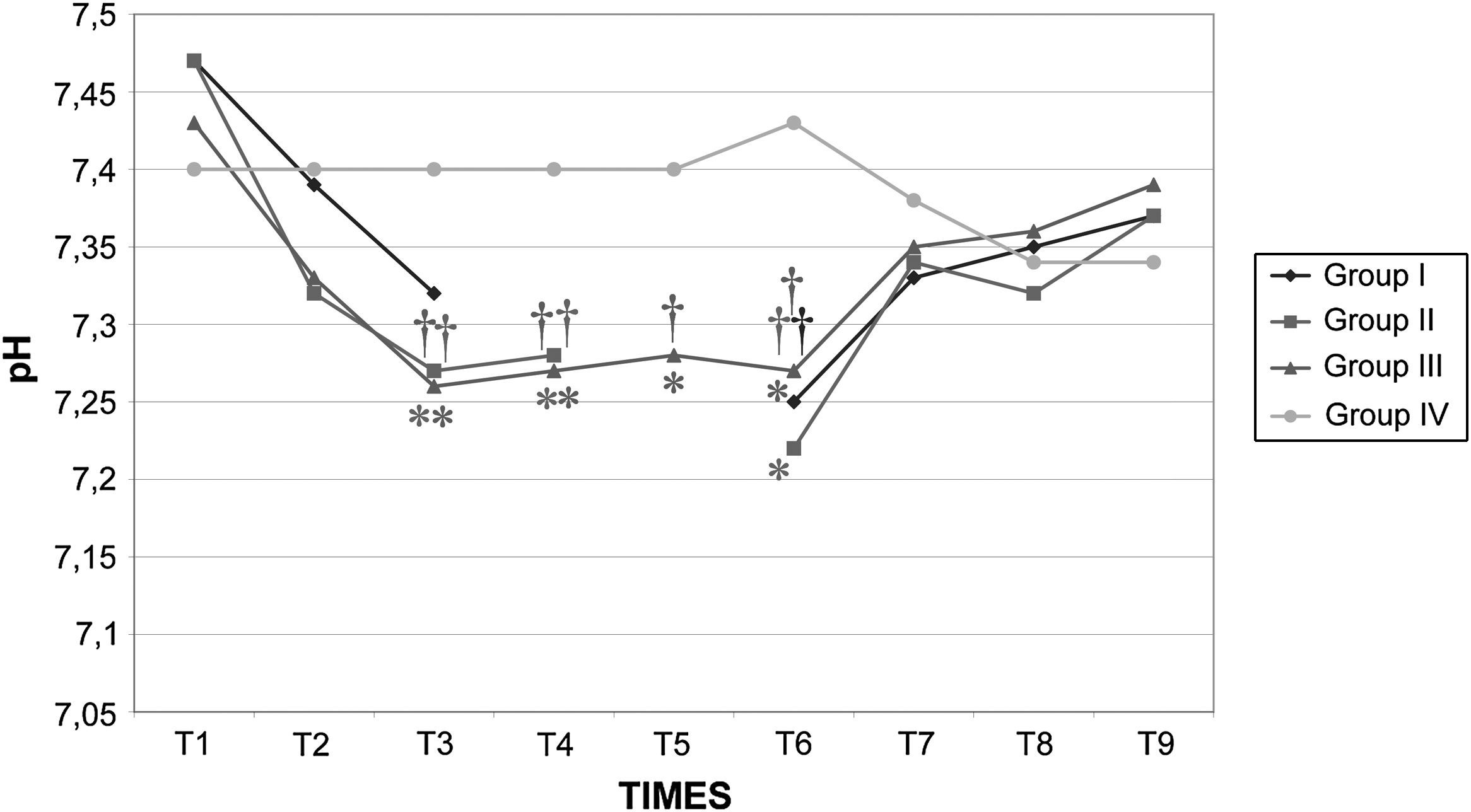
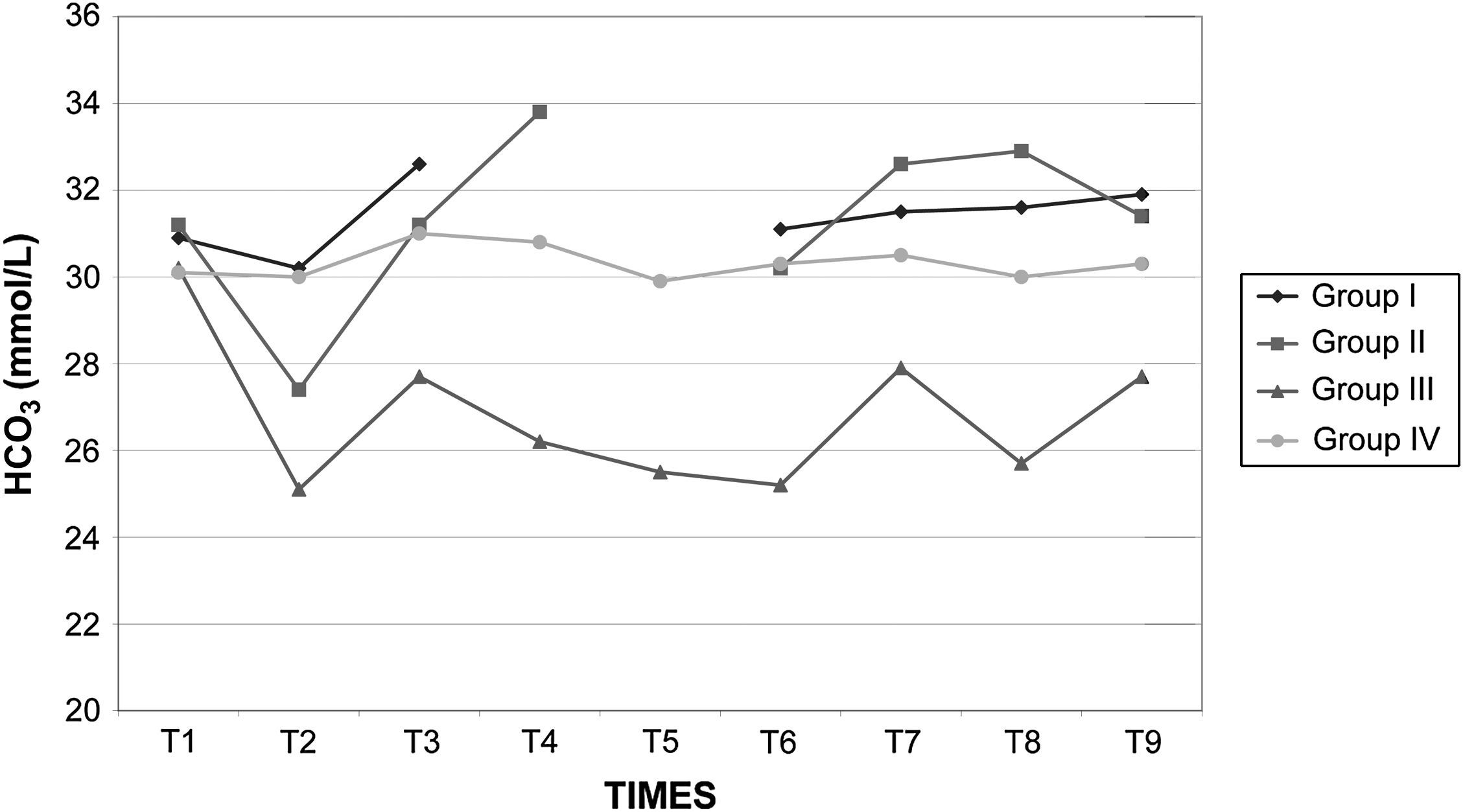
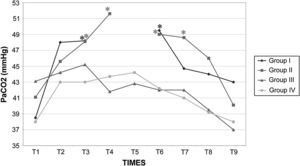
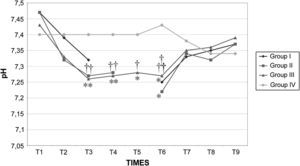
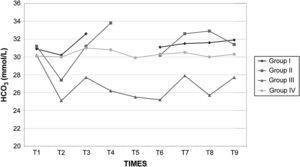
Los valores de la gasometría arterial y el pH permanecieron estables en los grupos I y IV, mientras que en los grupos II y III, durante el clampaje, se observó una disminución significativa adicional de los valores de pH. En el grupo II el HCO3– permaneció en valores>26mmol/l durante el clampaje y desclampaje para compensar la acidosis, pero en el grupo III permaneció en valores<26mmol/l (figs. 7 a 9).
Equilibrio acidobásico en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; TIMES: tiempos.
Equilibrio acido-básico en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; TIMES: tiempos.
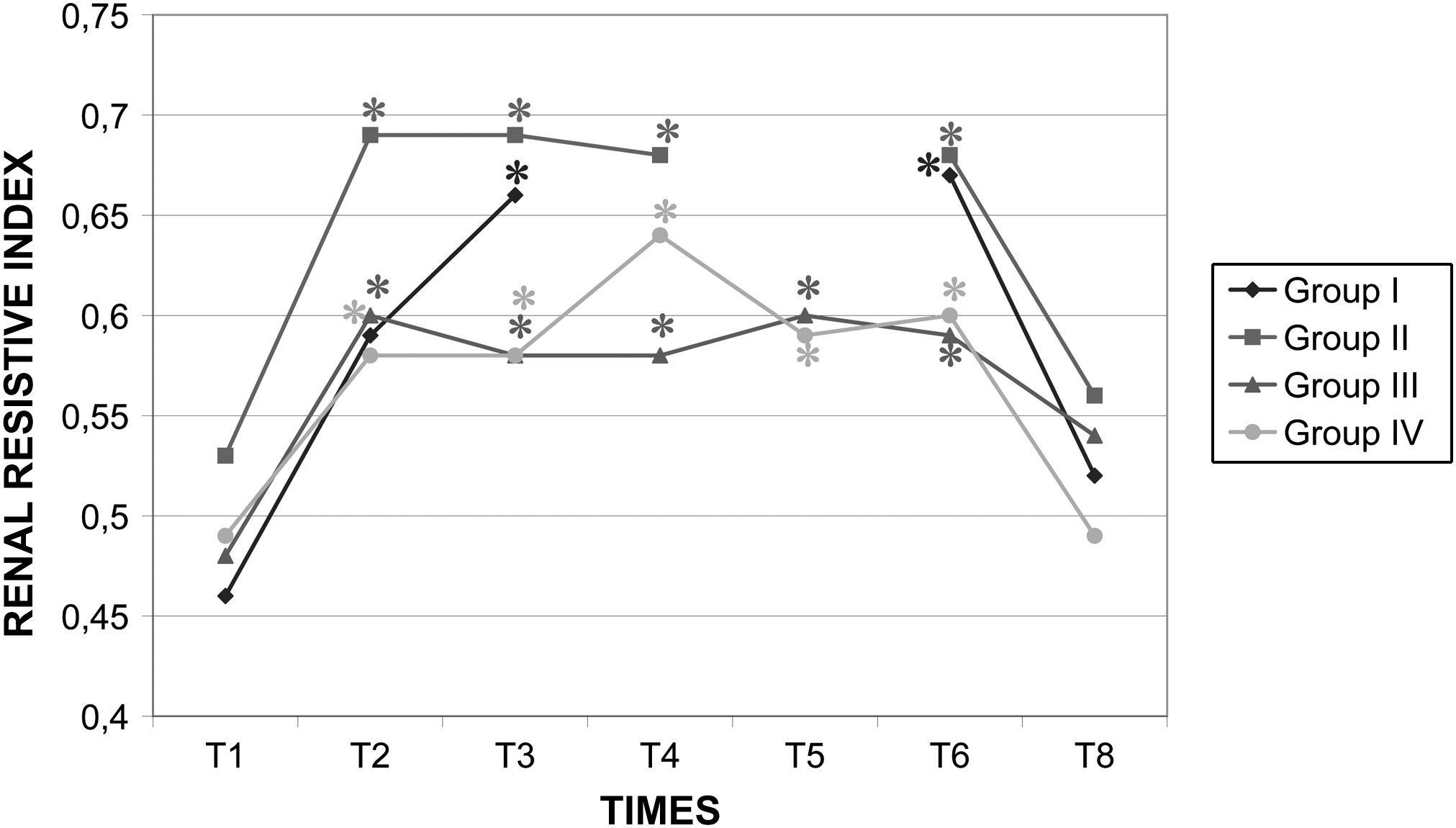
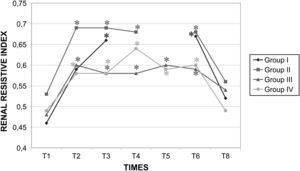
En ningún grupo se observaron cambios significativos de la concentración de urea o creatinina. En todos los grupos, después de la creación del neumoperitoneo se observó un aumento significativo (p<0,05) del IRR. No obstante, el clampaje aórtico no indujo un aumento adicional (fig. 10). En el grupo III, la diuresis fue de 0,57ml/kg/h, lo que representó una disminución del 60% comparado con la producida durante el clampaje laparoscópico de 60min (grupo II, 1,45ml/kg/h). Comparado con la diuresis del grupo I (1,66ml/kg/h), esta disminución alcanzó el 65%. Por último, la diuresis en el grupo II fue un 59,2% más baja que durante los 120min de laparoscopia en ausencia de clampaje aórtico (1,40ml/kg/h).
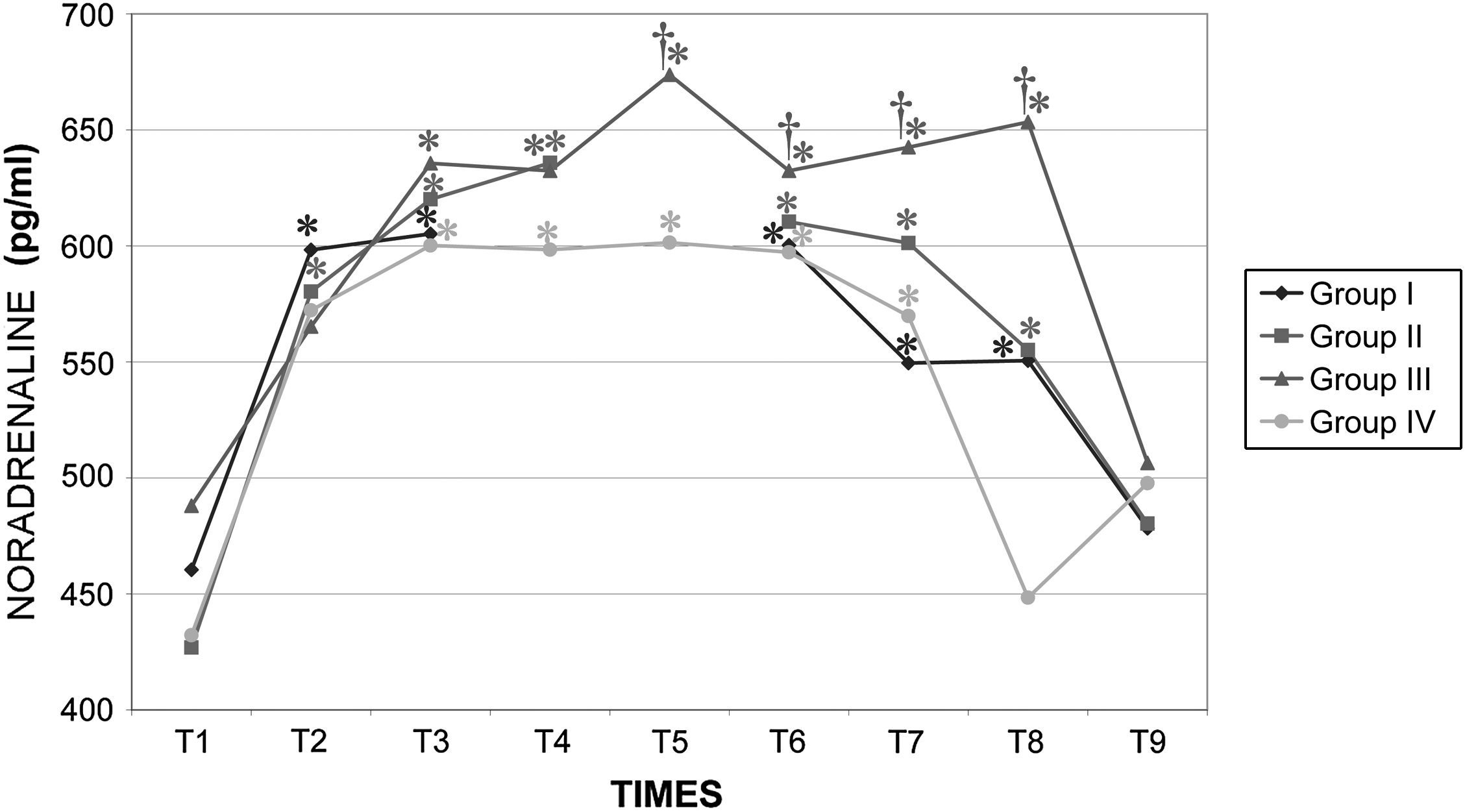
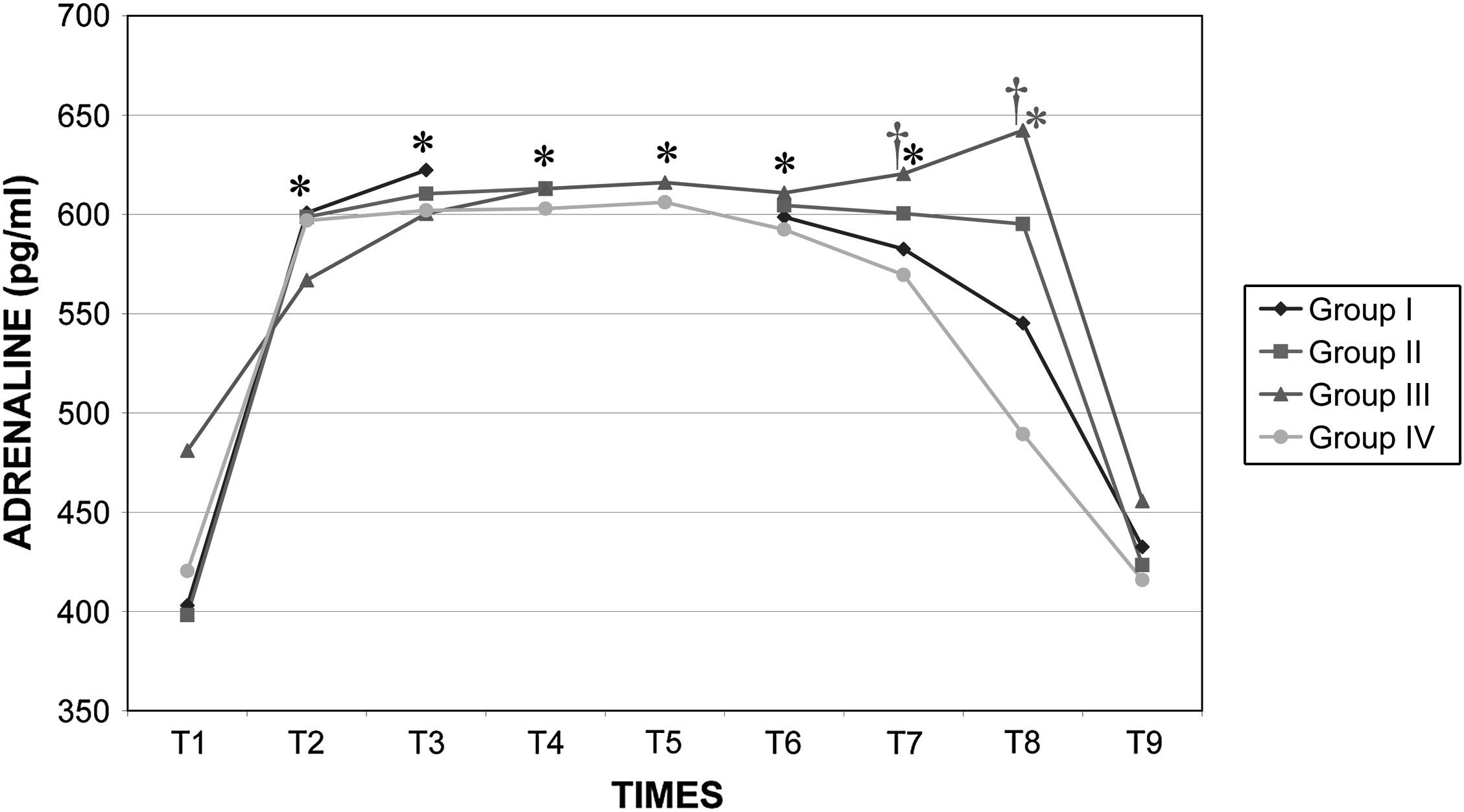
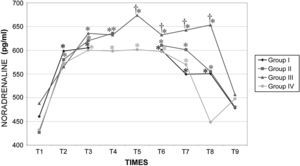
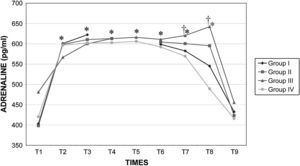
Durante la cirugía la concentración de catecolaminas fue similar en todos los grupos. Inmediatamente después de crear el neumoperitoneo, se observó un aumento significativo (p<0,001) de la concentración plasmática de adrenalina y noradrenalina, y estos valores permanecieron altos durante todo el procedimiento. Los valores determinados en el período postoperatorio inmediato (30 y 60min después del desclampaje) aumentaron con una duración creciente del clampaje aórtico, pero esto dejó de observarse a las 24h (figs. 11 y 12).
Concentraciones plasmáticas de noradrenalina en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; NORADRENALINE (pg/ml): noradrenalina (pg/ml); TIMES: tiempos.
Concentraciones plasmáticas de adrenalina en cerdos anestesiados con sevoflurano, fentanilo y vecuronio durante cirugía laparoscópica con (grupos I, II y III) o sin (grupo IV) clampaje aórtico. ∗Cambio significativo desde el período basal (p<0,05). †Significativamente diferente del grupo IV (p<0,05) (neumoperitoneo de 120min en ausencia de clampaje aórtico, grupo de control). ADRENALINE (pg/ml): adrenalina (pg/ml); Group I: grupo I; Group II: grupo II; Group III: grupo III; Group IV: grupo IV; TIMES: tiempos.
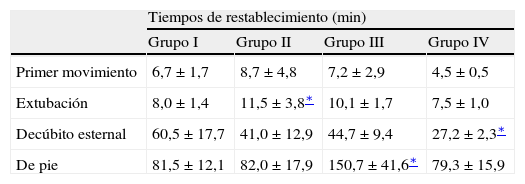
Entre grupos no se observaron diferencias significativas en los tiempos de restablecimiento, excepto para el tiempo hasta ponerse de pie, que fue significativamente más prolongado en el grupo III (animales que se sometieron a 120min de clampaje aórtico) (tabla I). En todos los animales la evaluación neurológica postoperatoria fue normal durante los 10 días en los que se evaluaron la conducta, movimiento, postura y reflejos bulbares (rotuliano, flexor, panicular y anal).
Tiempos de restablecimiento en cerdos anestesiados con sevoflurano, fentanilo, y vecuronio y sometidos a cirugía laparoscópica con (grupos I, II, y III) o sin (grupo IV) clampaje aórtico
La cirugía laparoscópica para el tratamiento de la patología aneurismática u oclusiva aórtica es un procedimiento emergente. Los estudios previos llevados a cabo por nuestro grupo han identificado un efecto sinérgico del neumoperitoneo y el clampaje aórtico con respecto a las consecuencias hemodinámicas, metabólicas y renales. Los efectos de la insuflación de CO2 en la cavidad peritoneal aumentan los inducidos por el clampaje aórtico infrarrenal y el desclampaje; por esta razón, en este contexto, las repercusiones de un abordaje laparoscópico son más graves que las de una técnica abierta. En conjunto, estos dos factores causan una disminución de la perfusión renal y una acidosis, que afecta negativamente al estado general del paciente durante este procedimiento quirúrgico25.
Por otra parte, es bien conocido que la duración del clampaje influye en los resultados de estas intervenciones pero no se dispone de datos claros que determinen un tiempo de clampaje umbral después del cual pueda comprometerse el restablecimiento del paciente. Con el presente estudio, tratamos de comprender con más detalle este importante problema y comparar los cambios fisiológicos que acontecen durante la cirugía laparoscópica aórtica abdominal infrarrenal con diferentes tiempos de clampaje, para determinar qué duración puede inducir cambios fisiológicos graves que impidan la realización del procedimiento quirúrgico sin riesgos. Por lo tanto, el objetivo del presente estudio fue ayudar a seleccionar correctamente a los pacientes en los que estaría indicada esta técnica. Se recomienda el adiestramiento previo en un modelo animal para evitar tiempos de clampaje excesivamente prolongados.
Están bien documentadas las consecuencias cardiovasculares sistémicas del clampaje aórtico infrarrenal durante la cirugía aórtica abdominal tanto en el ser humano8 como en cerdos26 y se ha descrito que son muy parecidas. Por lo tanto, este modelo animal reproduce con exactitud los cambios observados en el ser humano. De forma parecida, recientemente, se han descrito sus repercusiones durante la cirugía laparoscópica. El control hemodinámico del clampaje aórtico fue similar para ambos abordajes quirúrgicos en cerdos25. En este estudio previo, al igual que en la presente investigación, el neumoperitoneo indujo un aumento significativo de la PA y la RVS. En términos generales, la mayor PA observada podría atribuirse al aumento de la presión intraabdominal. La creación de un neumoperitoneo desencadena un aumento de la RVS y la PA para compensar la disminución del GC secundaria a la disminución del retorno venoso27, según se observó en el presente estudio. En nuestra opinión, la hipertensión arterial también puede estar causada por cualquiera de estos tres factores: la compresión mecánica del lecho vascular esplácnico, el reflejo simpático a partir de las regiones esplácnicas, y la liberación de los mediadores de la vasoconstricción humoral, como la renina o la vasopresina28-30.
El clampaje de la aorta también indujo un aumento pronunciado de la PA, muy probablemente debido al aumento súbito de la impedancia del flujo sanguíneo aórtico y el aumento consiguiente de la tensión de la pared ventricular sistólica o de la poscarga. Sin embargo, también podrían ser importantes factores como la contractilidad miocárdica, precarga, volemia, y activación del sistema nervioso simpático31. En el presente estudio, en todos los grupos, después de la creación del neumoperitoneo, se observaron aumentos significativos de la concentración plasmática de adrenalina y noradrenalina y ambos parámetros permanecieron elevados durante la cirugía. Por lo tanto, consideramos que esto podría haber desempeñado un papel en el aumento de la PA. Aunque en diversas publicaciones no se han destacado respuestas hemodinámicas significativas al clampaje infrarrenal32,33, en general, la respuesta hemodinámica consiste en un aumento de la PA (7-10%) y de la RVS (20-32%) sin cambios significativos de la frecuencia cardíaca8-10,34. En general, el GC disminuye en un 9-33%33. Los cambios descritos en las presiones de llenado ventricular no han sido constantes11,35. En el presente estudio, los cambios de estos parámetros observados en los grupos siguieron un patrón similar. Por lo que respecta al efecto de los tiempos de clampaje sobre las variables hemodinámicas registradas, la presión arterial y la frecuencia cardíaca aumentaron significativamente a los 120min del clampaje para compensar la disminución concurrente y muy significativa (y mantenida con el tiempo) del gasto cardíaco. La taquicardia compensadora es el mecanismo normal de respuesta usado para mantener el GC y compensar la disminución del retorno venoso36,37. Estos parámetros siguieron siendo altos tras el desclampaje aórtico.
A pesar del aumento de la PA y RVS y de la disminución del GC secundarios a la creación del neumoperitoneo, los valores de estas variables durante la cirugía fueron similares entre los grupos I, II y IV. Por esta razón, creemos que el clampaje aórtico de hasta 60min no afecta de manera importante a los cambios hemodinámicos relacionados con el neumoperitoneo, como se demostró por el hecho de que estas variables cambiaron en ausencia de clampaje en el grupo IV. Sin embargo, se observaron unas repercusiones hemodinámicas más pronunciadas con tiempos de clampaje>60min.
Después de la insuflación intraabdominal, el CO2 se absorbe parcialmente y requiere una eliminación a través de los pulmones. Por consiguiente, cuando la función pulmonar está comprometida, puede desarrollarse hipercapnia, lo que da lugar a acidosis y depresión de la función miocárdica, que, en último término, puede inducir arritmia y colapso cardiovascular27. Sin embargo, la SpO2 puede mantenerse fácilmente en valores>90% durante este tipo de procedimiento quirúrgico, siempre que se proporcione un soporte ventilatorio correcto. Por esta razón, en este estudio se utilizó ventilación controlada para mantener una concentración espiratoria de CO2 de 35-40 mmHg durante todo el procedimiento. Esto se obtuvo aumentando la ventilación minuto desde 3,5±0,2 l/min antes de la laparoscopia hasta 4,7±0,4 l/min durante la laparoscopia y con el mantenimiento de una tasa ventilatoria de 10-12 respiraciones/min, de modo que pudo evitarse la hipercapnia38,39. En ausencia de enfermedad cardiopulmonar preexistente, se ha descrito que la insuflación de CO2 en la cavidad peritoneal hasta una presión intraabdominal<15 mmHg no interfiere significativamente con el intercambio de gases pulmonares. Durante la creación del neumoperitoneo de 60min de duración, se observó una correlación estadísticamente significativa entre la PaCO2 y la concentración espirada de CO240,41. Tras el clampaje, en los grupos II y III se observó una disminución significativa del pH. Este parámetro siguió siendo bajo en estos grupos durante el clampaje de la aorta y no se restablecieron los valores basales hasta 30min después del desclampaje. Esto podría atribuirse al efecto combinado del clampaje aórtico y el neumoperitoneo, que podría dar lugar al desarrollo de una acidosis mixta de origen metabólico y respiratorio. La acidosis observada en los grupos II y III no estuvo compensada por los cambios ventilatorios descritos previamente, por lo que indujo un aumento de los valores de bicarbonato y propició que consideráramos su origen metabólico e hipercápnico mixto, según ha propuesto previamente Tobias et al42. En el grupo III la disminución de bicarbonato observada sugiere una acidosis sostenida en dicho grupo. En los otros grupos, la acidosis fue aguda; por lo tanto, este parámetro no tuvo tiempo suficiente para disminuir. Es bien conocido que, durante la acidosis aguda, los valores de HCO3– en general no se modifican. Además, la disminución del flujo sanguíneo (bajo gasto cardíaco) y la consecuente disminución de la diuresis representan factores adicionales que limitan la reabsorción de HCO3– a través del túbulo renal proximal. Durante el clampaje aórtico de 120min, la perfusión tisular es insuficiente debido a la disminución del gasto cardíaco; por lo tanto, todos los tejidos experimentan hipoxia y se inicia un metabolismo anaeróbico a nivel celular, lo que produce una depleción de iones hidrógeno (H+) e induce una mayor acidosis. Este mismo resultado ha sido descrito previamente por Papalambros et al43, que documentaron una asociación positiva entre la duración del clampaje aórtico y las concentraciones de malondialdehído, que son un indicador de la agresión oxidativa durante la corrección quirúrgica de un aneurisma aórtico abdominal.
En hasta un 5% de los procedimientos aórticos abiertos se produce insuficiencia renal aguda que requiere diálisis como complicación grave y se asocia con una tasa de mortalidad elevada44. En el presente estudio, el aumento del IRR evidenciado durante la laparoscopia, tanto con como sin clampaje aórtico, sugiere que su incidencia puede ser mayor con este abordaje que en un procedimiento aórtico convencional. En la insuficiencia renal intervienen muchos factores. Por una parte, el clampaje aórtico desencadena cambios hemodinámicos prolongados que influyen en la función renal, aumentando la resistencia vascular renal y disminuyendo notablemente el flujo sanguíneo hasta la corteza renal45. Por otra parte, el aumento de la presión intraabdominal secundario a la insuflación de CO2 contribuye de manera marcada a la disminución significativa del flujo renal46, debido tanto a la compresión vascular del parénquima renal como a la disminución del gasto cardíaco. A pesar de la ausencia de una lesión renal permanente, en todos los grupos se observó una disminución sustancial de la diuresis (< 2ml/kg/h). Esta disminución fue más importante en el grupo de clampaje de 120min de duración. Por esta razón, al igual que debido a la existencia de una oliguria significativa durante la cirugía, está justificada una selección cuidadosa de los pacientes para los procedimientos que implican un clampaje aórtico laparoscópico, en particular en aquellos que presentan nefropatías preexistentes, para evitar un deterioro adicional de su proceso.
Durante el neumoperitoneo la presión intraabdominal aumenta la concentración plasmática de catecolaminas47. Los resultados del presente estudio indican que la insuflación de dióxido de carbono provoca su liberación durante la cirugía laparoscópica. Además, la duración del clampaje determinó diferencias significativas de sus valores a los 15 y 60min tras el desclampaje pero no después de 24h. Esto se correlacionó con el mayor compromiso hemodinámico, metabólico y renal observado en el grupo III (120min de clampaje aórtico). Por esta razón, consideramos que, al inicio del procedimiento, es obligatoria una cuidadosa monitorización hemodinámica48 y que no está indicado en pacientes con cardiopatía grave.
En el presente estudio el restablecimiento fue rápido. El tiempo medio hasta que los animales se pusieron de pie fue significativamente más prolongado en el grupo III (tiempo de clampaje 120min, comparado con los otros grupos). Es probable que esto sea atribuible a la isquemia de las patas traseras, causada por el clampaje aórtico prolongado. No obstante, en todos los animales, la evaluación neurológica postoperatoria fue normal. Como han descrito previamente Di Centa et al3, la laparoscopia permite un restablecimiento más rápido y reduce el traumatismo quirúrgico.
Los resultados experimentales del presente estudio respaldan las recomendaciones previas3 con respecto a la importancia primordial de una selección correcta de los pacientes para evitar las complicaciones graves durante la cirugía o en el período postoperatorio inmediato. Los pacientes con cardiopatías graves o insuficiencia renal no deben someterse a un clampaje aórtico laparoscópico prolongado.
Esta investigación se financió a través del Fondo de Investigación Sanitaria, Instituto de Salud Carlos III, Ministerio de Sanidad y Consumo, España (PI041172).