La inversión del flujo de la arteria carótida interna (ACI) es un medio eficaz de protección cerebral durante la implantación de un stent carotídeo. Su principal limitación es que, en ausencia de flujo colateral adecuado, es posible que el paciente no lo tolere. El objetivo del presente estudio fue determinar si la identificación preoperatoria de colaterales intracraneales con angiografía por tomografía computarizada (ATC) o por resonancia magnética (ARM) puede predecir un flujo colateral adecuado y la tolerancia neurológica de la inversión del flujo de la ACI para la protección contra la embolización. La presente investigación estudió a pacientes tratados mediante angioplastia e implantación transcervical de un stent carotídeo. La neuroprotección se realizó mediante inversión del flujo de la ACI. Se realizó en todos los pacientes una angiografía cervical y cerebral no cruenta con ATC o ARM y se detectó, como mínimo, una colateral intracraneal permeable. Se determinó la presión retrógrada media de la arteria carótida. Los cambios neurológicos durante el clampaje y la inversión del flujo de la carótida se monitorizaron de forma continua con electroencefalografía (EEG). Se incluyeron 37 pacientes con, al menos, una colateral intracraneal permeable observada en las imágenes cerebrales con ATC o ARM. La presión retrógrada media en la arteria carótida fue de 58 mmHg. Todos los procedimientos se realizaron técnicamente con éxito. No se observaron cambios EEG con la oclusión de la arteria carótida común y la inversión del flujo de la ACI. Una colateral intracraneal permeable proporciona la perfusión cerebral suficiente para realizar la oclusión e inversión del flujo de la carótida sin cambios en el EEG. El progreso continuado en las modalidades de diagnóstico no invasivo por la imagen se está haciendo de mayor utilidad en el conocimiento de la fisiología cerebral y la selección de pacientes que van a ser tratados mediante procedimientos invasivos de la arteria carótida.
La inversión del flujo de la arteria carótida interna (ACI) es un medio muy eficaz de protección cerebral durante la implantación de un stent en la arteria carótida1-10 (SAC). No obstante, en la actualidad no disponemos de medios para determinar preoperatoriamente si un paciente puede tolerar la inversión intraoperatoria del flujo de la ACI para SAC. Los primeros estudios publicados documentan un número reducido pero definitivo de pacientes que manifestaron una intolerancia neurológica significativa (0-4% en diferentes series) en el momento de la oclusión de la arteria carótida común (ACC) con inversión del flujo de la ACI1,5,6,8,9,11. Se ha formulado la teoría de que la hipoperfusión es consecuencia del escaso desarrollo de circulación colateral intracraneal o su ausencia5,7,12. En los últimos años, la angiografía por tomografía computarizada (ATC) y la angiografía por resonancia magnética (ARM) han demostrado ser las técnicas más útiles para la evaluación no invasiva de la circulación cervical y cerebral13-19.
El primer objetivo del presente estudio fue determinar si la identificación preoperatoria de colaterales intracraneales con ATC o ARM se correlacionaba con la ausencia de disfunción neurológica durante la oclusión de la ACC y la inversión del flujo de la ACI. Este estudio no se diseñó para evaluar los resultados a corto o largo plazo de la implantación de un stent en la carótida utilizando inversión de flujo para la neuroprotección. Con este fundamento, evaluamos prospectivamente la capacidad para tolerar la inversión intraoperatoria del flujo de la ACI de 37 pacientes con, al menos, una colateral intracraneal permeable. Todos los pacientes se trataron con la implantación de un SAC transcervical con inversión de flujo de la ACI para neuroprotección. Un segundo objetivo del estudio fue determinar la frecuencia con la que se presentan colaterales intracraneales en los pacientes tratados mediante procedimientos de revascularización carotídea. Con este objetivo revisamos la circulación intracraneal explorada mediante ATC y ARM en los últimos 76 pacientes en los que hemos realizado una intervención de la carótida (tanto implantación de un stent como endarterectomía). Una vez más, el objetivo del presente estudio no fue la comparación de los resultados entre la implantación de un stent transcervical y otros tipos de revascularización carotídea, sino la evaluación de la anatomía del polígono de Willis en una cohorte de pacientes tratados mediante intervenciones de la carótida.
Materiales y MétodosEfectuamos un análisis retrospectivo de los datos obtenidos prospectivamente de pacientes que se sometieron a angioplastia e implantación transcervical de un stent de la carótida durante un período de 24 meses, desde agosto de 2004 a agosto de 2006, en el Nebraska and Western Iowa Veterans Administration Medical Center. Además, se revisaron retrospectivamente los estudios de diagnóstico por la imagen de todos los pacientes tratados durante el mismo período con procedimientos alternativos de revascularización carotídea (incluida la endarterectomía carotídea y la implantación de un stent en la carótida por vía femoral con un sistema de protección cerebral con filtro). Todos los individuos dieron el consentimiento informado quirúrgico estándar y los procedimientos se efectuaron de acuerdo con las guías de la institución.
Obtención de imágenes de la estenosis de la carótida y de las colaterales intracranealesTodos los pacientes fueron explorados preoperatoriamente mediante eco-Doppler cervical y angiografía no invasiva cervical y cerebral con ATC o ARM. En general, la ATC fue el método de elección para la evaluación de la circulación de la carótida, mientras que la ARM se solicitó para pacientes con insuficiencia renal, alergia al contraste iodado y pacientes que requerían imágenes de resonancia magnética cerebral para la evaluación de un posible infarto agudo. Todos los estudios carotídeos con eco-Doppler fueron realizados por uno de los técnicos vasculares mediante un sistema ecográfico Acuson (Mountain View, CA) Sequoia-512 con una sonda exploradora o transductor de tipo array lineal de 8MHz. El examen eco-Doppler cervical estándar de la carótida incluyó las presiones de ambos brazos y una evaluación Doppler codificado en color del flujo de los sistemas carotídeos extracraneales bilaterales, al igual que de la arteria vertebral y subclavia. Después de una exploración sagital y transversa en modo B para evaluar la distribución y morfología de la placa, se realizó el estudio de la onda espectral obtenida en el centro de la luz de las arterias carótida común, externa e interna con un registro de la velocidad sistólica y telediastólica máximas. El grado de estenosis se evaluó utilizando las determinaciones de velocidad sistólica pico máxima y telediastólica, basadas en criterios publicados20.
La ATC del cayado aórtico y de los vasos cervicales y cerebrales, incluido el polígono de Willis, se realizó con un tomógrafo multicorte Philips (Hamburgo, Alemania) Mx8000 Multislice o con un tomógafo de 40 canales Philips Brilliance 190P. La inyección mecánica de 100ml de material de contraste (350 Omnipaque; Healthcare, Waukesha, WI) se administró en la vena antecubital con un flujo de 3,5ml/s. La exploración se inició una vez el cursor en el cayado aórtico detectó una unidad Hounfield de 100. Se realizaron cortes helicoidales de 1,3mm; empezando por debajo del cayado aórtico en dirección craneal e incluyendo el parénquima cerebral. Se evaluaron tanto las imágenes originales como la reconstrucción tridimensional (3D) de los vasos.
La ARM del cayado aórtico y los vasos cervicales y cerebrales, incluido el polígono de Willis, se realizó en un imán Philips de 1,5 Tesla. Específicamente, el cayado y las carótidas cervicales se evaluaron con secuencias en estado de equilibrio 3D en tiempo de vuelo (time of flight) con una adquisición con realce de gadolinio. Los vasos cerebrales y el polígono de Willis se visualizaron utilizando secuencias 2D en tiempo de vuelo. Se evaluaron tanto las imágenes originales como la reconstrucción multiplanar 3D de los vasos.
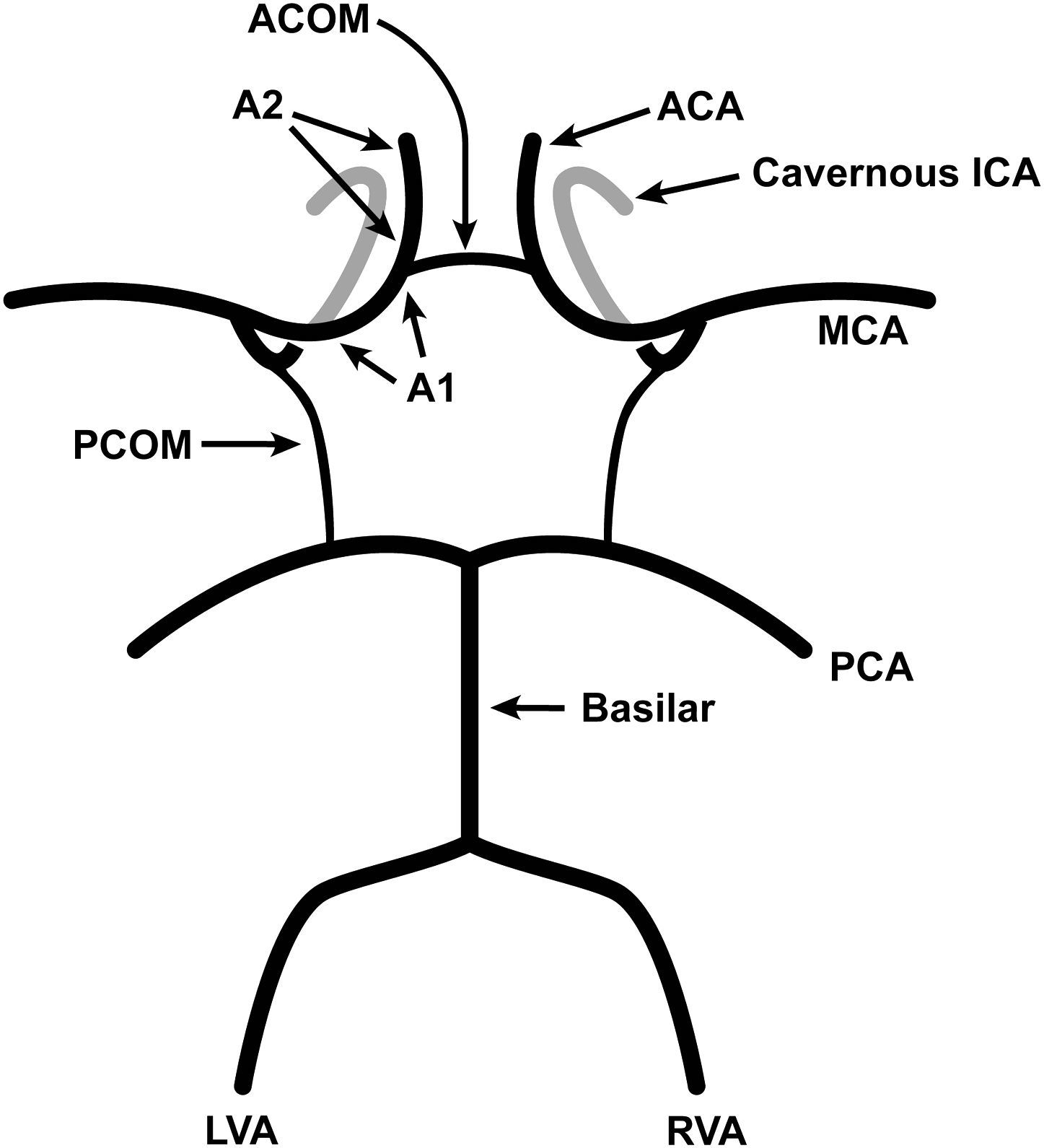
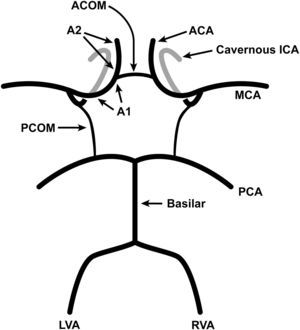
Determinación del grado de estenosis y permeabilidad de las colaterales intracranealesPara determinar el grado de estenosis de cada ACI utilizando ATC o ARM, se aplicaron los criterios del North American Symptomatic Carotid Endarterectomy Trial. A partir de estas exploraciones, se documentó la presencia o ausencia de vías colaterales intracraneales (figs. 1 y 2). La arteria comunicante anterior (AcoA) se caracterizó como permeable si se visualizó flujo que conectaba la ACI distal a través de los segmentos permeables A1. La AcoA se caracterizó como ausente si no se visualizó o en caso de ausencia de cualquiera de los segmentos A1. La arteria comunicante posterior (AcoP) homolateral se caracterizó como permeable si se visualizó flujo que conectaba la arteria basilar con la ACI distal a través de un segmento P1 homolateral permeable de la arteria cerebral posterior. La AcoP se caracterizó como ausente si no se visualizó o si la arteria cerebral posterior era de origen fetal, originándose directamente de la ACI y sin tener conexión con la arteria basilar.
Diagrama del polígono de Willis. En la base del cerebro, las arterias carótidas internas (ACI) y la arteria basilar forman un polígono de arterias comunicantes conocido como “polígono de Willis”. Éste está formado por delante por las arterias cerebrales anteriores (ACA), ramas de la ACI, que están conectadas por la arteria comunicante anterior (AcoA), y por detrás, por las dos arterias cerebrales posteriores (ACP), que están conectadas a cada lado con la ACI por la arteria comunicante posterior (AcoP). El segmento de la ACA proximal a la AcoA es el segmento A1, y el distal a la AcoA es el segmento A2. Las dos ACP son ramas de la arteria basilar, que se origina de la confluencia de la arteria vertebral izquierda y derecha (AVI y AVD, respectivamente). ACA: arterias cerebrales anteriores; ACOM: arteria comunicante anterior; ICA: arterias carótidas internas; LVA: arterial vertebral izquierda; PCA: arterias cerebrales posteriores; PCOM: arteria comunicante posterior; RVA: arterial vertebral derecha.
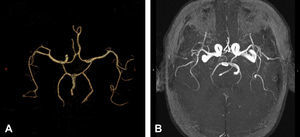
A Arteriografía por tomografía computarizada de un hombre de 75 años de edad con estenosis sintomática de la arteria carótida interna (ACI) derecha. B Angiografía por resonancia magnética (ARM) de un hombre de 82 años de edad con ictus hemisférico izquierdo secundario a estenosis de la ACI izquierda. En ambos pacientes, la reconstrucción 3D de la circulación intracraneal muestra el polígono de Willis completo con una arteria comunicante anterior (AcoA) y una arteria comunicante posterior (AcoP) permeables, fácilmente visibles.
Nuestra técnica quirúrgica se ha descrito previamente con detalle8,21. Los procedimientos se efectuaron en el quirófano con un aparato OEC 9800 portátil de brazo C móvil con un intensificador de imágenes de 12 pulgadas (OEC Medical Systems, Salt Lake City, UT) y una mesa de fibra de carbono con la superficie motorizada en cuatro direcciones (Allegro 6800 Mobile Imaging Table; Orthopedic Systems, Union City, CA). El paciente fue posicionado en decúbito supino en la mesa del quirófano y sometido a anestesia general. En general, ésta se indujo con propofol y se mantuvo con desflurano. La ventilación se ajustó para mantener una normocapnia. Para el control de la presión arterial, se dispuso de noradrenalina y de nitroglicerina. Después de practicar una anestesia general, se inició una monitorización electroencefalográfica (EEG). Durante la intervención, el EEG se monitorizó continuamente con un sistema de monitorización intraoperatoria de 16 canales (Cascade; Cadwell Labs, Kennewick, WA). Un técnico con experiencia monitorizó el EEG de acuerdo con las guías publicadas por la American Society of Electroneurodiagnostic Technologists.
Por vía percutánea, utilizando la técnica de Seldinger y una guía ecográfica, se colocó un introductor de 10 French en la vena yugular interna contralateral. Después de esto, se practicó una incisión de 2cm sobre la ACC justo por encima de la clavícula y se controló el vaso. Se administró una dosis de heparina para aumentar el tiempo de cefalina por encima de 250 s22. En ese momento, se realizó una prueba de clampaje de la ACC y se evaluaron posibles alteraciones en el EEG. Se consiguió un abordaje en la ACC a través de la colocación de un introductor de 9 french de 13cm de longitud (Check-Flo Introducer Set; Cook, Bloomington, IN) y se realizó una angiografía del sistema carotídeo cervical e intracraneal. Seguidamente, se clampó la ACC proximalmente al lugar de entrada del introductor y se ocluyó la arteria carótida externa (ACE) utilizando un catéter de embolectomía arterial de 4 French sobre guía (Arrow International Reading, PA) y se determinó la presión retrógrada en la ACI. Se estableció una inversión del flujo conectando los puertos laterales del introductor arterial y venoso. La inversión del flujo se examinó mediante exploración angiográfica, con y sin oclusión de la ACE. En la inmensa mayoría de los casos, se estableció una inversión del flujo adecuada (confirmada angiográficamente) sin la necesidad del balón de oclusión colocado en la ACE. A continuación, se cruzó la estenosis de la ACI utilizando una guía flexible de 0,014 pulgadas; mediante máscara de mapeo se posicionó el stent (Carotid Wallstent Monorail de 8 o 10mm de diámetro; Boston Scientific, Natick, MA), se desplegó y se dilató con un balón monorraíl hinchado hasta 8 atmósferas. Para la prevención de un episodio de bradicardia asociado a la dilatación carotídea, se infundió una dosis de 0,5-1,0mg de atropina antes de hinchar el balón. En todos los casos se obtuvo una angiografía cervical y cerebral al completar el procedimiento para confirmar la ausencia de estenosis residual y de embolia apreciables. Se retiraron los introductores y guías, y la ACC se cerró con la sutura en U que se había colocado al inicio a nivel del punto de punción. Se practicó un cierre estándar del platisma y de la piel. Los pacientes fueron explorados neurológicamente por el cirujano responsable la misma noche del día del procedimiento, el primer día postoperatorio y en cada visita clínica de seguimiento.
ResultadosCaracterísticas demográficas de los pacientes intervenidos en el período del estudioDurante el período del estudio se practicaron 80 intervenciones carotídeas. Los pacientes fueron tratados según las preferencias del cirujano responsable. Se llevaron a cabo 37 implantaciones transcervicales de un stent carotídeo, 26 endarterectomías y 7 implantaciones de un stent carotídeo con abordaje femoral. Setenta y seis de los pacientes eran hombres y 4 mujeres, con una edad media de 68 años (límites 49-84). Cuatro de estos pacientes (todos tratados con una endarterectomía carotídea) fueron intervenidos sobre la base del eco-Doppler carotídeo combinado con ATC o ARM, en las que no se dispuso de la evaluación de la circulación cerebral. Estos pacientes fueron derivados a nuestro servicio con una ATC o ARM cervical adecuada de la carótida pero sin una evaluación de la circulación cerebral, y el cirujano vascular responsable decidió realizar una endarterectomía carotídea sin obtener una segunda ATC o ARM. Los cuatro pacientes se excluyeron de un análisis adicional. Los 76 pacientes restantes (37 tratados con la implantación transcervical de un stent carotídeo, 32 con endarterectomía carotídea y 7 con la implantación de un stent carotídeo por vía femoral) se evaluaron preoperatoriamente con una combinación de eco-Doppler y ATC (58 pacientes) o ARM (18 pacientes) de las carótidas, que incluyó la descripción de la anatomía cervical y cerebral.
Resultados en pacientes sometidos a inversión del flujoEl abordaje y la implantación de un SAC fueron satisfactorios en los 37 casos tratados con implantación transcervical con resolución angiográfica (< 20% de estenosis residual) de todas las estenosis. En el momento del tratamiento, habían presentado síntomas 21 pacientes (57%). De las estenosis de la ACI, 34 eran>70 % y 3 (todas sintomáticas) eran del 50-70%. En los 30 días posteriores al procedimiento no se produjeron muertes o eventos neurológicos. En la evaluación por eco-Doppler de seguimiento (realizada después de 1 y 6 meses y, acto seguido, con carácter anual), se encontró que todos los stents carotídeos estaban permeables sin estenosis residuales significativas. Entre los 32 pacientes tratados con endarterectomía carotídea, uno falleció de pancreatitis al cabo de 20 días de la intervención, dos presentaron hematomas postoperatorios en el cuello, uno de los cuales requirió una nueva intervención, y dos presentaron disfonía transitoria postoperatoria. Entre los siete pacientes tratados con la implantación de un stent por vía femoral, no se produjeron episodios de ictus ni muertes. En un paciente no se pudo canular la ACC y, más tarde, se sometió a una endarterectomía sin incidentes.
Todos los pacientes tratados con la implantación transcervical de un stent presentaron, como mínimo, una colateral intracraneal permeable en el polígono de Willis (una AcoA o una AcoP homolateral). Específicamente, en 16 pacientes se identificó una AcoA permeable, en seis una AcoP homolateral permeable, y en 15 ambas arterias colaterales estaban permeables. En todos los pacientes se detectó como mínimo una arteria vertebral permeable. En tres pacientes se identificó una oclusión de la carótida contralateral; en los tres se detectó flujo colateral a través de la AcoP a partir del sistema vertebrobasilar permeable. El tiempo medio de inversión del flujo en la ACI fue de 22min (rango 9-32). La presión retrógrada media en la arteria carótida fue de 58 mmHg (rango 25-85). No se identificó una correlación significativa entre el grado de estenosis y la presión en el muñón (p>0,05). La oclusión de la ACC e inversión del flujo de la ACI no produjo cambios en el EEG y fue bien tolerada.
Colaterales del polígono de Willis en todo el grupoEstuvieron disponibles datos completos sobre la anatomía vascular cervical y cerebral para otros 39 pacientes tratados, durante el mismo período de tiempo, mediante revascularización carotídea con un método diferente de la implantación transcervical de un stent. De estos pacientes, treinta y dos se trataron con una endarterectomía carotídea y siete con la implantación de un stent por vía femoral. Los 39 se estudiaron con un eco-Doppler carotídeo preoperatorio combinado con una ATC o una ARM de las carótidas que incluyó la anatomía cervical y cerebral. Estos pacientes no se trataron con un stent transcervical debido a las preferencias de los cirujanos (de 18 pacientes, 12 se trataron con una endarterectomía y seis con la implantación de un stent por vía femoral), a la presencia de una placa muy calcificada23-26 identificada en la ATC y/o en el estudio con eco-Doppler (de siete pacientes, todos sometidos a endarterectomía), a circulación colateral inadecuada para la implantación de un SAC transcervical (de siete pacientes, seis tratados con una endarterectomía y uno con la implantación de un stent por vía femoral), a preferencias del paciente (de cuatro pacientes, todos tratados con endarterectomía), y a la identificación de una placa de ecolucencia elevada, con o sin un trombo cuestionable en el lugar de la estenosis26-28 mediante el estudio con eco-Doppler y/o ATC (tres pacientes, todos tratados con una endarterectomía). En cuatro de los pacientes con colaterales inadecuadas se detectó una AcoA permeable y una AcoP ausente con una ACI contralateral ocluida, en dos se detectó una AcoA permeable y una AcoP ausente con la oclusión del segmento A1 de la arteria cerebral anterior contralateral, y en uno la AcoA y AcoP no eran permeables. Por consiguiente, en la serie del presente estudio basada en la evaluación preoperatoria con ATC o ARM para el tratamiento mediante procedimientos de revascularización carotídea, se detectaron pruebas de colaterales intracraneales insuficientes en siete de 76 pacientes (9%).
DiscusiónLa inversión del flujo es una técnica establecida de neuroprotección aplicada para la implantación de un SAC por vías transcervical y femoral7,29. El método posee ventajas conceptuales separadas comparado con la protección distal con filtros22,24,27. Estas ventajas incluyen el inicio de la neuroprotección antes de cruzar la lesión11,30, la ausencia de complicaciones (traumatismos, disecciones o espasmo) a partir de la interacción con la ACI12,22,24,27,31,32, y la eliminación de ateroembolias detectadas con eco-Doppler transcraneal durante la neuroprotección21. La falta de tolerancia del paciente de la inversión del flujo debido a disfunción neurológica intraoperatoria es el principal inconveniente de la técnica3. Dicho esto, la inversión del flujo puede ser mejor tolerada que su interrupción en la ACI, y la inversión del flujo puede aumentar el flujo colateral a través del polígono de Willis1,5,6,8,9,21. Es interesante destacar que la tasa descrita de intolerancia a la inversión del flujo de la ACI es del 0-4% en diferentes series4, lo que parece ser ligeramente mejor que la tasa del 5-15% descrita para las series de oclusión con balón de la ACI11,33. Aunque previamente se han documentado diversos casos de intolerancia neurológica en el momento de la implantación transcervical de un SAC, sólo se ofrecieron detalles de dos de ellos. Ambos pacientes presentaban una oclusión de la ACI contralateral y un ictus contralateral antiguo. Por desgracia, no se hacía mención de los patrones vasculares en relación con la integridad de las colaterales intracraneales4. El presente estudio demuestra que los pacientes que presentan, como mínimo, una colateral permeable del polígono de Willis en los estudios de ATC o ARM, pueden tolerar tanto el clampaje de la ACC como la inversión del flujo de la ACI incluso en presencia de oclusión de la ACI contralateral. Estos datos sugieren que la ATC o la ARM pueden ofrecer una evaluación preoperatoria no invasiva de la circulación cerebral colateral y predecir la capacidad de un paciente para tolerar la inversión del flujo carotídeo, mediante delimitación de los patrones y de la suficiencia de las colaterales intracraneales. El análisis de los datos del presente estudio, realizado a partir de un extenso grupo de pacientes sometidos a intervenciones de revascularización carotídea (implantación de un stent o endarterectomía) en un centro de asistencia terciaria, reveló que en el 9% se identificaron pruebas de colaterales intracraneales inadecuadas cuando se estudiaron preoperatoriamente con ATC o ARM. Estos datos demuestran que la inmensa mayoría (> 90%) de los pacientes que requieren revascularización carotídea pueden someterse sin riesgos tanto a un clampaje de la ACC como a una inversión del flujo, y que el requisito de los patrones de colaterales puede identificarse de modo fiable con una evaluación preoperatoria no invasiva mediante ATC y ARM. La importancia de estos hallazgos es evidente porque estas técnicas de diagnóstico por la imagen tienen la posibilidad de identificar a pacientes que tolerarán sin problemas la detención del flujo (endarterectomía carotídea o implantación de un stent de la carótida con oclusión mediante balón de la ACI distal) o la inversión del flujo (implantación de un stent de la carótida con clampaje de la ACC e inversión del flujo de la ACI).
Con la mejora de la tecnología, la ARM y la ATC proporcionan imágenes anatómicas excelentes de los vasos cerebrales e información específica con respecto a la dinámica del flujo en el polígono de Willis34. Previamente, se ha demostrado que las colaterales intracraneales identificadas mediante ARM se correlacionan con la presión retrógrada en la ACI en el momento de la endarterectomía carotídea34. El estudio demostró que la oclusión del segmento A1 de la arteria cerebral anterior combinada con la oclusión de AcoP se correlacionó con presiones retrógradas más bajas de la ACI. Sin embargo, el estudio no incluyó una correlación directa entre la presencia de colaterales y la tolerancia neurológica de la detención del flujo en la ACI. Los hallazgos del presente estudio coinciden con los de estudios previos que demuestran que la arteriografía convencional puede usarse para predecir la isquemia cerebral como consecuencia de la detención del flujo de la carótida durante la endarterectomía carotídea y para determinar la necesidad de implantación de una derivación17,35. Esta investigación pionera demostró que la inserción de una derivación fue uniformemente innecesaria para prevenir la isquemia intraoperatoria durante la realización de una endarterectomía35 cuando está presente el llenado cruzado de la arteria carótida contralateral, mientras que la ausencia de flujo contralateral fue una variable con valor pronóstico de isquemia cerebral intraoperatoria17. No obstante, la angiografía convencional alberga un riesgo sustancial (1-3%) de isquemia cerebral sintomática relacionada con el procedimiento36-38 y un riesgo mucho mayor (23-44% en los diferentes estudios) de episodios isquémicos clínicamente silentes, según lo identificado mediante la exploración con resonancia magnética ponderada en difusión13-19,39. Además, la práctica de una arteriografía convencional es significativamente más difícil porque requiere una canulación de cuatro vasos y una posible compresión de la ACC contralateral para obtener resultados óptimos40.
Los pacientes no evaluados en este estudio fueron aquellos con circulación colateral insuficiente en las imágenes realizadas por ATC y ARM; estos pacientes se sometieron a endarterectomía o a la implantación de un stent en la carótida con un dispositivo de protección provisto de un filtro. En nuestra practica habitual, realizamos una derivación en todos los pacientes durante la endarterectomía carotídea y, por lo tanto, no disponemos de datos para evaluar si la ausencia de colaterales intracraneales adecuadas predeciría la intolerancia neurológica de la detención del flujo en la ACI durante la EAC. Las características de estos pacientes y su tolerancia de la detención del flujo carotídea o la inversión del flujo no han sido examinadas en la presente investigación y han de ser estudiadas con mayor detalle. La mejora progresiva tecnológica de la ATC y la ARM contribuirá a definir no sólo las colaterales asociadas al polígono de Willis sino también las presentes entre la ACE, ACI y las colaterales lemptomeníngeas. Estos datos mejorarán nuestro conocimiento sobre la fisiología de la detención e inversión del flujo de la ACI en este grupo de pacientes, ya que se ha demostrado que muchos de ellos toleran la oclusión de la carótida en el momento de la endarterectomía y, probablemente, tolerarán también la inversión del flujo17,35.
Dos limitaciones potenciales del presente estudio merecen una discusión adicional. En primer lugar, desde un punto de vista metodológico, en lugar de la estrategia utilizada en la presente serie, donde los cirujanos responsables efectuaron todas las evaluaciones, habría sido preferible que las evaluaciones neurológicas hubieran sido realizadas por un médico independiente (un neurólogo u otro profesional titulado por los National Institutes of Health [NIH]). Sin embargo, al igual que la mayor parte de los cirujanos vasculares expertos en intervenciones carotídeas, el grupo del presente estudio tiene mucha experiencia en la evaluación de los síndromes ictales y en el uso de la escala de ictus del NIH, y la mayor parte de los estudios retrospectivos sobre revascularización de la carótida incluyen una evaluación neurológica obtenida por el equipo de cirujanos que efectúa las intervenciones. En segundo lugar, la monitorización del EEG fue el método primario usado para la documentación intraoperatoria de la tolerancia neurológica de la inversión del flujo en los pacientes del presente estudio41. Aunque es menos directo que la evaluación del estado neurológico en el paciente en estado de vigilia, el EEG se caracteriza por una capacidad establecida para detectar la isquemia cerebral durante la cirugía de la carótida42-44 efectuada con anestesia general. Ciertamente, diversos estudios demuestran que el uso de EEG intraoperatorio durante la revascularización carotídea documenta apropiadamente los déficits neurológicos42 y reduce significativamente las tasas de ictus perioperatorio43,44.
Los datos del presente estudio demuestran que una colateral intracraneal permeable proporciona una perfusión cerebral suficiente para practicar la oclusión e inversión del flujo de la carótida sin cambios neurológicos. Además, en la gran mayoría de los pacientes que requieren endarterectomía o implantación de un stent carotídeo están presentes colaterales intracraneales y pueden identificarse preoperatoriamente de manera fiable y no invasiva con ATC o ARM. Los progresos continuados en las técnicas no invasivas de diagnóstico por la imagen, mediante ATC o ARM, aportan un mayor conocimiento de la fisiología cerebral, y ofrecen la posibilidad de establecer un plan preoperatorio detallado, al igual que una estrategia de selección óptima de los pacientes que requieren procedimientos carotídeos invasivos.