La revascularización percutánea de la arteria renal para tratar la hipertensión arterial y la insuficiencia renal es común en la actualidad, y cada vez es más obvio que la intervención en la arteria renal puede estar asociada con lesiones en el parénquima. La frecuencia, la causa y los resultados de las lesiones funcionales agudas asociadas con la intervención renal están poco perfiladas. Nuestro objetivo fue determinar la frecuencia de dichas lesiones 30 días después de la intervención sobre la arteria renal, para identificar los factores asociados y determinar si la disfunción renal funcional relacionada con el procedimiento está asociada con sucesos clínicos adversos diferidos. Se realizó un análisis retrospectivo de los pacientes sometidos a angioplastia de la arteria renal por afectación aterosclerótica entre 1990 y 2007. No se utilizaron dispositivos de protección embólica distal. La disfunción renal del parénquima renal se definió como un aumento persistente de las concentraciones séricas de creatinina≥0,5mg/dl un mes después de la intervención. Se determinó la ausencia de morbilidad por causas renales (aumento persistente de la creatinina>20% de los valores iniciales, progresión a hemodiálisis y fallecimiento por causas renales) y la supervivencia del paciente. Cuatrocientos dieciocho pacientes fueron sometidos a 581 angioplastias de la arteria renal: 57% por hipertensión arterial, 23% por hipertensión arterial asociada a insuficiencia renal crónica, y 12% por insuficiencia renal aislada. En el 30% de los pacientes se produjeron lesiones renales funcionales agudas. La presencia de una disfunción renal se asoció con una disminución significativa de la ausencia de morbilidad por causas renales (media±EEM 80±2% frente a 55±10%, ausencia de lesión frente a lesión, p<0,01) y con una disminución notable de la supervivencia durante el seguimiento a los 5 años (71±4% frente a 41±10%, p<0,01). Durante este período, el triple de pacientes con lesiones funcionales evolucionó a hemodiálisis en comparación con los pacientes que no las presentaron (19 frente a 7%, p<0,01). Mediante el análisis multivariante, la presencia de un aneurisma aórtico abdominal (AAA) no reparado, una tasa de filtración glomerular baja, diabetes mellitus no insulinodependiente, arteriopatía renal contralateral, y un riñón solitario estuvieron asociados de forma significativa con lesiones funcionales y pobres efectos clínicos beneficiosos a largo plazo. Se encontró que la hipertensión arterial, la hiperlipidemia, y el volumen del contraste no fueron significativos. Las lesiones renales funcionales se producen en aproximadamente el 20% de los pacientes sometidos a intervención percutánea de la arteria renal y son más probables en presencia de un AAA no reparado, diabetes mellitus no insulinodependiente, y enfermedad renal preexistente. La disfunción renal aguda es un factor predictivo negativo de la supervivencia y está asociada con una mayor tasa de insuficiencia renal posterior, necesidad de diálisis y muerte. Si bien este estudio no permite establecer una relación causal, los pacientes que están predispuestos a la disfunción renal aguda pueden presentar factores subyacentes que también conduzcan a una disminución de la función renal a largo plazo y a una disminución de la supervivencia.
La presencia de estenosis aterosclerótica de la arteria renal está asociada con hipertensión arterial mal controlada e insuficiencia renal progresiva que conducen a nefropatía isquémica y otras lesiones en órganos vitales1,2. Los argumentos actuales para justificar la actitud intervencionista se basan principalmente en la constatación del hecho de que la estenosis progresa en el 51% de las arterias renales a los 5 años del diagnóstico, el 25% de los que presentan una estenosis>60% desarrollará atrofia renal en 2 años, y aproximadamente el 5% anual de las arterias renales con estenosis>60% progresará a oclusión3,4. El tratamiento endoluminal se ha convertido en una alternativa a la revascularización quirúrgica ya que puede ofrecerse a un mayor porcentaje de pacientes afectados con una mortalidad y morbilidad relativamente bajas; sin embargo, los resultados funcionales a largo plazo parecen ser equivalentes2,5,6. Muchos estudios han demostrado el éxito técnico y anatómico inmediato y a largo plazo de esta intervención, y su frecuencia va en aumento, a pesar de un bajo nivel de prueba para demostrar su eficacia en todos los pacientes y los datos limitados sobre la tasa de morbilidad aguda y a largo plazo relacionada con la intervención. Además, los factores clínicos asociados con las lesiones renales relacionadas con la intervención siguen estando mal definidos, al igual que el impacto de dicha lesión en la morbilidad renal a largo plazo y la supervivencia del paciente2,5,7-14. El objetivo de este estudio fue determinar la frecuencia de la disfunción renal funcional aguda 30 días después de las angioplastias de la arteria renal, para identificar los factores asociados a la misma y determinar si este tipo de lesión relacionada con la intervención está asociada con los episodios clínicos adversos diferidos durante el seguimiento.
MétodosDiseño experimentalTomamos muestras de una base de datos mantenida de forma prospectiva sobre las angioplastias de la arteria renal a causa de arteriopatía renal aterosclerótica entre junio de 1990 y junio de 2007, e identificamos aquellos pacientes sometidos a intervención percutánea por nefropatía vascular sintomática. La disfunción renal aguda se definió como un aumento persistente en las concentraciones séricas de creatinina≥0,5mg/dl un mes después de la intervención. Se determinó la ausencia de morbilidad renal (aumento persistente de la creatinina>20% del valor inicial, progresión a hemodiálisis y fallecimiento por causas renales) y supervivencia del paciente. En cada paciente se identificaron los datos demográficos, los procesos comórbidos existentes, y los factores de riesgo de aterosclerosis.
Algoritmo de tratamientoLos pacientes con hipertensión arterial, aumento de las concentraciones séricas de creatinina, insuficiencia cardíaca congestiva, o disminución de la masa renal fueron sometidos a un estudio diagnóstico para identificar la presencia de estenosis de la arteria renal. Este estudio consistió en una angiografía estándar, una angiografía por resonancia magnética, una gammagrafía renal con isótopos, o un eco-Dopppler. Los criterios para identificar la estenosis de la arteria renal en el eco-Dopppler se han descrito con anterioridad. La angiografía se realizó en presencia de los criterios clínicos definidos por Rundback et al15 y de una estenosis>60% en la ecografía o la angiografía por resonancia magnética o una gammagrafía renal positiva. Las intervenciones se realizaron en pacientes con estenosis renal≥50% en la angiografía, independientemente de las comorbilidades. Los pacientes que no cumplieron los criterios clínicos establecidos recibieron tratamiento médico. Los riñones afuncionales no fueron tratados. En presencia de patología bilateral, los criterios clínicos para el tratamiento de ambos riñones fueron los mismos que los de la estenosis solitaria de la arteria renal. Tras la intervención se realizó el seguimiento de los pacientes a intervalos de 6 meses y durante estos intervalos se determinó la presión arterial, la concentración sérica de creatinina, y el número de fármacos antihipertensivos. Se realizó como mínimo un eco-Dopppler a cada paciente a los 6 meses de la intervención y posteriormente una ecografía cada 6 meses para evaluar la permeabilidad. Si el eco-Dopppler mostró una estenosis≥60% y el paciente presentó síntomas recurrentes, se realizó una angiografía y la reestenosis se trató si fue≥50%.
DefinicionesLa arteriopatía coronaria se definió como antecedentes de angina de pecho, infarto de miocardio, cardiopatía congestiva, o revascularizaciones coronarias previas. La enfermedad cerebrovascular incluyó antecedentes de ictus, crisis isquémicas transitorias, o revascularización de la arteria carótida. La hipercolesterolemia se definió como una concentración de colesterol en ayunas>200mg/dl. La diabetes se definió como una concentración de glucosa plasmática en ayunas>110mg/dl o una HbA1c>7%. Los diabéticos se clasificaron como insulinodependientes (DMID) o no insulinodependientes (DMNID). La hipertensión arterial se definió como una presión arterial sistólica>140 mmHg o una presión arterial diastólica>90 mmHg en 3 ocasiones durante un período de 6 meses. El síndrome metabólico se definió como se ha descrito previamente16 (resistencia a la insulina o alteración en la tolerancia a la glucosa, hipertensión arterial, dislipidemia, y obesidad abdominal), con la excepción de la circunferencia abdominal, que no se registró de forma rutinaria. Una puntuación del índice de masa corporal≥27,0 sustituyó como puntuación positiva a una circunferencia abdominal>102 o>88cm para pacientes hombres o mujeres, respectivamente. La creatinina elevada se definió como un valor≥1,5mg/dl en dos ocasiones consecutivas durante un período de 3 meses. La insuficiencia renal crónica se definió como una concentración de creatinina en suero>1,5mg/dl durante más de 6 meses. La tasa de filtración glomerular estimada (TFGe) se definió como 186,3 ∗ creatinina sérica−1,154∗ edad−0,203∗ 0,742 (si mujeres) ∗1,212 (si afroamericanas). La concentración inicial de creatinina sérica fue el valor registrado más cercano a la intervención. Se consideró que los pacientes presentaron un ‘‘riñón afuncional'’ si cumplían dos de los siguientes criterios locales utilizados en nuestro centro durante el tiempo del estudio: 1) eco-Dopppler identificando una longitud entre polos renales<9cm sin flujo renal en la arteria renal principal y velocidad sistólica máxima en el parénquima<10cm/s, 2) ausencia renal (quirúrgica o congénita), o 3) nefrograma no visible en el arteriograma con contraste. El índice de resistencia renal se definió en el eco-Doppler como 100 × (1 – [EDV/PSV]). La nefroesclerosis se definió de la siguiente forma: grado 1, vasos intrarrenales normales, progresión ordenada de los patrones ramificados (sin recorte), nefrograma normal con diferenciación de la unión corticomedular; grado 2, ectasia de las arterias arqueadas e interlobares distales, recorte periférico, reducción del volumen arterial con masa renal normal, nefrograma normal; grado 3, ectasia destacada extendiéndose centralmente, recorte total con terminaciones abruptas de la arteria interlobar, volumen arterial notablemente reducido con disminución de la masa renal, nefrograma débil o ausente. El éxito de la intervención endoluminal fue una estenosis residual<30%; se consideró su fracaso ante estenosis residuales≥30%, determinadas mediante angiografía, incluidas las lesiones incapaces de ser dilatadas o atravesadas y oclusión a los 30 días. El fallecimiento en los primeros 30 días tras la intervención se consideró relacionado con la misma. Las respuestas iniciales de la función renal a la angioplastia se definieron del siguiente modo: la curación de la función renal requirió una concentración de creatinina sérica<1,5mg/dl; la función renal estable, un aumento o reducción<20% en la concentración de creatinina sérica; la mejoría de la función renal, una reducción>20% en la concentración de creatinina sérica; el deterioro de la función renal se consideró como fracaso del tratamiento y requirió un aumento>20% en la concentración de creatinina sérica15. Con el objeto de notificar la ausencia de morbilidad por causas renales, se definió dicha morbilidad del siguiente modo: 1) un aumento (> 20%) persistente en la concentración de creatinina sérica con respecto a los valores iniciales, 2) la progresión a hemodiálisis, y 3) el fallecimiento por causas relacionadas con el riñón15.
Análisis estadísticoRealizamos nuestro análisis sobre la base de la intención por tratar. Los valores determinados se muestran como porcentajes o medias±1 desviación estándar. Las tasas de supervivencia y de efectos beneficiosos clínicos se calcularon utilizando un análisis de tabla de vida utilizando los criterios de la Society for Vascular Surgery. Los errores estándar se presentan en análisis de la tabla de vida. Se utilizó el test del rango logarítmico para determinar las diferencias entre las tablas de vida. Los análisis se realizaron utilizando el programa SAS versión 8.2 (SAS Institute, Cary NC). El modelo de riesgos proporcionales de Cox se utilizó para los criterios de evaluación dependientes del tiempo. Se comprobó la asunción de los riesgos proporcionales y se confirmaron las covarianzas significativas utilizando las curvas logarítmicas (-log[supervivencia]). La asociación de la mortalidad con la reestenosis, la necesidad de hemodiálisis, y los resultados clínicos a largo plazo se comprobaron en modelos univariantes separados, con la covarianza dependiente del tiempo. Se utilizaron los modelos de regresión logística para los criterios determinados al poco tiempo de la intervención (complicaciones, efectos beneficiosos clínicos a corto plazo). La dependencia de cada covariable en el resultado se comprobó en primer lugar de forma separada utilizando el test chi cuadrado. Las covariables con un nivel de significancia p≤0,10 se incluyeron en el análisis de multivarianza gradual.
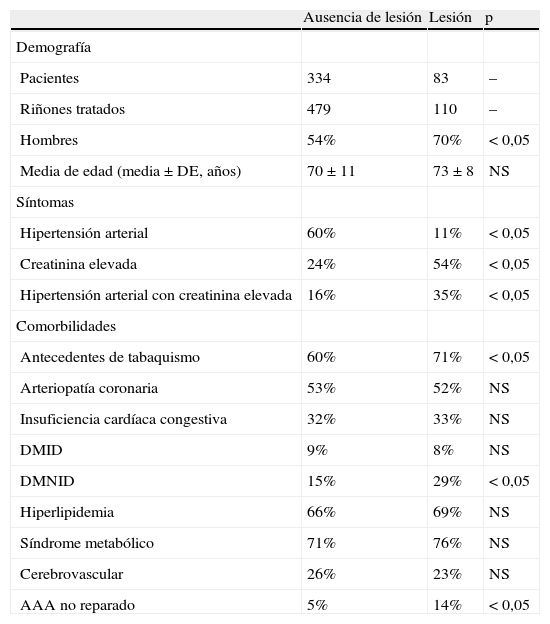
ResultadosPoblación global de pacientesCuatrocientos dieciocho pacientes fueron sometidos a 581 angioplastias de la arteria renal (1990-1995 124, 1996-2001 212, y 2002-2007 245). En conjunto, 57% fueron hombres con una media de edad de 70 años (tabla I). Las indicaciones para la intervención fueron: hipertensión arterial mal controlada (57%), hipertensión arterial mal controlada asociada con insuficiencia renal crónica (creatinina>1,5mg/dl, 23%), e insuficiencia renal crónica (creatinina>1,5mg/dl, 12%); el 68% presentó diabetes mellitus, el 60% hiperlipidemia, el 24% enfermedad renal crónica en estadio 1 o 2, el 65% presentó enfermedad renal crónica en estadio 3, y el 20% enfermedad renal crónica en estadio 4 o 5. Las tablas I y II muestran la distribución de la población entre pacientes que respondieron y aquellos que no lo hicieron.
Características del paciente, síntomas y comorbilidades
| Ausencia de lesión | Lesión | p | |
| Demografía | |||
| Pacientes | 334 | 83 | – |
| Riñones tratados | 479 | 110 | – |
| Hombres | 54% | 70% | < 0,05 |
| Media de edad (media±DE, años) | 70±11 | 73±8 | NS |
| Síntomas | |||
| Hipertensión arterial | 60% | 11% | < 0,05 |
| Creatinina elevada | 24% | 54% | < 0,05 |
| Hipertensión arterial con creatinina elevada | 16% | 35% | < 0,05 |
| Comorbilidades | |||
| Antecedentes de tabaquismo | 60% | 71% | < 0,05 |
| Arteriopatía coronaria | 53% | 52% | NS |
| Insuficiencia cardíaca congestiva | 32% | 33% | NS |
| DMID | 9% | 8% | NS |
| DMNID | 15% | 29% | < 0,05 |
| Hiperlipidemia | 66% | 69% | NS |
| Síndrome metabólico | 71% | 76% | NS |
| Cerebrovascular | 26% | 23% | NS |
| AAA no reparado | 5% | 14% | < 0,05 |
AAA: aneurisma aórtico abdominal; DE: desviación estándar; DMID: diabéticos insulinodependientes; DMNID: diabéticos no insulinodependientes; NS: no significativo.
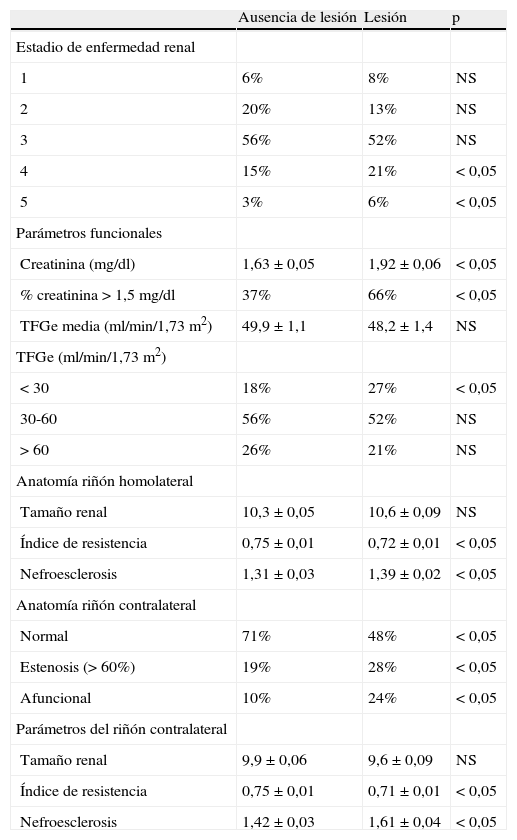
Enfermedad renal, concentración de creatinina, TFGe, parámetros hemodinámicos y anatómicos homolaterales y contralaterales
| Ausencia de lesión | Lesión | p | |
| Estadio de enfermedad renal | |||
| 1 | 6% | 8% | NS |
| 2 | 20% | 13% | NS |
| 3 | 56% | 52% | NS |
| 4 | 15% | 21% | < 0,05 |
| 5 | 3% | 6% | < 0,05 |
| Parámetros funcionales | |||
| Creatinina (mg/dl) | 1,63±0,05 | 1,92±0,06 | < 0,05 |
| % creatinina>1,5mg/dl | 37% | 66% | < 0,05 |
| TFGe media (ml/min/1,73m2) | 49,9±1,1 | 48,2±1,4 | NS |
| TFGe (ml/min/1,73m2) | |||
| < 30 | 18% | 27% | < 0,05 |
| 30-60 | 56% | 52% | NS |
| > 60 | 26% | 21% | NS |
| Anatomía riñón homolateral | |||
| Tamaño renal | 10,3±0,05 | 10,6±0,09 | NS |
| Índice de resistencia | 0,75±0,01 | 0,72±0,01 | < 0,05 |
| Nefroesclerosis | 1,31±0,03 | 1,39±0,02 | < 0,05 |
| Anatomía riñón contralateral | |||
| Normal | 71% | 48% | < 0,05 |
| Estenosis (> 60%) | 19% | 28% | < 0,05 |
| Afuncional | 10% | 24% | < 0,05 |
| Parámetros del riñón contralateral | |||
| Tamaño renal | 9,9±0,06 | 9,6±0,09 | NS |
| Índice de resistencia | 0,75±0,01 | 0,71±0,01 | < 0,05 |
| Nefroesclerosis | 1,42±0,03 | 1,61±0,04 | < 0,05 |
NS: no significativo; TFGe: tasa de filtración glomerular estimada.
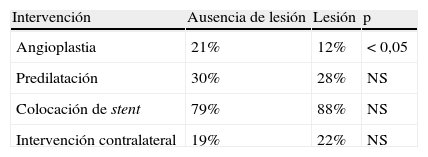
El 20% de los pacientes presentaron disfunción renal aguda. No existieron diferencias en la incidencia de lesiones renales funcionales a lo largo del tiempo (1990-1995 16%, 1996-2001 19%, y 2002-2007 20%). Al segregar a los pacientes en función de si presentaban lesión o no, existieron significativamente más fumadores activos, pacientes con DMNID, y presencia de aneurisma aórtico abdominal (AAA) no reparado en el grupo que presentó lesión (tabla I). De entre los pacientes que sufrieron disfunción renal aguda, el 65% presentó una concentración preoperatoria de creatinina>1,5mg/dl en comparación con el 37% de los que no la sufrieron (p<0,05) (tabla II). El número de pacientes con TFGe<30ml/min fue significativamente mayor en el grupo que sufrió disfunción renal aguda (Tabla II). Las indicaciones para la intervención de la hipertensión arterial mal controlada asociada a insuficiencia renal crónica estuvieron asociadas con disfunción renal aguda, asi como con la presencia de enfermedad renal contralateral (tabla II). El fracaso técnico fue equivalente en ambos grupos, y no se perdió ningún riñón debido a la oclusión aguda o a lesiones anatómicas. No existieron diferencias significativas en la predilatación, colocación de stent, o intervención renal contralateral simultánea entre los grupos (tabla III). No existió ninguna asociación entre episodios agudos periintervención y disfunción renal. Como cabría esperar, el porcentaje de éxito clínico a los 3 meses mostró un número significativo de pacientes con deterioro tras la lesión compatible con la definición de disfunción renal aguda (tabla IV).
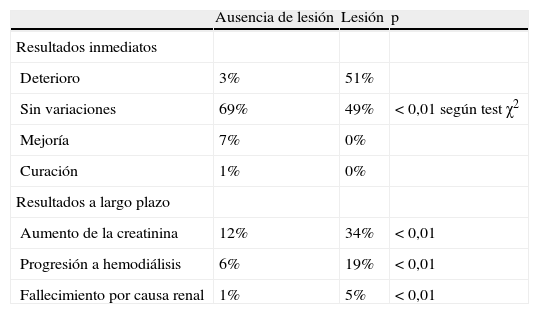
Resultados
| Ausencia de lesión | Lesión | p | |
| Resultados inmediatos | |||
| Deterioro | 3% | 51% | |
| Sin variaciones | 69% | 49% | < 0,01 según test χ2 |
| Mejoría | 7% | 0% | |
| Curación | 1% | 0% | |
| Resultados a largo plazo | |||
| Aumento de la creatinina | 12% | 34% | < 0,01 |
| Progresión a hemodiálisis | 6% | 19% | < 0,01 |
| Fallecimiento por causa renal | 1% | 5% | < 0,01 |
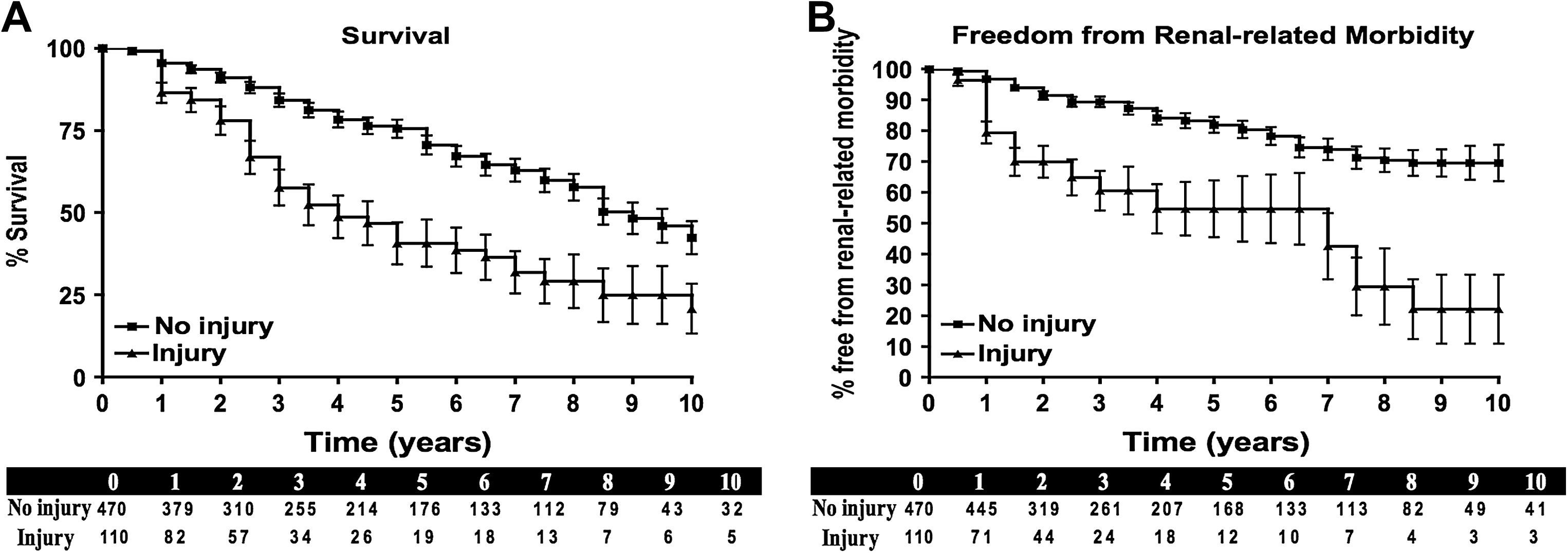
La presencia de disfunción renal del parénquima estuvo asociada con una reducción significativa de la ausencia de morbilidad a los 5 años por causas renales (media ± error estándar de la media [EEM] 80±2 frente a 55±10%, ausencia de lesión frente a lesión; p<0,01) y aumento destacado de la supervivencia en el seguimiento a los 5 años (71±4 frente a 41±10%, p<0,01) (fig. 1). En el seguimiento durante este período, el triple de pacientes con lesiones parenquimatosas progresaron a hemodiálisis en comparación con los pacientes que no presentaron lesiones (19 frente a 7%, p<0,01) (tabla IV). Mediante el análisis multivariante, la presencia de un AAA no reparado, DMNID, TFGe<30ml/min/1,73m2, nefroesclerosis homolateral avanzada, y patología de la arteria renal contralateral estuvieron asociados de forma significativa con disfunción renal y pocos efectos clínicos beneficiosos a largo plazo. La hipertensión arterial, la insuficiencia cardíaca congestiva, la hiperlipidemia, y el volumen de contraste no fueron significativos.
A Análisis de supervivencia de Kaplan-Meier de pacientes con y sin lesión del parénquima renal (definiéndose la lesión como el aumento persistente de la concentración sérica de creatinina≥0,5mg/dl 1 mes después de la intervención). B Análisis de Kaplan-Meier de la ausencia de morbilidad por causas renales (aumento persistente de la concentración de creatinina>20% del valor inicial, progresión a hemodiálisis, fallecimiento por causas renales) de los pacientes con y sin lesión del parénquima renal. El número de pacientes en riesgo en cada intervalo temporal se muestra debajo de cada figura. No se muestran los errores estándar que sobrepasan el 10%.
En el estudio actual, la disfunción renal funcional aguda se produjo en aproximadamente el 20% de los pacientes sometidos a intervención percutánea en la arteria renal y fue más probable en presencia de un AAA no reparado, DMNID, y enfermedad renal preexistente. La aterosclerosis renal es una enfermedad progresiva asociada a nefropatía isquémica, que se manifiesta mediante hipertensión arterial mal controlada o deterioro de la función renal17. Un metaanálisis sobre colocación de stent primario en la arteria renal documentó un porcentaje de éxito técnico del 96-100% y una tasa de reestenosis tras la colocación del stent primario que osciló entre el 9 y el 39% a los 6 y 12 meses, respectivamente18. Recientemente hemos demostrado que las reintervenciones renales tienen una permeabilidad primaria del 82% y una permeabilidad primaria asistida del 100% a los 5 años5. Los resultados concernientes a la mejoría funcional renal tras la angioplastia son variables, con una incidencia de mejoría solamente del 15-25% y un empeoramiento real de la función renal descrito en un porcentaje significativo de los pacientes5,7-11. Martin et al9 revisaron las tasas de complicación de dos series de gran tamaño y dos metaanálisis para determinar las tasas de complicación ponderadas. Las tasas de complicaciones perioperatorias oscilaron entre el 12 y el 36%, estando relacionadas la mayoría de ellas con el lugar de abordaje. En esta serie observamos un patrón similar. En el estudio de Schillinger et al19, se produjo una insuficiencia renal aguda transitoria en aproximadamente el 10% de los pacientes con arteriopatía periférica durante las primeras 24h tras la angioplastia; sin embargo, la insuficiencia renal persistente o la enfermedad renal terminal se observaron raramente. Los factores predictivos de la insuficiencia renal aguda en este estudio fueron la hipertensión arterial y la insuficiencia cardíaca congestiva. Otros factores asociados con la insuficiencia renal transitoria tras una intervención con contraste son una insuficiencia renal preexistente, DMNID, fármacos hipoglucemiantes, y deshidratación. En este estudio, la presencia de DMNID estuvo asociada con una mayor tasa de disfunción renal. La incidencia de embolización de la arteria renal varió desde el 1 al 8%, con porcentajes de oclusión de la arteria renal del 0,8-2,5%9. Si bien no observamos ninguna correlación entre la lesión anatómica o la permeabilidad vascular y el deterioro funcional en este estudio, los signos iniciales y la insuficiencia renal preexistente estuvieron asociados con la aparición de disfunción. Beutler et al20 describieron que el 8% de los pacientes mostró signos clínicos de émbolos de colesterol, y como mínimo un 20% de estos pacientes sufrieron una reducción de la función renal.
Nefropatía isquémicaLa nefropatía isquémica se define como la disminución de la función excretora renal como consecuencia de la alteración en la perfusión renal21. En pacientes ancianos con estenosis de la arteria renal, también contribuyen otros factores a la insuficiencia renal crónica. La nefroesclerosis hace referencia a la enfermedad primaria en arterias renales parenquimatosas que provocan una atrofia glomerular, lesiones tubulointersticiales, y fibrosis22. Estos cambios se observan en pacientes ancianos e hipertensos y son irreversibles. Es necesario un control meticuloso de la presión arterial para prevenir un mayor deterioro22. En esta serie, identificamos la presencia de un empeoramiento de la nefroesclerosis en aquellos pacientes que posteriormente sufrieron disfunción renal aguda, lo que sugiere que los cambios irreversibles ya estaban presentes y que no es probable que la intervención beneficiase al paciente. Además, la embolización recurrente ‘‘silenciosa'’ por colesterol o restos de colesterol a partir de los ateromas aórticos puede contribuir a un deterioro gradual e inexorable de la función renal y es posible que no pueda diferenciarse de la nefroesclerosis22. La presencia de un AAA no reparado en esta serie estuvo asociada con disfunción renal, apoyando esta hipótesis. Se ha sugerido que la nefropatía isquémica se produce debido a la embolización de residuos procedentes de la lesión aterosclerótica obstructiva y no a la isquemia persistente debida a la alteración hemodinámica23. Los pobres resultados asociados con una TFGe baja de forma crónica sugerirían que el riñón no dispone de una reserva potencial y la lluvia de ateroémbolos tendrá un mayor efecto. De forma análoga, la presencia de patología contralateral y nefroesclerosis preexistente también son marcadores de la reducción de la reserva renal funcional. Muchos pacientes con insuficiencia renal crónica secundaria a nefropatía isquémica son ancianos, y solamente el 10-15% requerirá un trasplante24. Muchos de los pacientes no dializados fallecerán por la enfermedad vascular subyacente25.
Ateroembolia y protección embólica distalUna causa evidente del deterioro en este estudio es la ateroembolia perioperatoria. Se cree que los émbolos de colesterol se producen en aproximadamente el 50% de las intervenciones percutáneas, aunque la mayoría permanecen silenciosos desde el punto de vista clínico26. El fallo renal debido a la ateroembolia inducida por la intervención se caracteriza por un lento declive en la función renal a lo largo de las 3-8 semanas posteriores, a diferencia de la nefropatía inducida por contraste, que se presenta de forma más temprana y a menudo se resuelve en 2-3 semanas27. Además, la patología ateroembólica de la arteria tiene una elevada morbilidad28,29. Una evaluación prospectiva de los pacientes con nefropatía ateroembólica demostró una mortalidad del 38%, mientras que el 24% de los pacientes desarrollaron una enfermedad renal terminal. Tras la intervención endovascular, puede producirse un deterioro de la función renal por cualquier causa en el 20-40% de los pacientes, lo que limita los efectos beneficiosos inmediatos de la técnica30. En el estudio realizado por Tsao et al31, los resultados de la función renal se estabilizaron o mejoraron en>90% de los pacientes, de forma similar a los resultados obtenidos por Holden et al13. En este estudio, la única diferencia significativa en las variables de la intervención fue el hecho de que aquellos pacientes que no sufrieron lesiones presentaban un mayor número de angioplastias primarias. Por otro lado, las técnicas utilizadas fueron equivalentes y no existieron diferencias temporales en la incidencia de disfunción renal a pesar de la evolución de los dispositivos endovasculares renales comercializados durante el período del estudio. Sin embargo, la presencia de un AAA no reparado estuvo asociada con disfunción renal, y esto probablemente reflejó una mayor probabilidad de manipulación en un entorno altamente ateroembólico. La experiencia inicial con los dispositivos de protección distal en las arterias renales en pacientes con una anatomía adecuada demuestra la captación de material embólico en aproximadamente el 60-70% de los casos y la mejoría/estabilización funcional renal en el 98% de los casos12,13,32. Un tamaño de particulas capturadas>60mm en un paciente con una baja TFGe perioperatoria estuvo asociado con resultados inferiores de la función renal postintervención. La probabilidad de que la embolia por una partícula capturada en un dispositivo de protección distal fuese>60μm se asoció con la etnia afroamericana, el diámetro del stent, y el cociente del diámetro stent/arteria renal14. En los pacientes con insuficiencia renal, la intervención endovascular con dispositivos de protección distal arrojó unos resultados de la función renal a las 4-6 semanas postintervención que se aproximaron a los de la revascularización quirúrgica33.
ConclusiónLa disfunción renal aguda se produce aproximadamente en el 20% de los pacientes sometidos a intervención percutánea de la arteria renal y son más probables en presencia de un AAA no reparado, diabetes, y enfermedad renal preexistente. Las lesiones renales funcionales agudas son un factor predictivo negativo de la supervivencia y están asociadas con la consiguiente insuficiencia renal, necesidad de diálisis, y fallecimiento. Si bien este estudio no permite establecer una relación causal, los pacientes que están predispuestos a disfunción renal aguda pueden tener factores subyacentes que también conduzcan a una reducción de la función renal a largo plazo y a una disminución de la supervivencia. En estos pacientes puede ser más beneficioso el uso de dispositivos de protección renal distal o el mejor tratamiento médico. Se esperan los resultados de varios ensayos clínicos prospectivos que puedan orientar sobre el uso apropiado de la intervención renal en este subgrupo específico de pacientes.
Presentado en el 18th Annual Winter Meeting de la Peripheral Vascular Surgery Society's, Snowmass, CO, 1-3 de febrero de 2008.