El tezosentán es un nuevo antagonista dual del receptor de la endotelina. El objetivo de este estudio consistió en examinar el efecto del tezosentán en la lesión pulmonar inducida por la isquemia-reperfusión de la aorta abdominal (IR) en ratas. Treinta y dos ratas Wistar albinas se distribuyeron de forma aleatoria en 4 grupos (8 por grupo) de la siguiente forma: grupo control (laparotomía simulada), grupo IR aórtica (isquemia durante 120 min y reperfusión durante 120 min), grupo IR aórtica + tezosentán (inyección intravenosa en bolo de 10 mg/kg de tezosentán antes de la isquemia, más infusión intravenosa continua de 1 mg/kg/h de tezosentán durante 120 min de isquemia y 120 min de reperfusión), y control + tezosentán. Se obtuvieron muestras de sangre y tejido pulmonar para su análisis bioquímico. Se determinaron las concentraciones de proteínas en el líquido del lavado broncoalveolar y las ratios del peso húmedo/seco del pulmón. También se realizó el estudio histológico. La IR aórtica aumentó de forma significativa (p < 0,05 frente al grupo control) y el tezosentán redujo de forma significativa (p < 0,05 frente al grupo IR aórtica) la concentración plasmática del factor de necrosis tumoral alfa; las concentraciones de malondialdehído, catalasa y mieloperoxidasa en el tejido pulmonar; y la concentración de proteína en el líquido del lavado broncoalveolar y la ratio peso húmedo/seco del pulmón. El estudio histológico mostró que el tezosentán atenuó los cambios morfológicos asociados con la lesión pulmonar. Los resultados de este estudio indican que el tezosentán atenúa la lesión pulmonar inducida por la IR aórtica en ratas. Proponemos que este efecto protector del tezosentán se debe a 1) la reducción de la respuesta inflamatoria, 2) la reducción del estrés oxidativo y de la peroxidación lipídica en el tejido pulmonar, 3) la reducción de la filtración microvascular pulmonar, y 4) la inhibición de la infiltración leucocitaria en el tejido pulmonar.
El clampaje y desclampaje de la aorta abdominal infrarrenal, que se utilizan de forma rutinaria durante la cirugía de la aorta abdominal, con frecuencia provocan dos lesiones sucesivas. En primer lugar, el clampaje aórtico provoca una lesión isquémica en las extremidades inferiores y, posteriormente, el desclampaje aórtico provoca la rápida reoxigenación de los tejidos isquémicos durante la reperfusión. Estas lesiones sucesivas, también llamadas isquemia-reperfusión (IR) aórtica, provocan lesiones en órganos distantes como los pulmonares.1,2 La lesión pulmonar inducida por la IR aórtica se caracteriza por la infiltración de leucocitos activados, el aumento del estrés oxidativo y la permeabilidad microvascular2,3 y la respuesta inflamatoria sistémica.4 La presentación clínica puede ser una hipoxia progresiva, edema pulmonar no cardiogénico, y síndrome de dificultad respiratoria aguda, con una elevada mortalidad.4 El Small Aneurysm Trial del RU ha informado que la disfunción pulmonar sigue siendo una causa importante de mortalidad y morbilidad en los pacientes sometidos a cirugía programada de aneurisma aórtico abdominal.5
La endotelina-1 (ET-1), aislada inicialmente del sobrenadante de un cultivo de células endoteliales porcinas, es un péptido de 21 aminoácidos6 y uno de los vasoconstrictores endógenos más potentes6 que interviene en respuestas del hospedador, como disfunción endotelial, activación leucocitaria, y proliferación de células musculares lisas.7,8 Además de su función vasoactiva, el papel de la ET-1 en la lesión tisular, en particular tras la IR, tiene un gran interés; la ET-1 interviene en las lesiones inducidas por la IR en diferentes órganos como los riñones9 y el hígado10 y en situaciones clínicas como las lesiones tras un infarto de miocardio11 y el rechazo agudo tras un trasplante de pulmón.12
No es sorprendente que los datos obtenidos de los estudios experimentales indiquen que la ET-1 también interviene en la patogénesis de la lesión pulmonar inducida por IR. Mizutani et al13 informaron que la ET-1 se expresa como resultado de la IR pulmonar y puede empeorar la función temprana de los injertos en un modelo canino de trasplante pulmonar. Mitsuoka et al14 hallaron que la ET-1 contribuye a los trastornos de la microcirculación pulmonar durante la lesión pulmonar inducida por la IR intestinal. La ET-1 también ha demostrado aumentar la permeabilidad vascular en el lecho vascular bronquial, lo que conduce a un aumento del peso húmedo del pulmón.15 En conjunto, todos estos hallazgos revelan la importancia de la ET-1 en la patogénesis de la lesión pulmonar por IR.
El tezosentán (Ro 61-0612) es un nuevo antagonista del receptor de la endotelina diseñado de forma específica para uso parenteral.16 Se ha descrito que el tezosentán tiene efectos protectores frente a la lesión pulmonar aguda en varios modelos experimentales, como la lesión pulmonar inducida por endotoxinas17 y por aspiración del meconio.18 Sin embargo, aún no se ha determinado su papel en la lesión pulmonar inducida por IR aórtica. Así pues, el objetivo del estudio consistió en examinar el efecto del tezosentán en la lesión pulmonar en un modelo experimental de IR aórtica. Para ello, se indujo la oclusión-reperfusión de la aorta abdominal infrarrenal en ratas, y se evaluó el efecto del tezosentán en la lesión pulmonar mediante análisis bioquímicos e histológicos.
Materiales y métodosAnimalesPara el experimento se utilizaron 32 ratas Wistar albinas de ambos sexos y de 200-250 g de peso, y se obtuvo la autorización del Animal Ethics Committee de la Süleyman Demirel University (Esparta, Turquía) (2 de abril de 2007, n. 23). Se alojaron en jaulas individuales con una temperatura y un ciclo lumínico controlados y tuvieron libre acceso a la comida y al agua. Todas las ratas recibieron un trato humanitario, según los “Principios para el cuidado de los animales de laboratorio” formulados por la National Society for Medical Research y la “Guía para el cuidado y uso de animales de laboratorio” preparada por el Institute of Laboratory Animal Resources y publicada por el National Institutes of Health (publicación 85-23 del NIH, revisada en 1985).
Diseño experimentalLas ratas se distribuyeron de forma aleatoria en uno de los 4 grupos experimentales (n = 8/grupo). El grupo control fue sometido a una laparotomía media y a la disección de la arteria aorta abdominal infrarrenal (AAI) sin oclusión; el grupo IR aórtica fue sometido a una laparotomía y al clampaje de la AAI durante 120 min, seguido de 120 min de reperfusión; el grupo control + tezosentán fue sometido a una laparotomía y a la disección de la AAI sin oclusión y recibió tezosentán; el grupo IR aórtica + tezosentán fue sometido a una isquemia de 120 min y a 120 min de reperfusión y recibió tezosentán. Las ratas de los grupos control e IR aórtica recibieron una solución salina. El tezosentán (Actelion Pharmaceuticals, Allschwill, Suiza) se diluyó en solución salina y se administró en forma de inyección intravenosa en bolo de 10 mg/kg antes de la isquemia aórtica y como infusión intravenosa continua de 1 mg/kg/h durante los 120 min de la isquemia y los 120 min de la reperfusión. La dosis y el momento de la infusión del tezosentán se decidieron según los estudios de Clozel et al,16 Rossi et al,17 y Krause et al.9
IR aórticaLas ratas fueron anestesiadas con hidrocloruro de ketamina (Ketalar®, 50 mg/kg intramuscular; Eczacıbaşı, Estambul, Turquía), y la anestesia se mantuvo con inyecciones intramusculares adicionales de hidrocloruro de ketamina.1,19 Las ratas se colocaron en decúbito supino bajo una cámara de calor. La piel se preparó de forma aséptica y se realizó una laparotomía media. Se instiló una solución salina tibia (10 ml) en la cavidad peritoneal para mantener el equilibrio hídrico. La aorta abdominal se expuso apartando con suavidad las asas intestinales hacia la izquierda con gasas empapadas en solución salina. Se colocó un clampaje microvascular atraumático (Vascustatts II, midi straight 1001-532; Scanlan, St. Paul, MN) a través de la AAI. El abdomen se cerró y la herida se cubrió con envoltura plástica para minimizar la pérdida de calor y de líquidos. Transcurridos 120 min se retiró el clampaje microvascular de la AAI y las extremidades posteriores se reperfundieron durante 120 min. La oclusión y la reperfusión aórticas fueron confirmadas por la pérdida y reaparición de un pulso satisfactorio en la aorta distal, de manera que se excluyó el fenómeno de no reflujo. Al finalizar la reperfusión se realizó una esternotomía media y se obtuvieron muestras de sangre de los ventrículos derechos de todas las ratas para su análisis bioquímico. Se realizó una traqueotomía con una cánula intravenosa de 16-gauge para realizar el lavado broncoalveolar (LBA). Se clampó el bronquio principal izquierdo y el lóbulo inferior derecho, y los lóbulos superior derecho y medio se lavaron tres veces con 2 ml de solución salina con 0,07 mmol/l de EDTA.4 El líquido del lavado se centrifugó en frío a 1.500 x g durante 20 min y se congeló a -20 °C. El líquido del LBA se utilizó posteriormente para determinar la concentración de proteína (protLBA) según el método de Lowry et al.20 El lóbulo superior izquierdo se extirpó para su estudio bioquímico y el lóbulo inferior izquierdo se extirpó para su estudio histológico. Se calculó la ratio húmedo/seco del lóbulo inferior derecho tras pesar el órgano recién extirpado y calentarlo a 90 °C en un horno de convección por gravedad durante un período de 72 h hasta que el peso del residuo restante permaneció constante.3 Todas las ratas fueron sacrificadas bajo anestesia, y las muestras se extrajeron y distribuyeron para posteriores análisis bioquímicos e histológicos.
Análisis bioquímicoExtracción de muestras de tejido y sangreLas muestras tisulares congeladas del pulmón de rata se pesaron y homogeneizaron (Ultra Turrax T25, 1:10 p/v; Janke & Kunkel, Staufen, Alemania) en 100 mmol/l de tampón fosfato (pH 7,4) conteniendo un 0,05% de azida de sodio en un baño de hielo. El homogenado se sonicó (Sonoplus UW 2070; Bandelin, Berlín, Alemania) durante 30 s y se centrifugó a 5.000 x g durante 10 min. El sobrenadante se congeló a -78 °C en alícuotas hasta que se utilizaron para su análisis bioquímico. El contenido proteico del sobrenadante se determinó según el método de Lowry et al.20 Se determinaron las concentraciones tisulares de malondialdehído (MDA), superóxido dismutasa, catalasa y mieloperoxidasa.
Las muestras de sangre se mantuvieron a temperatura ambiente durante 30 min y se separó el plasma de los eritrocitos mediante centrifugación a 4.000 x g durante 10 min. Todas las muestras se mantuvieron a -80 °C hasta la fecha del análisis. Se determinaron las concentraciones plasmáticas de factor de necrosis tumoral alfa (TNF-α), interleucina-1-beta (IL-1β), y ET-1.
MDA, superóxido dismutasa, catalasa y mieloperoxidasaLa concentración de MDA en el tejido pulmonar de rata se determinó mediante espectrofotometría con un kit comercial (Bioxytech MDA-586™; Oxis Research, Foster City, CA) según las instrucciones del fabricante. La actividad de la superóxido dismutasa y la catalasa del tejido pulmonar de rata se determinó mediante espectrofotometría a 450 y 540 nm, utilizando kits Cayman Chemical Company (Ann Arbor, MI). La actividad de la mieloperoxidasa en el tejido pulmonar de rata se determinó mediante kits ELISA (BioCheck, Foster City, CA) según las instrucciones del fabricante.
TNF-α, IL-1β, y ET-1Las concentraciones plasmáticas de TNF-α e IL-1β se determinaron mediante kits comerciales (BioSource™; Invitrogen, Carlsbad, CA) utilizando un método ELISA en un lector de microplacas por absorbancia (ELx808™; Biotek Instruments, Winooski, VT). La concentración plasmática de ET-1 se determinó mediante un inmunoensayo enzimático utilizando un kit comercial (rat big ET-1 EIA kit; Assay Designs, Ann Arbor, MI).
Estudio histológicoMuestras pequeñas de pulmón se fijaron en formalina al 10%, se tiñeron con hematoxilina y eosina, y un patólogo especializado que desconocía el origen de las muestras las visualizó al microscopio (BX41®; Olympus, Tokio, Japón). La lesión pulmonar se clasificó mediante un sistema de puntuación semicuantitativo descrito por Shields et al.21 Este sistema se basó en la congestión, la infiltración de leucocitos polimorfonucleares (PMNN), y la hemorragia intraalveolar con puntuaciones de 0 a 3: 0, ausencia de cambios; 1+, cambios leves, focales; 2+, cambios moderados, multifocales; 3+, cambios severos, amplios.
Análisis estadísticoLos resultados se presentan como promedio ± desviación estándar (DE). Para realizar el análisis estadístico se utilizó un programa informático (SPSS versión 15.0; SPSS, Inc., Chicago, IL). Durante el análisis estadístico de los resultados bioquímicos, las diferencias entre grupos se determinaron mediante el análisis de varianza de una vía, seguido de un test post hoc de Tukey de diferencias honestamente significativas. La significancia estadística se estableció en p < 0,05. Durante el análisis estadístico de los resultados histológicos, las diferencias entre grupos se determinaron mediante el test Kruskal-Wallis y el test U de Mann-Whitney. La significancia estadística se estableció en p < 0,05.
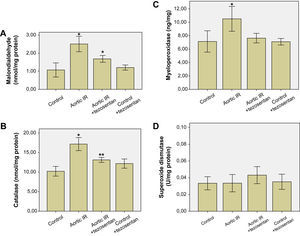
ResultadosAnálisis bioquímicoConcentraciones tisulares de MDA, superóxido dismutasa, catalasa y mieloperoxidasaLas concentraciones tisulares de MDA (nmol/mg de proteína), superóxido dismutasa (U/mg de proteína), catalasa (nmol/mg de proteína), y mieloperoxidasa (ng/mg) se presentan en la figura 1. La IR aórtica provocó un aumento significativo de las concentraciones tisulares de MDA (2,50 ± 0,42 frente a 1,07 ± 0,39, p < 0,001), catalasa (17,16 ± 1,67 frente a 10,20 ± 1,23, p < 0,001), y mieloperoxidasa (10,52 ± 1,85 frente a 7,14 ± 1,59, p < 0,001) en comparación con el grupo control (figs. 1A a 1C, respectivamente). El tratamiento con tezosentán del grupo IR aórtica + tezosentán provocó una reducción significativa en las concentraciones tisulares de MDA (1,68 ± 0,18 frente a 2,50 ± 0,42, p < 0,001), catalasa (13,11 ± 0,63 frente a 17,16 ± 1,67, p < 0,001) y mieloperoxidasa (7,64 ± 0,71 frente a 10,52 ± 1,85, p = 0,001) en comparación con el grupo IR aórtica (figs. 1A a 1C, respectivamente). No existieron diferencias estadísticamente significativas entre las concentraciones tisulares de superóxido dismutasa del grupo control (0,03 ± 0,00), el grupo IR aórtica (0,03 ± 0,01), el grupo IR aórtica + tezosentán (0,04 ± 0,01), y el grupo control + tezosentán (0,03 ± 0,00) (p > 0,05 en todas las comparaciones) (fig. 1D).
A Concentraciones de malondialdehído en el tejido pulmonar. ∗p < 0,05 frente a otros grupos. B Concentraciones de catalasa en el tejido pulmonar. ∗p < 0,05 frente a otros grupos, ∗∗p < 0,05 frente a los grupos control e IR aórtica. C Concentraciones de mieloperoxidasa en el tejido pulmonar. ∗p < 0,05 frente a otros grupos. D Concentraciones de superóxido dismutasa en el tejido pulmonar. No existieron diferencias estadísticamente significativas entre los grupos (p > 0,05 en todas las comparaciones). Aortic IR: isquemia-reperfusión aórtica; Aortic IR + tezosentan: isquemia-reperfusión aórtica + tezosentán; Catalase (nmol/mg protein): catalasa (proteína nmol/mg); Control + tezosentan: control + tezosentán; Malondialdehyde (nmol/mg protein): malondialdehído (proteína nmol/mg); Myeloperoxidase (ng/mg): mieloperoxidasa (ng/mg); Superoxide dismutase (U/mg protein): superóxido dismutasa (proteína U/mg).
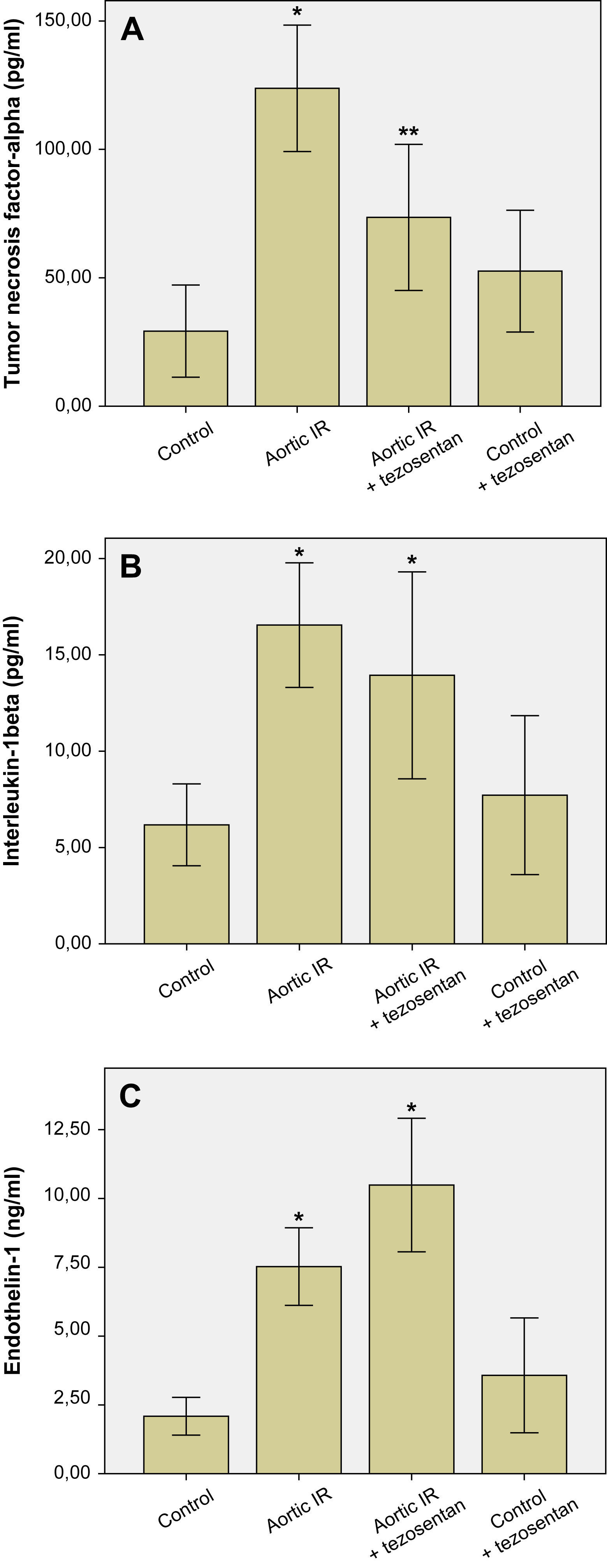
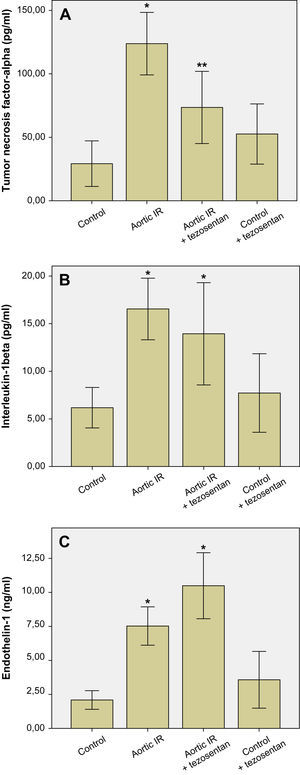
Las concentraciones plasmáticas de TNF-α (pg/ml), IL-1β (pg/ml) y ET-1 (ng/ml) se muestran en la figura 2. La IR aórtica provocó un aumento significativo de las concentraciones plasmáticas de TNF-α (123,78 ± 24,6 frente a 29,23 ± 17,94, p < 0,001), IL-1β (16,54 ± 3,23 frente a 6,17 ± 2,12, p < 0,001) y ET-1 (7,52 ± 1,40 frente a 2,08 ± 0,68, p < 0,001) en comparación con el grupo control (figs. 2A a 2C, respectivamente). El tratamiento con tezosentán del grupo IR aórtica + tezosentán provocó una reducción significativa de las concentraciones plasmáticas de TNF-α (73,51 ± 28,44 frente a 123,78 ± 24,61, p = 0,006) en comparación con el grupo IR aórtica (fig. 2A). El tratamiento con tezosentán del grupo IR aórtica + tezosentán redujo la concentración plasmática de IL-1β en comparación con la del grupo IR aórtica (13,93 ± 5,37 frente a 16,54 ± 3,23), pero la diferencia no fue estadísticamente significativa (p = 0,617) (fig. 2B). El tratamiento con tezosentán del grupo IR aórtica + tezosentán provocó un aumento significativo adicional de la concentración plasmática de ET-1 (10,48 ± 2,42 frente a 7,52 ± 1,40, p = 0,047) en comparación con el grupo IR aórtica (fig. 2C).
A Concentraciones de TNF-α en el plasma. ∗p < 0,05 frente a otros grupos, ∗∗p < 0,05 frente a los grupos control e IR aórtica. B Concentraciones de IL-1β en el plasma. ∗p < 0,05 frente a los grupos control y control + tezosentán. C Concentraciones de ET-1 en el plasma. ∗p < 0,05 frente a otros grupos. Aortic IR: isquemia-reperfusión aórtica; Aortic IR + tezosentan: isquemia-reperfusión aórtica + tezosentán; Control + tezosentan: control + tezosentán; Endothelin-1 (ng/ml): endotelina-1 (ng/ml); Interleukin-1beta (pg/ml): interleucina-1-beta (pg/ml); Tumor necrosis factor-alpha (pg/ml): necrosis tumoral alfa (pg/ml).
La concentración de protLBA (mg/ml) y las ratios del peso del pulmón húmedo/seco se muestran en la tabla I. La concentración de protLBA y la ratio del peso del pulmón húmedo/seco fueron significativamente más elevadas en el grupo IR aórtica que en el grupo control (p < 0,01 y p < 0,001, respectivamente) (tabla I). La concentración de protLBA y la ratio del peso del pulmón húmedo/seco fueron significativamente menores en el grupo IR aórtica + tezosentán que en el grupo IR aórtica (p < 0,001 y p < 0,01, respectivamente) (tabla I).
Resultados de la concentración de protLBA y la ratio del peso del pulmón húmedo/seco
| Grupo control (n = 8) | Grupo IR aórtica (n = 8) | Grupo IR aórtica + tezosentán (n = 8) | Grupo control + tezosentán (n = 8) | |
| protLBA (mg/m) | 133,37 ± 0,37 | 271,87 ± 16,09a | 141,37 ± 10,56 | 138,75 ± 19,91 |
| Ratio peso pulmón húmedo/seco | 4,21 ± 0,29 | 6,37 ± 0,37a | 4,65 ± 0,48b | 4,28 ± 0,23 |
IR: isquemia-reperfusión; protLBA: concentración de proteína.
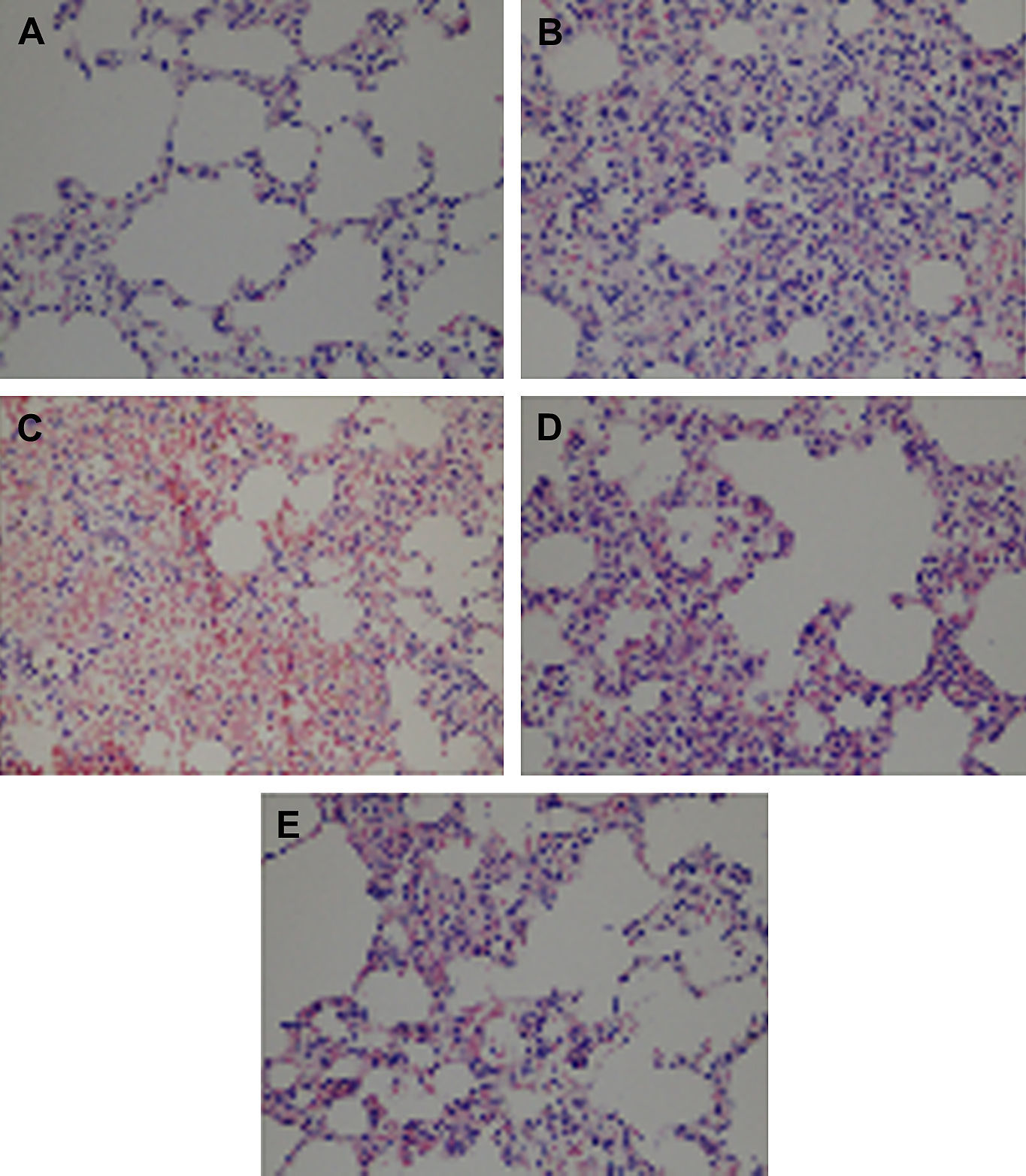
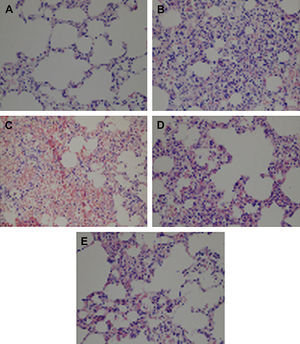
Los resultados del estudio histológico con tinción de hematoxilina-eosina se muestran en la tabla II y la figura 3. El estudio histológico mostró cambios morfológicos mínimos en el grupo control (tabla II, fig. 3A). La congestión, la infiltración de PMNN, y la hemorragia intraalveolar fueron significativamente más elevadas en el grupo IR aórtica que en el grupo control (p = 0,001, p = 0,045 y p = 0,003, respectivamente) (tabla II, figs. 3B y 3C). La congestión, la infiltración de PMNN, y la hemorragia intraalveolar fueron significativamente más bajas en el grupo IR aórtica + tezosentán que en el grupo IR aórtica (p = 0,037, p = 0,019 y p = 0,040, respectivamente) (tabla II, figs. 3D y 3E).
Resultados del estudio histológico
| Grupo control (n = 8) | Grupo IR aórtica (n = 8) | Grupo IR aórtica + tezosentán (n = 8) | Grupo control + tezosentán (n = 8) | |
| Congestión | 1,85 ± 0,37 | 2,85 ± 0,37∗ | 2,28 ± 0,48 | 2,14 ± 0,69 |
| Infiltración PMNN | 1,42 ± 0,78 | 2,14 ± 0,37∗ | 1,42 ± 0,53 | 1,28 ± 0,48 |
| Hemorragia intraalveolar | 1,00 ± 0,57 | 2,42 ± 0,53∗ | 1,42 ± 0,53 | 1,62 ± 0,74 |
IR: isquemia-reperfusión; PMNN: leucocitos polimorfonucleares.
El tezosentán atenúa los cambios morfológicos asociados con la lesión pulmonar inducida por la IR aórtica. Los cortes histológicos pulmonares se tiñeron con hematoxilina-eosina (HE) y se examinaron al microscopio óptico. A Congestión e infiltración PMNN mínimas en el grupo control (x400). B Destacada infiltración PMNN y congestión en el grupo IR aórtica (x400). C Extensa hemorragia intraalveolar en el grupo IR aórtica (x400). D Se observa una destacada reducción de la infiltración PMNN en el grupo IR aórtica + tezosentán en comparación con el grupo IR aórtica (x400). E Se observa una destacada reducción de la hemorragia intraalveolar en el grupo IR aórtica + tezosentán en comparación con el grupo IR aórtica (x400).
Los resultados de este estudio indican que el tezosentán atenúa la lesión pulmonar inducida por la IR aórtica en ratas. La prueba obtenida a partir de este estudio que apoya esta conclusión se resume de la siguiente forma: 1) el análisis bioquímico demostró que el tezosentán redujo el estrés oxidativo, la peroxidación lipídica, la infiltración leucocitaria en el tejido pulmonar, y la filtración microvascular pulmonar tras la IR aórtica y 2) el estudio histológico demostró que el tezosentán atenuó los cambios morfológicos asociados con la IR aórtica.
El estrés oxidativo es uno de los componentes más tempranos e importantes de lesión pulmonar inducida por la IR aórtica.1,2,22 El desclampaje aórtico provoca la rápida reoxigenación de los tejidos isquémicos y da lugar a la producción de especies reactivas de oxígeno (ERO), básicamente el radical superóxido (O2–), peróxido de hidrógeno (H2O2) y radical hidroxilo (OH–). La superóxido dismutasa cataliza la dismutación del O2– en O2 y en H2O2 menos reactivo.23 El H2O2 se convierte posteriormente en agua y O2 por la enzima catalasa, evitándose así la formación de OH– altamente reactivo.23 Observamos que la IR aórtica no causó cambios en la concentración de superóxido dismutasa pero causó un aumento significativo en la concentración de catalasa. La ausencia de cambios en la concentración de superóxido dismutasa tras la IR aórtica puede explicarse tanto por la secuencia de activación de enzimas antioxidantes celulares como por la magnitud del estrés oxidativo. Puesto que el O2– se considera la ERO “primaria”, su producción excesiva podría haber causado una regulación al alza concomitante y el agotamiento de la superóxido dismutasa. Además, la magnitud de las ERO pudo haber sido tan excesiva que el abundante H2O2 residual reguló al alza la enzima catalasa.
En nuestro estudio, el tezosentán no provocó cambios en la concentración de superóxido dismutasa pero sí una reducción significativa de la concentración de catalasa. Este hallazgo indica que el tezosentán redujo tanto el estrés oxidativo como la necesidad de regular al alza las enzimas antioxidantes tras la IR aórtica gracias a sus propiedades antioxidantes. Apoyando esta opinión, Gupta et al24 informaron que el bosentán, un antagonista mixto del receptor ETA-ETB, atenuó el estrés oxidativo y restauró los mecanismos de defensa antioxidante celulares en la IR miocárdica en ratas. Además, Duda et al25 informaron que el aumento del flujo miocárdico postisquémico de ET-1 estimula la generación de O2– por el complejo mitocondrial II y que el tezosentán atenúa la generación de O2– durante la disfunción endotelial coronaria tras la isquemia cardíaca en cobayas.
La peroxidación lipídica, un mecanismo autocatalítico mediado por las ERO, provoca tanto lesiones en el ADN como destrucción de las membranas celulares afectando a los ácidos grasos poliinsaturados, que son extremadamente sensibles a la oxidación.23 Se ha sugerido que la peroxidación lipídica está estrechamente relacionada con la lesión tisular inducida por la IR, y su metabolito final, MDA, es un buen indicador de la velocidad de la peroxidación lipídica.1,2,11,22,24 En concordancia con los resultados de estudios realizados en animales sobre la lesión pulmonar inducida por la IR aórtica,1,2,22 hallamos que ésta causó un destacado aumento de la peroxidación lipídica en el tejido pulmonar. En nuestro estudio, el tezosentán redujo de forma significativa la velocidad de la peroxidación lipídica, otro resultado que indica su propiedad antioxidante. El bosentán también ha demostrado reducir las concentraciones tisulares de MDA en la lesión por IR miocárdica en ratas.11,24
Numerosas pruebas indican que los leucocitos activados desempeñan un papel clave en la patogénesis de la lesión pulmonar inducida por la IR aórtica.2,3,22 La lesión por IR mediada por los leucocitos se caracteriza por una activación leucocitaria, quimiotaxis, adhesión de los leucocitos a las células endoteliales y transmigración.3,26 Se sabe que los leucocitos activados producen O2– y H2O2 y causan disfunción de las células endoteliales y lesiones en el tejido intersticial y las células parenquimatosas. La mieloperoxidasa es una enzima secretada por los leucocitos activados, y en varios estudios experimentales se ha utilizado la actividad de la mieloperoxidasa como índice de la sensibilidad del secuestro tisular de los PMNN.1,3,4,10 El tratamiento con tezosentán redujo los niveles de infiltración de PMNN inducida por la IR aórtica hasta los niveles del grupo control, como demuestra la determinación de la mieloperoxidasa y el estudio histológico. Coincidiendo con estos resultados, Mitsuoka et al14 informaron que el pretratamiento con TAK-044, un antagonista no selectivo del receptor de la ET, redujo de forma significativa la infiltración de PMNN en los pulmones en la lesión por IR intestinal en ratas. El bosentán, un bloqueante no selectivo del receptor de la ET, también ha demostrado reducir las concentraciones de mieloperoxidasa en la lesión pulmonar inducida por la IR hepática.10 Las endotelinas inducen la acumulación de leucocitos en los vasos pulmonares en ratas,27 probablemente debido a su capacidad para desencadenar interacciones entre los leucocitos y las células endoteliales28 y para regular al alza la expresión de las moléculas de adhesión.29 Así pues, especulamos que en nuestro estudio el bloqueo del receptor de la ET por parte del tezosentán podría haber prevenido el efecto activador de la ET-1 en el proceso de la transmigración de los leucocitos activados hacia el tejido pulmonar.
Si bien la fuente predominante de la ET-1 son las células endoteliales in vivo, la ET-1 es producida por las células de la musculatura lisa de las vías respiratorias así como por las células epiteliales en respuesta a los mediadores inflamatorios.30 La síntesis de la ET-1 está regulada al alza durante la lesión por IR, y se han descrito concentraciones elevadas de ET-1 en el plasma tras una IR pulmonar,13 en el tejido hepático tras una IR hepática,10 y en el tejido miocárdico tras una IR miocárdica.31 Dado que muchos de los tipos celulares productores de ET no disponen de vesículas de almacenamiento o vías de secreción reguladas, la regulación de la ET se produce durante su síntesis, en particular durante la transcripción. En una variedad de células, el RNAm de la ET-1 está regulado al alza por el TNF-α y las interleucinas.6 La respuesta inflamatoria sistémica, un componente bien conocido de la IR aórtica, estimula la liberación de ET-1 con otros mediadores, como el TNF-α, la IL- 1β, y la IL-2.32 Coincidiendo con esta indicación, en nuestro estudio las concentraciones de ET-1, TNF-α, e IL-1β en el plasma aumentaron tras la IR aórtica.
Se sabe que la ET-1 ejerce sus efectos biológicos a través de los receptores de la ETA y la ETB en humanos. Desde el punto de vista funcional, tanto los receptores ETA como los ETB están asociados con vasoconstricción cuado se encuentran en las células de la musculatura lisa, mientras que los receptores ETB median en la vasodilatación dado que se localizan habitualmente en el endotelio.30 Los receptores ETB también funcionan probablemente como receptores de eliminación.33 Este mecanismo de eliminación mediado por el ETB es especialmente importante en el pulmón, donde se retiene el 80% de la ET-1 circulante.34 El tezosentán, una sustancia derivada del bosentán, es un nuevo antagonista hidrosoluble del receptor de la ET optimizado para actuar con elevada potencia tanto en los receptores ETA como en los ETB.16 Observamos que las concentraciones de ET-1 en el plasma aumentaron aún más y de forma significativa con el tratamiento con tezosentán tras la IR aórtica. Este hallazgo indica un grado considerable de antagonismo reduciendo la eliminación de la ET-1 circulante mediada por el receptor ETB. Coincidiendo con este hallazgo se han descrito concentraciones aumentadas de ET-1 en el plasma tras la administración de tezosentán en lesión pulmonar inducida por endotoxinas en porcinos17 y en lesión pulmonar secundaria a la aspiración de meconio en porcinos.18
Dado que el sistema de la ET tiene efectos beneficiosos y perjudiciales, puede considerarse como una espada de doble filo en humanos.33 En cuanto a los efectos perjudiciales, la ET-1 se considera un mediador proinflamatorio. Ratones transgénicos con sobreexpresión de la ET-1 liberan cantidades aumentadas de TNF-α, interferón-γ, IL-1, e IL-6.35 La ET-1 también estimula la liberación de TNF-α, IL-1β, e IL-6 por parte de los monocitos.36 Kuklin et al37 informaron que el tezosentán causó un aumento adicional de las concentraciones plasmáticas de ET-1, TNF-α, e IL-8 en casos de lesión pulmonar inducida por lipopolisacáridos en ovinos. A diferencia de los resultados de este estudio de Kuklin et al,37 las concentraciones de TNF-α del grupo IR aórtica + tezosentán de nuestro estudio se redujeron de forma significativa, a pesar de un aumento adicional de las concentraciones de ET-1, y las concentraciones de IL-1β se redujeron ligeramente. Si bien este hallazgo puede parecer incongruente al principio, Peralta et al10 hallaron que el tezosentán redujo las concentraciones plasmáticas de TNF-α inducidas por la IR hepática en ratas, y Fedak et al31 informaron que el bosentán redujo la expresión miocárdica del TNF-α en la IR en ratas. Además, Juergens et al38 investigaron el efecto antagonizante del bosentán en los efectos proinflamatorios de la ET-1 en los receptores de la ETB en cultivos de monocitos humanos. Ese elegante estudio mostró que el bosentán inhibió de forma significativa la producción de TNF-α (-64%) inducida por la ET-1 y no tuvo ningún efecto destacado en la producción de IL-1β, y los autores llegaron a la conclusión de que los receptores de la ETB en los monocitos actúan como fuente primaria para inducir el TNF-α y tienen un efecto muy bajo en la producción de IL-1β.38 Por último, nuestros resultados indican que el tezosentán redujo la respuesta inflamatoria tras la IR aórtica.
La estimulación de la liberación de ET-1 durante la lesión pulmonar por IR está asociada con el aumento de la permeabilidad microvascular y el peso del pulmón.3,4,14 Este aumento del agua tisular y la extravasación de albúmina pueden reproducirse en el laboratorio mediante la infusión de dosis altas de ET-1 y parece estar mediada por los receptores de la ETA y ETB.39 La ET-1 ha demostrado estimular la producción del factor activador de las plaquetas y del factor de crecimiento del endotelio vascular, conocidos ambos por aumentar la permeabilidad vascular.40 Sin embargo, apenas existen pruebas de que la propia ET-1 pueda inducir la extravasación de albúmina, excepto posiblemente como efecto secundario de la liberación del péptido natriurético atrial o mediante la acción sinérgica de la ET-1 con el factor activador de las plaquetas para facilitar el edema de las vías o del parénquima respiratorios.30 Observamos que el bloqueo de los receptores ETA y ETB por parte del tezosentán impidió el desarrollo del edema pulmonar inducido por la ET-1 tras la IR aórtica. Coincidiendo con nuestros resultados, Kuklin et al37 informaron que el tezosentán mejora el aumento de la permeabilidad microvascular inducida por la ET-1 en el tejido pulmonar de ratas septicémicas. Rossi et al17 también hallaron que el tezosentán contrarrestó por completo el aumento del líquido pulmonar extravascular inducido por la endotoxina.
En nuestro estudio, el tezosentán atenuó los cambios morfológicos asociados a la lesión pulmonar como demuestra la reducción de la congestión, de la infiltración de PMNN y de la hemorragia intraalveolar. Donaubauer et al41 informaron que la inhalación de LU-135252, un antagonista del receptor de la ETA, a dosis bajas redujo la gravedad de la inflamación intersticial y la hemorragia intersticial en la lesión pulmonar experimental inducida por el agotamiento del surfactante. Por último, nuestros resultados indican que el bloqueo de los receptores de la ETA y la ETB por parte del tezosentán a una dosis de 10 mg/kg en bolo más 1 mg/kg en infusión continua revierte los cambios histológicos tras la IR aórtica.
Un aspecto esencial es hallar la dosis y la duración exactas de la infusión de los antagonistas de los receptores de la ET-1, a la vez que se estudian los efectos beneficiosos potenciales frente a la lesión por IR. Battistini et al42 informaron que la neumonitis por inmunocomplejos se vio atenuada por un antagonista selectivo de la ETA y una dosis baja de un antagonista no selectivo del receptor ETA/ETB, mientras que una dosis elevada de este último componente aumentó el grado de acumulación de neutrófilos y de lesiones hemorrágicas. De acuerdo con la mejor información de la que disponemos, en la literatura no existe ningún estudio publicado que investigue el efecto del tezosentán en las lesiones de órganos distantes inducidas por la IR aórtica. Por tanto, tuvimos en cuenta los estudios de Clozel et al,16 Rossi et al17 y Krause et al9 a la hora de decidir la dosis y la duración de la infusión en nuestro estudio. La semivida del tezosentán en ratas es de unas 2 h,16 y por eso administramos tezosentán en una inyección en bolo seguida de una infusión intravenosa continua durante los períodos de IR. Se informó que la administración de 10 mg/kg de tezosentán en bolo intravenoso fue bien tolerado por las ratas Wistar conscientes.16 Antes de empezar este estudio también realizamos un estudio piloto para comprobar la tolerancia de las ratas a 10 mg/kg en bolo más 1 mg/kg/h en infusión continua de tezosentán. Si bien no realizamos determinaciones hemodinámicas, lo que puede considerarse una limitación de este estudio, la dosis pareció ser bien tolerada por las ratas sometidas a IR aórtica o laparotomía simulada. No se produjo ningún fallecimiento prematuro durante el experimento. Puesto que sacrificamos a las ratas inmediatamente después de finalizar el período de reperfusión, no disponemos de datos sobre el efecto del tezosentán en la mortalidad posterior a ese período.
En resumen, los resultados de este estudio indican que el tezosentán atenúa la lesión pulmonar inducida por la IR aórtica en ratas. Proponemos que los mecanismos de este efecto protector del tezosentán son la reducción del estrés oxidativo y la peroxidación lipídica en el tejido pulmonar, la reducción de la respuesta inflamatoria sistémica y la extravasación microvascular pulmonar, y la inhibición de la infiltración leucocitaria. Sin embargo, son necesarios estudios experimentales adicionales para esclarecer los mecanismos moleculares del efecto protector del tezosentán frente a la lesión pulmonar inducida por la IR aórtica.
Los autores agradecen a Actelion Pharmaceuticals (Allschwill, Suiza) la generosa donación del vial de tezosentán. Los kits comerciales para los análisis bioquímicos fueron patrocinados por Actelion (Estambul, Turquía).