La flegmasia cerulea dolens es una complicación devastadora de la trombosis venosa profunda masiva, que, desde un punto de vista clínico, se caracteriza por un edema global de la extremidad inferior e insuficiencia arterial posterior. En estos experimentos se evaluaron los efectos tisulares locales de la obstrucción venosa aguda combinada con isquemia arterial parcial. Los experimentos se efectuaron para evaluar los efectos de la heparina sobre la respuesta de las citocinas a la obstrucción venosa y arterial parcial simultáneas. Se sometieron las patas traseras de ratones a condiciones de oclusión venosa unilateral e isquemia parcial de la pata con torniquete, confirmadas mediante registros de láser Doppler (LD). Los ratones se sometieron a obstrucción venosa de la pata trasera con heparina no fraccionada intravenosa (200 UI/kg) o suero salino intravenoso 5 min antes de la oclusión venosa. Los ratones sometidos a tratamiento simulado recibieron anestesia sola sin oclusión venosa. Después de 3 h, se sacrificó a los animales y se obtuvo tejido para determinación del edema (proporción de peso total con respecto al seco, H/S), viabilidad muscular, índices de trombosis local (complejo trombina-antitrombina [TAT]) y análisis de citocinas para el oncogén 1 relacionado con el crecimiento (GRO-1) e interleucina 6 (IL-6), niveles de proteína a través de un enzimoinmunoanálisis de adsorción y ARNm a través de una reacción en cadena de la polimerasa retrotranscriptasa. Para confirmar la anticoagulación sistémica en ratones tratados con suero salino y heparina, se documentó el tiempo de sangría y el volumen de hemorragia. La administración de heparina intravenosa dio lugar a un aumento marcado de ambos parámetros. El examen con LD confirmó la obstrucción venosa y el flujo arterial continuado. La obstrucción venosa dio lugar a un edema visible agudo que se correlacionó con una proporción H/S significativamente mayor pero que no se asoció con una disminución significativa de la viabilidad muscular. Los niveles de proteína y ARNm de GRO-1 e IL-6 aumentaron significativamente en el grupo de oclusión venosa comparado con el de simulación. El tratamiento con heparina disminuyó significativamente los niveles de TAT III pero no alteró el perfil de los niveles de proteína de GRO-1 o de IL-6 observados con la oclusión venosa. La oclusión venosa con isquemia parcial induce una expresión exclusiva y potente de citocinas locales. El tratamiento con heparina no mejoró la respuesta de las citocinas. Estos datos indican que este tratamiento no modula su respuesta a la obstrucción venosa.
La flegmasia cerulea dolens es una complicación devastadora de la trombosis venosa profunda iliofemoral masiva y da lugar a la obstrucción del flujo venoso global. Desde un punto de vista clínico, el proceso se caracteriza por edema tisular masivo, cianosis, dolor e inflamación cutánea. Sin tratamiento, la progresión de la enfermedad puede provocar insuficiencia arterial y gangrena venosa isquémica1.
El presente estudio se diseñó para evaluar la respuesta inflamatoria a la oclusión venosa global y obstrucción arterial parcial en el músculo esquelético de la extremidad intacta. Puesto que las citocinas se han implicado en una lesión tisular en diversos procesos inflamatorios, se evaluaron sus niveles tisulares. La respuesta inflamatoria a estas condiciones experimentales se evaluó mediante determinación de los niveles tisulares de la quimocina CXC proinflamatoria, el oncogén 1 relacionado con el crecimiento (GRO-1, también conocido como KC de ratón), y la interleucina 6 (IL-6), un reactante de fase aguda. El GRO-1, un potente quimioatrayente y activador de los neutrófilos, es el equivalente en el ratón de la IL-8 humana2. Ésta se ha implicado en la respuesta inflamatoria a la trombosis venosa en el ser humano y en roedores3,4. Por otra parte, la IL-6 es una citocina pleiotrópica que participa en la mediación de la respuesta de fase aguda y de la inflamación5,6. Después de trombosis venosa se ha encontrado un aumento de la proteína de IL-6 en las paredes venosas7. Mediante determinación del complejo trombina-antitrombina (TAT) III, se han identificado pruebas locales de trombosis. Este complejo es un marcador sensible de la activación de la cascada de la coagulación que se forma cuando la antitrombina III se une a la trombina activada8,9.
El componente farmacológico primario del tratamiento clínico de este problema devastador se ha dirigido al proceso trombótico. Además de una trombectomía mecánica o una trombólisis dirigida con catéter, las intervenciones antitrombóticas suelen incluir la infusión de heparina10-13. Además de sus efectos anticoagulantes, se atribuyen a la heparina propiedades antiinflamatorias14-17. Puesto que desempeña un papel destacado en el tratamiento clínico de la oclusión venosa, los experimentos también se diseñaron para determinar el grado hasta el cual el fármaco moduló la respuesta de las citocinas y la protrombótica a la oclusión venosa y oclusión arterial parcial.
Materiales y MétodosTorniquete de tensión controladaEl torniquete de tensión controlada se modificó ligeramente de las descripciones previas18. Para estos experimentos, se efectuó un torniquete con una sutura de seda del 0 tunelizada a través de dos pequeños tubos de plástico de 2 mm y aplicada circunferencialmente alrededor del muslo del ratón. Un extremo se fijó a una manivela y el otro a un pletismógrafo de anillos de mercurio (strain gauge) (modelo MG2; Mark-10, Hicksville, NY), con una lectura de la tensión en kilogramos. Todos los experimentos se efectuaron en una mesa calentada para mantener la temperatura corporal de los animales a 37 °C.
Protocolo de los animalesLos cuidados de los animales y procedimientos experimentales cumplieron con los “Principles of Laboratory Animal Care” (Guide for the Cared and Use of Laboratory Animals, National Institutes of Health, publication 86-23, 1985) y aprobó el estudio el comité de investigación del Massachusetts General Hospital. Los ratones B6,129SF2/J (Jackson Laboratory, Bar Harbor, ME) se anestesiaron con una inyección intraperitoneal (IP) de pentobarbital (50-60 mg/kg). La anestesia se mantuvo durante todo el experimento, con dosis adicionales (15-25 mg/kg) según las necesidades. Aproximadamente 15 min después de la inducción anestésica, se aplicó el torniquete de tensión controlada a la pata trasera de los animales. Para obtener una oclusión venosa e isquemia parcial, se aplicó una tensión de 0,04 kg durante 3 h. Los ratones del grupo de tratamiento simulado se sometieron a una anestesia de 3 h, con afeitado de la pata y el mantenimiento de la temperatura corporal a 37 °C sin oclusión venosa o arterial. Los ratones del experimento recibieron suero salino o heparina intravenosa después de la inducción de la anestesia y 5 min antes de la aplicación del torniquete. Después de 3 h de cada condición experimental, se sacrificaron los ratones sometidos a la oclusión venosa heparinizados y no heparinizados y los animales de tratamiento simulado. Se obtuvieron las patas traseras de los animales para determinación del edema tisular, viabilidad muscular, determinación de los niveles de proteína y de ARNm de GRO-1 e IL-6 y niveles de TAT.
Determinación directa del flujo venosoPara confirmar el flujo venoso durante las condiciones experimentales, las patas de los ratones (n = 5) se sometieron a ecografía venosa directa a través de un abordaje femoral utilizando una sonda de flujo needlepoint láser Doppler (filamento de 0,5 mm; Moor Instruments, Wilmington, DE) después de 30 min de oclusión basal y venosa. Con la ayuda de un microscopio quirúrgico y un micromanipulador (World Precision Instruments, Sarasota, FL), se efectuó ecografía venosa directa y se realizó un análisis de la morfología de la onda. El flujo venoso en unidades de flujo se determinó en el período basal y durante la oclusión venosa.
Determinación no cruenta de la perfusión tisularLa perfusión global de la pata trasera (n = 10) se evaluó con el uso de un escáner de láser Doppler no cruento (Moor Instruments), como se ha descrito previamente18.
Tratamiento con heparinaPara evaluar el efecto de la anticoagulación con heparina sobre la oclusión venosa de la pata, se inyectó en la cola de los animales heparina no fraccionada (Elkins-Sinn, Cherry Hill, NJ) en una dosis de 200 UI/kg 5 min antes del momento de aplicación del torniquete. Para confirmar la anticoagulación de los animales con la dosis administrada de heparina no fraccionada, 5 min después de su administración (o de la de suero salino), se efectuaron análisis cualitativos y cuantitativos de la hemorragia de la cola. Para comparar cualitativamente el tiempo de sangría entre ratones heparinizados y no heparinizados, se usaron papeles de filtro19,20 (#42; Whatman, Maistone, Reino Unido). Se cortaron las colas de los ratones anestesiados con un diámetro de calibre 5 y se permitió que sangraran en papel de Whatman a intervalos cada 30 s. El tamaño de las manchas se determinó por el número de gotas de sangre en el intervalo de 30 s. En el análisis cuantitativo la sangre del abordaje de la cola se recogió en tubos de Eppendorf citratados durante 7 min. Se compararon los volúmenes de hemorragia entre el grupo tratado y no tratado con heparina21.
Edema tisularEl grado de edema del músculo esquelético de la pata trasera se determinó por la proporción del peso en húmedo con respecto al seco. El tejido se pesó inmediatamente después de su obtención para determinar el peso en húmedo y se introdujo en un horno de secado (55 °C) durante 24 h hasta la obtención de un peso en seco constante.
Viabilidad del músculo esqueléticoLa viabilidad tisular se estimó mediante la reducción de una sal de tetrazolio en cristales de formazán de color, insolubles en agua por transportadores de electrones y enzimas oxidativas presentes en las mitocondrias del tejido viable. Al final del experimento, se obtuvieron las patas, se eliminó la piel y el tejido se cortó en tres fragmentos. El tejido se pesó e incubó con 3 ml de suero salino neutralizado con fosfato, suplementado con 300 μl de 1 mg/ml de 3-(4,5-dimetiltiazol-2-il)-2,-difeniltetrazolio (MTT) (Sigma, St Louis, MO) durante 3 h. Acto seguido, se extrajo la sal de formazán insoluble en agua en 3 ml de 2-propanol. Se eliminaron las alícuotas (200 μl), y se determinó la absorbancia a 570 nm utilizando un lector de microplacas. Las muestras de tejido se secaron en un horno y se pesaron. El índice de viabilidad se expresa como densidad óptica a 570 nm (DO570) relativa al peso del tejido en seco18.
Marcadores de trombosis tisularLos niveles de TAT se determinaron utilizando un enzimoinmunoanálisis de adsorción (ELISA; Dade Behring, Deerfield, IL) en extractos de proteína procedentes del músculo esquelético (véase más adelante) sometido a obstrucción venosa e isquemia parcial.
Análisis de citocinas tisularesExtracción de proteínasLas muestras de músculo esquelético de la pata trasera se congelaron instantáneamente en nitrógeno líquido inmediatamente después de su obtención y se almacenaron a –80 °C hasta su análisis. Cada muestra de músculo se trituró en un tubo de análisis que contenía 1 ml de tampón de análisis de radioinmunoprecipitación, añadiéndose 10 μl de inhibidor de la proteasa. Acto seguido, la muestra se centrifugó a 13.000 x g durante 10 min, después de lo cual se homogeneizó con ultrasonidos durante 20 s. La muestra homogeneizada se transfirió a tubos de Eppendorf y nuevamente se centrifugó a 16.000 x g durante 15 min.
ELISASe utilizaron kits de ELISA (Quantikine mouse KC and IL-6; R&D Systems, Mineápolis, MN) que empleaban una técnica de enzimoinmunoanálisis de adsorción sándwich cuantitativo para determinar los niveles de proteína de GRO-1 y de IL-6. Las muestras se pipetearon en pocillos de una microplaca revestidos con un anticuerpo específico de proteína y se permitió su incubación durante 2 h a temperatura ambiente. Los pocillos se lavaron para eliminar cualquier sustancia no fijada. Se añadió un conjugado KC de ratón que contenía un anticuerpo dirigido contra GRO-1 y se incubó durante otras 2 h. Los pocillos se lavaron de nuevo añadiéndose un reactivo de color y se incubaron durante 30 min protegidos de la luz directa. La reacción produjo un color azul, cuya intensidad se determinó mediante DO570 correlacionándose con la concentración de la proteína en cuestión. Los valores se leyeron uno por uno en la curva estándar y se normalizaron con respecto a la concentración total de proteínas, que se determinó con otro análisis usando el equipo BCA Protein Assay Reagent Kit (Pierce Biotechnology, Rockford, IL).
Análisis de ARNmEl aislamiento de ARN se inició con la homogeneización de las muestras de músculo en 5 ml del reactivo Trizol (Invitrogen, Carlsbad, CA) utilizando un triturador de tejidos. Las muestras se incubaron a temperatura ambiente para la disociación de los complejos de nucleoproteína, después de lo cual se añadió 1 ml de cloroformo y las muestras se agitaron y se depositaron en hielo. A continuación, se centrifugaron a 10.000 x g durante 20 min a 4 °C, lo que dio lugar a una separación en dos fases, una inferior orgánica y la superior acuosa, que contenía el ARN. Acto seguido, se precipitó el ARN, se lavó en etanol y se almacenó a –20 °C hasta que se efectuó el análisis de reacción en cadena de la polimerasa retrotranscriptasa (RCP-RT) a tiempo real (iCycler iQ; Bio-Rad, Hercules, CA).
En primer lugar, se efectuó el paso RT de la reacción para producir moldes de ADNc a partir del ARNc aislado. En la preparación para la RCP se usó el equipo QuantiTect SYBR Green PCR (Qiagen, Valencia, CA). Se preparó una mezcla maestra con los cebadores (primers) forward (sentido) y reverse (antisentido), 5’-3’, disponibles comercialmente para la respectiva citocina (Invitrogen). Para GRO-1, las secuencias de cebador usadas fueron GTCAACCACTGTGCTAGTAGAAG (5'-3', F) y GTCCTTTGAACGTCTCTGTCC (5'-3', R). Para IL-6, fueron CCTAGTGCGTTATGCCTAAGC (5'-3', F) y CAACAAACCATCTGGCTAGG (5'-3', R). La mezcla maestra que contenía los cebadores se pipeteó en microplacas a las que se añadieron moldes de ADNc. El iCycler se programó en consecuencia para alrededor de 40 ciclos. La placa se introdujo en el termociclador para el proceso de RCP a tiempo real. Se efectuó un análisis de la curva de fusión para comprobar la pureza del producto de RCP. Los datos generados se leyeron frente a la curva estándar y se expresaron como aumentos o disminuciones relativos frente a los niveles simulados de ARNm.
Análisis estadísticoEl análisis estadístico se efectuó con el programa Instat versión 3 (GraphPad, San Diego, CA). Los datos se expresaron como medias ± DE. Las comparaciones se efectuaron utilizando pruebas t para datos apareados y un análisis de la varianza cuando estuvo indicado.
ResultadosFlujo venoso directo y perfusión tisular globalEn condiciones de oclusión venosa (OV), el flujo venoso femoral fue significativamente menor que en condiciones basales (OV 33 ± 9 comparado con basal 242 ± 27 unidades de flujo/segundo, p < 0,01, n = 5; fig. 1A). De forma parecida, la perfusión tisular global fue marcadamente más reducida en animales sometidos a oclusión venosa (308 ± 25 comparado con basal 1.204 ± 56 unidades de flujo/s, p < 0,001, n = 10 en cada grupo; fig. 1B). Estos resultados confirman la presencia de isquemia parcial y oclusión venosa global.
Evaluación láser Doppler de la perfusión de la pata trasera de ratones durante la oclusión venosa. A La ecografía venosa femoral directa demostró una disminución significativa del flujo durante la oclusión venosa (∗p < 0,01). B Las imágenes láser Doppler confirmaron el flujo arterial disminuido pero mantenido durante la oclusión venosa (∗p < 0,001). VO: oclusión venosa. Venous Flux Units/sec ±SE: Flujo venoso en unidades de flujo/segundo ± EE. Experimental Conditions: Condiciones experimental. Basal: Período basal. VO: Obstrucción venosa. Tissue Flux Units/sec ±SE: Flujo venoso en unidades de flujo/segundo ± EE.
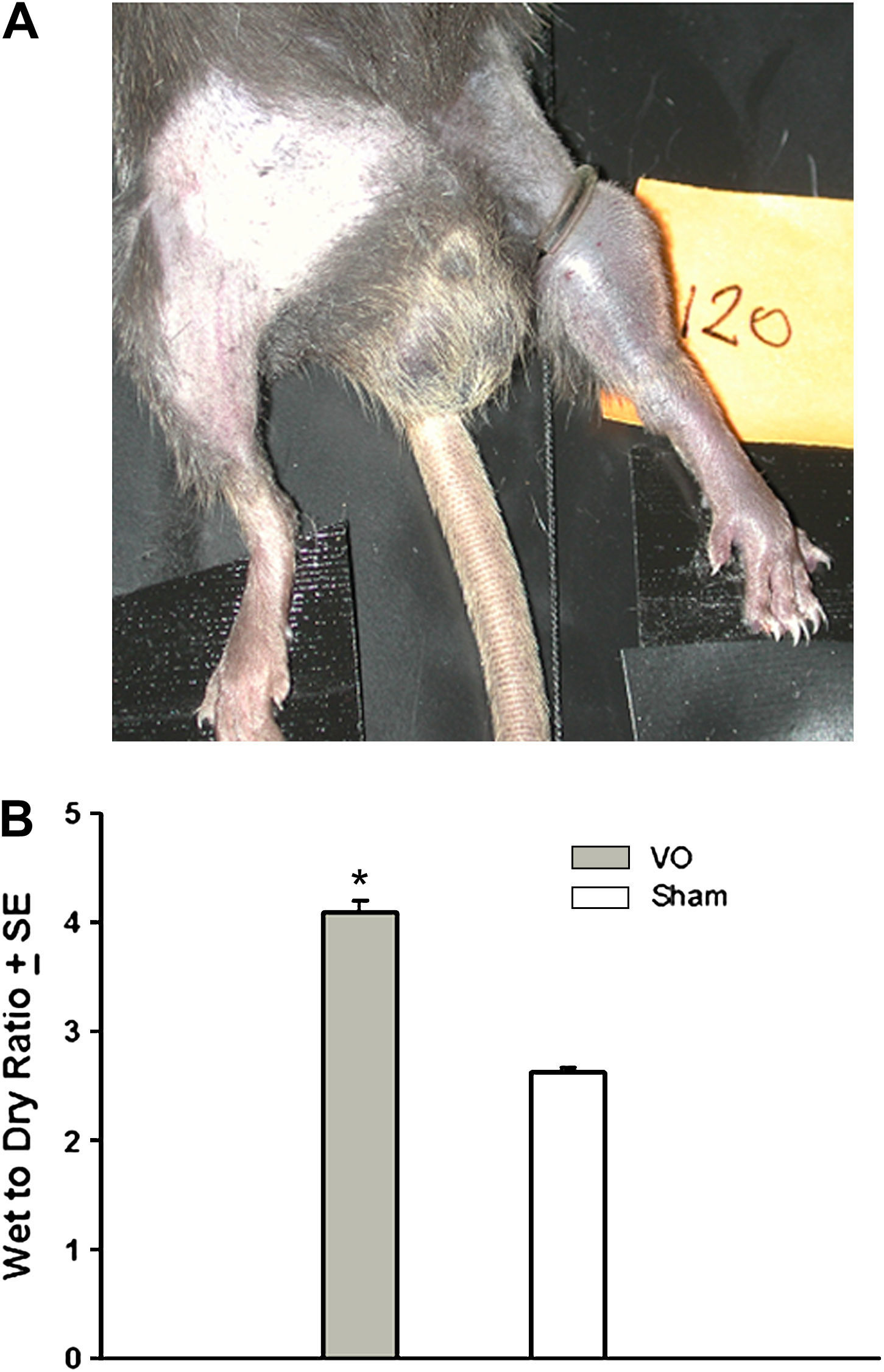
La oclusión venosa se tradujo en un edema y cianosis sustanciales de la pata trasera de los animales (fig. 2A). En el grupo OV comparado con el de simulación (sin torniquete) la proporción de peso en húmedo con respecto al seco fue significativamente más alta (OV 4,10 ± 0,10 comparado con simulada 2,63 ± 0,04, p < 0,001, n = 8 en cada grupo) (fig. 2B).
Aspecto macroscópico de la oclusión venosa y el edema tisular. A En las patas de los animales sometidas a oclusión venosa se observaron edema y cianosis macroscópicos. B El edema tisular, según lo determinado por la proporción de peso total con respecto al seco, aumentó significativamente en las patas sometidas a oclusión venosa (∗p < 0,01). VO: oclusión venosa. Wet to Dry Ratio ±SE: Proporción peso en húmedo con respecto a seco ± EE. VO: Obstrucción venosa. Sham: Simulación.
No se identificaron diferencias en la viabilidad del músculo esquelético de la pata trasera entre grupos OV y simulación según lo determinado mediante análisis MTT de actividad mitocondrial. Normalizados con respecto a los animales sometidos a la simulación, en los sometidos a oclusión venosa la viabilidad fue de 106 ± 7% (n = 8 en cada grupo).
Efectos de la oclusión venosa sobre la expresión génica de las citocinasAl cabo de 3 h de la oclusión venosa, los niveles de IL-6 en estado de equilibrio aumentaron 43 ± 13 veces (n = 8) comparado con los niveles en animales sometidos a la simulación (n = 6). De forma similar, los niveles de ARNm de GRO-1 aumentaron 35 ± 12 veces (n = 8) comparado con el grupo de simulación (n = 6).
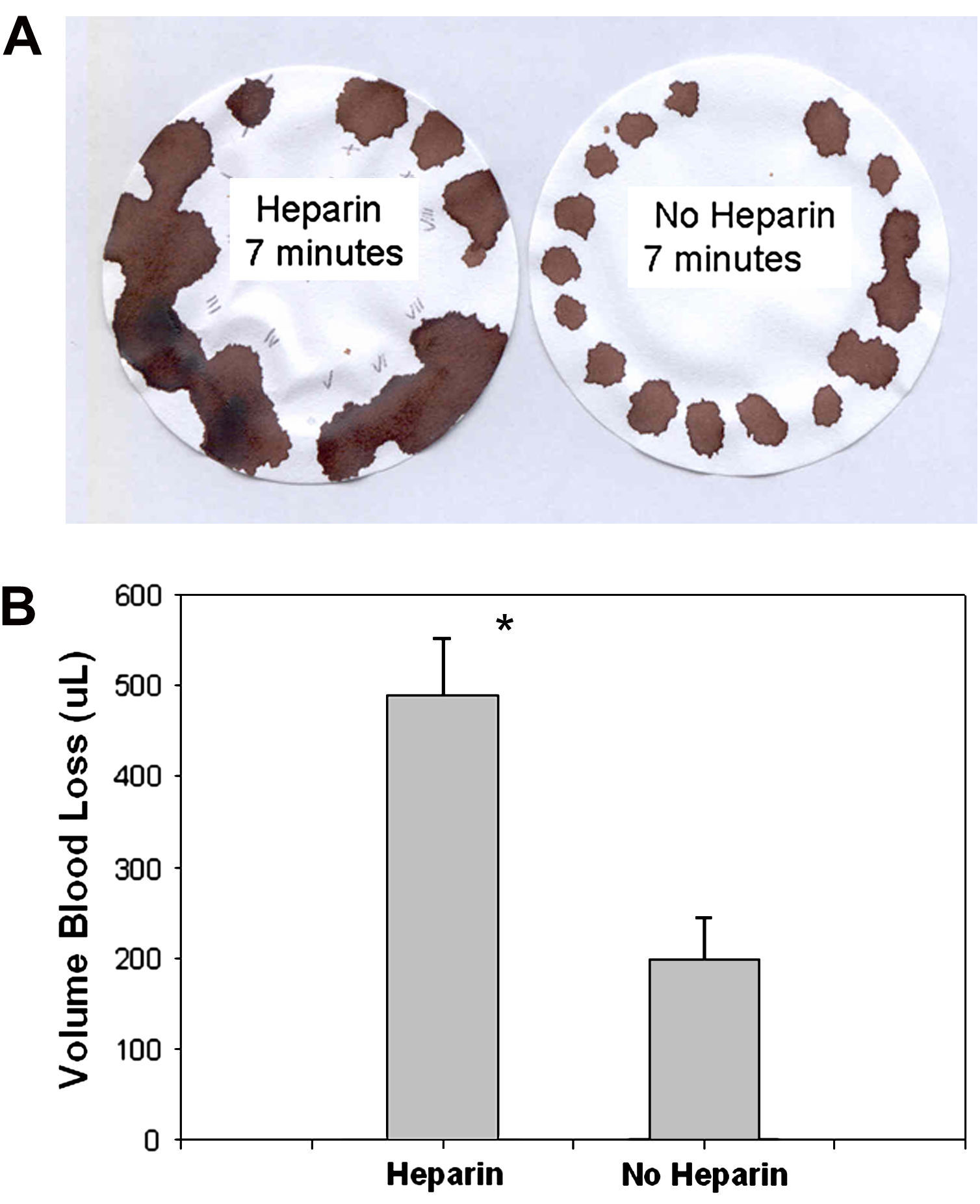
Tratamiento con heparinaSe demostró anticoagulación en animales tratados con una inyección de heparina (200 UI/kg) intravenosa. El análisis cualitativo del tiempo de sangría usando el papel de filtro de Whatman reveló una hemorragia más profusa a cada intervalo de 30 s, observado como manchas más anchas en el papel (fig. 3A). Desde un punto de vista cuantitativo, la cantidad de pérdida hemática de la sección de la cola fue significativamente mayor en el grupo heparinizado que en el no heparinizado (fig. 3B). Durante un período de 7 min, el volumen de la pérdida hemática fue de 488 ± 64 μl en el grupo tratado con heparina comparado con 198 ± 47 μl en el otro (∗p < 0,01, n = 6 en cada grupo).
Anticoagulación de los animales con heparina. A En presencia de heparina, las manchas obtenidas en cada intervalo de tiempo fueron considerablemente mayores que las obtenidas en ratones tratados con suero salino. B El análisis cuantitativo de la pérdida hemática demostró una hemorragia significativamente mayor a partir de ratones heparinizados (∗p < 0,01). Heparin 7 minutes: Heparina 7 minutos. No Heparin 7 minutes: Sin heparina 7 minutos. Volume Blood Loss (μL): Volumen de pérdida hemática (μl). Heparin: Heparina. No Heparin: Sin heparina.
Después de 3 h de oclusión venosa, se observó un aumento significativo de la proteína de GRO-1 con tratamiento con suero salino o heparina comparado con simulado (OV salino, n = 6, 10,7 ± 2,6; OV heparina, n = 8, 12,02 ± 4,36; simulado, n = 6, 1,73 ± 0,3 pg/mg de proteínas totales; p < 0,001 comparado con simulado). El tratamiento con heparina no alteró el aumento de 9 veces del nivel de proteína de GRO-1 comparado con el simulado (fig. 4). Después de 3 h de oclusión venosa, los niveles de IL-6 en músculo esquelético de animales tratados con suero salino o heparina no fueron significativamente diferentes de los del grupo de simulación (fig. 5, n = 6-8). La oclusión venosa se asoció con un aumento marcado de los niveles de TAT (fig. 6) comparado con el grupo de simulación (∗p < 0,001 frente a simulado, n = 5 en cada grupo) y comparado con los ratones tratados con heparina (+p < 0,05 frente a heparina, n = 5 en cada grupo). En condiciones de obstrucción venosa con heparina, persistió el aumento de los niveles de TAT (∗∗p < 0,01, n = 5).
Expresión de proteína de GRO-1 durante la oclusión venosa. La oclusión venosa (OV) con y sin heparina dio lugar a un aumento considerable de los niveles de GRO-1 comparado con animales sometidos a simulación (∗p < 0,001). GRO-1: oncogén 1 relacionado con el crecimiento. GRO-1 pg/mg protein ±DR: GRO-1 pg/ml de proteína ± EE. VO: Obstrucción venosa. VO Heparin: Obstrucción venosa + heparina. Sham: Simulación.
Expresión de proteína de IL-6 durante la oclusión venosa. La oclusión venosa (OV), con y sin heparina, no dio lugar a un aumento significativo de los niveles de IL-6 comparado con animales sometidos a simulación. IL-6: interleucina 6. IL-6 pg/mg protein ±SE: IL-6 pg/ml de proteína ± EE. VO: Obstrucción venosa. VO Heparin: Obstrucción venosa + heparina. Sham: Simulación.
Expresión de TAT III durante la oclusión venosa. La expresión de TAT III en músculo esquelético en ratones sometidos a oclusión venosa fue significativamente mayor que en los animales sometidos a oclusión venosa y heparina (+p < 0,05) y animales del grupo de simulación (∗p < 0,01). En animales sometidos a oclusión venosa en presencia de heparina, persistió el aumento de la expresión comparado con el grupo de simulación (∗∗p < 0,01). VO: oclusión venosa. TAT III ng/mg protein + SE: TAT III ng/ml de proteína ± EE. VO: Obstrucción venosa. VO Heparin: Obstrucción venosa + heparina. Sham: Simulación.
Estos experimentos demuestran que la obstrucción venosa global y la isquémica parcial combinadas proporcionan un medio visual (fig. 2A), trombótico (fig. 6), e inflamatorio (fig. 4) en la pata trasera de ratón que se aproxima a las características clínicas de la flegmasia cerulea dolens en seres humanos. Para crear el modelo, confirmamos la oclusión venosa y la isquemia parcial usando técnicas cruentas de láser Doppler, que examinó directamente el flujo venoso femoral (figs. 1A y 1B). El análisis cuantitativo del tejido sometido a oclusión venosa e isquemia parcial reveló un edema tisular sustancial según lo indicado por la proporción del peso total con respecto al peso seco (fig. 2B).
Una vez se definieron las características físicas de la flegmasia mediante inspección visual y análisis cuantitativo del edema, se efectuaron los experimentos para evaluar la viabilidad del músculo esquelético. No se observó necrosis significativa tras la aplicación del torniquete controlado en las patas traseras de los animales durante 3 h. Los estudios previos sobre los efectos de la oclusión venosa en colgajos de tejido miocutáneo demostraron una disminución destacada de la viabilidad tisular. En modelos de isquemia/reperfusión, al igual que en colgajos de tejido, la evaluación experimental de una obstrucción venosa aislada (en ausencia de oclusión arterial) ha demostrado un aumento de los marcadores de lesión muscular22-25. Usando colgajos de músculo recto interno y aplicando una oclusión venosa total, Gabriel et al26 demostraron necrosis muscular asociada con una duración más prolongada que en la oclusión venosa aislada. En humanos con flegmasia, la necrosis del músculo esquelético es muy poco frecuente y una complicación tardía10,27,28. En comparación con los trabajos efectuados con colgajos miocutáneos, los experimentos del presente estudio no demostraron una disminución de la viabilidad muscular asociada con oclusión venosa e isquemia parcial. En la presente investigación se usó un torniquete de tensión controlada para producir obstrucción venosa y oclusión arterial en la pata intacta en lugar de un colgajo miocutáneo para simular flegmasia. Este modelo requiere una extensa movilización tisular que es pertinente para la transferencia de tejido, pero que no reproduce la situación real de la enfermedad venosa oclusiva trombótica o maligna. Esta extensa movilización tisular no sólo implica oclusión venosa sino también afectación linfática y una lesión inespecífica. El torniquete de tensión controlada no permite aislar por completo los efectos venosos de los arteriales, como es posible en el modelo miocutáneo; pero el torniquete evita la extensa movilización de tejido. No obstante, es posible que el edema global observado con la oclusión venosa pudiera haberse relacionado con una obstrucción linfática más que venosa. Para abordar esta posibilidad, se registró la información cualitativa relativa al flujo linfático tras la inyección de azul de isosulfano en las patas traseras después de la aplicación del torniquete para la oclusión venosa. Durante ésta, se detectó la excreción inmediata del colorante en el sistema urinario y biliar y la expresión de citocinas no se relacionó con una obstrucción linfática detectable.
Puesto que no se produjo una mionecrosis sustancial, se efectuaron experimentos para analizar la expresión génica de las citocinas proinflamatorias en el músculo esquelético. La respuesta inflamatoria bajo estas condiciones experimentales se evaluó determinando los niveles tisulares de la quimiocina CXC proinflamatoria, GRO-1 (también conocida como KC de ratón), y la IL-6, un reactante de fase aguda. El análisis RCP-RT de la expresión relativa de ARNm para GRO-1 e IL-6 documentó un aumento sustancial comparado con animales en tratamiento simulado. Este hallazgo suscitó nuestro deseo de extender este análisis para incluir los niveles de proteínas de citocinas y trombóticas en el músculo y para evaluar el efecto de la heparina sobre la expresión de proteínas de las citocinas.
El efecto anticoagulante de la heparina en ratones puede evaluarse de forma fiable usando técnicas cualitativas y cuantitativas. La técnica cualitativa del papel de Whatman y el volumen hemático cuantitativo confirmaron una anticoagulación sustancial antes de la aplicación del torniquete. A pesar de que la anticoagulación previa a la obstrucción arterial y venosa no es una estrategia pertinente desde un punto de vista clínico para tratar la flegmasía, fue necesario un pretratamiento para garantizar la anticoagulación durante el estrés fisiológico experimental. La heparinización disminuyó significativamente la expresión de TAT, un marcador de trombosis, en las patas traseras de los animales sometidas a oclusión venosa (fig. 6). En estos experimentos, aun cuando la heparina se administró antes del inicio de la oclusión venosa, los niveles de TAT siguieron siendo más bajos que en los animales tratados con suero salino, pero mayores que en aquellos sometidos a simulación. En estos experimentos, la cantidad de heparina administrada a los animales en forma de bolo fue 10 veces la dosis administrada normalmente en una infusión intravenosa continuada sólo 5 min después de la infusión29. Este hallazgo sugiere que la oclusión venosa es un estado protrombótico grave que es relativamente resistente a los efectos anticoagulantes de la heparina. Junto con esta observación, también encontramos que, a pesar de un aumento de 2,5 veces en el tiempo de sangría y de la administración pre hoc de heparina, no hubo una alteración de la expresión de la proteína de GRO-1 o de IL-6 en el músculo esquelético (figs. 4 y 5). La oclusión venosa aumentó marcadamente la expresión de GRO-1 pero no de IL-6 en músculo esquelético comparado con animales del grupo simulado. La IL-8 y su equivalente en ratones, GRO-1, se han estudiado extensamente en modelos previos de trombosis venosa e inflamación3,4,30-32. Por consiguiente, el aumento de los niveles de proteína de este análogo murino como respuesta al estrés provocado por la oclusión venosa y la isquemia parcial confirmó un medio inflamatorio sustancial en el músculo esquelético. La incapacidad de la oclusión venosa para aumentar los niveles de proteína de IL-6 fue inesperada cuando se considera en el contexto de un incremento destacado de los niveles de ARNm de IL-6. La revisión de los estudios previos sobre el papel de la IL-6 en los procesos trombóticos sugiere que su expresión puede estar confinada a la pared venosa30,31. Por lo tanto, es posible que la imposibilidad de estos estudios para documentar un aumento de los niveles de proteína asociado a oclusión venosa, a pesar del aumento de los ARNm respectivos, podría guardar relación con un efecto dilucional, debido al edema del músculo esquelético, ya que dicho edema no se ha asociado a trombosis en la pared venosa.
En conclusión, los resultados del presente estudio indican que, en este modelo de ratón de flegmasia cerulea dolens, la anticoagulación terapéutica disminuyó sustancialmente la concentración de marcadores de trombosis pero no la expresión de citocinas en el músculo esquelético. En la extracción de estas conclusiones, los experimentos descritos parten de la investigación previa evaluando la respuesta inflamatoria a la oclusión venosa en dos situaciones concretas. En primer lugar, el análisis de proteínas y ARNm de citocinas se confinó al tejido muscular de la pata más que a las venas aisladas. En segundo lugar, la disminución del flujo arterial asociada a las formas más malignas de trombosis arterial proporcionó otra variable que no se ha estudiado previamente en los modelos murinos de obstrucción venosa. Estos hallazgos indican que las medidas terapéuticas para alterar la respuesta de las citocinas asociada con la obstrucción venosa y la isquemia parcial debe dirigirse específicamente a estos factores, a sus receptores o a las células inflamatorias.
Esta investigación se financió a través de una Merit Award del Research Service of the Veterans Administration, VA Department of Defense Combat Casualty Care Project, Department of Surgery, y la Division of Vascular Endovascular Surgery, Massachusetts General Hospital.
H. T. Hua y H. Albadawi contribuyeron por igual al presente estudio.