La neutralización selectiva del factor de crecimiento BB derivado de las plaquetas (PDGF-BB), el factor básico de crecimiento fibroblástico (bFGF), y el factor de crecimiento transformante beta1 (TGF-beta1) mediante anticuerpos específicos administrados localmente a injertos de politetrafluoroetileno expandido (PTFEe) puede disminuir la hiperplasia neointimal. Se dividieron 60 cerdos en dos grupos (n = 30 cada uno) y, a continuación, se dividieron adicionalmente en cinco subgrupos. El grupo 1 se sometió a la colocación de un injerto de interposición PTFEe pretratado con Matrigel® en la arteria ilíaca bilateral. Tres subgrupos (A, B y C) recibieron un anticuerpo monoclonal específico anti-PDGF-BB, bFGF o TGF-beta1. Otro (D) recibió todos los anticuerpos y el otro sirvió como control (sin isotipos inmunes de inmunoglobulina G [IgG]) (E). El grupo 2 se sometió a la implantación de un injerto de interposición de PTFEe pretratado con Matrigel® sobre el que se sembraron células endoteliales (CE) de arteria ilíaca bilateral. Tres subgrupos (A, B y C) recibieron un anticuerpo específico frente a PDGF-BB, bFGF o TGF-beta1. Uno (D) recibió todos los anticuerpos y uno sirvió como control (sin isotipos inmunes IgG) (E). La microscopia óptica y la tinción inmunohistoquímica revelaron que la formación de hiperplasia neointimal se redujo significativamente en los subgrupos D comparados con los otros (p < 0,05). En aquéllos, el pretratamiento diferente influyó en la formación de hiperplasia neointimal. Fue más pronunciada en las prótesis revestidas de CE y Matrigel (p < 0,05). En un cultivo de órgano, se identificó una disminución del grado de liberación de PDGF-BB, bFGF y TGF-beta1 en los animales del subgrupo D comparado con los otros (p < 0,05). En los subgrupos D la liberación de PDGF-BB, bFGF y TGF-beta1 dependió del pretratamiento de PTFEe. Se liberó una mayor cantidad de estos factores de crecimiento en las prótesis pretratadas con CE y Matrigel (p < 0,05), y el índice de marcado con bromodesoxiuridina confirmó la mayor incorporación en este subgrupo (p < 0,001). La utilización combinada de anticuerpos monoclonales anti-PDGF-BB, bFGF y TGF-beta1, administrados localmente, reduce la formación de hiperplasia neointimal.
Los injertos sintéticos fabricados con politetrafluoroetileno expandido (PTFEe) pueden utilizarse como sustitutos de las venas autólogas, pero se caracterizan por una permeabilidad reducida en los vasos cuyo diámetro es < 6 mm debido a la trombosis precoz o al fracaso tardío a partir de hiperplasia neointimal.1 Los injertos infrapoplíteos de PTFE se asocian a una tasa de permeabilidad primaria a los 4 años de tan sólo el 12%.2 En la actualidad, se han propuesto dos estrategias para combatir la formación de hiperplasia neointimal. La primera consiste en crear una capa de células endoteliales en la superficie del injerto sintético que sea capaz de resistir a las fuerzas de cizallamiento del torrente circulatorio.3,4 La segunda utiliza la elución de fármacos con propiedades antiproliferativas en el lugar de la lesión del vaso.5,6
La hiperplasia neointimal es una respuesta celular y molecular, caracterizada por una proliferación continua anormal, predominantemente de células musculares lisas (CML) y tejido conectivo derivado de los componentes mediales y de la producción de la matriz extracelular, siendo el resultado final la hiperplasia de la pared del vaso y la estenosis luminal. En modelos de primate, la hiperplasia neointimal se desarrolla a lo largo del injerto debajo de la capa endotelial intacta.7 En seres humanos, Herring y LeGrand8 observaron que los fracasos tardíos de las prótesis implantadas podían deberse a una hiperplasia neointimal anastomótica.
El mecanismo subyacente de la hiperplasia intimal sigue siendo desconocido, pero podrían desempeñar un papel diversas citocinas y factores de crecimiento. Las células endoteliales (CE) producen, entre otras sustancias, factor de crecimiento derivado de las plaquetas9 (PDGF), factor de crecimiento fibroblástico básico10 (bFGF), y factor de crecimiento transformante beta111 (TGF-beta). El PDGF consiste en moléculas diméricas que pueden existir como homodímeros o heterodímeros de dos cadenas peptídicas diferentes pero relacionadas llamadas PDGF-A y PDGF-beta9 (es decir, PDGF-AA, PDGF-BB y PDGF-AB). Las CE secretan principalmente el homodímero PDGF-BB.12 PDGF es un importante mitógeno de las células del tejido conectivo en cultivo y desempeña un papel en la promoción de la migración de las células musculares lisas desde la media a la íntima.13 bFGF es un miembro de los mitógenos de unión a la heparina y se caracteriza por su afinidad por ésta y su capacidad para estimular las CE y la proliferación de las CML.10,14,15 El TGF-beta, un polipéptido homodimérico de 25 kDa, secretado en forma latente por las células de los mamíferos, tiene la capacidad de estimular la proliferación en función de su concentración.11 Produce efectos estimuladores a concentraciones bajas, mientras que a concentraciones altas provoca la inhibición de la proliferación de CML.16 Por lo tanto, esta última tendría una función reguladora.
Probamos la hipótesis de que la formación de hiperplasia neointimal anastomótica en injertos sintéticos podría neutralizarse con anticuerpos específicos, anti-PDGF-BB, bFGF y TGF-beta1, administrados localmente en un modelo in vivo.
Material y métodosLos cuidados y procedimientos en animales cumplieron con la Guide for the Care and Use of Laboratory Animals, Institute of Laboratory Animal Resources, Commission on Life Sciences, National Research Council (Washington, D.C.: National Academy Press, 1996). Se incluyeron 60 cerdos (Renato Rossi Farm, Maccarese, Roma, Italia) que fueron alojados en el centro de cuidados de animales en el departamento de cirugía pediátrica del Ospedale Bambino Gesu, Palidoro (Roma, Italia). Los animales tenían libre acceso a comida y agua. Todos eran hembras y pesaban 35-40 kg. Se dividieron en dos grupos (n = 30 cada uno) y a continuación se subclasificaron en cinco subgrupos (n = 6 cada uno). En el grupo 1 se implantó un injerto de interposición de PTFEe (WL Gore and Associates, Flagstaff, Estados Unidos) en la arteria ilíaca bilateral prerrevestido de Matrigel®(Becton Dickinson Europe, Meylan Cedex, Francia). En los tres subgrupos (A, B y C) el prerrevestimiento también se asoció con un anticuerpo monoclonal específico frente a PDGF-BB, bFGF o TGF-beta1 (Peprotech, Londres, Reino Unido), respectivamente. En un subgrupo (D) se asociaron los tres anticuerpos y uno sirvió como control (sin isotipos inmunes de inmunoglobulina G [IgG]). El grupo 2 se sometió a la implantación de un injerto de interposición de PTFEe prerrevestido con Matrigel, sobre el que se sembraron células endoteliales (CE), en arteria ilíaca bilateral. De forma parecida, en los tres subgrupos (A, B y C) el pretratamiento también se asoció con un anticuerpo específico frente a uno de los factores de crecimiento. Un subgrupo (D) recibió los tres anticuerpos y otro sirvió como control (sin isotipos inmunes de IgG) (E). Todos los injertos de PTFEe medían 4 mm de diámetro y 5 cm de longitud, con una distancia internodal de 30 μm.
Procedimientos quirúrgicosLa anestesia se indujo con tiletamina más zolacepam reconstituido con xilacina por vía intramuscular y se mantuvo con isoflurano al 1% a través del tubo endotraqueal. La exposición y explantación de ambas venas yugulares para obtener células endoteliales homólogas para su siembra se efectuaron mediante anticoagulación intravenosa con heparina en dosis de 110 U/kg, después de lo cual se administraron dosis suplementarias (55 U/kg) a intervalos cada 30 min hasta completar la cirugía. Los animales se restablecieron de la intervención, y después de 15 días, se efectuó un segundo procedimiento quirúrgico. Se expusieron las arterias ilíacas. Se colocó un injerto de interposición de PTFEe terminoterminal bilateral de 5 cm de longitud 1 cm por debajo de la bifurcación aórtica. Para construir las anastomosis se usó una sutura interrumpida de PTFEe de 7/0. No se observó un desajuste de calibre entre la arteria ilíaca donante y el injerto. La hidratación se preservó mediante infusión continua de solución salina normal (10 ml/kg/h). La permeabilidad del injerto se evaluó en el momento de la cirugía mediante criterios de inspección, evaluación continua con eco-Doppler del pulso femoral e inspección directa en el momento de la extracción para evaluación histológica. Todos los animales se sacrificaron en el día 60 postoperatorio (mediante inyección IV de Beuthanasia-D Special [Schering-Plough Animal Health, Kenilworth, NJ] al término del procedimiento quirúrgico). Con anestesia general, se anticoaguló a los animales (heparina sódica 110 U/kg/IV) y los injertos se retiraron con un cuff de arteria sana en el lugar de las anastomosis.
Cultivo de células endotelialesBrevemente, se lavaron las venas yugulares con suero salino estéril, tamponado con fosfato (phosphate-buffered saline [PBS]) (Dako, Glostrup, Dinamarca) y se eliminaron todas las marcas de los clampajes y los lugares de las agujas. Las venas se canularon en un extremo y se lavaron cuidadosamente dos veces con PBS precalentado a 37 °C. Acto seguido, las venas se distendieron con una solución de colagenasa de tipo II (Sigma, St. Louis, MO), disuelta con un porcentaje del 0,01% de solución equilibrada de Hanks (EuroClone, Cramlington, Reino Unido), precalentada a 37 °C. Las venas se incubaron durante 10 min a 37 °C en una incubadora suministrada con un 5% de CO2. Después de la incubación, el contenido de la vena se lavó con 20 ml de solución equilibrada de Hanks en un tubo de 50 ml y las suspensiones de células resultantes se centrifugaron durante 5 min a 1.000 rpm a temperatura ambiente. El sedimento de células se resuspendió en 15 ml de un medio 199 (Clonetics, Cambrex BioScience, Rockland, ME), un 20% de suero de ternera fetal, 90 μg/ml de heparina, 2 mmol de glutamina, 101 UI/ml de penicilina y 100 μg/ml de estreptomicina y se sembraron en placas dentro de frascos T25 (Falcon, Becton Dickinson Labware, Franklin Lakes, NJ). Las células crecieron en un medio de un 5% de CO2 a 37 °C. El medio de cultivo se reemplazó a días alternos. Las células siempre se reimplantaron después de 15 días en el mismo animal.
Confirmación de la identidad de las células endotelialesLas CE se identificaron por su típica morfología en adoquín con un microscopio de contraste de fases Zeiss (Carl Zeiss, S.p.A., Arese, Italia). La identidad de las células se confirmó adicionalmente por la presencia de factor de von Willebrand (antígeno del factor VIII) utilizando un anticuerpo de conejo anti-factor de von Willebrand humano.
Preparación de los injertos vasculares de PTFEeLos injertos de PTFEe se revistieron con Matrigel con la adición de anticuerpos específicos frente a PDGF-BB, bFGF, y TGF-b1 en una dosis de 2 mg/cm2 o sin isotipos inmunes de IgG (controles). Todos los anticuerpos también eran específicos de cerdo. Las dosis de antibióticos se eligieron de acuerdo con nuestras observaciones previas,17 y estas dosis neutralizaron por completo los factores de crecimiento. Además, la adición de anticuerpos específicos no suprimió la producción y síntesis de las otras citocinas y/o factores de crecimiento. De hecho, antes de la siembra, examinamos las CE en busca de la liberación de interleucina 1 (IL-1) e IL-6. El Matrigel mantenido a -20 °C se solidificó en condiciones estériles en los injertos de PTFEe a temperatura ambiente durante 20 min. Nuestras observaciones preliminares in vitro demostraron que los anticuerpos se liberan gradualmente del Matrigel cuando son insertados en un sistema de flujo laminar18 (fuerza de cizallamiento = 6 din/cm2). Acto seguido, las CE se sembraron en el injerto del grupo 2 a una densidad de 200.000/cm2 y se cultivaron hasta su confluencia en un dispositivo de rotación adaptado con este objetivo específico durante al menos 15 días (media 15 ± 3, límites 15-21, mediana 16). Este dispositivo garantizó una velocidad de rotación constante y una temperatura de 37 °C. El propio tubo de rotación era de aluminio lo que permitió su esterilización. La adherencia de las CE en el Matrigel en condiciones de flujo laminar18 se preserva después del revestimiento. Además, antes de su implantación in vivo, en los controles se confirmó la vitalidad y funcionalidad de las células mediante el método de exclusión con el colorante azul de tripano (Sigma).
Estudios de endotelización de las CE e hiperplasia neointimalPara evaluar la formación de hiperplasia neointimal y de endotelización, se preparó una muestra de una extremidad con la técnica de fijación de presión in vivo para su examen y estudio en microscopio óptico e inmunohistoquímico. Brevemente, los injertos y vasos adyacentes se perfundieron con suero salino durante 3 min. A continuación, los injertos se perfundieron con formol a una presión fisiológica (100 mmHg). Después de 2 min, se procedió a la ligadura de ambos lados de arterias y venas, lo que permitió la fijación de la presión de los vasos.
Microscopia electrónicaLos injertos de PTFEe se fijaron en glutaraldehído (2,5% en 0,1 M del tampón cacodilato) durante 3 h a 4 °C, se lavaron tres veces en 0,1 M de tampón cacodilato posfijado en OsO4 (2% en 0,1 M de tampón cacodilato) durante una hora y después se lavaron 3 veces en 0,1 M de tampón cacodilato. Los injertos de PTFEe se deshidrataron en una solución seriada de etanol y se secaron mediante el método del punto crítico (Emscope CPD 750; Emscope Lab., Ashford, Reino Unido). Se montó un segmento del injerto de PTFEe en portas de microscopía electrónica tras su recubrimiento con oro coloidal (Emscope Sc 500; 15 mA, 44 s) y se examinaron con microscopio electrónico de barrido (S-570; Hitachi, Tokio, Japón), a 15 Kv. Cada muestra se analizó con una magnificación elevada (x200 y x1.000) en lugares estándar (en la parte proximal, media y distal del injerto y cada 0,5 mm). Para cada área se determinó el porcentaje de endotelización mediante planimetría computarizada. Dos anatomopatólogos diferentes repitieron tres veces las determinaciones de manera enmascarada y se calculó la media.
Microscopio ópticoLas secciones fijadas que representaban el injerto proximal, medio y distal se fijaron en parafina y se tiñeron con hematoxilina y eosina (Sigma). Dos anatomopatólogos enmascarados para el estudio efectuaron las comparaciones morfométricas en los lugares estándar (en la porción proximal, media y distal del injerto y cada 5 mm) utilizando videomorfometría computarizada (Quantimet 500; Leica, Cambridge Ltd., Cambridge, Reino Unido). Se realizaron comparaciones entre grupos del porcentaje de estenosis transversal atribuida a la hiperplasia neointimal y el grado de grosor neointimal en la unión arterial-injerto indexado con el grosor del injerto de PTFEe. El porcentaje de estenosis transversal se calculó dividiendo el área neointimal por el área circunscrita por la superficie interna de una sección transversal del segmento de PTFEe. El área neointimal se calculó sustrayendo el área luminal del área delimitada por la superficie interna del corte transversal de PTFEe: % de estenosis transversal = área interna de PTFEe - área luminal/área interna de PTFEe.
Tinciones inmunohistoquímicasLas tinciones inmunohistoquímicas se prepararon utilizando técnicas estándar de inmunoperoxidasa. Brevemente, las secciones seriadas (de 3 μm de grosor), montadas en 3-aminopropiltrietoxilano (Dako), se desparafinaron en xileno, se rehidrataron en soluciones seriadas de etanol y se trataron con metanol que contenía un 0,3% de H2O2 para neutralizar la actividad de la peroxidasa endógena. Después de un lavado en la solución PBS sin Ca y Mg (pH 7,4), los portas se incubaron en suero de caballo normal (Vector Laboratories, Burlingame, CA) durante 30 min a temperatura ambiente. Este último y todos los reactivos posteriores se diluyeron en PBS, que contenía un 0,1% de albúmina sérica bovina, añadidos a 200 μl/porta e incubados en una cámara de humedad cerrada herméticamente. El suero de caballo normal se eliminó y los portas se incubaron toda la noche a 4 °C con el anticuerpo policlonal anti-factor VIII (Dako) y el anticuerpo monoclonal anti-alfa-actina específico de CML (Dako). Tras la incubación, se eliminó el anticuerpo primario y los portas se lavaron dos veces en PBS. Se usó un anticuerpo secundario (Vector Laboratories) a una dilución de 1:200. Tras la incubación durante 30 min y dos lavados en PBS, se añadió el complejo avidina-biotina (Vector Laboratories) durante 30 min a temperatura ambiente. Los portas se lavaron en PBS, y se inició la reacción de la peroxidasa utilizando un 0,06% de diaminobencidina (Sigma) y un 0,01% de peróxido de hidrógeno. Después de un lavado final, las secciones se deshidrataron en etanol, se clarificaron en xileno, y se montaron bajo un portaobjetos.
Cultivo de tejidosPara evaluar la liberación y producción de PDGF-BB, bFGF y TGF-beta1, se preparó un cultivo de tejidos del injerto obtenido de la extremidad contralateral. Brevemente, se abrieron longitudinalmente los injertos y el segmento aórtico por encima y por debajo de aquéllos, se dividieron en tres porciones de 17 mm cada una (que representaban la anastomosis proximal, de la porción media y distal) y se lavaron durante 10 min con un medio de Eagle modificado por Dulbecco (Clonetics, Cambrex BioScience) suplementado con antibióticos (gentamicina 200 mg/ml, y penicilina 100 UI/ml). Las muestras se depositaron en 48 pocillos de cultivo tisular Costar (Cambridge, MA). El tejido se incubó durante 5 días a 37 °C en una atmósfera de un 5% de CO2. Se obtuvieron alícuotas de los medios condicionados a las 72 h y se centrifugaron durante 5 min a 15.000 rpm y el sobrenadante se almacenó a -80 °C para análisis de PDGF-BB, bFGF y TGF-beta1 mediante análisis de enzimoinmunosorbencia (ELISA). La producción de los factores de crecimiento también se evaluó con un método de inmunoelectrotransferencia. Para evaluar el endotelio después de un cultivo de órgano de 5 días, se usó un método de exclusión del colorante azul de tripano para visualizar la viabilidad celular.
ELISALa presencia de PDGF-BB, bFGF y TGF-beta1 en medios condicionados libres de suero de los injertos de PTFEe se determinó con ELISA (Quantikine human PDGF-BB, bFGF, TGF-b1; R&D Systems, Oxford, Reino Unido).
InmunoelectrotransferenciaLa liberación de PDGF-BB, bFGF y TGF-beta1 se confirmó mediante inmunoelectrotransferencia. Para detectar los factores en los medios condicionados de los injertos de PTFEe, se añadió un exceso de anticuerpos anti-PDGF-BB, bFGF o TGF-beta1 (4 μg/ml) a los medios condicionados. Acto seguido, se precipitó con proteína A de Staphylococcus aureus (Sigma). La concentración de proteína de las muestras derivadas de los medios condicionados inmunoprecipitados se determinó usando un análisis de proteínas de Bradford (Sigma). Se suspendieron 40 microgramos de la proteína total en el tampón reductor. Acto seguido, se separaron las muestras con electroforesis en gel de poliacrilamida-dodecilosulfato sódico al 10% (SDS-PAGE) durante 1,5 h a 120 V y se transfirieron a nitrocelulosa durante una hora a 100 V. Las membranas se incubaron en un tampón neutralizador (un 5% de leche en polvo sin grasa, un 0,1% de Tween 20 y PBS) y se sondaron toda la noche con el anticuerpo IgG monoclonal murino anti-PDGF-BB, bFGF y TGF-beta1 humanos (1 μg/ml). Las membranas se incubaron con un anticuerpo murino secundario específico, conjugado con peroxidasa de rábano picante (dilución 1:2.000, Peprotech), desarrollado con el uso de un equipo de realce de quimioluminiscencia (Peprotech) y expuesto a una película de rayos X XAR Kodak (Rochester, NY) durante 1, 5 y 10 min. Como controles positivos, se usaron PDGF-BB, bFGF y TGF-beta1 recombinantes humanos (150 ng). Se examinaron las películas y se adquirieron mediante el densitómetro Imaging Fluor-S (Bio-Rad, Hercules, CA). Todos los resultados se normalizaron para el control positivo.
Índice de marcado con bromodesoxiuridinaA partir de las 48 h del cultivo de órgano, se añadió bromodesoxiuridina (BrdU) al medio de cultivo a una concentración final de 10 μmol/l. Cada sección se desparafinó en xileno, se rehidrató en etanol y se introdujo junto con el tampón citrato (10 mM, pH 6) en un horno de microondas (750 W) para tres ciclos de calor de 5 min. Las secciones se tiñeron usando anticuerpos anti-BrdU (Dako) diluidos hasta 1:100; además, se usó un anticuerpo anti-alfa-actina específico de CML (Dako) diluido hasta 1:100. El complejo avidina-biotina se añadió durante 30 min a temperatura ambiente. Los portas se lavaron en PBS, y se inició la reacción de la peroxidasa utilizando un 0,06% de diaminobencidina y un 0,01% de peróxido de hidrógeno. Después de un aclarado final, las secciones se deshidrataron en etanol, se clarificaron en xileno y se montaron bajo un portaobjetos. Las secciones se contratiñeron en hematoxilina (Sigma) para visualizar los núcleos no marcados. El número total de núcleos neointimales marcados y no marcados en cada campo de alta resolución se utilizó como índice de marcado BrdU. Este índice se evaluó como el porcentaje medio de núcleos marcados de las CML neointimales [(núcleos marcados/núcleos totales) x 100].
Análisis estadísticoLos datos se introdujeron en una hoja de cálculo informática y se analizaron con un programa estadístico (SPSS 12.0 para Windows, estadística básica y avanzada, 1989-2003; SPSS Inc., Chicago, Estados Unidos). Todos los experimentos se efectuaron por duplicado y los resultados se expresaron como media ± desviación estándar de seis experimentos diferentes. Las variables continuas se compararon con la prueba de la U de Mann-Whitney o un análisis de Kruskal-Wallis de la varianza de una vía. Se consideró significativo un valor de p < 0,05.
ResultadosNo se registró mortalidad operatoria, y todos los animales sobrevivieron a la duración del estudio. En los explantes, todos los injertos estaban permeables. No se identificaron infecciones del injerto, aneurismas o anomalías anastomóticas (estenosis o pseudoaneurismas); y todos los injertos se habían incorporado satisfactoriamente.
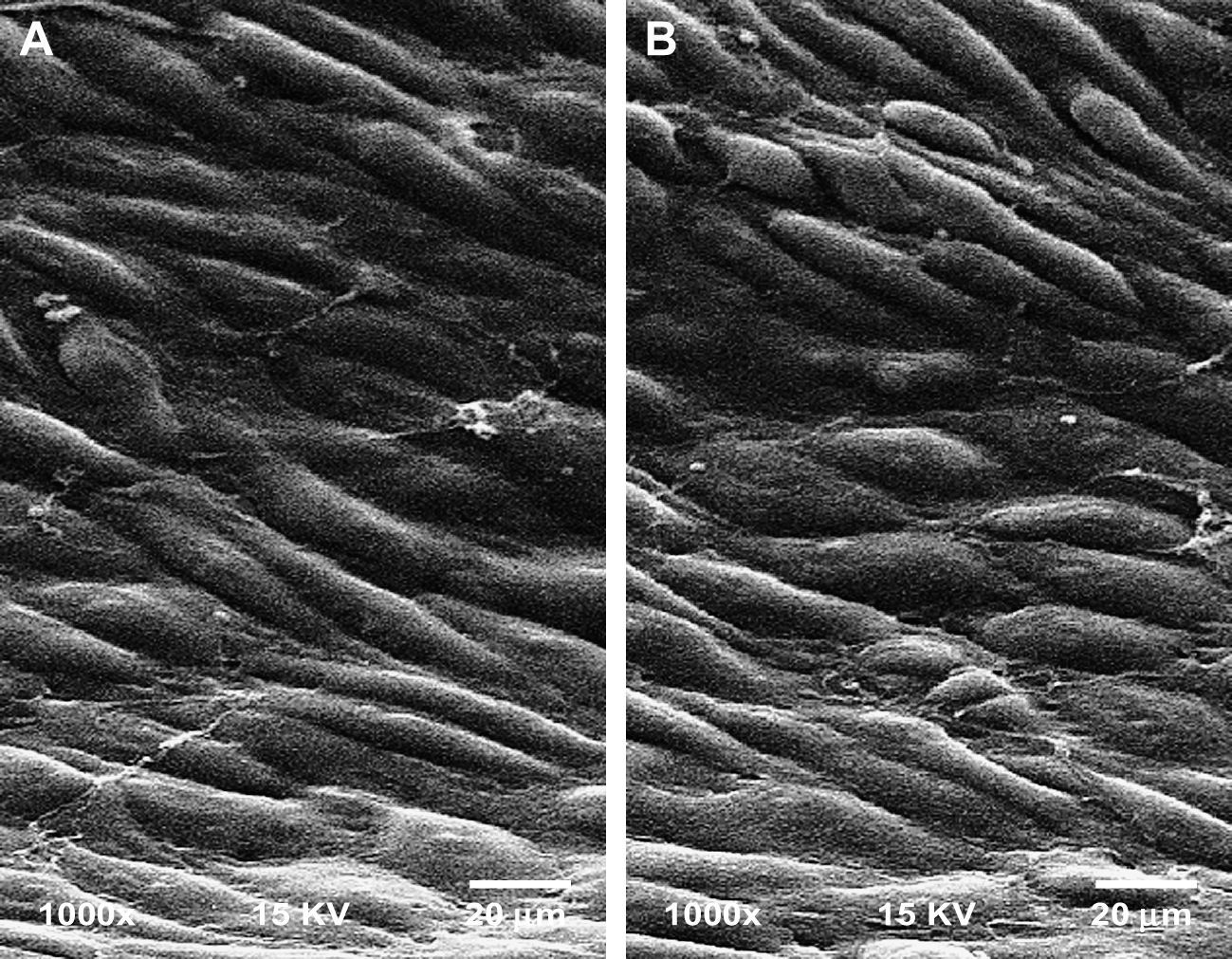
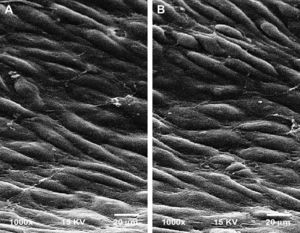
Microscopia electrónicaEl examen de las secciones del injerto después del explante reveló que la endotelización de las CE con el clásico patrón de “adoquín” se adhería a los islotes nodales y obliteraba por completo las fibrillas internodales de PTFEe en todos los grupos (fig. 1).
Micrografía electrónica de barrido representativa que no muestra diferencias entre los grupos de control en el momento del explante. Los paneles muestran la endotelización de las células (CE) con el clásico patrón adherente a los islotes nodales y obliteración de las fibrillas internodales del grupo 1, subgrupo E (A), y grupo 2, subgrupo E (B) (magnificación original, x 1.000).
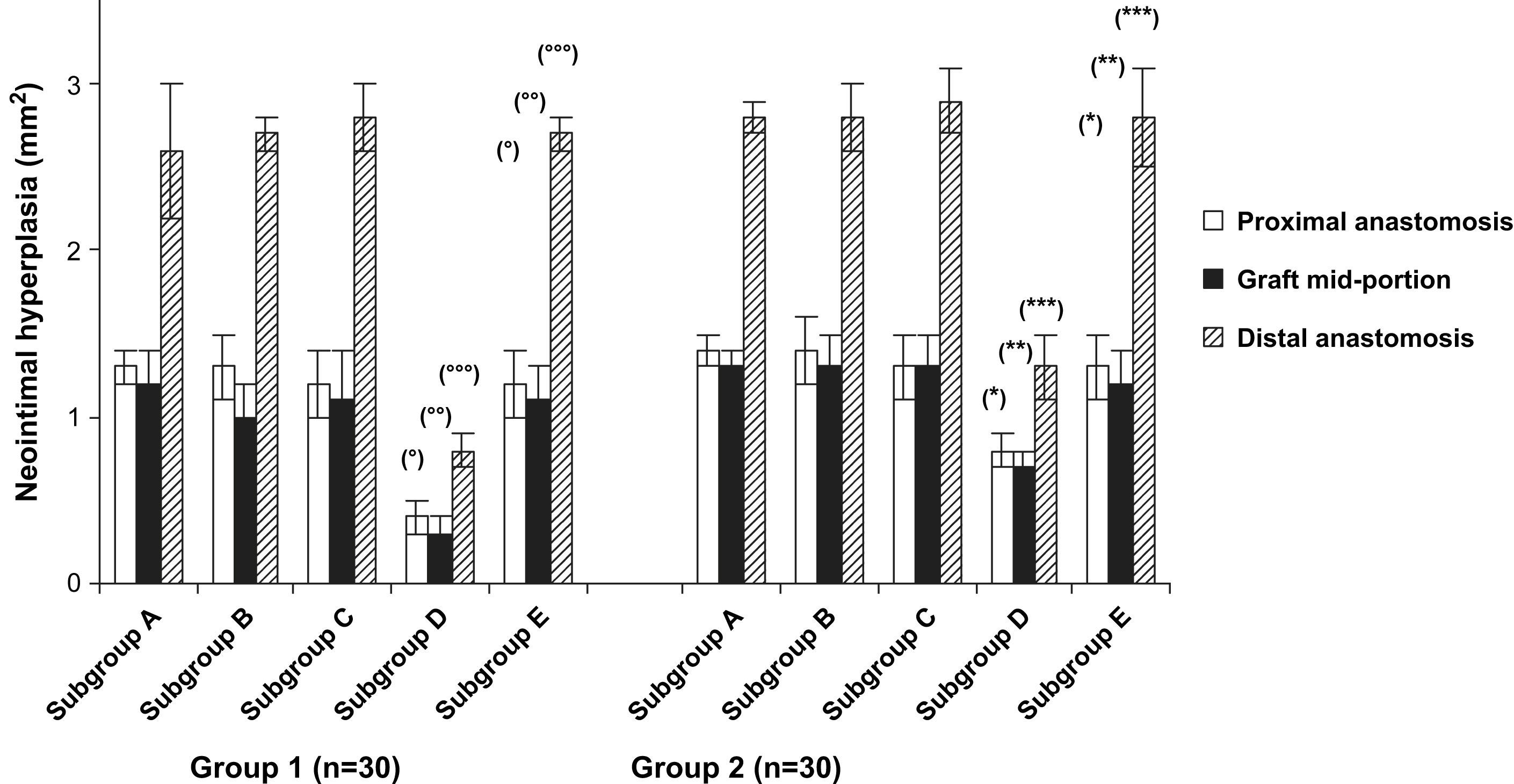
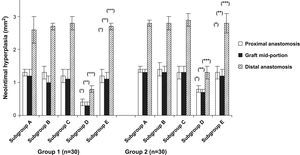
En la figura 2 se describen los resultados de la hiperplasia neointimal en los diferentes grupos. La histología macroscópica en el punto final del día 60 demostró una hiperplasia neointimal considerable en la porción proximal, media y distal del injerto en ambos grupos. Aunque se detectó una tendencia hacia una disminución de la neoíntima en la porción media del injerto, el grosor anastomótico proximal no difirió de la porción media. Al contrario, el grosor anastomótico distal estaba aumentado significativamente comparado con la porción proximal y media en todos los grupos (p < 0,0001). En la comparación de los tratamientos del injerto, la formación de hiperplasia neointimal disminuyó significativamente en animales del subgrupo D (p < 0,001). Sin embargo, dentro de los subgrupos D, el pretratamiento diferente ejerció una influencia significativa en la formación de hiperplasia neointimal. Fue más pronunciada en las prótesis pretratadas con CE y Matrigel (p < 0,04).
Formación de hiperplasia neointimal en la anastomosis proximal, media y distal. En los subgrupos D, la formación de hiperplasia neointimal disminuyó significativamente comparado con los controles (subgrupos E). Grupo 1, subgrupo D comparado con subgrupo E, ○p < 0,02, ○○p < 0,03 y ○○○p < 0,001; grupo 2, subgrupo D comparado con subgrupo E, ∗p < 0,01, ∗∗p < 0,03 y ∗∗∗p < 0,02. Distal anastomosis: anastomosis distal; Graft mid-portion: porción media del injerto; Group: grupo; Neointimal hyperplasia (mm2): hiperplasia neointimal (mm2); Proximal anastomosis: anastomosis proximal; Subgroup: subgrupo.
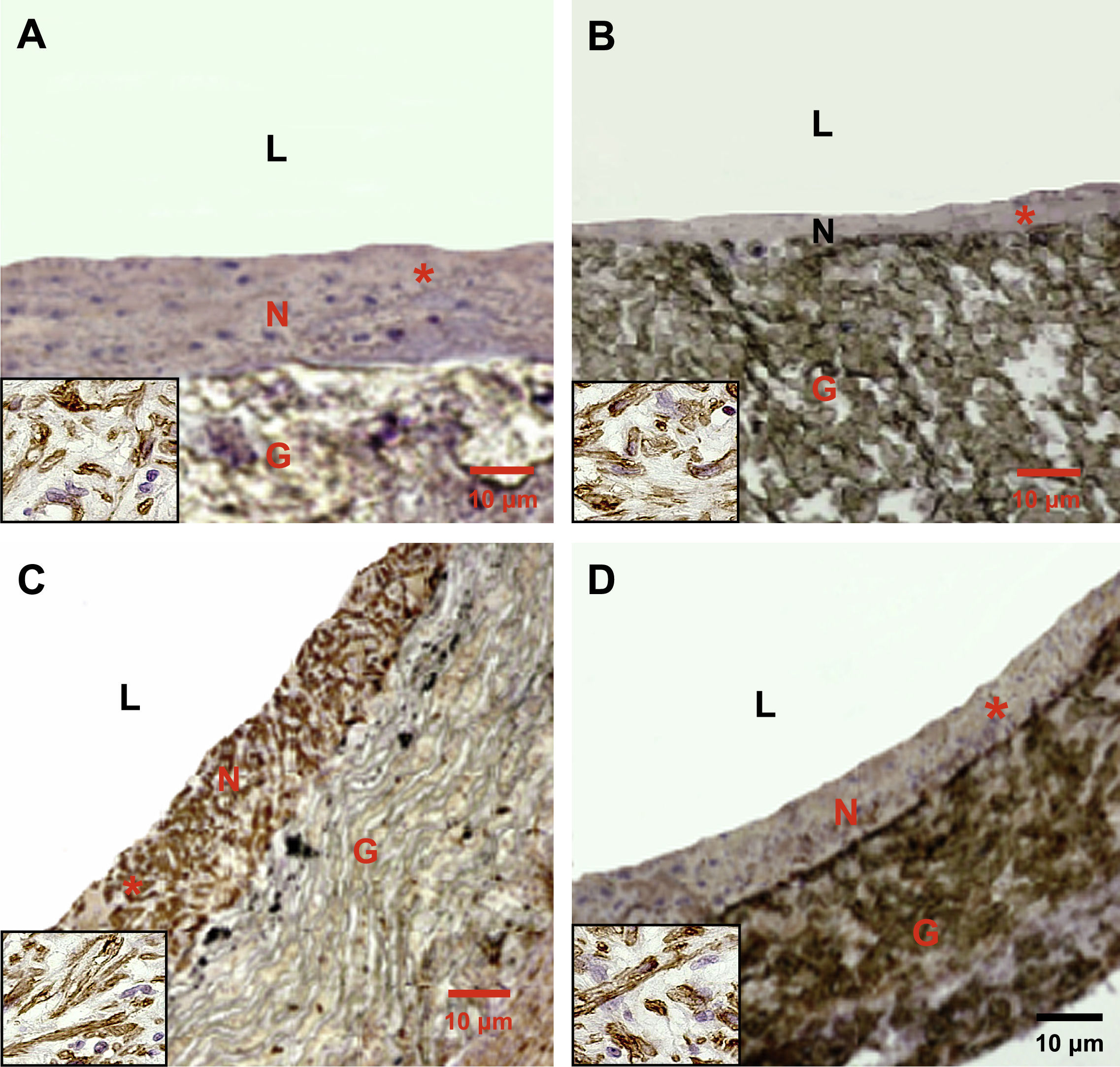
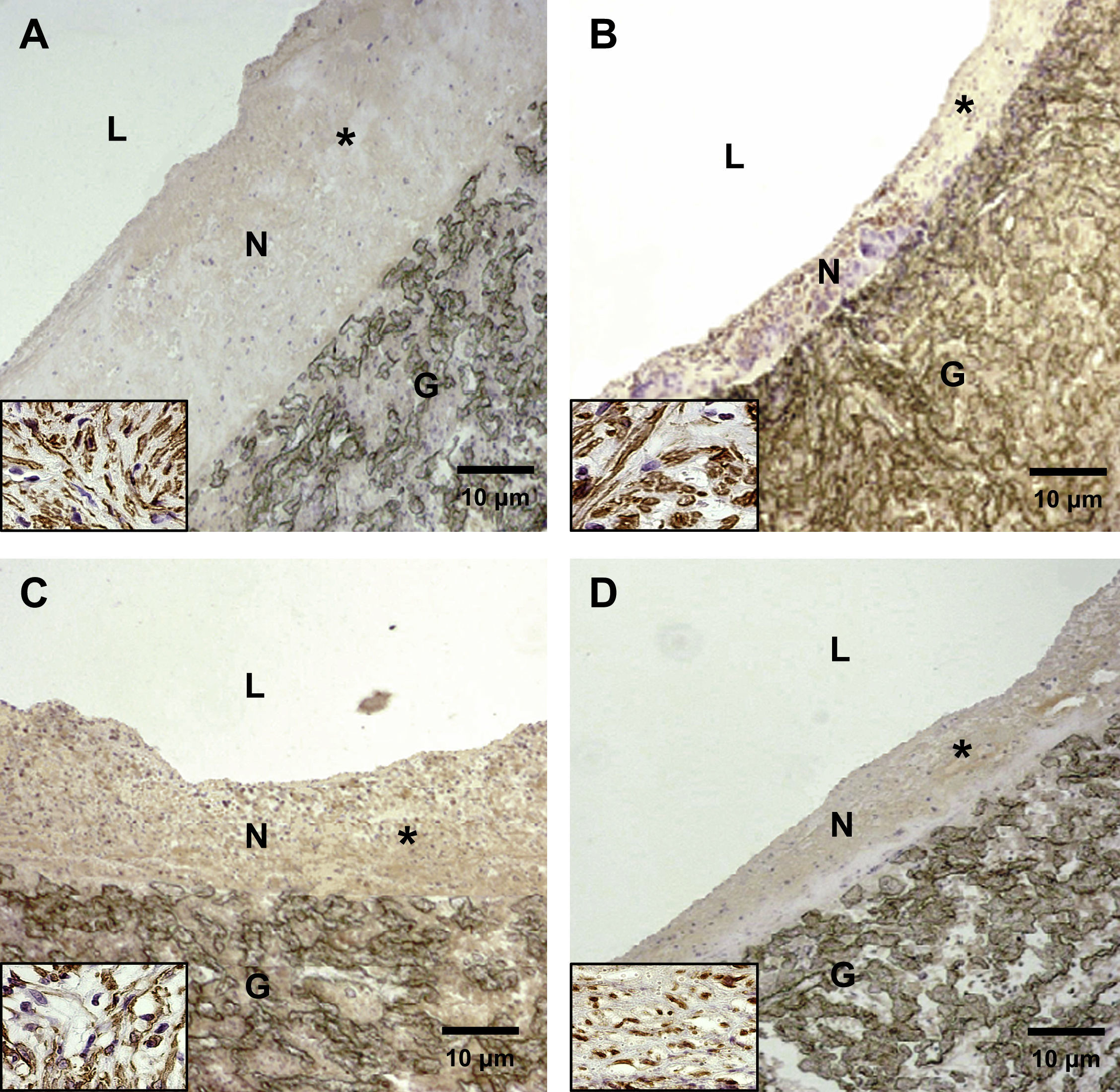
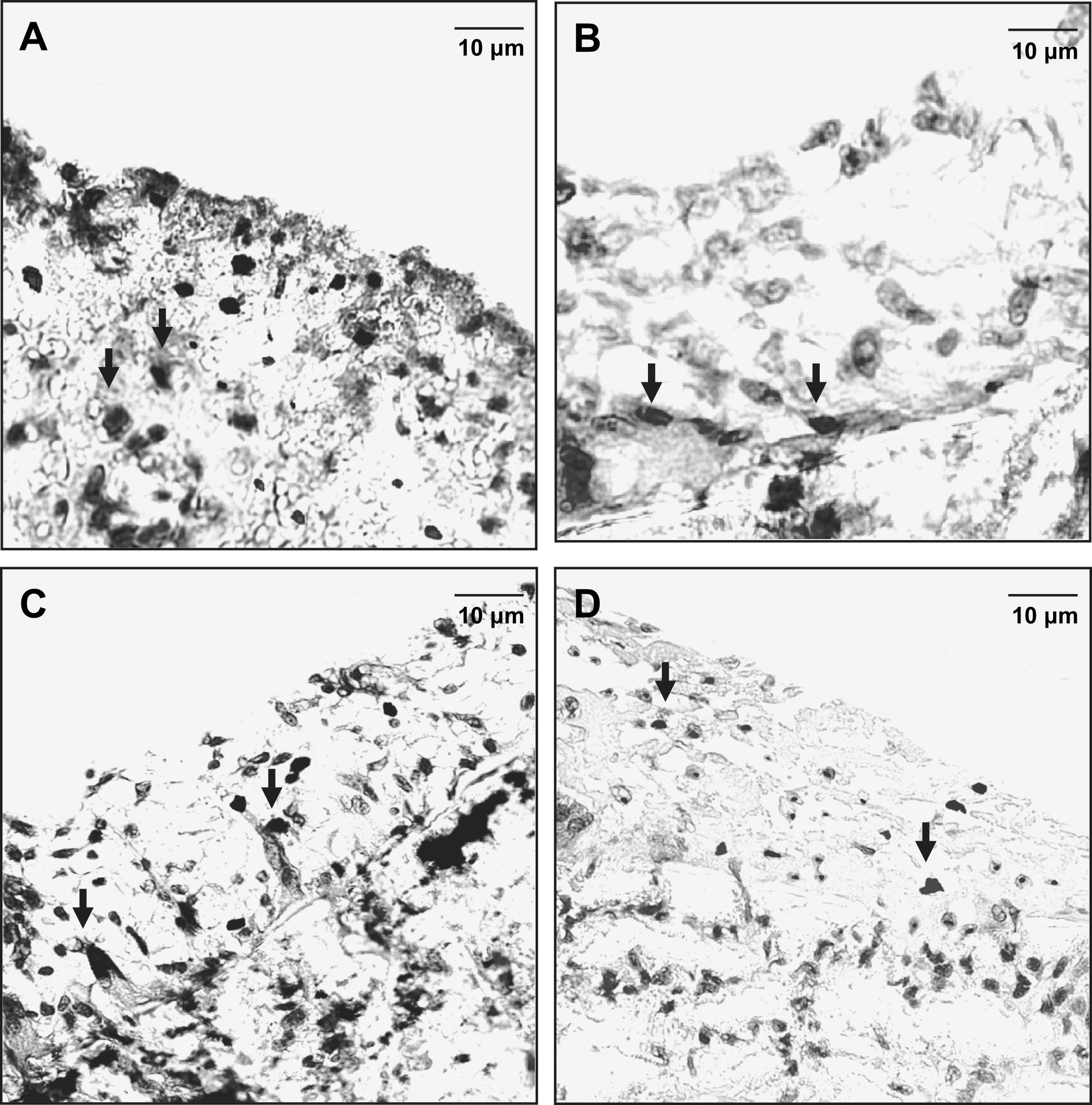
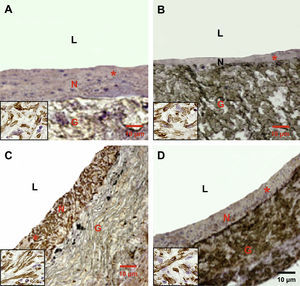
En las figuras 3 y 4 se muestran las secciones teñidas representativas en la anastomosis proximal y distal. Las tinciones inmunohistoquímicas revelaron que las células endoteliales cubrían las superficies de la neoíntima según lo demostrado con la tinción del antígeno relacionado con el factor VIII. Las células musculares lisas eran el principal tipo de células neointimales identificadas mediante tinción con alfa-actina entre la superficie luminal y la porción interna del injerto.
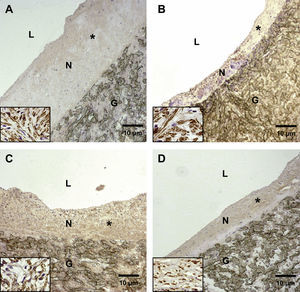
La formación de hiperplasia neointimal representativa en la anastomosis proximal se redujo significativamente en animales pertenecientes a los subgrupos D comparados con los otros subgrupos (grupos 1 y 2, control, A y C). En los animales del grupo 2, subgrupo D, la formación de hiperplasia neointimal fue más pronunciada (D) comparado con el grupo 1, subgrupo D (B). G: material del injerto de politetrafluoroetileno expandido (PTFEe) (magnificación original x 10); L: luz; N: neoíntima. Los insertos (ángulo inferior izquierdo) muestran con mayor magnificación que la mayoría de las células de la neoíntima son positivas para la tinción con alfa-actina (magnificación original, x 40).
La formación de hiperplasia neointimal representativa en la anastomosis distal se redujo significativamente en animales pertenecientes a los subgrupos D comparados con los otros subgrupos (grupos 1 y 2, control, A y C). En los animales del grupo 2, subgrupo D, la formación de hiperplasia neointimal fue más pronunciada (D) comparado con el grupo 1, subgrupo D (B). G: material del injerto de PTFEe (magnificación original x 10); L: luz; N: neoíntima. Los insertos (ángulo inferior izquierdo) muestran con mayor magnificación que la mayoría de las células de la neoíntima son positivas para la tinción con alfa-actina (magnificación original, x 40).
Después del cultivo de órgano, las células endoteliales eran viables según el método de exclusión con azul de tripano.
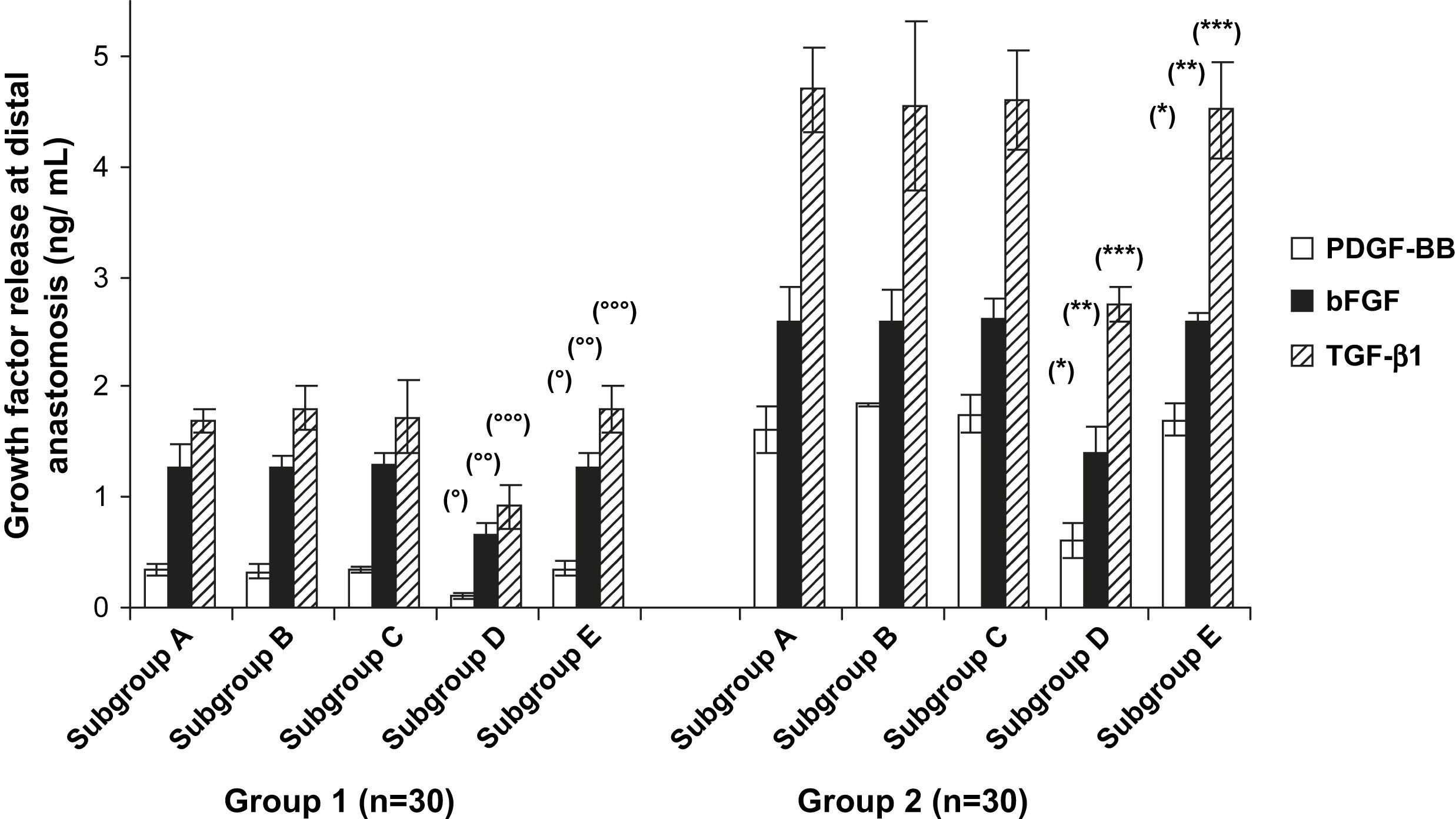
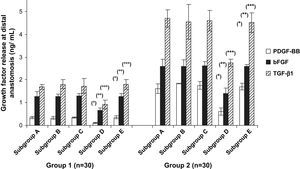
ELISAEn la figura 5 se describe la liberación de diversos factores de crecimiento en el medio de cultivo para la anastomosis distal. En las prótesis pretratadas con CE y Matrigel se liberó una cantidad significativamente mayor de PDGF-BB, bFGF y TGF-beta1 (p < 0,001). En la comparación de los tratamientos del injerto, la cantidad de liberación de factores de crecimiento en el grupo 1 o en el grupo 2 disminuyó significativamente en los animales del subgrupo D comparado con los otros subgrupos (p < 0,04). Sin embargo, dentro de los subgrupos D, la liberación de estos factores dependió del pretratamiento de PTFEe: los injertos pretratados con CE y Matrigel liberaron más factores de crecimiento que los pretratados con Matrigel solo (p < 0,001).
Liberación de los diversos factores de crecimiento en el cultivo de órgano en la anastomosis distal. En los subgrupos D, la liberación de PDGF, bFGF y TGF-beta1 disminuyó significativamente comparado con los controles (subgrupos E). Grupo 1, subgrupo D comparado con subgrupo E, ○p < 0,02, ○○p < 0,03 y ○○○p < 0,01; grupo 2, subgrupo D comparado con subgrupo E, ∗p < 0,001, ∗∗p < 0,03 y ∗∗∗p < 0,002. bFGF: factor básico de crecimiento fibroblástico; Group: grupo; Growth factor release at distal anastomosis (ng/mL): liberación de factor de crecimiento en la anastomosis distal (ng/ml); PDGF-BB: factor de crecimiento BB derivado de las plaquetas; Subgroup: subgrupo; TGF-β1: factor de crecimiento transformante beta1.
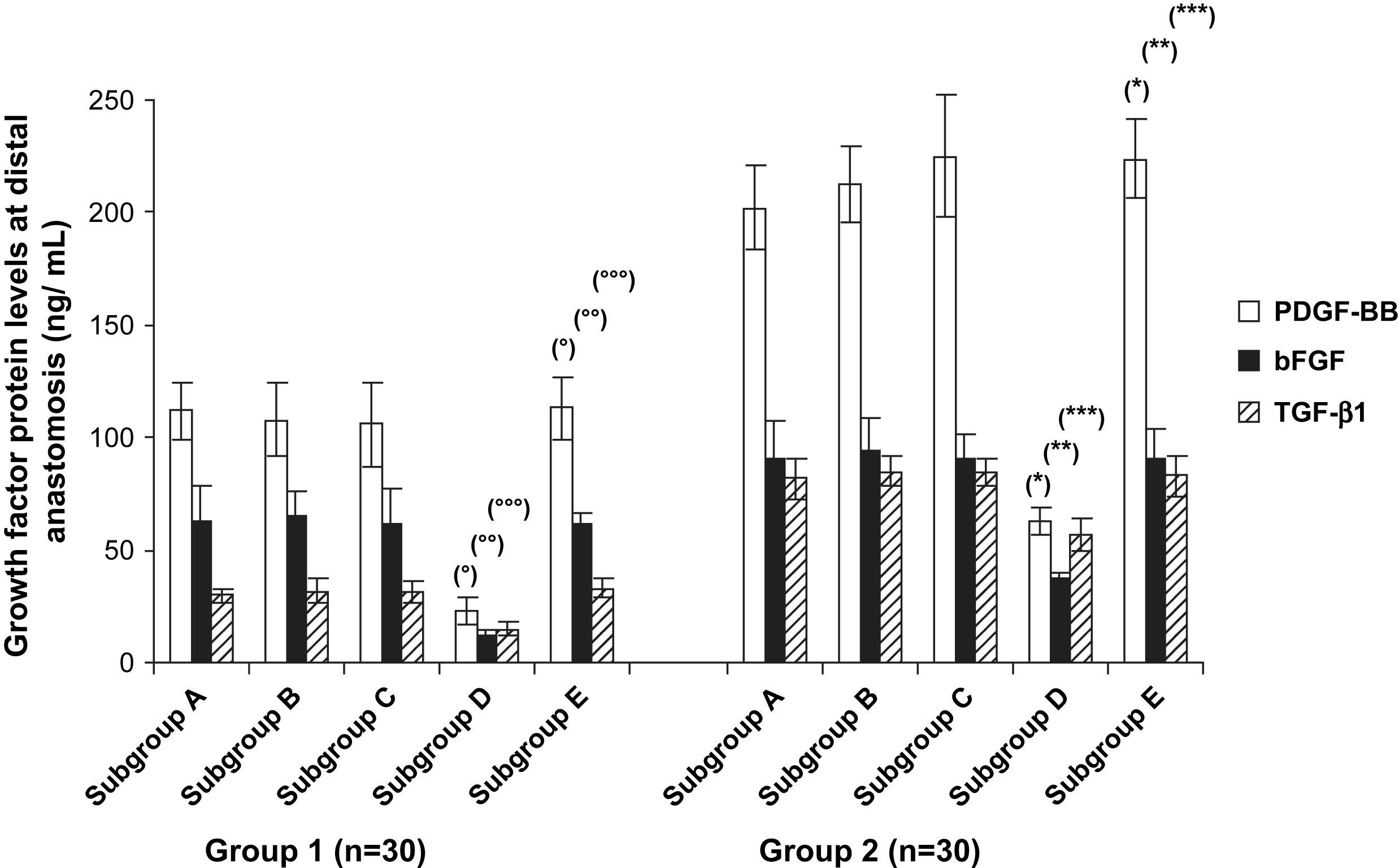
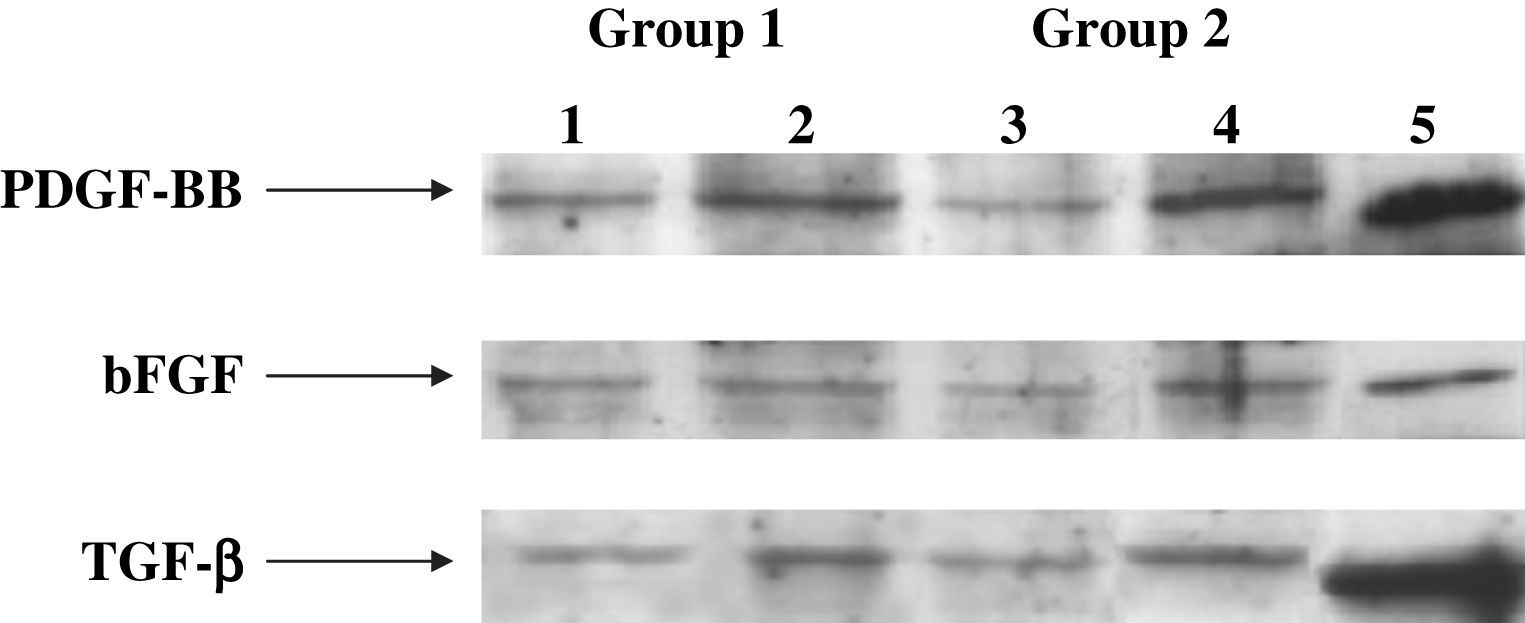
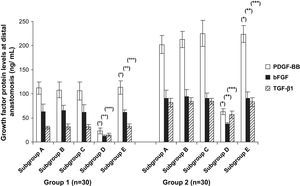
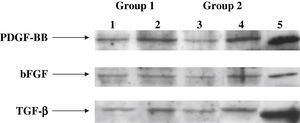
La inmunoelectrotransferencia confirmó los resultados del ELISA, y en la figura 6 se muestran los niveles de proteínas de los factores de crecimiento en la anastomosis distal. Los niveles de proteínas de estos factores fueron significativamente mayores en el grupo 2 comparado con el 1 (p < 0,001). Cuando se analizaron los tratamientos del injerto, observamos niveles de proteínas de estos factores significativamente más bajos en los subgrupos D comparado con los otros subgrupos (p < 0,001). Sin embargo, dentro de los subgrupos D, en las prótesis pretratadas con células endoteliales y Matrigel (p < 0,004) se produjo una cantidad significativamente mayor de proteínas (fig. 7).
Niveles de proteínas de los diversos factores de crecimiento en el cultivo de órgano en la anastomosis distal. En los subgrupos D, los niveles de proteínas de PDGF, bFGF y TGF-beta1 disminuyeron significativamente comparado con los controles (subgrupos E). Grupo 1, subgrupo D comparado con subgrupo E, ○p < 0,001, ○○p < 0,004 y ○○○p < 0,001; grupo 2, subgrupo D comparado con subgrupo E, ∗p < 0,001, ∗∗p < 0,03 y ∗∗∗p < 0,03. bFGF: factor básico de crecimiento fibroblástico; Group: grupo; Growth factor protein levels at distal anastomosis (ng/mL): liberación de factor de crecimiento en la anastomosis distal (ng/ml); PDGF-BB: factor de crecimiento BB derivado de las plaquetas; Subgroup: subgrupo; TGF- β1: factor de crecimiento transformante beta1.
Análisis de inmunoelectrotransferencia para determinación de PDGF, bFGF y TGF-beta1 en los medios condicionados de los injertos de PTFEe en la anastomosis distal. Como controles positivos se usaron PDGF, bFGF y TGF-beta1 recombinantes humanos (carril 5). En los subgrupos D, los niveles de proteínas de PDGF, bFGF y TGF-beta1 disminuyeron significativamente (carriles 1 y 3) comparado con los otros grupos (carriles 2 y 4, controles) (p < 0,001). En los subgrupos D, en las prótesis tratadas con células endoteliales y Matrigel (carril 3 comparado con 1), se produjo una cantidad significativamente mayor de proteína (p < 0,004). bFGF: factor básico de crecimiento fibroblástico; Group: grupo; PDGF-BB: factor de crecimiento BB derivado de las plaquetas; TGF- β1: factor de crecimiento transformante beta1.
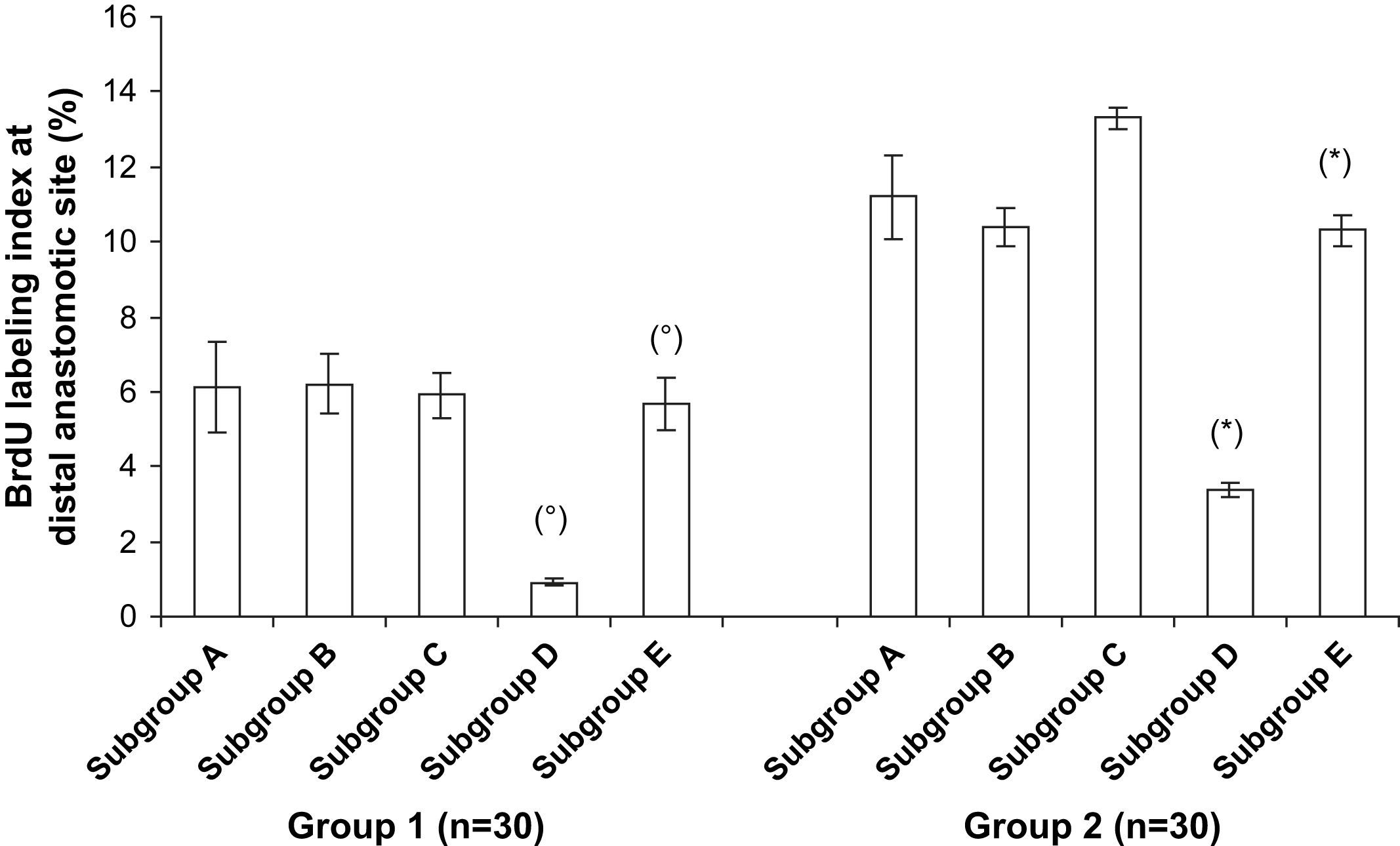
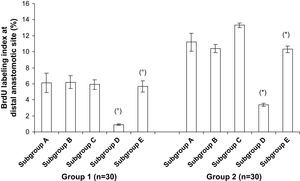
En la figura 8 se muestran los datos del índice de marcado con BrdU en la anastomosis distal. Su incorporación en los núcleos de las células musculares lisas en la anastomosis distal fue significativamente mayor en el grupo 2 comparado con el 1 (p < 0,001). En la comparación de los tratamientos del injerto, su incorporación se redujo significativamente en animales del subgrupo D (p < 0,001). Sin embargo, dentro de estos subgrupos D, el pretratamiento diferente ejerció una influencia significativa en su incorporación. Fue más pronunciada en las prótesis pretratadas con CE y Matrigel (p < 0,001) (fig. 9).
Índice de marcado con bromodesoxiuridina (BrdU) de las células musculares lisas (CML) en la anastomosis distal. En los subgrupos D, el índice disminuyó significativamente comparado con los controles (subgrupos E). Grupo 1, subgrupo D comparado con subgrupo E, ○p < 0,001; grupo 2, subgrupo D comparado con subgrupo E, ∗p < 0,001. BrdU labeling index at distal anastomotic site (%): índice de marcado con bromodesoxiuridina (BrdU) en la anastomosis distal (%); Group: grupo; Subgroup: subgrupo.
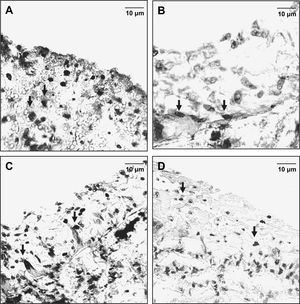
Marcado representativo con bromodesoxiuridina (BrdU) de las células musculares lisas (CML) en la anastomosis distal. El marcado de CML se redujo significativamente en animales pertenecientes a los subgrupos D comparados con los otros subgrupos (grupos 1 y 2, control, A y C). En los animales del grupo 2, subgrupo D, el marcado de CML fue más evidente (D) comparado con el grupo 1, subgrupo D (B) (magnificación original, x 40).
El hallazgo principal de este estudio fue que los injertos de PTFEe pretratados con Matrigel, y la administración simultánea de anticuerpos frente a PDGF, bFGF y TGF-beta1, redujo significativamente la formación de hiperplasia neointimal. La importancia de estas observaciones reside en el hecho de que la hiperplasia neointimal influye en alto grado en el destino de la reconstrucción vascular protésica de pequeño calibre. Representa la respuesta a una lesión vascular, que se sigue de una intensa actividad de las células musculares lisas, que da lugar a la proliferación en la media, migración a la íntima, proliferación en la íntima, y aumento del volumen celular y de la producción de matriz extracelular y es más prominente en las anastomosis de los injertos vasculares protésicos.19
Paradójicamente, en el presente estudio la siembra de CE no desempeñó ningún papel en una disminución adicional de formación de hiperplasia neointimal o mejores tasas de permeabilidad. La creación de una capa de células endoteliales en la superficie de un injerto protésico, capaz de resistir las fuerzas de cizallamiento del torrente circulatorio, puede aumentar la permeabilidad del injerto a corto plazo3,4,20 y reducir la trombogenicidad de los sustratos sintéticos,21,22 inhibiendo e invirtiendo la coagulación.23,24 Todos los injertos pretratados con Matrigel y anticuerpos frente a PDGF, bFGF y TGF-beta1 estaban permeables, y la formación de hiperplasia neointimal se redujo significativamente, comparado con los injertos en los que se sembraron CE. Walpoth et al25 observaron que la fibrina y el factor de crecimiento endotelial vascular producen efectos lesivos sobre el proceso de integración tisular del injerto, porque aumentan el crecimiento neointimal en la anastomosis proximal. En el presente estudio, el Matrigel no ejerció un efecto perjudicial sobre la permeabilidad del injerto, probablemente porque la endotelización con CE a partir de la anastomosis y/o proliferación transmural impidió la trombosis e inhibió un cierto grado la producción de mitógeno relacionado con CE.
Por otra parte, en injertos pretratados con CE, la proliferación anastomótica de CML y el engrosamiento intimal tuvieron lugar debajo del endotelio intacto26 de modo exagerado y más rápido comparado en los injertos no pretratados. Los hallazgos del marcaje con BrdU también confirmaron una mayor proliferación de células musculares lisas en los injertos pretratados con células endoteliales. Las interacciones iniciales entre los diferentes mitógenos liberados por las CE y CML podrían estar implicadas en la mayor formación de hiperplasia neointimal. Estos hallazgos confirmaron nuestras observaciones previas in vitro.17
Además, esperábamos que la neutralización de los factores de crecimiento clave redujera incluso más la formación de hiperplasia neointimal. Ferns et al27 demostraron que el desarrollo de una lesión intimal en la arteria carótida de ratas lampiñas atímicas se inhibe mediante anticuerpos policlonales anti-PDGF. Los autores no encontraron una diferencia estadísticamente significativa en los índices de marcado medial o intimal entre ratas tratadas con anti-PDGF y ratas tratadas con IgG no inmune, lo que sugiere que la disminución de la lesión neointimal se debe principalmente a la migración por quimiotactismo de las CML mediales a la media inducida por PDGF. Lindner et al28 observaron que el factor bFGF desempeña un papel clave en la replicación del músculo liso después de una lesión. En modelos de ratas sometidas a lesión carotídea, la infusión de este factor de crecimiento produce un aumento sustancial de la proliferación de células musculares lisas,29 y el tratamiento con un anticuerpo anti-bFGF neutraliza la proliferación de estas células en alrededor del 80%.30 Aunque el factor PDGF y bFGF son potencialmente importantes en la proliferación y quimiotactismo celular, es probable que ninguno de los dos actúe individualmente en el proceso de la hiperplasia neointimal sino que requiera la presencia de otras condiciones para producir una hiperplasia neointimal significativa31 (es decir, activación del plasminógeno, IL-1, IL-6, factor alfa de necrosis tumoral, TGF-beta, etc.). En particular, TGF-beta actúa in vitro como un potente inhibidor de los factores de crecimiento para las células endoteliales y musculares lisas y es capaz de determinar indirectamente una respuesta proliferativa mediada a través de la secreción autocrina de PFGF.32 El factor TGF-beta induce la proliferación de células musculares lisas a través de un mecanismo bimodal: a concentraciones bajas produce un efecto estimulador pero a concentraciones altas da lugar a la inhibición de su proliferación.16
De acuerdo con estas observaciones previas, en el presente estudio podríamos haber observado un aumento de la formación de hiperplasia neointimal en los subgrupos tratados con anticuerpos específicos anti-TGF-beta1, pero no se registró una diferencia significativa. Los hallazgos del presente estudio disminuyen la importancia de este factor en la regulación de los otros factores de crecimiento liberados, como mínimo, en las condiciones de estos experimentos. Al contrario, la neutralización simultánea de los tres factores de crecimiento previno la formación de hiperplasia neointimal. Como mínimo en teoría, esto refleja y demuestra la estrecha relación entre las células endoteliales, las células musculares lisas y los diversos factores de crecimiento y citocinas liberados en los modelos in vivo. El cultivo de órgano confirmó que, después de 60 días de implantación, los injertos pretratados con CE y Matrigel liberaron y produjeron más factores de crecimiento que los pretratados con Matrigel solo y, en consecuencia, indujeron una mayor respuesta de hiperplasia neointimal.
En conclusión, el uso combinado de anticuerpos monoclonales anti-PDGF-BB, bFGF y TGF-beta1, administrados localmente, reduce la formación de hiperplasia neointimal pero su reducción está influida adversamente por el pretratamiento del injerto con células endoteliales.
Damos las gracias al Sr. Pierpaolo Coluccia por su ayuda en la preparación de las tinciones inmunohistoquímicas y al Sr. Quinto Giustiniani por su ayuda en la microscopia electrónica.
La financiación de este estudio corrió a cargo de W. L. Gore and Associates.