Con la aparición del tratamiento endovascular de la patología aneurismática aórtica, aquellos aneurismas aórticos abdominales con cuellos infrarrenales cortos (≤ 10 mm, AAACC) se consideran aneurismas yuxtarrenales. El tratamiento mínimamente invasivo consiste en intervenciones híbridas o endoimplantes fenestrados. Presentamos nuestra experiencia con la corrección aórtica directa de los AAACC realizada a través de un abordaje completamente laparoscópico. Los resultados se expresan como medianas con los valores extremos. Desde febrero de 2002 hasta diciembre de 2007 se realizó la corrección laparoscópica de AAACC en 32 pacientes. La longitud del cuello aórtico infrarrenal fue de 5 mm (0-10). La media de edad en los 29 hombres y las 3 mujeres fue de 70 años (límites 50-84). Nueve pacientes acudieron con insuficiencia renal preoperatoria de grado 1 (28,1%). La intervención fue completamente laparoscópica en 30 pacientes (93,7%). Los abordajes aórticos incluyeron las exposiciones retrorrenal izquierda (n = 24) y retrocólica transperitoneal izquierda (n = 8). La media de tiempo para la intervención fue de 270 min (intervalo 215-410) y para el clampaje 83 min (intervalo 36-147). El clampaje aórtico fue suprarrenal en 14 casos (43,7%), con un tiempo medio de 24 min (intervalo 9-37). La media de la pérdida de sangre fue de 850 ml (intervalo 215-2.400). La mortalidad a los 30 días fue del 3,1% (un paciente falleció por infarto de miocardio). Dos pacientes acudieron con complicaciones sistémicas severas (6,4%): coagulopatía postoperatoria con síndrome hemorrágico y neumopatía. Diecisiete presentaron complicaciones sistémicas leves o moderadas no mortales (53,1%): insuficiencia renal transitoria (n = 12), colitis isquémica de grado 1 (n = 1), insuficiencia suprarrenal (n = 1), isquemia miocárdica (n = 1), y arritmia cardíaca (n = 2). Un paciente volvió a ser intervenido debido a una obstrucción intestinal. Se reintrodujo la dieta líquida al cabo de 1 día (intervalo 1-13). La mayoría de los pacientes pudieron deambular hacia el día 3 (intervalo 2-17). La duración media de la hospitalización fue de 48 h (intervalo 12-552) en la unidad de cuidados intensivos y de 10 días (intervalo 4-37) en el hospital. Tras un seguimiento medio de 27 meses (intervalo 1-50), 28 pacientes siguen vivos, con una recuperación completa sin anomalías en el implante. Tres pacientes fallecieron: uno a causa de una neumopatía y dos por carcinoma, a los 29, 19, y 44 meses de seguimiento, respectivamente. Dos pacientes presentaron una dilatación aórtica yuxtarrenal estable < 35 mm. La corrección yuxtarrenal laparoscópica completa de los AAA es factible, resultando una buena alternativa para los pacientes con AAACC. Los resultados a corto y medio plazo tienen una buena correlación con los de la cirugía abierta. Así mismo, la corrección laparoscópica completa reduce el traumatismo de los abordajes quirúrgicos amplios. Sobre la base de estos alentadores resultados preliminares, siempre que es posible, decidimos realizar tratamiento laparoscópico a los pacientes con AAACC y un riesgo quirúrgico bajo.
Los aneurismas aórticos abdominales (AAA) yuxtarrenales representan un porcentaje creciente de intervenciones quirúrgicas abiertas en aquellos casos de corrección aneurismática, que oscila entre el 8 y el 20%1-3. Con la aparición de la reparación endovascular (EVAR), estos aneurismas se definen mejor como AAA con cuellos infrarrenales cortos (AAACC) que no permiten el correcto sellado de los endoimplantes3-6. Esta definición incluye a todos los AAA con una longitud de cuello < 10 mm7,8. La reparación aórtica directa (RAD) mediante aneurismorrafia e interposición de bypass protésico sigue siendo la única técnica duradera y fiable para tratar los AAACC9. El objetivo de nuestro trabajo es presentar nuestra experiencia con la RAD en AAACC realizada a través de un abordaje totalmente laparoscópico. Se comentan los aspectos técnicos, las ventajas y los límites de esta nueva técnica mínimamente invasiva.
Materiales y MétodosEntre febrero de 2002 y diciembre de 2007, realizamos en nuestro centro 154 correcciones de AAA completamente laparoscópicas, de las cuales 32 casos eran AAACC (20,8%). Se obtuvieron los datos demográficos y clínicos de forma prospectiva y se analizaron de forma retrospectiva.
Técnica quirúrgicaLa exposición laparoscópica de los AAACC se realizó mediante abordaje transperitoneal retrorrenal (TPRR) y retrocólico10,11 (TPRC). Cuando fue necesario, la disección más allá de la arteria renal izquierda difirió entre ambos abordajes. Con el abordaje TPRR, se seccionó el pilar izquierdo del diafragma. Con el TPRC, fue necesario movilizar la vena renal izquierda y seccionar el plexo celíaco.
La aneurismorrafia laparoscópica del AAACC utilizó pasos similares a los descritos previamente para la corrección de los AAA infrarrenales12 completamente laparoscópica. Cuando fue necesario realizar un clampaje suprarrenal, utilizamos el clampaje secuencial para reducir el tiempo de isquemia renal13. Se utilizaron 3 estrategias en función de la anatomía aórtica yuxtarrenal:
- 1.
Si la aorta yuxtarrenal estaba libre de trombos, se colocó en primer lugar un clampaje infrarrenal para realizar la corrección del aneurisma. Luego se colocó un segundo clampaje por encima de las arterias renales, y se soltó el infrarrenal para poder realizar la anastomosis proximal cerca del ostium de la arteria renal. El tiempo de isquemia renal, pues, fue el tiempo necesario para realizar solamente la anastomosis proximal.
- 2.
En los casos en los que la aorta yuxtarrenal no fue adecuada para el clampaje, se colocó en primer lugar un clampaje aórtico suprarrenal para realizar la corrección. Si la zona de destino de la anastomosis proximal era suficientemente larga por debajo de las arterias renales, se colocó un segundo clampaje infrarrenal y se liberó el suprarrenal. El tiempo de isquemia renal fue el tiempo necesario para realizar la aneurismorrafia y la preparación del cuello infrarrenal.
- 3.
Si la preparación de la aorta infrarrenal no permitió una longitud suficiente para mover el clampaje infrarrenal tras la corrección del aneurisma, se realizó también una anastomosis proximal bajo el clampaje suprarrenal. El tiempo de isquemia renal fue entonces el tiempo necesario para realizar la anastomosis proximal.
Para realizar el bypass con interposición del implante se utilizaron prótesis de Dacron tubulares o bifurcadas (Gelweave o Gelsoft-Plus; Vascutek-Terumo, Inchinnan, RU). Las anastomosis se realizaron con dos suturas continuas semicircunferenciales de polipropileno anudadas previamente en parches de Teflón. Se utilizó un manguito de Teflón para reforzar la línea de sutura en casos de fragilidad o delgadez aórtica. Los dos extremos de la hebra se anudaron internamente14,15.
Experiencia clínicaSe realizaron tomografías computerizadas helicoidales (TCH) en todos los pacientes. Se calculó el diámetro máximo del aneurisma y la longitud del cuello proximal según los estándares descritos para la EVAR4. Los AAACC se definieron como aneurisma con una longitud de cuello proximal < 10 mm en la TC. Los pacientes se clasificaron según los criterios de la American Society of Anesthesiologists (ASA). Además, todos los pacientes fueron sometidos a una evaluación cardíaca preoperatoria con ecocardiografías de esfuerzo y pruebas de funcionalidad pulmonar, hepática y renal. La insuficiencia renal se definió como concentraciones de creatinina > 1,5 mg/dl. La clasificación de la gravedad se realizó según los criterios de la Society for Vascular Surgery (SVS): grado 1 y grado 2 para concentraciones de creatinina de 1,5 a 2,4 y de 2,5 a 5,9 mg/dl, respectivamente16. Las contraindicaciones para la corrección laparoscópica de los AAACC fueron: 1) rotura e inflamación del aneurisma, 2) necesidad de reconstrucción concomitante de la arteria renal derecha, 3) necesidad de reconstrucciones complejas de las arterias renales y/o viscerales, y 4) pacientes no idóneos para cirugía aórtica.
Entre los datos intraoperatorios se incluyeron el tiempo de la intervención y del clampaje, la pérdida de sangre, y la temperatura corporal al final de la intervención. Definimos el tiempo de clampaje aórtico como el tiempo transcurrido entre la colocación del clampaje aórtico y la liberación del clampaje de la primera arteria ilíaca o femoral. Los tiempos de isquemia renal hicieron referencia al tiempo total de oclusión renal desde el momento de la colocación del clampaje aórtico hasta la perfusión de la arteria renal. La conversión a corrección abierta se definió por la necesidad de realizar una laparotomía para completar la intervención.
Todos los pacientes fueron enviados a la unidad de cuidados intensivos (UCI) inmediatamente después de la intervención y llevados a planta al normalizarse los parámetros hemodinámicos, respiratorios y biológicos. La mortalidad y la morbilidad se notificaron según los criterios de la SVS16. Resumiendo, la mortalidad precoz o tardía incluyó todos los fallecimientos acaecidos antes o después de 30 días, respectivamente. Las complicaciones se clasificaron como sistémicas –graves, leves o moderadas–, locales vasculares, y locales no vasculares. La insuficiencia renal postoperatoria se consideró una complicación sistémica cuando las concentraciones máximas postoperatorias de creatinina superaron la puntuación renal preoperatoria.
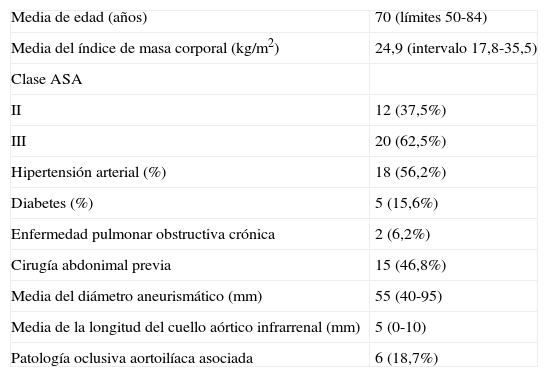
ResultadosSe estudiaron 32 pacientes (29 hombres y 3 mujeres) con una edad media de 70 años (límites 50-84). Se clasificaron como ASA II (n = 12) y III (n = 20). Las intervenciones se realizaron de forma programada en todos los pacientes. Nueve de ellos (28,1%) presentaron una insuficiencia renal de grado 1 con una concentración media de creatinina de 1,74 mg/dl (intervalo 1,5-2,4). Cinco pacientes (15.6%) presentaron patología coronaria. Otros datos preoperatorios se resumen en la tabla I. El tamaño medio de los aneurismas fue de 55 mm (intervalo 40-95). El cuello proximal presentó una longitud media de 5 mm (intervalo 0-10). Dieciséis AAACC fueron aneurismas aórticos (50%), 8 fueron aneurismas aortoilíacos (25%), y 8 fueron aneurismas asociados con patología oclusiva aortoilíaca (25%).
Datos demográficos y anatómicos
| Media de edad (años) | 70 (límites 50-84) |
| Media del índice de masa corporal (kg/m2) | 24,9 (intervalo 17,8-35,5) |
| Clase ASA | |
| II | 12 (37,5%) |
| III | 20 (62,5%) |
| Hipertensión arterial (%) | 18 (56,2%) |
| Diabetes (%) | 5 (15,6%) |
| Enfermedad pulmonar obstructiva crónica | 2 (6,2%) |
| Cirugía abdonimal previa | 15 (46,8%) |
| Media del diámetro aneurismático (mm) | 55 (40-95) |
| Media de la longitud del cuello aórtico infrarrenal (mm) | 5 (0-10) |
| Patología oclusiva aortoilíaca asociada | 6 (18,7%) |
ASA: American Society of Anesthesiologists.
En la reconstrucción distal precisaron implantes tubulares 16 pacientes (50%) y bifurcados –biilíacos o bifemorales– 8 pacientes en cada caso. Treinta intervenciones fueron completamente laparoscópicas (93,7%). El paciente 4 fue sometido a una conversión a través de una laparotomía de 6 cm en el flanco debido a la existencia de amplias calcificaciones que dificultaban el sobrecosido de la aorta distal. El paciente 31 fue sometido a una conversión debido a que la vena renal izquierda era retroaórtica e impedía el clampaje suprarrenal seguro así como la exposición a través de un abordaje retrocólico. Tres pacientes fueron sometidos a reconstrucciones infrainguinales concomitantes debido a la presencia de lesiones oclusivas femoropoplíteas asociadas. Un paciente fue sometido a una adrenalectomía derecha asociada mediante laparoscopia debido a metástasis de un cáncer pulmonar.
El abordaje laparoscóspico de la aorta fue TPRR en 24 pacientes y TPRC en 8. El tiempo de intervención medio fue de 270 min (intervalo 215-410). La media de tiempo de clampaje aórtico total fue de 83 min (intervalo 36-147). Catorce pacientes fueron sometidos a clampaje suprarrenal (43,7%). El tiempo medio de clampaje suprarrenal fue de 24 min (intervalo 9-37). Se realizó la división de la vena renal izquierda utilizando una grapadora laparoscópica en un caso de vena renal retroaórtica. La pérdida media de sangre fue de 850 cc (intervalo 215-2.400). La media de la temperatura corporal al final de la intervención fue de 36,5 °C (intervalo 35,1-37,4).
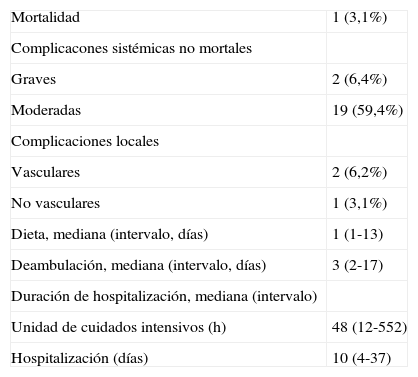
Una paciente falleció por un infarto de miocardio el día 21 (3,1%). Presentaba lesiones coronarias graves no tratables. Lo consideramos un error en la selección del paciente cuando teníamos poca experiencia. Es más, fue nuestro primer caso de corrección laparoscópica de AAACC; la intervención fue difícil, con una pérdida de sangre de 2.400 cc. No se produjeron otros fallecimientos intrahospitalarios. Dos pacientes presentaron complicaciones sistémicas graves no mortales (6,9%) (tabla II). Un paciente desarrolló una neumopatía con insuficiencia respiratoria; tenía graves antecedentes de enfermedad pulmonar obstructiva crónica. Un segundo paciente presentó un síndrome hemorrágico debido a una coagulopatía; la indicación para la cirugía fue un AAACC sintomático, con crecimiento progresivo que alcanzó los 8 cm de diámetro. Cinco meses antes había sido sometido a una angioplastia coronaria con stent recubierto debido a una angina inestable. Recibió un tratamiento con clopidogrel y ácido acetilsalicílico hasta la intervención. La corrección laparoscópica del AAACC transcurrió sin problemas con un tiempo de clampaje suprarrenal de 20 min y una pérdida de sangre de 850 ml. La coagulopatía y la hemorragia postoperatoria fueron controladas sin necesidad de reintervenir, pero necesitó cuidados intensivos y una estancia prolongada en la UCI. El postoperatorio posterior transcurrió sin problemas. Diecisiete pacientes desarrollaron complicaciones sistémicas leves o moderadas no mortales (53,1%). El estado renal preoperatorio empeoró en 12 pacientes (37,5%) y se resolvió sin necesidad de diálisis. Cinco de estos pacientes (41,7%) presentaron una insuficiencia renal de grado 1 que empeoró a grado 2, siendo la media de la concentración máxima de creatinina de 4,71 mg/dl (intervalo 3,6-5,81). Las concentraciones postoperatorias de creatinina volvieron a los valores iniciales antes de recibir el alta en todos los pacientes excepto en dos. Otras complicaciones sistémicas fueron arritmia cardíaca (n = 2), insuficiencia suprarrenal tras una adrenalectomía concomitante (n = 1), isquemia miocárdica (n = 1), y colitis isquémica de grado 1 (n = 1). Tres pacientes presentaron complicaciones locales (9,3%). El primero fue reintervenido por una obstrucción intestinal, que se debió a una incarceración de un asa intestina en el orificio del puerto. El segundo presentó una disección de la arteria renal izquierda, probablemente debido a la tracción del pedículo renal durante el clampaje de la aorta yuxtarrenal. El tercer paciente presentó una infección superficial de la ingle, que se resolvió con tratamiento local.
Datos postoperatorios
| Mortalidad | 1 (3,1%) |
| Complicacones sistémicas no mortales | |
| Graves | 2 (6,4%) |
| Moderadas | 19 (59,4%) |
| Complicaciones locales | |
| Vasculares | 2 (6,2%) |
| No vasculares | 1 (3,1%) |
| Dieta, mediana (intervalo, días) | 1 (1-13) |
| Deambulación, mediana (intervalo, días) | 3 (2-17) |
| Duración de hospitalización, mediana (intervalo) | |
| Unidad de cuidados intensivos (h) | 48 (12-552) |
| Hospitalización (días) | 10 (4-37) |
Aparte de estas complicaciones, los pacientes se recuperaron rápidamente con mínimas molestias de la herida (tabla II). La sonda nasogástrica se retiró al final de la intervención. La duración media del íleo paralítico fue de 2 días (intervalo 1-4). La dieta líquida se reintrodujo tras 1 día (intervalo 1-13), y la mayoría de los pacientes pudieron deambular hacia el día 3 (intervalo 2-17), con un dolor mínimo. La media de la estancia en la UCI y en el hospital fue de 48 h (intervalo 12-552) y 10 días (intervalo 4-37), respectivamente.
Veintiocho pacientes siguen vivos y completamente recuperados tras un seguimiento medio de 27 meses (intervalo 1-50). Dos de estos pacientes desarrollaron una dilatación de la aorta suprarrenal, que se evaluó en 28 y 32 mm, respectivamente. No se observaron otras alteraciones hemodinámicas o morfológicas en los estudios de seguimiento mediante eco-Doppler y angiografía por TC. Un paciente falleció por un síndrome de dificultad respiratoria 29 meses después de la intervención laparoscópica. Dos pacientes fallecieron debido a un cáncer broncopulmonar y de colon, respectivamente, a los 9 y 44 meses de la intervención.
DiscusiónDado que cada vez se reparan más AAA infrarrenales mediante técnicas endovasculares, los AAACC constituyen un porcentaje creciente de pacientes derivados para la corrección aórtica abierta1-3. La EVAR se utiliza ampliamente en casos de aneurismas infrarrenales, pero los pacientes con cuellos proximales menores de 15 mm no son considerados candidatos para esta intervención17. A pesar de estas limitaciones, las intervenciones mínimamente invasivas han entrado recientemente en el campo de la corrección de los AAACC. Se han desarrollado algunas alternativas. La primera consiste en una intervención híbrida en la que se crean bypass extraanatómicos para perfundir las arterias renales a partir de las arterias ilíacas, seguido del realineado de la aorta mediante stents recubiertos18-20. El traumatismo quirúrgico con esta técnica es notable, pues se suma la morbilidad de la revascularización renal convencional a la del procedimiento endovascular. Estas intervenciones raramente se ponen en práctica y su uso no está extendido. Se han propuesto diseños de stents recubiertos adaptados, incluidos los que disponen de fenestraciones o ramificaciones para las arterias renales para solucionar estas limitaciones. Sin embargo, la técnica sigue siendo compleja, y necesita la colocación exacta de los orificios o las ramas. La amenaza de complicaciones renales y ateroembolia mortal sigue siendo un problema en este tratamiento de EVAR21,22. Se desconoce la durabilidad de estas intervenciones, siendo inciertos los resultados a medio y largo plazo, especialmente en lo que concierne a las endofugas de tipo I, los efectos adversos potenciales sobre la función renal, y el estrechamiento o la oclusión de los vasos viscerales21,22.
La laparoscopia es una alternativa para la corrección de los AAACC. Tiene como objeto reducir el traumatismo quirúrgico evitando grandes abordajes abdominales. El desafío de la corrección completamente laparoscópica de los AAACC está relacionado con las dificultades específicas de la reparación aórtica directa en este subgrupo de pacientes, básicamente, la exposición de la aorta yuxtarrenal, la calidad de la pared aórtica para las anastomosis, y la duración del clampaje aórtico y/o renal. Queremos destacar encarecidamente que el cirujano que desee reparar los AAACC mediante laparoscopia tiene que: 1) adquirir experiencia en la corrección laparoscópica de los AAA infrarrenales y 2) recordar que en los casos de dificultad quirúrgica siempre es factible la conversión a cirugía abierta.
La exposición laparoscópica de la aorta suprarrenal se logra mejor mediante un abordaje TPRR11. Este abordaje utiliza una rotación mediovisceral derecha completa y permite una mayor exposición de la aorta yuxtarrenal. El TPRC estuvo indicado en casos de situación retroaórtica de la vena renal izquierda o de adherencias periesplénicas10. Un inconveniente del TPRC para la corrección de los AAACC es la vena renal izquierda, que atraviesa la aorta yuxtarrenal. Es posible seccionarla, pero puede provocar insuficiencia renal2. Otros abordajes videoscópicos de la aorta abdominal no parecen adecuados para la corrección laparoscópica de los AAACC. El abordaje retroperitoneoscópico es interesante en los pacientes con insuficiencia respiratoria severa, pero el área de trabajo se ve reducida, internamente por detrás de la grasa retroperitoneal y externamente por la colocación de los trócares23. El abordaje directo transperitoneal no es adecuado debido al grosor del mesocolon izquierdo, que obstaculiza la exposición de la aorta yuxtarrenal. Además, el cubrimiento de la prótesis no es satisfactorio24.
Se ha demostrado que, aunque más compleja que en el caso de AAA infrarrenales, la corrección abierta de los AAACC puede realizarse con una tasa de mortalidad baja, pero con un incremento de la morbilidad renal25-27. Cuando es necesario, el clampaje suprarrenal constituye un desafío importante durante la corrección de los AAACC de forma completamente laparoscópica. El tiempo de isquemia renal supone un riesgo de insuficiencia renal1,28,29. El tiempo de clampaje suprarrenal obtenido en nuestra serie fue cercano a las cifras de la cirugía abierta y bajo el umbral de preservación de la función renal13,28. Debemos destacar que el 41,7% de los pacientes con mejoría renal postoperatoria presentaron insuficiencia renal preoperatoria, lo que constituye un factor de riesgo inevitable en pacientes con AAACC2,3,27. Sin embargo, la mayoría de los pacientes recuperan la función renal normal1. Los tiempos totales de clampaje aórtico fueron similares a los descritos durante la corrección laparoscópica de AAA infrarrenales12,30,31. El uso de una grapadora para las anastomosis aortoprotésicas podría ser interesante para reducir el tiempo de clampaje. Sin embargo, los dispositivos experimentales necesitan una longitud del cuello aórtico de como mínimo 15-20 mm para permitir la anastomosis y no son adecuados para los AAACC31.
Varias complicaciones sistémicas en nuestra serie se comparan favorablemente con las cifras de la cirugía abierta2,27. Observamos menos de un 5% de complicaciones pulmonares, incluso en pacientes con enfermedad pulmonar obstructiva crónica. La incidencia de complicaciones pulmonares se sitúa alrededor del 20% tras la corrección abierta de los AAACC2,27. Esta ventaja de la laparoscopia se ha descrito en otras especialidades y en otras series de cirugía aórtica laparoscópica12,14,30,32-38.
La recuperación postoperatoria demuestra el efecto beneficioso de la laparoscopia en términos de dolor, vuelta a la dieta y deambulación. Series anteriores ya habían demostrado que estas ventajas bien conocidas de la laparoscopia también eran válidas tras la cirugía aórtica laparoscópica12,14,30,32-38.
Observamos solamente dos dilataciones estables de la aorta suprarrenal tras un seguimiento medio de 27 meses. No se produjeron otras complicaciones relacionadas con las correcciones aórticas. Sin embargo, es necesario un seguimiento más largo para asegurar la fiabilidad de la corrección laparoscópica de los AAACC, especialmente en lo que respecta al desarrollo de pseudoaneurismas y aneurismas aórticos yuxtarrenales. Estos datos son similares a los de la corrección abierta y demuestran la fiabilidad a medio plazo de la corrección laparoscópica de los AAACC. No se produjeron dehiscencias abdominales, que es un inconveniente bien conocido de la corrección abierta de aneurismas39.
La selección de los pacientes es obligada antes de realizar una corrección completamente laparoscópica de los AAACC. En los casos de lesiones oclusivas severas y difusas asociadas de las arterias viscerales no susceptibles al tratamiento mediante técnicas endoluminales, sería preferible una intervención abierta. Este límite no es absoluto y podría evolucionar con la experiencia del cirujano y con futuras mejoras. Otras contraindicaciones son la rotura y la inflamación de los aneurismas y los pacientes no candidatos para la cirugía aórtica.
ConclusiónLa corrección completa de los AAACC mediante laparoscopia es factible en pacientes seleccionados. Las intervenciones vasculares aórticas que requieren abordajes quirúrgicos extensos subrayan las ventajas de la laparoscopia ya que se evitan dichos abordajes. La laparoscopia reduce el traumatismo quirúrgico a la vez que permite una corrección fiable y duradera de los aneurismas. A raíz de estos resultados preliminares alentadores, proponemos la corrección laparoscópica siempre que sea posible en los pacientes con AAACC y riesgo quirúrgico bajo. Es necesario disponer de una mayor experiencia y de seguimientos más largos para asegurar los efectos beneficiosos reales de esta técnica en comparación con la corrección abierta.
Presentado en el XXIIIth Annual Congress of the French Society of Vascular Surgery, Estrasburgo, Francia, 14-17 de junio de 2008.