El fracaso de los accesos vasculares causa el 20% de las hospitalizaciones de pacientes en hemodiálisis. La fístula arteriovenosa nativa, el mejor tipo de acceso vascular para diálisis, tiene un índice de permeabilidad primaria a 1 año extremadamente variable, oscilando entre el 40 y el 80%. La hiperplasia de la neoíntima es la causa más importante de disfunción primaria tardía de la fístula arteriovenosa. En los últimos años, el índice de permeabilidad primaria tardía no ha mejorado debido al aumento de pacientes ancianos con un número elevado de comorbilidades y a la ausencia de nuevos métodos terapéuticos. Realizamos un estudio de casos y controles para analizar qué factores o fármacos pueden influir en el índice de permeabilidad primaria tardía de la fístula arteriovenosa nativa en 60 nuevos pacientes en programa de hemodiálisis. El índice de permeabilidad primaria tardía de la fístula arteriovenosa fue del 75,1% a los 12 meses, 58,5% a los 24 meses, y 50% a los 987 días. Las concentraciones de homocisteína durante el seguimiento estuvieron asociadas de forma significativa con el fracaso del acceso vascular (odds ratio 28,5±1,9 frente a 22,3±1,2mmol/l, p<0,01). Las concentraciones plasmáticas de folato tendieron a una relación inversa con el fracaso de la fístula arteriovenosa (odds ratio 11,5±1,2 frente a 14,6±1,1 ng/ml, p=0,06). Los pacientes tratados con ácido fólico y/o estatinas presentaron un índice de permeabilidad primaria tardía de la fístula significativamente más alto que aquellos sin tratamiento, 81,7% frente a 66% tras 1 año y 71,5% frente a 39,1% tras 2 años (p=0,02), respectivamente. Otros factores no estuvieron asociados con el fracaso del acceso vascular. El tratamiento reductor de homocisteína mediante estatinas y ácido fólico está asociado con una supervivencia prolongada de la fístula arteriovenosa. Es importante realizar ensayos aleatorizados para verificar nuestra observación.
La disfunción del acceso vascular, responsable de aproximadamente el 20% de las hospitalizaciones en pacientes en programa de hemodiálisis1, es una de las causas más importantes de morbilidad. Las fístulas arteriovenosas nativas tienen un índice de permeabilidad primaria al año extremadamente variable, oscilando entre el 40 y el 80%2,3.
Las principales causas de disfunción precoz del acceso vascular nativo son su fracaso técnico, estrategia de creación de una nueva fístula, patología cardiovascular (principalmente insuficiencia cardíaca) y referencia tardía al servicio de nefrología. Las concentraciones elevadas de urea pueden reducir la función endotelial y cardíaca, empeorando el flujo sanguíneo al acceso vascular4. Además, la atención nefrológica tardía se asocia con un uso más frecuente a corto plazo de catéteres venosos centrales, cuyas complicaciones pueden aumentar el riesgo de fracaso de la fístula arteriovenosa, especialmente debido a una estenosis venosa central y a su canulación precoz5.
La principal causa de fracaso diferido es la hiperplasia de la neoíntima, que conduce al desarrollo de estenosis y posterior trombosis, aunque sus mecanismos no son bien conocidos6. En los últimos años, los índices de permeabilidad primaria tardía de la fístula arteriovenosa no han mejorado debido a que el número de pacientes ancianos, con comorbilidades severas, ha aumentado y no se han introducido nuevos métodos terapéuticos. En este artículo se analiza la acción de algunos fármacos sobre los índices de permeabilidad primaria tardía del acceso vascular para hemodiálisis.
Objetivo y métodosRealizamos un estudio a largo plazo de casos y controles, en un único centro, para analizar qué factores y/o fármacos pueden afectar al índice de permeabilidad primaria tardía de los accesos vasculares nativos para hemodiálisis. La inclusión de pacientes comenzó en enero de 2001 y acabó en diciembre de 2004. El período de seguimiento finalizó en diciembre de 2007. Escogimos a pacientes con una fístula arteriovenosa nativa colocada antes o después de empezar el tratamiento de diálisis. Excluimos 11 fístulas arteriovenosas con disfunción primaria precoz, considerando como tal a aquellos casos en los que la fístula no llegó a desarrollarse suficientemente para su utilización o falló durante el primer mes. Analizamos los datos de 60 pacientes nuevos en programa de hemodiálisis. El fracaso de la fístula se definió como una trombosis súbita de la misma o la aparición de una estenosis que requirió intervención, detectados mediante fistulografía tras la sospecha durante el seguimiento. Cada mes se determinaron las concentraciones de hemoglobina, sodio, potasio, calcio y fósforo. Cada 3 meses se comprobaron los niveles de parathormona, la tasa de catabolismo proteico y albúmina, mientras que las concentraciones de homocisteína, ácido fólico y vitamina B12 se analizaron cada 4 meses. Los datos relativos al tratamiento se recogieron en una base de datos Access de Microsoft (Redmond, WA). La distribución aleatorizada de los pacientes para tratamiento con ácido fólico se realizó según protocolo previamente publicado7. Los pacientes tratados con estatinas, antiagregantes plaquetarios e hipotensores iniciaron el tratamiento justo antes de entrar en el estudio. En ocasiones, modificamos las pautas durante el período de seguimiento según las necesidades de los pacientes. Clasificamos a los pacientes en tratamiento con un fármaco cuando el período de tratamiento duró como mínimo más de la mitad del tiempo de seguimiento de ese paciente. El análisis estadístico se realizó mediante el software SPSS (SPSS, Inc., Chicago, IL). Las variables continuas se expresaron como media ± error estándar de la media. Las variables continuas se compararon utilizando el test t de Student o el test de suma de rangos de Wilcoxon. Las variables nominales se compararon utilizando el test chi cuadrado. Se realizó el análisis de multivarianza para determinaciones repetidas en las mediciones seriadas de variables continuas. Utilizamos un análisis de regresión por pasos para investigar los factores predictivos independientes de los criterios de valoración. Analizamos el índice de permeabilidad primaria tardía de la fístula arteriovenosa nativa utilizando el método Kaplan-Meier (KM). Los pacientes censurados incluían aquellos que no presentaron un fracaso del acceso vascular, fueron trasladados a otro centro de diálisis, recibieron un trasplante renal o fallecieron con el acceso de larga permeabilidad. Se realizó el test de rango logarítmico para las comparaciones de variables únicas. Se utilizó un análisis de regresión logística para comprobar qué variables independientes se correlacionaron con el índice de permeabilidad primaria tardía de la fístula arteriovenosa. El nivel de significancia se estableció en p<0,05.
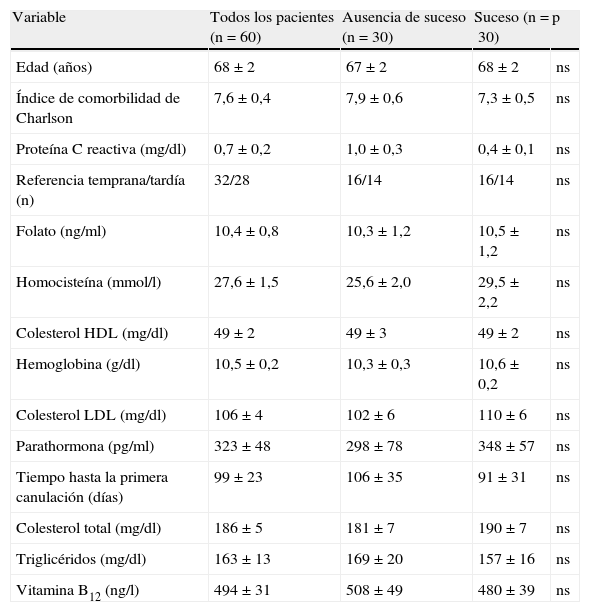
ResultadosLa tabla I muestra los datos iniciales de los pacientes clasificados por sucesos. Muchos factores, como edad, comorbilidades, referencia al servicio de nefrología, colocación de catéter venoso central al inicio de la hemodiálisis, tiempo transcurrido entre la intervención y la primera canulación del acceso, tipo de fístula arteriovenosa, valores de la presión arterial, parámetros bioquímicos iniciales y tratamiento antiagregante plaquetario, no estuvieron asociados con el índice de permeabilidad primaria tardía. Detectamos que las concentraciones plasmáticas basales de homocisteína fueron menores en los pacientes sin sucesos (concentraciones de homocisteína de 25,6±2,0 frente a 29,5±2,2mmol/l, respectivamente, p=no significativa [ns]).
Datos iniciales de los pacientes, en conjunto y divididos por suceso
| Variable | Todos los pacientes (n=60) | Ausencia de suceso (n=30) | Suceso (n=30) | p |
| Edad (años) | 68±2 | 67±2 | 68±2 | ns |
| Índice de comorbilidad de Charlson | 7,6±0,4 | 7,9±0,6 | 7,3±0,5 | ns |
| Proteína C reactiva (mg/dl) | 0,7±0,2 | 1,0±0,3 | 0,4±0,1 | ns |
| Referencia temprana/tardía (n) | 32/28 | 16/14 | 16/14 | ns |
| Folato (ng/ml) | 10,4±0,8 | 10,3±1,2 | 10,5±1,2 | ns |
| Homocisteína (mmol/l) | 27,6±1,5 | 25,6±2,0 | 29,5±2,2 | ns |
| Colesterol HDL (mg/dl) | 49±2 | 49±3 | 49±2 | ns |
| Hemoglobina (g/dl) | 10,5±0,2 | 10,3±0,3 | 10,6±0,2 | ns |
| Colesterol LDL (mg/dl) | 106±4 | 102±6 | 110±6 | ns |
| Parathormona (pg/ml) | 323±48 | 298±78 | 348±57 | ns |
| Tiempo hasta la primera canulación (días) | 99±23 | 106±35 | 91±31 | ns |
| Colesterol total (mg/dl) | 186±5 | 181±7 | 190±7 | ns |
| Triglicéridos (mg/dl) | 163±13 | 169±20 | 157±16 | ns |
| Vitamina B12 (ng/l) | 494±31 | 508±49 | 480±39 | ns |
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; ns: no significativo.
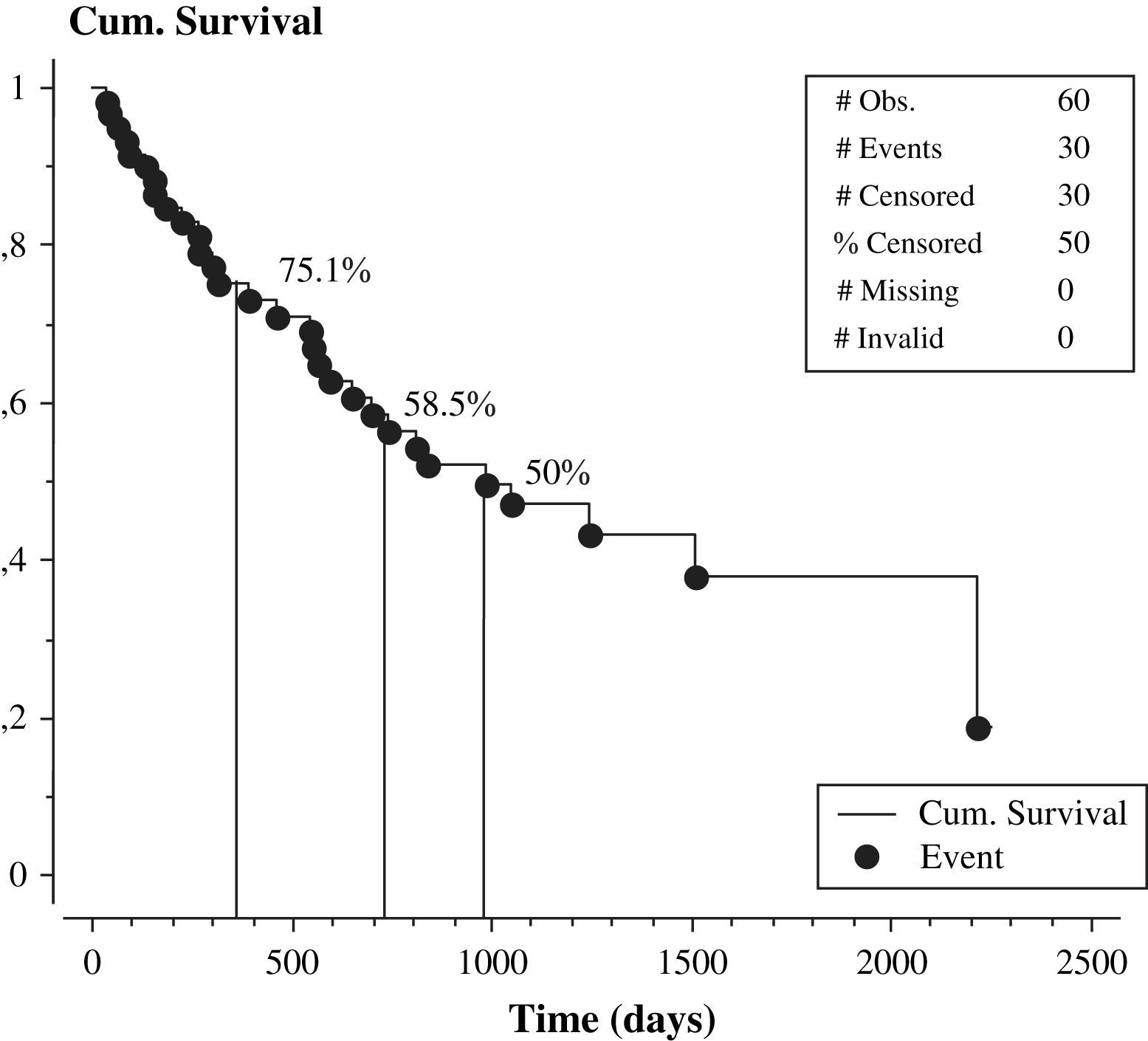
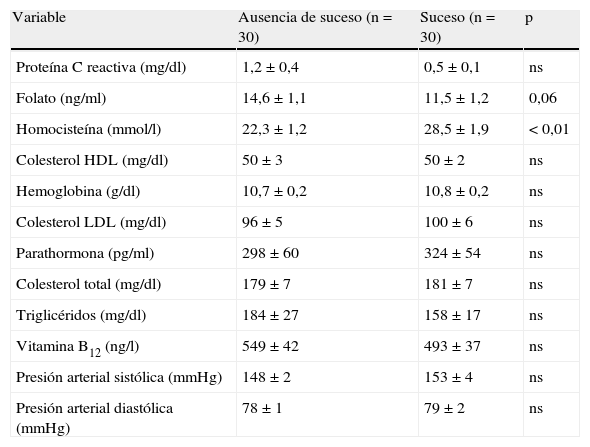
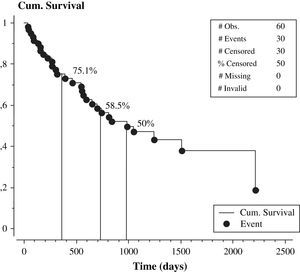
El seguimiento promedio fue de 25 meses. Las concentraciones plasmáticas de homocisteína durante el seguimiento estuvieron asociadas directamente con el fracaso del acceso vascular (odds ratio 28,5±1,9 frente a 22,3±1,2mmol/l, p<0,01). Las concentraciones séricas de folato tendieron a relacionarse indirectamente con el fracaso de la fístula (odds ratio 11,5±1,2 frente a 14,6 frente a 1,1 ng/ml, p=0,06). Muchas variables no estuvieron asociadas con el fracaso del acceso vascular (tabla II). El 50% de nuestros pacientes (30 de 60) presentaron disfunción del acceso vascular. Diez de los 30 pacientes sin fracaso del acceso vascular finalizaron el período de seguimiento, mientras que los 20 restantes sin disfunción del acceso vascular no finalizaron el período de seguimiento por los siguientes motivos: 5 pacientes se trasladaron a otro centro de diálisis, 2 recibieron un trasplante renal y 13 fallecieron. La figura 1 muestra la curva KM de supervivencia con respecto al índice de permeabilidad primaria de la fístula, que fue del 75,1% a los 12 meses, 58,5% a los 24 meses y del 50% a los 987 días.
Datos de los pacientes durante el seguimiento, divididos por suceso
| Variable | Ausencia de suceso (n=30) | Suceso (n=30) | p |
| Proteína C reactiva (mg/dl) | 1,2±0,4 | 0,5±0,1 | ns |
| Folato (ng/ml) | 14,6±1,1 | 11,5±1,2 | 0,06 |
| Homocisteína (mmol/l) | 22,3±1,2 | 28,5±1,9 | < 0,01 |
| Colesterol HDL (mg/dl) | 50±3 | 50±2 | ns |
| Hemoglobina (g/dl) | 10,7±0,2 | 10,8±0,2 | ns |
| Colesterol LDL (mg/dl) | 96±5 | 100±6 | ns |
| Parathormona (pg/ml) | 298±60 | 324±54 | ns |
| Colesterol total (mg/dl) | 179±7 | 181±7 | ns |
| Triglicéridos (mg/dl) | 184±27 | 158±17 | ns |
| Vitamina B12 (ng/l) | 549±42 | 493±37 | ns |
| Presión arterial sistólica (mmHg) | 148±2 | 153±4 | ns |
| Presión arterial diastólica (mmHg) | 78±1 | 79±2 | ns |
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; ns: no significativo.
Índice de permeabilidad primaria tardía de la fístula arteriovenosa nativa. Cum. Survival=Supervivencia acumulada. # Obs.=# Obs. # Events=# Sucesos. # Censored=# Censurados. % Censored=% Censurados. # Missin=# Ausentes. # Invalid=# Invalidos. Event Times=Momento del suceso. Time (days)=Tiempo (días).
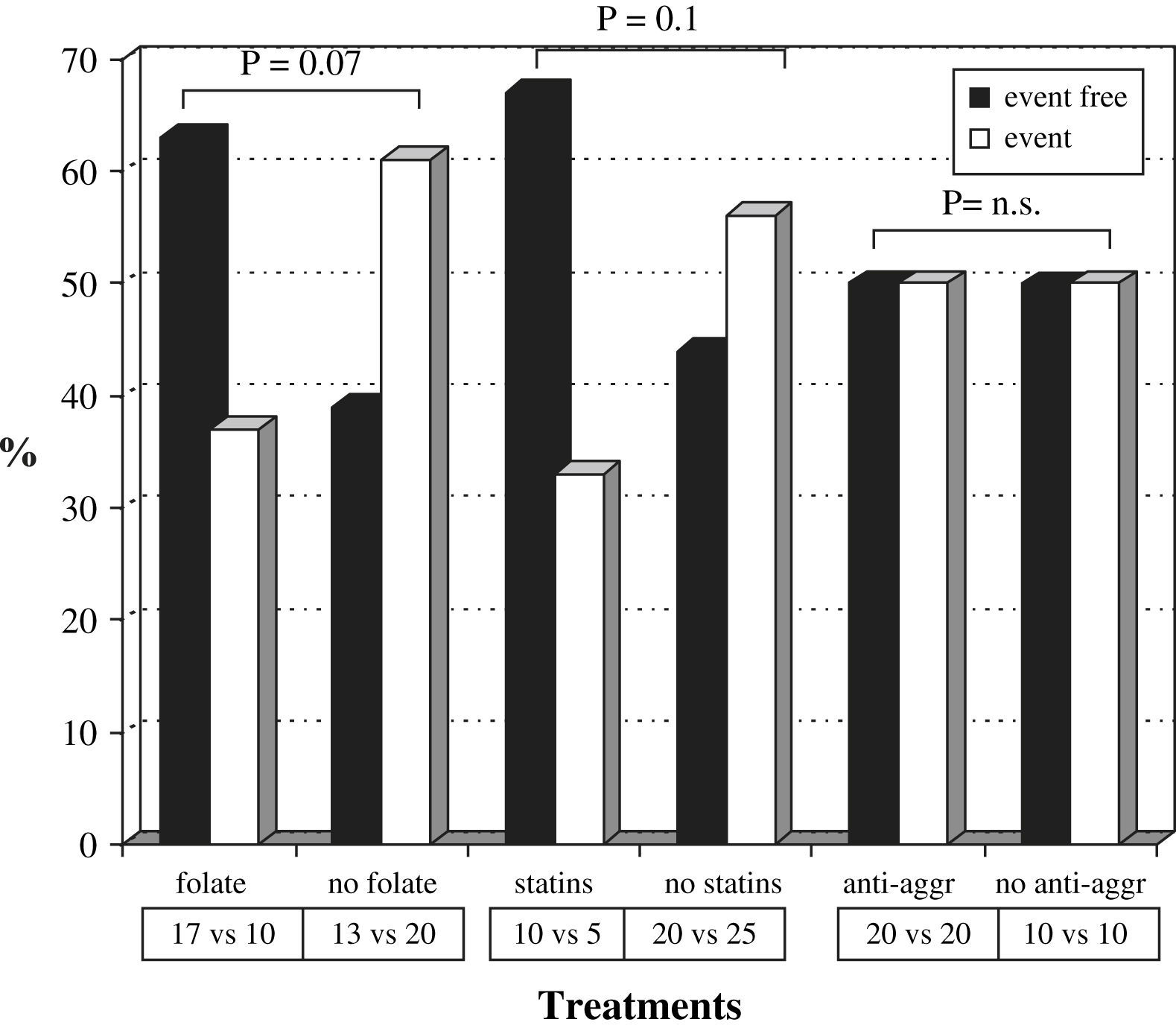
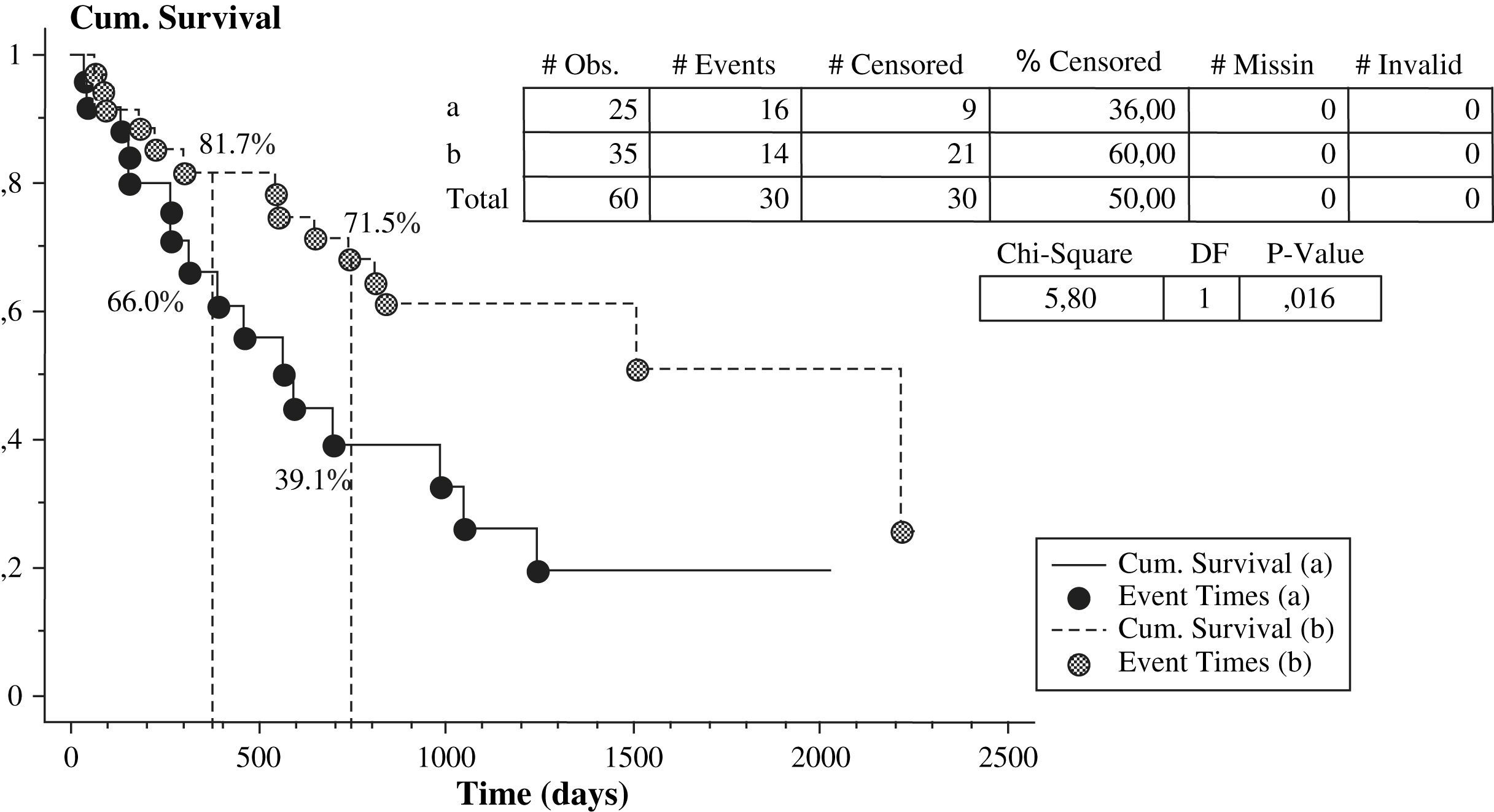
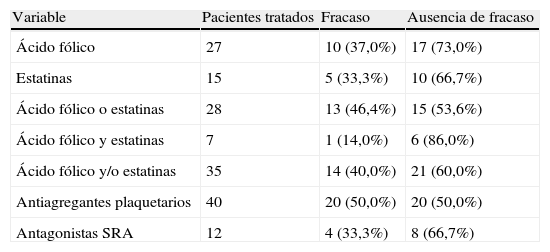
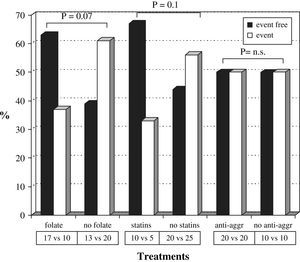
La tabla III muestra el número de pacientes tratados con cada fármaco y el número absoluto o el índice de fracaso de la fístula arteriovenosa según el tipo de tratamiento. Veintisiete pacientes estaban en tratamiento con 5mg/día de ácido fólico por vía oral y 15 recibían estatinas: 9 tomaban 10-20mg/día de atorvastatina y seis dosis de 10-20mg/día de simvastatina. La figura 2 muestra la tasa de fístulas arteriovenosas con o sin acontecimientos adversos con respecto al tratamiento con ácido fólico, estatinas y antiagregantes plaquetarios. Los pacientes que recibieron tratamiento con ácido fólico presentaron una tasa de fracasos del acceso vascular menor que aquellos sin tratamiento, 37% (10 de 27) frente al 61% (20 de 33) (χ2 =3,3, p=0,07). Los pacientes tratados con estatinas presentaron una tasa de fracaso del acceso vascular menor que aquellos sin tratamiento con estatinas, 33% (5 de 15) frente al 56% (25 de 45) (χ2 =2,2, p=0,1). Además, los pacientes tratados con ácido fólico y estatinas presentaron una tasa de fracaso del acceso vascular menor (1 de 7, 14%) que los tratados con ácido fólico o estatinas (13 de 28, 46%) y que los pacientes sin tratamiento (16 de 25, 64%). Observamos una tendencia hacia la significación estadística cuando comparamos los pacientes tratados con ácido fólico o estatinas (n=28) y los pacientes sin ninguno de ambos fármacos (n=25) (χ2 =1,7, p=ns). Se alcanzó la significación estadística al comparar los pacientes con tratamiento combinado de ácido fólico y estatinas (n=7) y los pacientes sin ninguno de ellos (n=25) (χ2 =5,4, p<0,05). Es más, la curva KM de supervivencia (fig. 3) mostró que los pacientes tratados con ácido fólico y/o estatinas (n=35) presentaron un índice de permeabilidad primaria del acceso significativamente mayor que los pacientes sin ninguno de los tratamientos (n=25), 81,7% frente a 66% después de 1 año y 71,5% frente a 39,1% después de 2 años (χ2 =5,8, p<0,05).
Número de pacientes y sucesos del acceso vascular según el tipo de tratamiento (datos expresados en número absoluto y porcentaje)
| Variable | Pacientes tratados | Fracaso | Ausencia de fracaso |
| Ácido fólico | 27 | 10 (37,0%) | 17 (73,0%) |
| Estatinas | 15 | 5 (33,3%) | 10 (66,7%) |
| Ácido fólico o estatinas | 28 | 13 (46,4%) | 15 (53,6%) |
| Ácido fólico y estatinas | 7 | 1 (14,0%) | 6 (86,0%) |
| Ácido fólico y/o estatinas | 35 | 14 (40,0%) | 21 (60,0%) |
| Antiagregantes plaquetarios | 40 | 20 (50,0%) | 20 (50,0%) |
| Antagonistas SRA | 12 | 4 (33,3%) | 8 (66,7%) |
SRA: sistema renina-angiotensina.
Índice de permeabilidad primaria tardía de la fístula arteriovenosa en función del suceso y los fármacos. n.s.: no significativo. Event free=sin sucesos. Event=suceso. Folate=folato. No folate=sin folato. Statins=estatinas. No statins=sin estatinas. Anti-aggr=antiag. plaquetario. No anti-aggr=sin antiag. plaquetario. Treatments=Tratamientos.
Índice de permeabilidad primaria tardía de la fístula arteriovenosa en función del tipo de tratamiento (el grupo a está formado por 25 pacientes sin tratamiento con ácido fólico o estatina; el grupo b está formado por 35 pacientes en tratamiento con ácido fólico o estatina como mínimo: 28 pacientes solamente con ácido fólico o estatina y 7 pacientes tratados con ambos). Cum. Survival=Supervivencia acumulada. # Obs.=# Obs. # Events=# Sucesos. # Censored=# Censurados. % Censored=% Censurados. # Missin=% Ausentes. # Invalid=# Invalidos. Chi-Square=Chi cuadrado. DF=DF. P-Value=Valor p.
Además, 12 pacientes en tratamiento con antagonistas del sistema renina-angiotensina (7 con inhibidores de la enzima conversora de la angiotensina [ECA], 4 en tratamiento con sartán, 1 en tratamiento combinado con IECA y sartán) presentaron un índice de permeabilidad primaria tardía mayor que los pacientes sin tratamiento con IECA o sartán, 67% (8 de 12) frente al 46% (22 de 48), sin que fuera estadísticamente significativo (χ2 =1,7, p=0,2). Por otro lado, el tratamiento con antiagregantes plaquetarios (16 pacientes con 100mg/día de ácido acetilsalicílico, 20 pacientes con 250mg/día de ticlopidina y 4 pacientes con tratamiento combinado) no varió el índice de permeabilidad primaria de la fístula. Los pacientes tratados con antiagregantes plaquetarios mostraron la misma tasa de fracaso del acceso vascular (20 de 40, 50%) que los no tratados (10 de 20, 50%). No se observaron diferencias con otros tratamientos, como antagonistas del calcio, betabloqueantes, vitamina D y estimuladores de la eritropoyesis.
Por último, el análisis de regresión logística múltiple, ajustado para los factores de riesgo habituales de fracaso del acceso vascular, mostró que el tratamiento combinado con ácido fólico y estatinas es la única variable independiente significativa que se correlaciona con la tasa de supervivencia primaria tardía de la fístula (χ2 =5,8, p<0,05).
DiscusiónEste estudio muestra por primera vez que el índice de permeabilidad primaria tardía de la fístula arteriovenosa nativa mejora con el tratamiento combinado de ácido fólico y estatinas. Los pacientes tratados con uno de ellos, pero mejor con ambos fármacos, presentaron un índice de permeabilidad primaria de la fístula arteriovenosa nativa más alto que los pacientes sin tratamiento. Tras estos resultados, creemos que sería apropiado realizar un ensayo aleatorizado y multicéntrico para verificar si el tratamiento combinado, con como mínimo estos dos fármacos, mejora el índice de permeabilidad primaria del acceso vascular en los pacientes hemodializados.
El ácido fólico, las estatinas y los antagonistas del sistema renina-angiotensina han demostrado un efecto protector del endotelio. Recientemente se ha demostrado en pacientes homocistinúricos8, dializados7 y en la población general9 que el tratamiento reductor de la homocisteína con ácido fólico mejora la morbilidad y la mortalidad cardiovascular10,11. Además, se ha demostrado que la concentración basal de homocisteína tiene una relación directa con el fracaso de la fístula12. Los resultados de este estudio sugieren una tendencia hacia una relación entre las concentraciones basales de homocisteína y el fracaso del acceso vascular, aunque dicha diferencia no fue estadísticamente significativa, probablemente debido al número reducido de pacientes en nuestro grupo de estudio. El nuevo hallazgo es que los pacientes tratados con ácido fólico que presentan concentraciones plasmáticas elevadas de folato y bajas de homocisteína, detectadas a menudo durante el seguimiento, tienen un mejor índice de permeabilidad primaria tardía de la fístula arteriovenosa. Creemos, aunque no podemos excluir un efecto directo del tratamiento con ácido fólico en el endotelio13, y que este resultado tiene una relación más clara cuando se asocia con una disminución de la concentración plamática de homocisteína. Por tanto, los ensayos futuros deben centrarse en normalizar la hiperhomocisteinemia mediante el tratamiento con complejo vitamínico B14, hemodiafiltración15,16, diálisis diaria estándar con bicarbonato17, N-acetilcisteína18 y otros fármacos capaces de reducir la hiperhomocisteinemia19.
Se ha demostrado el efecto protector de las estatinas sobre el endotelio además de su capacidad hipolipemiante20. Las estatinas, p. ej., al reducir la producción del inhibidor del activador del plasminógeno de tipo 1 en las células del endotelio y la musculatura lisa, ejercen sus efectos protectores modificando el balance en la zona de las lesiones vasculares hacia un aumento de la fibrinólisis, reduciendo el riesgo de formación de trombos21. Además, se ha demostrado que las estatinas, al aumentar la movilización de las células progenitoras endoteliales desde la médula ósea, inhiben la estenosis vascular como consecuencia de la hiperplasia de la neoíntima, optimizando el balance entre las células progenitoras endoteliales y las células progenitoras de la musculatura lisa22. Nuestros resultados demuestran que cerca del 70% de los pacientes en hemodiálisis y en tratamiento con estatinas no presentan fracaso primario de la fístula y este resultado es independiente de la eficacia hipolipemiante, lo que confirma la idea de que el efecto pleiotrópico de las estatinas protege de la hiperplasia de la neoíntima.
También detectamos que los pacientes en hemodiálisis tratados con antagonistas del sistema renina-angiotensina tienen una tendencia hacia una tasa significativamente menor de fracasos del acceso vascular y que este efecto protector del endotelio no depende de los valores de presión arterial. Estos resultados concuerdan con la hipótesis de un efecto beneficioso de estos fármacos, similar al recientemente decrito en un análisis retrospectivo que mostró el efecto protector de los IECA23 en los implantes para accesos vasculares. Nuestros datos confirman no solamente los resultados de Saran et al23, quienes observaron una reducción significativa del riesgo de fracaso de la fístula con el uso de IECA (riesgo relativo [RR]=0,56, p<0,01), sino también los resultados de Gradzki et al24, quienes mostraron un riesgo menor de fracaso del implante en pacientes tratados con IECA (RR=0,32, p<0,01). Así mismo, los resultados de Garrancho et al25 son similares a los anteriormente referidos, con una reducción del RR del 30%. Se han propuesto varios mecanismos para este efecto protector: inhibición de la hiperplasia de la íntima, proliferación y migración de las células de la musculatura lisa.
Además, este estudio muestra que el tratamiento con antiagregantes plaquetarios no es útil para mejorar el índice de permeabilidad primaria tardía de la fístula arteriovenosa nativa, lo que confirma los resultados de un ensayo comparativo aleatorizado que demostró que no existía efectos beneficiosos significativos con el tratamiento de ácido acetilsalicílico y clopidogrel para la prevención de la trombosis del implante26. Muchos ensayos han abordado la eficacia de los fármacos antiagregantes plaquetarios para prevenir al fracaso precoz de las fístulas arteriovenosas nativas. El mayor de ellos27 mostró unos índices de trombosis de la fístula en los grupos placebo y ticlopidina del 19 y 12% respectivamente, aunque esta diferencia no fue estadísticamente significativa. Además, los resultados del ensayo Dialysis Access Consortium sobre clopidogrel28 nos indican que el uso de clopidogrel no está asociado con una mejora de la permebilidad de la fístula.
Este estudio monocéntrico de pequeño tamaño no es concluyente con respecto a la elección de los fármacos protectores del endotelio de las fístulas arteriovenosas de los pacientes en hemodiálisis, pero esperamos que alentará a nefrólogos y cirujanos vasculares para verificar estos resultados mediante estudios aleatorizados multicéntricos. Así pues, en el futuro quizá será posible tratar la hiperplasia de la neoíntima con nuevos fármacos29,30, pero en la actualidad, algunos fármacos en uso, como el ácido fólico y las estatinas, parecen ser los más interesantes para prolongar la supervivencia de la fístula arteriovenosa.
Agradecemos especialmente a las enfermeras de hemodiálisis las observaciones de las fístulas arteriovenosas y las mediciones del flujo sanguíneo de los accesos vasculares. También damos las gracias a los compañeros del Second Division of General Surgery y del Radiology Department, Vimercate Hospital, por su importante papel, respectivamente, en la creación de las fístulas arteriovenosas quirúrgicas y el diagnóstico y tratamiento de la estenosis de las fístulas arteriovenosas.
Presentado parcialmente en el XLIV ERA-EDTA Congress, Barcelona, España, 21-24 de junio de 2007.