El objetivo del presente estudio fue utilizar angiografía tomográfica computarizada (ATC) dinámica en pacientes sometidos a tratamiento endovascular de aneurisma torácico (TEVA) antes y después de la intervención para caracterizar el movimiento aórtico inducido por la pulsatilidad cardíaca en las zonas esenciales de sellado proximal TEVA y estudiar la influencia de la implantación de una endoprótesis. En seis pacientes con aneurismas aórticos torácicos (AAT) sometidos a TEVA se obtuvieron seis estudios ATC dinámicos preoperatorios y seis postoperatorios. Los datos se adquirieron utilizando ATC dinámica retrospectiva con sindronización electrocardiográfica reconstruyéndose ocho fases durante el ciclo cardíaco. Las exploraciones se adquirieron durante una sola apnea. Se efectuaron reconstrucciones multiplanares perpendiculares a la aorta en cinco puntos de referencia torácicos anatómicos quirúrgicamente pertinentes: 1cm proximal al tronco innominado, 1cm proximal y 1cm distal a la arteria subclavia izquierda, y 1cm proximal y 3cm distales al extremo proximal de la endoprótesis. Después de la segmentación de la luz aórtica en imágenes, se determinaron el cambio de diámetro y el cambio del área durante el ciclo cardíaco. El cambio de diámetro se determinó a través de su medición en la zona de contraste desde la luz aórtica y se presenta el cambio medio a lo largo de un eje de 180. Antes y después del TEVA, encontramos una distensión significativa del arco aórtico torácico y de la aorta torácica descendente durante el ciclo cardíaco. El diámetro de la distensión varió del 3 al 12% y el área, del 2-20%. Esta distensión se mantuvo después de TEVA. Los pacientes con AAT experimentan cambios del diámetro y del área aórtica durante el ciclo cardíaco. La magnitud y, por lo tanto, la importancia clínica de esta distensión aórtica varían entre pacientes. Después de la implantación de una endoprótesis, la distensión aórtica durante el ciclo cardíaco está preservada. Esto puede tener importantes implicaciones para calcular el tamaño de la endoprótesis así como para su diseño y permeabilidad ya que las fuerzas que se ejercen sobre ella podrían ser mucho mayores después de la implantación de lo anticipado inicialmente por los fabricantes.
En pacientes seleccionados adecuadamente, el tratamiento endovascular de los aneurismas torácicos (TEVA) de la aorta torácica descendente o incluso del arco aórtico distal es una alternativa atractiva a la cirugía abierta1,2. Se ha demostrado que el TEVA entraña una menor mortalidad y morbilidad quirúrgicas, y se asocia a una disminución de la estancia hospitalaria y a una mejora del resultado clínico en pacientes apropiados3,4. La anatomía y morfología del cuello aórtico proximal donde se efectúa el sellado de la endoprótesis son los factores más críticos para determinar la viabilidad del procedimiento5,6. La angiografía tomográfica computarizada (ATC) estática es la modalidad más utilizada para evaluar pre y postoperatoriamente los aneurismas aórticos torácicos (ATT), y por lo tanto, la selección de los pacientes y del dispositivo suele basarse en imágenes estáticas7,8.
La distensibilidad aórtica puede desempeñar un papel causal en el desarrollo de complicaciones de la TEVA, como las endofugas, migración, rotura o incluso colapso de la endoprótesis. Con el desarrollo y la aplicación de técnicas de diagnóstico por la imagen dinámica, como la ATC con sincronización electrocardiográfica (ECG) y la angiografía por resonancia magnética (ARM), ha sido posible estudiar el movimiento y distensión aórticos durante el ciclo cardíaco9,10. Los informes previos de nuestro grupo demostraron una distensión aórtica significativa en puntos de referencia anatómicos importantes en la aorta abdominal y la aorta torácica ascendente y descendente9,11-13. En otros estudios se efectuaron observaciones similares usando diferentes modalidades, como ecografía en modo M y ecografía intravascular14,15 (EIV). La distensión aórtica del cuello del aneurisma permanece preservada después de tratamiento endovascular aórtico abdominal (TEVAA) pero en ningún estudio previo se ha analizado la distensión aórtica postoperatoria después de TEVA9,13. Una mejora de los conocimientos sobre los cambios pre y postoperatorios después de tratamiento endovascular contribuye tanto a la selección del dispositivo como al diseño de las endoprótesis. Con unos conocimientos sobre los cambios del diámetro aórtico durante el ciclo cardíaco, pueden tomarse mejores decisiones sobre el tamaño de la endoprótesis; y claramente su diseño debe adaptarse a los cambios de la conformación aórtica. El objetivo del presente estudio fue utilizar ATC sincronizada con el ECG para caracterizar la distensión aórtica pulsátil en importantes puntos de referencia anatómicos de la aorta torácica en pacientes con AAT antes del TEVA e investigar la influencia de la implantación de una endoprótesis torácica en la distensión aórtica.
MétodosEntre 2005 y 2008, seis pacientes (dos hombres, cuatro mujeres; edad media 69 años, límites 56-79) con AAT distal a la arteria subclavia izquierda (cuatro localizados en la zona 3 y dos en la zona 4), evaluados para un TEVA en nuestro hospital, fueron examinados pre y postoperatoriamente utilizando cine-ATC dinámica. Todos fueron tratados mediante TEVA, usando la endoprótesis Relay (Bolton Medical, Sunrise, Florida). La zona de sellado proximal era proximal a la arteria subclavia izquierda en cuatro pacientes y distal en dos. Las exploraciones postoperatorias se efectuaron a los 2-219 días después del TEVA (mediana 88 días).
Las series de datos retrospectivos de ATC activada mediante ECG se adquirieron en un equipo TC Philips Brilliance de 64 cortes (Philips Medical Systems, Best, Holanda). Las imágenes se adquirieron durante una fase de apnea única de 20 s durante la que se exploró la aorta torácica. Los parámetros del examen fueron los siguientes: grosor de los cortes 0,9mm, incremento 0,7mm, colimación 64 x 0,625mm y pitch 0,25. El campo de visión fue de 250 x 250mm y el tamaño de la matriz reconstruida fue de 512 x 512, lo que dio lugar a un tamaño del vóxel de 0,5 x 0,5 x 0,5mm. Los parámetros de exposición a la radiación fueron de 120 kVp y 300mA, lo que dio lugar a un índice de dosis TC (CTDIvol) de 17,6 mGy. Se inyectó un contraste no iónico intravascular (preoperatorio 150ml, postoperatorio 120ml; Iopromide, Schering, Berlín, Alemania), seguido de un bolo de suero salino de 60ml a una tasa de flujo de 6ml/s. La exploración se inició usando un programa de activación del bolo con un umbral de 100 UH sobre el basal. Se efectuaron reconstrucciones retrospectivas activadas por el ECG en ocho puntos de tiempo equidistantes durante el ciclo cardíaco. La serie de datos de cada paciente se introdujo en una estación de trabajo diferente (Extended Brilliance Workspace; Philips Medical Systems) y se procesaron utilizando la función de revisión cardíaca del programa.
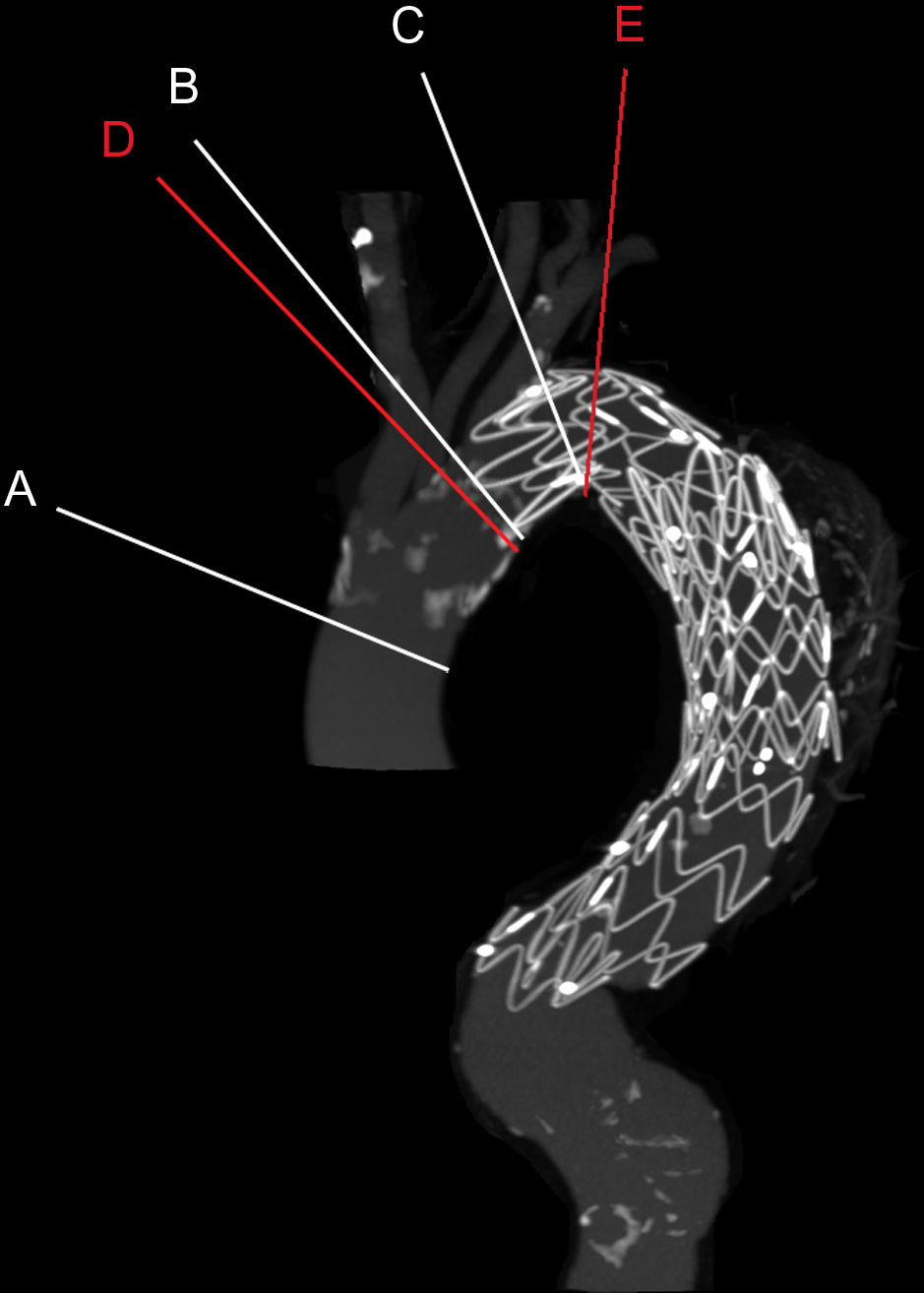
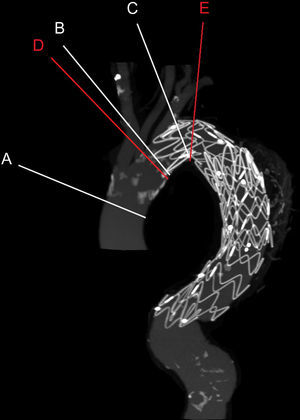
Se efectuaron reconstrucciones multiplanares perpendiculares a la aorta torácica, y se reconstruyeron ocho imágenes durante el ciclo cardíaco, lo que dio lugar a dos series de datos dimensionales-tiempo (2D-t). Seleccionamos cinco niveles anatómicos pertinentes para la evaluación y seguimiento de los AAT típicos y zonas de sellado proximal (fig. 1). Estos cinco niveles anatómicos fueron 1cm proximal al tronco innominado (nivel A), 1cm proximal (nivel B) y 1cm distal (nivel C) a la arteria subclavia izquierda, y 1cm proximal (nivel D) y 3cm distales (nivel E) al origen proximal de la endoprótesis. Éste se definió como la primera imagen ortogonal en la que era visible por primera vez el armazón de la endoprótesis. Para determinar los niveles D y E al mismo nivel pre y postoperatoriamente, se midió la distancia de la línea del centro de la luz desde los troncos supraaórticos hasta el origen proximal de la endoprótesis en el examen postoperatorio y se aplicó al preoperatorio.
Niveles anatómicos. Se muestra la reconstrucción de la proyección de intensidad máxima ATC en la que se estudiaron los niveles: 1cm proximal al tronco innominado (nivel A), 1cm proximal (nivel B) y 1cm distal (nivel C) a la arteria subclavia izquierda, y 1cm proximal (nivel D) y 3cm distales (nivel E) a la zona de sellado proximal definitiva. Los niveles en rojo dependen de la posición de la endoprótesis.
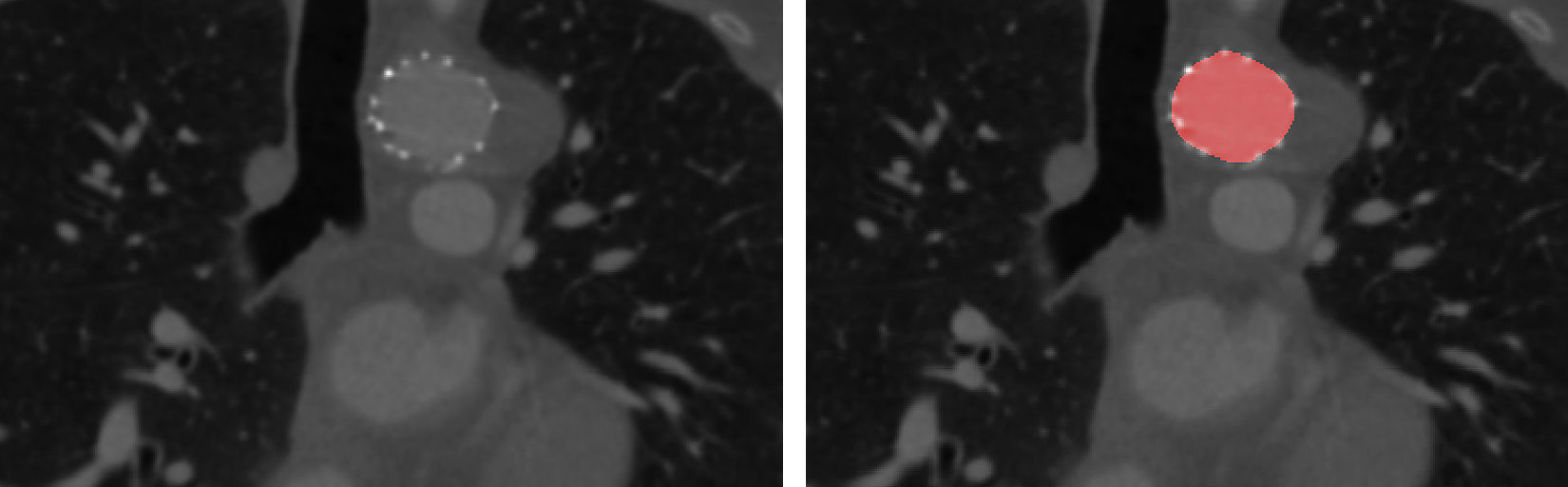
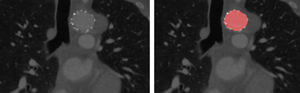
Las series de datos 2D-t se importaron a un programa informático Dynamix (Image Sciences Institute, University Medical Center, Utrecht, Holanda) para su análisis. La luz aórtica se segmentó de manera semiautomática en la exploración de cada fase en función de los valores de grises. En la luz aórtica se seleccionó un punto de origen y se definió un umbral (técnica del umbral), después de lo cual las segmentaciones se corrigieron manualmente. El primer observador efectuó las segmentaciones dos veces para el cálculo de la reproductibilidad intraobservador. Un segundo observador también efectuó las segmentaciones para su cálculo. En las imágenes postoperatorias, los filamentos del armazón de la endoprótesis se consideraron el borde externo de la segmentación a nivel E (fig. 2).
Después de la segmentación de la luz aórtica en cada fase cardíaca, se determinaron el cambio de diámetro y el cambio del área durante el ciclo cardíaco. El cambio de diámetro (la diferencia entre los diámetros mínimo y máximo durante el ciclo cardíaco) se determinó a través del centro de la masa de la luz aórtica a lo largo de 180 ejes, con un incremento angular de 1 grado. Se presenta el cambio medio a lo largo de estos 180 ejes. Los datos sobre el cambio del área y del diámetro se expresan como la media de todos los pacientes ± desviación estándar (DE). Los datos presentados son la media de las primeras y segundas determinaciones del observador 1.
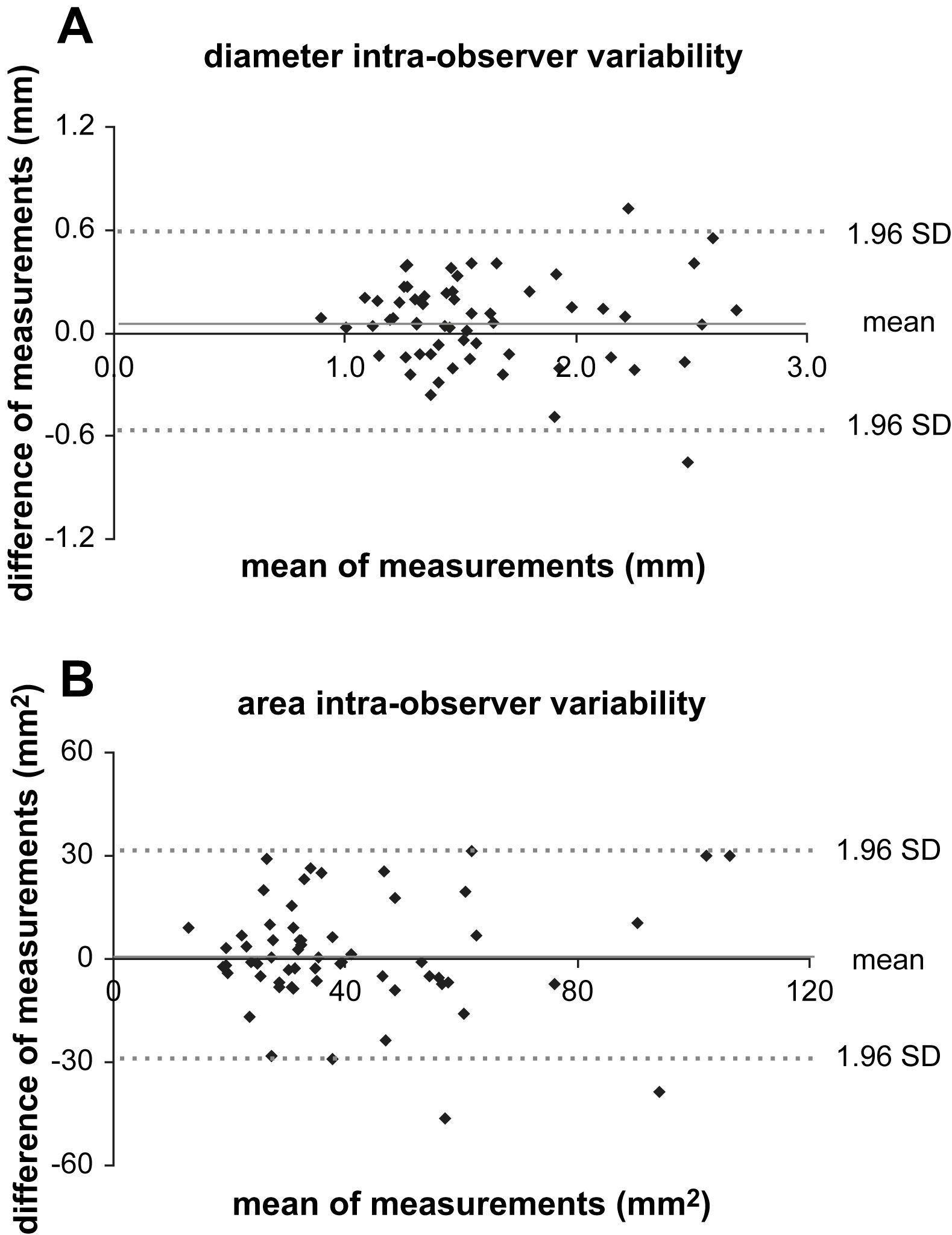
En cada paciente, el análisis estadístico de las diferencias entre los diámetros mínimo y máximo durante el ciclo cardíaco a lo largo de 180 ejes a cada nivel se efectuó utilizando la prueba t de Student para datos apareados. Se consideró estadísticamente significativo un valor de p<0,05. La reproductibilidad de las determinaciones se analizó con la diferencia de Bland y Altman frente el análisis de la media16. Los coeficientes de variabilidad intra e interobservador se calcularon como dos veces la DE de las diferencias16. Las diferencias pre y postoperatorias entre los cambios del diámetro y del área se consideraron significativas cuando fueron mayores que el coeficiente de repetibilidad (CR) intraobservador.
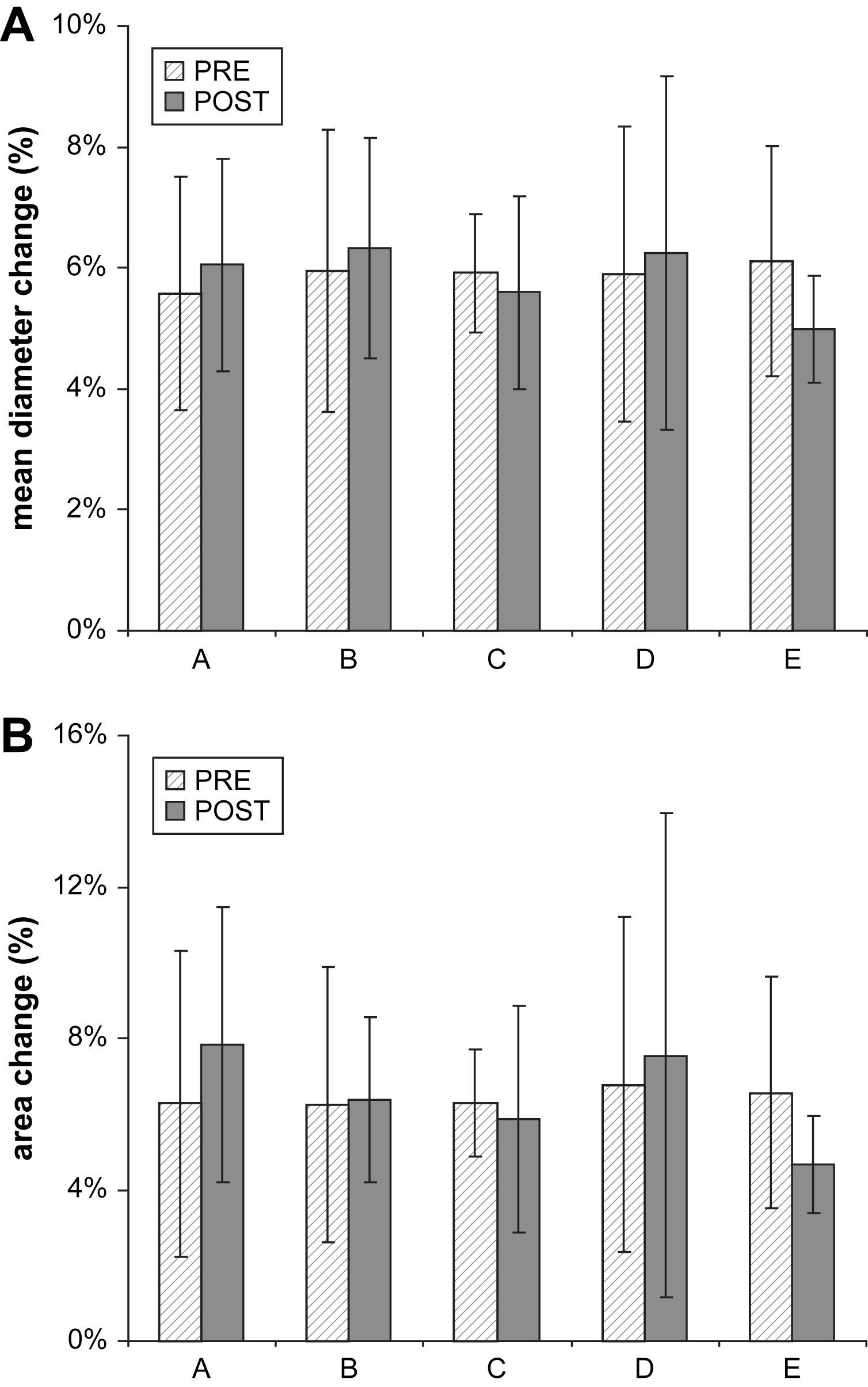
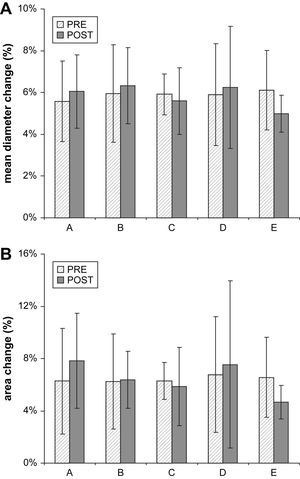
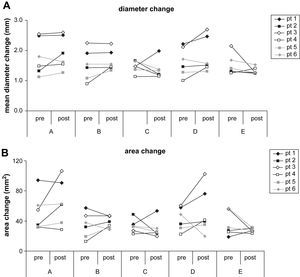
ResultadosDiámetro aórtico medioLos resultados se muestran en las figuras 3A y 4A. Durante el ciclo cardíaco, a cada nivel anatómico, en cada paciente, en los exámenes tanto pre como postoperatorio, el diámetro aórtico demostró un cambio significativo (p<0,05). En el preoperatorio, el cambio medio de diámetro (de todos los pacientes) fue del 5,6% 1cm proximal al tronco innominado (nivel A; límites 3,4-9,1%, DE 1,9), del 5,9% 1cm proximal a la arteria subclavia izquierda (nivel B; límites 3,4-10,0%, DE 2,3), del 5,9% 1cm distal a la arteria subclavia izquierda (nivel C; límites 4,6-7,3%, DE 1,0), del 5,9% 1cm proximal a la zona de sellado definitivo (nivel D; límites 3,9-10,8%, DE 2,4%) y del 6,1% 3cm distales a la zona de sellado definitivo (nivel E; límites 3,7-9,5%, DE 1,9%) (fig. 1). Esto se corresponde con cambios de 1,8mm (límites 1,1-2,5, DE 0,5), 1,5mm (límites 0,9-2,3, DE 0,5), 1,5mm (límites 1,1-1,7, DE 0,2), 1,6mm (límites 1,0-2,2, DE 0,4), y 1,5mm (1,3-12,2, DE 0,3). Los cambios máximo y relativo del diámetro de todos los pacientes fueron de 2,5mm a nivel A y del 10,8% a nivel D.
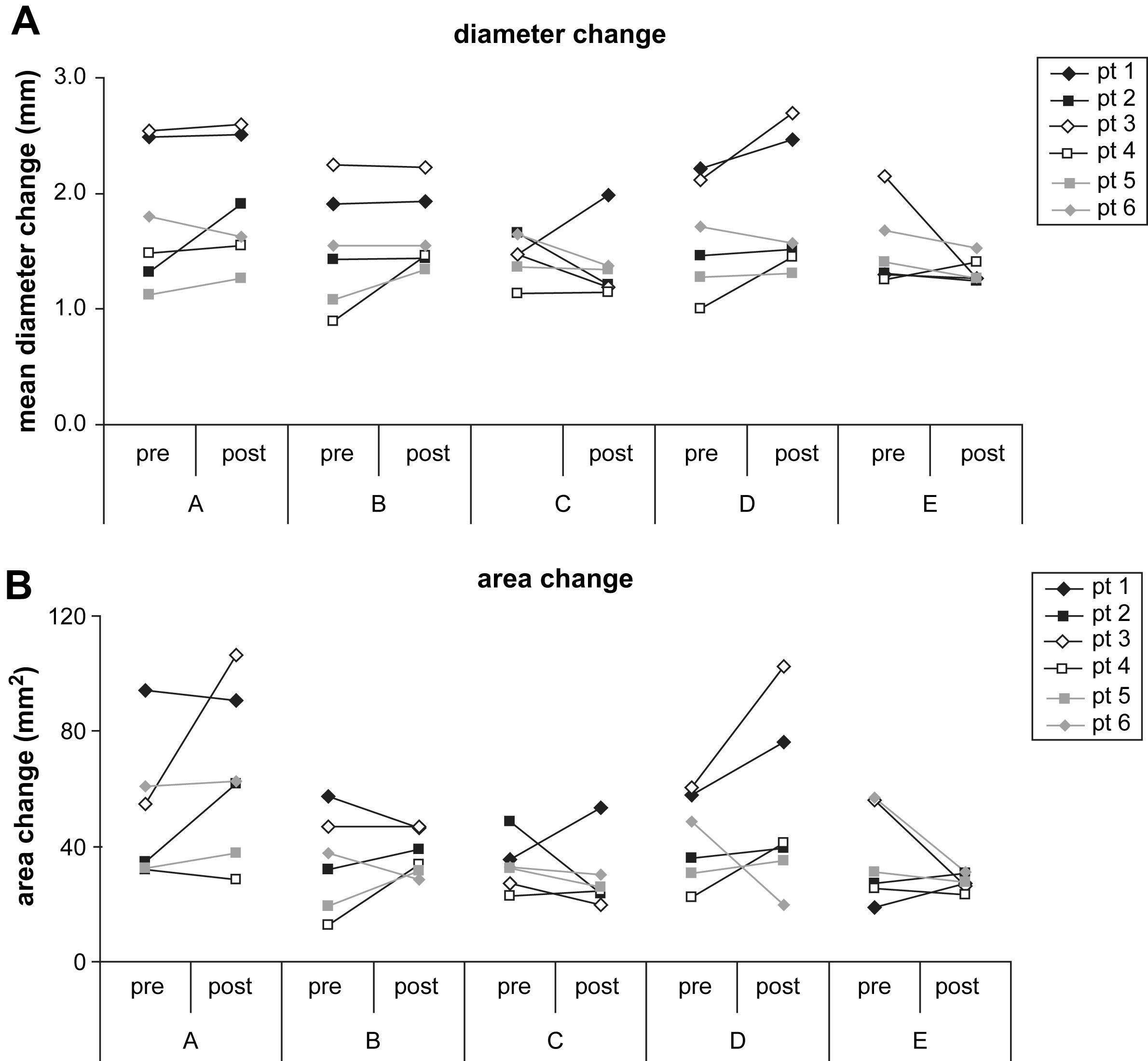
Cambios del diámetro (A) absoluto y del área (B) por paciente. Se representan gráficamente las determinaciones absolutas pre y postoperatorias para todos los pacientes y se conectan con una línea. area change: cambio del área; area change (mm2): cambio del área (mm2); diameter change: cambio del área; mean diameter change (mm): cambio medio de diámetro (mm); pt: paciente.
Postoperatoriamente, para el nivel A se demostró un cambio medio de diámetro del 6,0% (límites 3,9-8,9%, DE 1,7), nivel B 6,3% (límites 4,5-9,7%, DE 1,8), nivel C 5,6% (límites 3,9-8,9%, DE 1,6), nivel D 6,2% (límites 3,5-11,7%, DE 2,9) y nivel E 5,0% (límites 3,3-5,9%, DE 0,9). Esto se corresponde con cambios absolutos de 1,9mm (límites 1,3-2,6, DE 0,5), 1,7mm (límites 1,3-2,2, DE 0,3), 1,4mm (límites 1,1-2,0, DE 0,3), 1,8mm (límites 1,3-2,7, DE 0,5), y 1,3mm (1,2-1,5, DE 0,1). Los cambios máximo y relativo del diámetro de todos los pacientes fueron de 2,7mm y del 11,7% a nivel D.
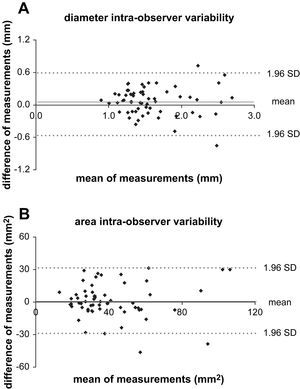
Para el cambio de diámetro, el CR intraobservador fue de 0,5mm y el coeficiente de variabilidad interobservador fue de 0,7mm, lo que indicó una reproductibilidad adecuada tanto intra como entre observadores (fig. 5A). Las diferencias medias entre los cambios de diámetro post y pre TEVA fueron más pequeñas que los CR, indicativo de la ausencia de diferencias significativas entre los cambios medios del diámetro pre y posTEVA (distensibilidad) en cualquiera de los niveles evaluados. En un paciente se observó una disminución significativa del cambio de diámetro dentro de la endoprótesis (nivel E) de 0,9mm (4,5%) con un aumento de 0,6mm (2,6%) proximales a ella (nivel D).
Variabilidad intraobservador de los cambios medios del diámetro (A) y del área (B). La diferencia de los pares se representa gráficamente frente a la media de los pares. La diferencia media es próxima a 0 y los límites de concordancia (1,96 DE) se encuentran dentro de los considerados aceptables. area intra-observer variability: variabilidad intraobservador del área; diameter intra-observer variability: variabilidad intraobservador del diámetro; difference of measurements (mm): diferencias de las determinaciones (mm); difference of measurements (mm2): diferencias de las determinaciones (mm2); mean: media; mean of measurements (mm2): media de las determinaciones (mm2); mean of measurements (mm): media de las determinaciones (mm); SD: desviación estándar.
Los resultados se muestran en las figuras 3B y 4B. A nivel A se demostró un cambio medio del área aórtica (de todos los pacientes) del 6,3% (límites 3,3-14,9%, DE 4,1%), a nivel B del 6,2% (límites 2,2-12,0%, DE 3,6%), a nivel C del 6,3% (límites 4,4-8,5%, DE 1,4%), a nivel D del 6,8% (límites 3,4-15,7%, DE 4,4%), y a nivel E del 6,6% (límites 2,6-12,4%, DE 3,1%). Esto se corresponde con 51,4mm2 (límites 31,8-94,2, DE 22,2), 34,4mm2 (límites 12,9-57,2, DE 15,2), 33,2mm2 (límites 22,9-48,5, DE 8,0), 42,6mm2 (límites 22,2-60,4, DE 14,0), y 35,9mm2 (límites 18,9-56,7, DE 14,9). Los cambios máximo y relativo del área aórtica de todos los pacientes fueron de 94,2mm2 a nivel A y del 15,7% a nivel D.
Postoperatoriamente, a nivel A se demostró un cambio medio del área aórtica del 7,8% (límites 3,0-13,7%, DE 3,6%), a nivel B del 6,4% (límites 4,4-10,0%, DE 2,2%), a nivel C 5,9% (límites 3,0-12,3%, DE 3,0), a nivel D 7,5% (límites 2,5-20,2%, DE 6,4%), y a nivel E 4,7% (límites 2,6-6,8%, DE 1,3%). Esto se corresponde con 64,5mm2 (límites 28,5-106,2, DE 27,2), 37,7mm2 (límites 28,7-46,7, DE 7,0), 29,6mm2 (límites 19,8-53,2, DE 11,0), 52,2mm2 (límites 19,5-102,3, DE 28,1), y 27,7mm2 (límites 23,4-30,9, DE 2,6). Los cambios máximo y relativo del área de todos los pacientes fueron de 106,2mm2 a nivel A y del 20,2% a nivel D.
Para el cambio del área, el CR intraobservador fue de 31,2mm2 y el coeficiente de variabilidad interobservador fue de 36,5mm2, indicativo de una repetibilidad adecuada dentro o entre observadores (fig. 5B). Las diferencias medias entre los cambios de diámetro post y pre TEVA fueron más pequeñas que los CR, indicativo de la ausencia de diferencias significativas entre los cambios del área pre y posTEVA (distensibilidad) en cualquiera de los niveles evaluados. En un paciente se detectaron aumentos significativos del cambio del área de 51,7mm2 (6,2%) a nivel A y de 41,9mm2 (6,5%) a nivel D y una disminución casi significativa de 29,6mm2 (7,5%) a nivel E.
DiscusiónEn el presente estudio, utilizamos cine-ATC para evaluar los cambios de diámetro y del área de la aorta torácica durante el ciclo cardíaco antes y después de TEVA. Para adquirir la serie de datos 2D-t que consistió en ocho imágenes por ciclo cardíaco, se usó ATC de 64 cortes activada por el ECG, lo que proporcionó una excelente resolución temporal y espacial. Este instrumento de diagnóstico por la imagen brinda la oportunidad exclusiva de estudiar la distensión aórtica antes y después de la implantación de una endoprótesis. Los conocimientos sobre la distensión aórtica específica de un paciente a un nivel específico permiten tomar mejores decisiones sobre el tamaño de la endoprótesis. También puede estudiarse la influencia de la implantación de la endoprótesis en esta distensión, lo que depara información valiosa que es pertinente para su diseño.
Hemos seleccionado cinco posiciones a lo largo de la aorta torácica para evaluar la distensión aórtica. Se seleccionó la posición de 1cm proximal al tronco innominado porque este nivel es pertinente como posible zona de anclaje para las endoprótesis torácica fenestradas. Los niveles 1cm proximal y distal a la arteria subclavia izquierda se eligieron porque son zonas de anclaje pertinentes para la TEVA. Por último, también seleccionamos las localizaciones 1cm proximal y 3cm distales a la zona de sellado proximal definitiva para evaluar la distensión en la aorta nativa y cubierta cerca de la fijación proximal del injerto.
Encontramos una distensión significativa en el arco aórtico torácico y en la aorta torácica descendente antes y después de la TEVA. El cambio medio del diámetro a lo largo de los 180 ejes varió del 3 al 12% y el cambio del área varió del 2 al 20%. Puede calcularse fácilmente que el cambio relativo esperado del área debe ser el doble del cambio relativo del diámetro. Puesto que para los datos del presente estudio no fue así, esta discrepancia sugiere una distensión asimétrica. Puesto que la expansión no se distribuye por igual a lo largo de la circunferencia aórtica, los cambios máximos de diámetro de los 180 ejes son incluso mayores (3-23%) y son similares a los resultados de los estudios efectuados previamente sobre distensión de la aorta torácica en pacientes con aneurismas aórticos abdominales11,12. En individuos sanos sin calcificaciones vasculares, se espera que la distensión aórtica durante el ciclo cardíaco sea incluso más pronunciada, lo que podría afectar a la permeabilidad del tratamiento endovascular en casos de rotura y disección aórtica traumática. Se identificó una tendencia no significativa hacia una mayor distensibilidad proximal a la endoprótesis (nivel D) y una disminución de la distensibilidad dentro de la endoprótesis (nivel E). Hemos observado que durante el ciclo cardíaco la distensión aórtica torácica se mantiene después de la implantación de una endoprótesis. La preservación de la distensibilidad podría tener implicaciones importantes para su diseño y permeabilidad porque las fuerzas ejercidas sobre ellas pueden ser mucho mayores después de la implantación de lo que inicialmente anticipan los fabricantes. Además, las decisiones tomadas sobre el tamaño de la endoprótesis se basan actualmente en técnicas diagnósticas de imagen estática, y pasan por alto los cambios del diámetro aórtico a través del ciclo cardíaco. Con los protocolos actuales de adquisición ATC multicorte de alta velocidad, la zona de anclaje aórtica se explora en una fracción del ciclo cardíaco. Las imágenes adquiridas pueden encontrarse en diástole, sístole o entre ambas. Cuando la diferencia entre los diámetros mínimo y máximo es del 12%, esto podría tener importantes implicaciones para calcular el tamaño de la prótesis así como su permeabilidad, que podría estar comprometida por una fijación, migración y endofugas (intermitentes). Consideramos que la elección de un tamaño un 10% mayor de lo necesario, según lo aconsejado por la mayoría de los fabricantes, debe basarse en los diámetros sistólicos. Cuando se calcula el tamaño en imágenes estáticas, la elección de un tamaño un 10% mayor podría ser insuficiente en algunos pacientes y sería preferible un margen más amplio de, como mínimo, el 20%.
Puesto que nuestros datos indican que la distensión aórtica es variable entre pacientes, es posible que aquellos con una distensión más pronunciada sean los que tienen un mayor compromiso de la permeabilidad de la prótesis. Sin embargo, son necesarios ensayos clínicos para respaldar la hipótesis de que el cálculo del tamaño de la endoprótesis y la selección de los pacientes, basada en las imágenes dinámicas, mejoran la permeabilidad del injerto y los resultados a medio y largo plazo. En condiciones ideales, en el futuro, la distensión aórtica se determinará por paciente y por nivel aórtico, lo que dará lugar a una mejor selección de los pacientes, a la vez que permitirá una elección más precisa de la endoprótesis más adecuada a cada caso.
LimitacionesHasta lo que conocen los autores, éste es el primer estudio con cine-ATC en la dinámica aórtica en pacientes AAT, tanto pre como posTEVA. Hemos efectuado un estudio de pre-post (las exploraciones pre-TEVA sirvieron como control para cada paciente), lo que reduce la variabilidad de grupo. Reconocemos que nuestros resultados son preliminares debido al pequeño tamaño de la muestra. No obstante, puesto que el procedimiento TEVA en pacientes AAT no se efectúa con tanta frecuencia como el TEVAA en pacientes con aneurisma aórtico abdominal y los diseños de las endoprótesis evolucionan rápidamente, creemos que estos resultados preliminares son valiosos. Los futuros estudios con muestras a mayor escala probablemente aumentarán la significación estadística de los resultados. Además, las segmentaciones se efectuaron de forma semiautomática y esto podría haber inducido algunos errores dependientes del observador. Sin embargo, los análisis de la variabilidad intra e interobservador demostraron una reproductibilidad adecuada de las determinaciones. También reconocemos la limitación potencial de efectuar determinaciones usando una estrategia bidimensional, que no caracteriza por completo el complejo movimiento aórtico tridimensional. En la actualidad estamos desarrollando los recursos necesarios para las evaluaciones volumétricas dinámicas (3D-t) de la aorta torácica.
ConclusiónEl presente estudio demostró la viabilidad de la cine-ATC para obtener imágenes del movimiento dinámico de la pared aórtica antes y después del TEVA en el arco aórtico y en la zona de sellado proximal. Los conocimientos sobre la distensión aórtica en esta área, donde se produce la fijación de la endoprótesis aórtica, son pertinentes para sus futuros diseños. En pacientes con aneurisma de aorta torácica la aorta torácica nativa manifiesta una distensión sustancial durante el ciclo cardíaco y este fenómeno se preserva tras la implantación de la endoprótesis. La magnitud y, por lo tanto, la importancia clínica, de esta distensión varían entre pacientes. Además, la discrepancia entre los cambios del área y del diámetro indica que esta distensión es asimétrica.