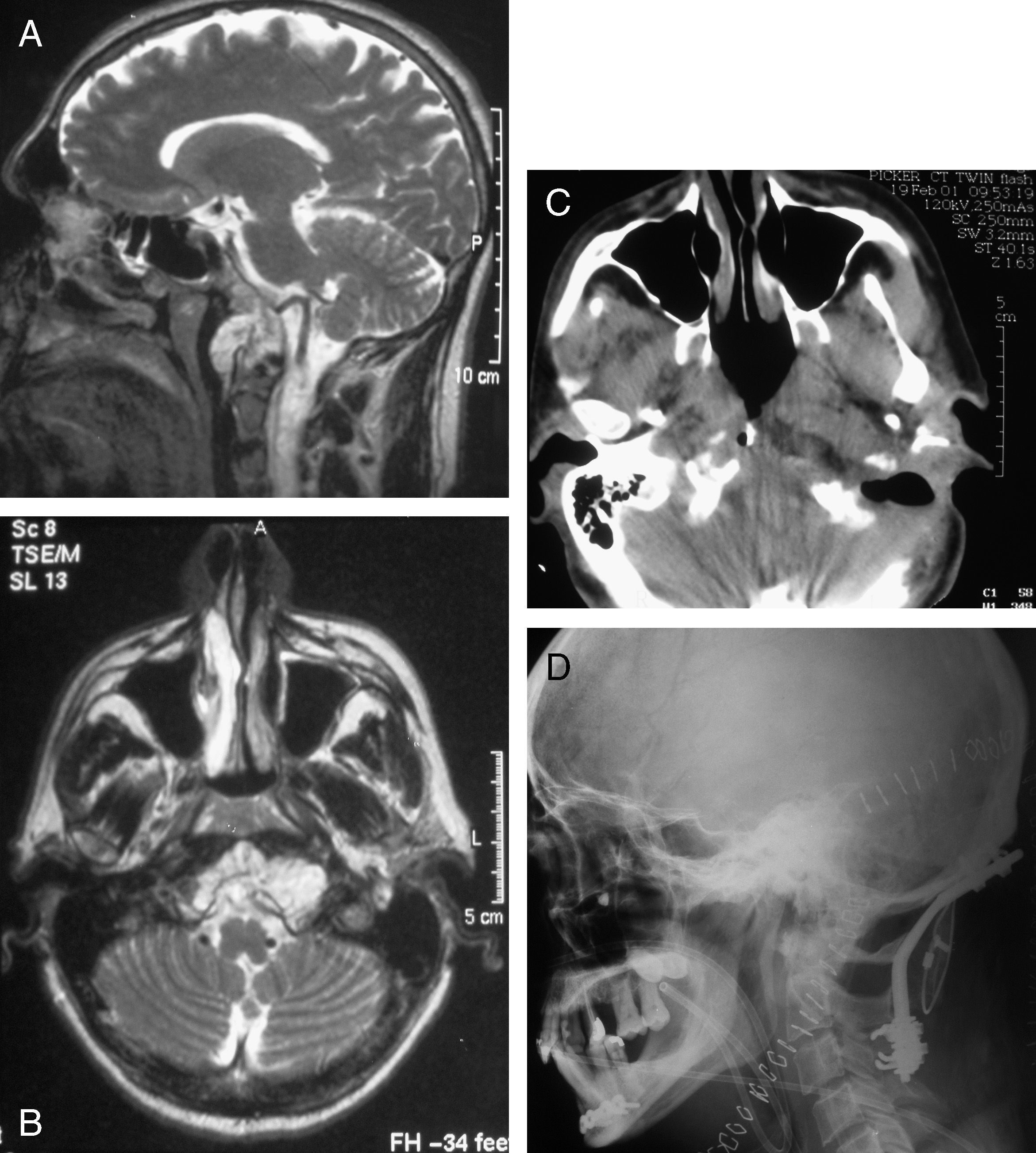
Los cordomas de clivus son neoplasias benignas con una alta tasa de recurrencia y mortalidad. La dificultad para conseguir una resección total y su naturaleza infiltrativa les confieren esta agresividad.
Material y métodoSe presenta una serie retrospectiva de 8 casos tratados quirúrgicamente en nuestro servicio desde 1993 hasta 2006.
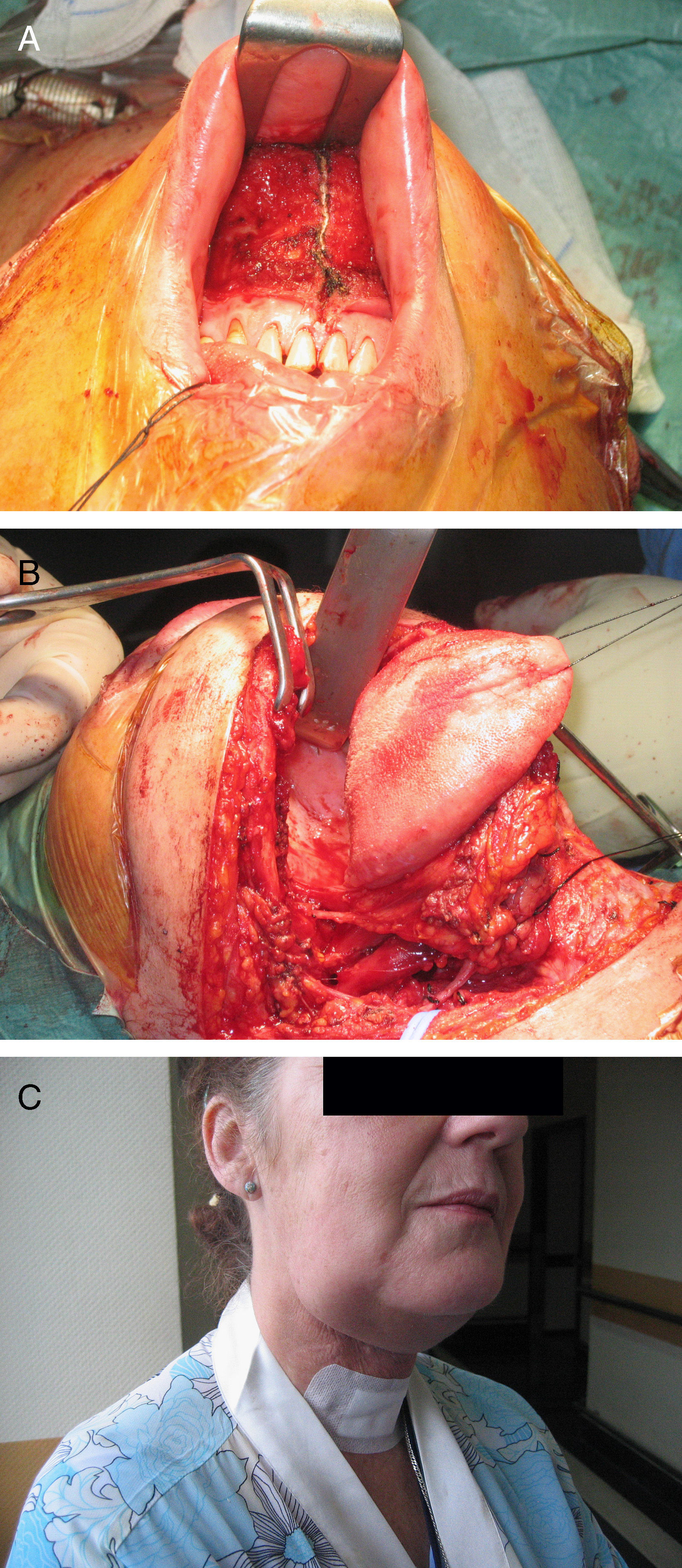
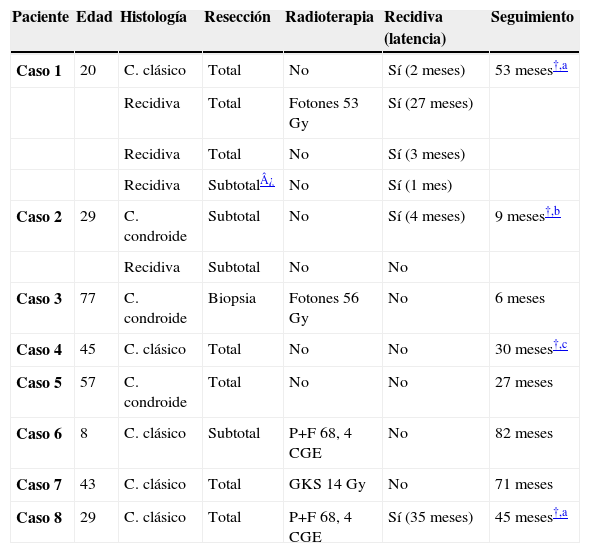
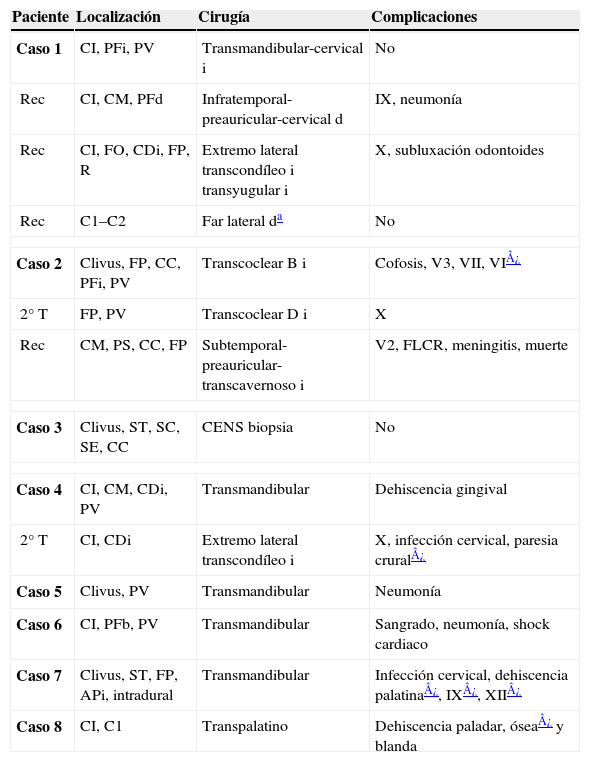
ResultadosLos 8 pacientes fueron sometidos a un total de 14 procedimientos quirúrgicos, de los que 6 fueron abordajes anteriores (5 transmandibulares), 2 subtemporales-preauriculares, 2 extremolateral transcondíleos y 2 transcocleares. En 7 pacientes, la intención fue curativa. En 2 casos fue preciso realizar la cirugía de forma secuencial, en dos tiempos. Se consiguió la resección total en el 58% de los procedimientos. El seguimiento medio fue de 40 meses. Dos pacientes fallecieron como consecuencia de recidiva local, un paciente falleció durante el postoperatorio y otro paciente falleció por causas no relacionadas con el tumor.
DiscusiónLa baja incidencia de los cordomas de clivus dificulta la elaboración de estudios randomizados acerca de su manejo. El tratamiento de elección es la cirugía, complementado con radioterapia en casos seleccionados. Preferimos emplear el abordaje transmandibular, combinándolo con extremolateral transcondíleo, en el caso de afectación condilar. Para extensiones laterales, optamos por el abordaje subtemporal-preauricular o vías transpetrosas. Las nuevas modalidades radioterápicas permiten el tratamiento eficaz de los remanentes tumorales.
ConclusionesLos abordajes extradurales implican regiones anatómicas familiares para el otorrinolaringólogo. Es imprescindible conocer las limitaciones de cada abordaje, a fin de evitar morbilidades innecesarias y resecciones incompletas.
Clival chordomas are benign neoplastic tumors displaying high morbidity and mortality rates. The difficulties involved in obtaining a total resection and its infiltrative nature explain this aggressiveness.
Material and methodWe present a retrospective clinical series of 8 surgically treated cases of clival chordomas at our department from 1993 to 2006.
ResultsAll 8 patients underwent a total of 14 surgical procedures, 6 of which were anterior approaches (5 transmandibular), 2 subtemporal-preauricular, 2 from the transcondylar lateral edge and 2 transcochlear. In 7 patients the surgery was performed with curative intent. In 2 cases it was necessary to perform the surgery sequentially, in two steps. Total resection was achieved in 58% of patients. Average follow up was 40 months. Two patients died due to local recurrence, one patient died in the postoperative period and another died due to causes which were not related with the tumor.
DiscusionThe low incidence of clival chordomas makes it difficult to carry out random clinical studies of its management. The treatment of choice is surgery, supplemented by radiotherapy in selected cases. We prefer to use the transmandibular approach, combined with transcondylar lateral edge approach when the occipital condyle is infiltrated. For lateral extensions, we use the subtemporal-preauricular or transpetrosal approaches. New radiotherapy modalities provide an effective treatment of tumoural residues.
ConclusionsExtradural approaches imply anatomical regions which are familiar for otolaryngologists. Specific knowledge about the limitations of each approach is essential in order to avoid unnecessary morbidity and incomplete resections.