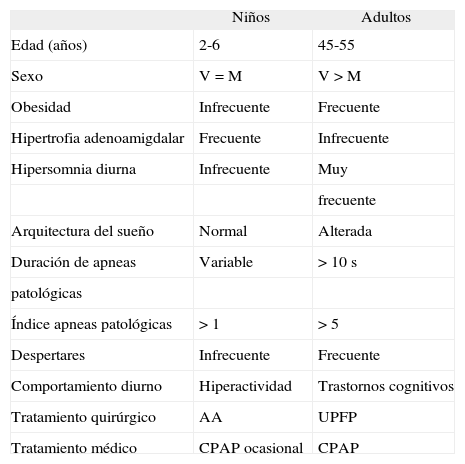
El síndrome de apnea obstructiva del sueño es una entidad bien conocida en adultos, pero hasta ahora ha sido menos estudiada en niños. Recientemente se ha producido un importante incremento en el reconocimiento de los trastornos del sueño en la etapa infantil. Nuestro objetivo es analizar los estudios científicos publicados en los últimos años. Hemos revisado artículos publicados acerca del síndrome de apnea obstructiva en edad pediátrica y hemos estudiado la sintomatología, el diagnóstico y las opciones de tratamiento. En conclusión, el curso natural y el pronóstico a largo plazo del síndrome de apnea obstructiva en la infancia no son bien conocidos, por lo que se necesitan más estudios en esta área.
Obstructive sleep apnoea syndrome is a well-known clinical entity in adults but until now it has been less well studied in children. In recent years there has been a dramatic increase in the recognition of sleep disorders in children. Our goal is to analyze scientific data published in the last few years. We reviewed published articles regarding paediatric obstructive sleep apnoea syndrome and extracted the clinical symptoms, diagnosis and treatment options. In conclusion, the natural course and long-term prognosis of childhood obstructive sleep apnoea syndrome are not well-known and further studies are needed in this area.