Mostrar los resultados del olfatómetro capaz de generar tareas olfativas en un equipo de resonancia magnética funcional (fMRI).
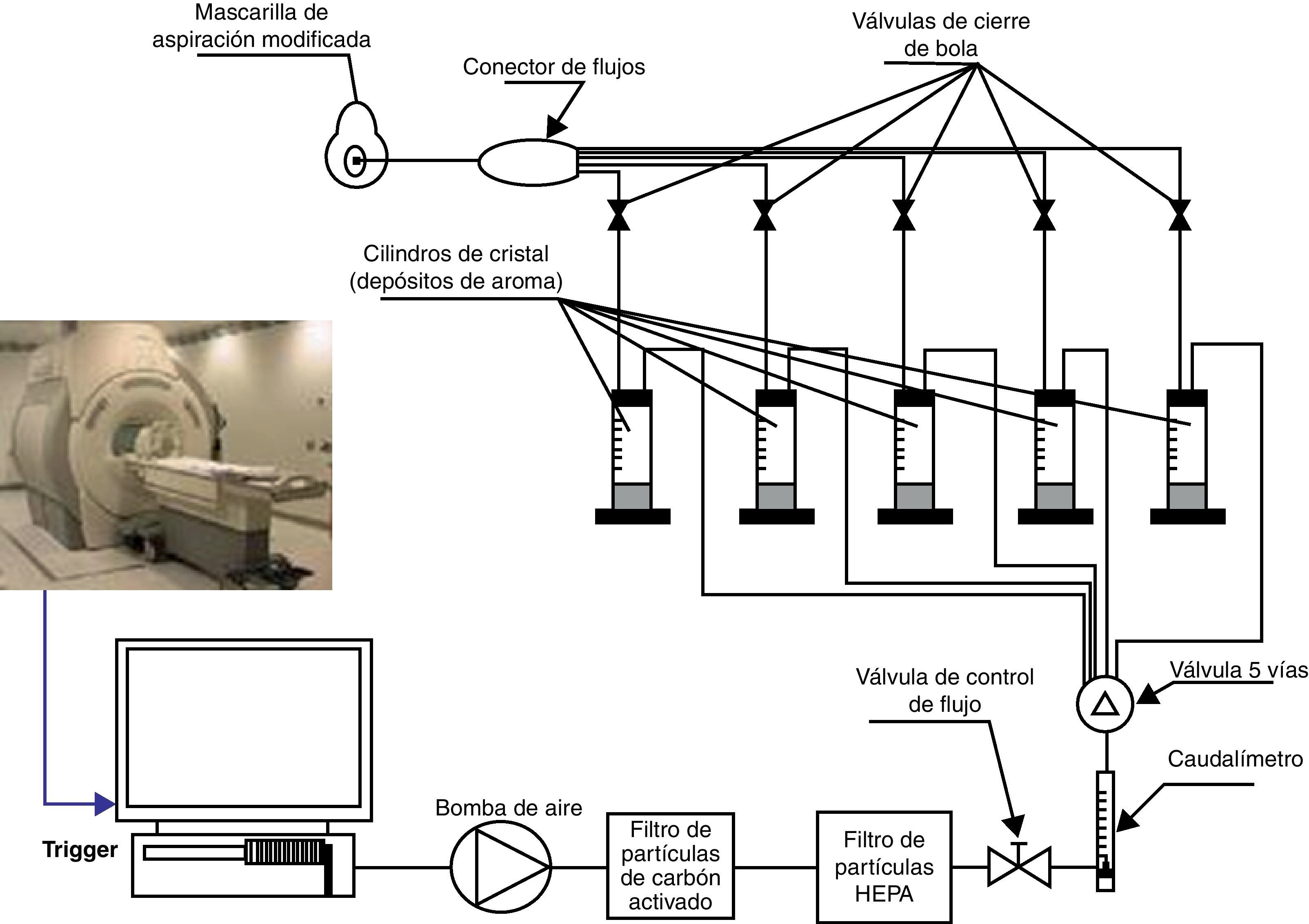
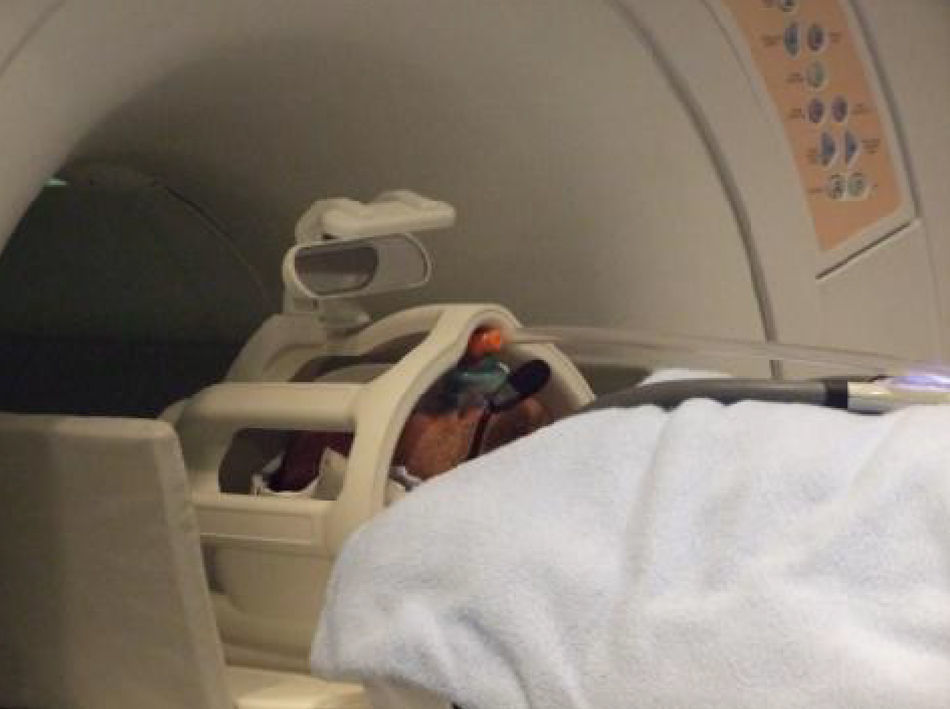
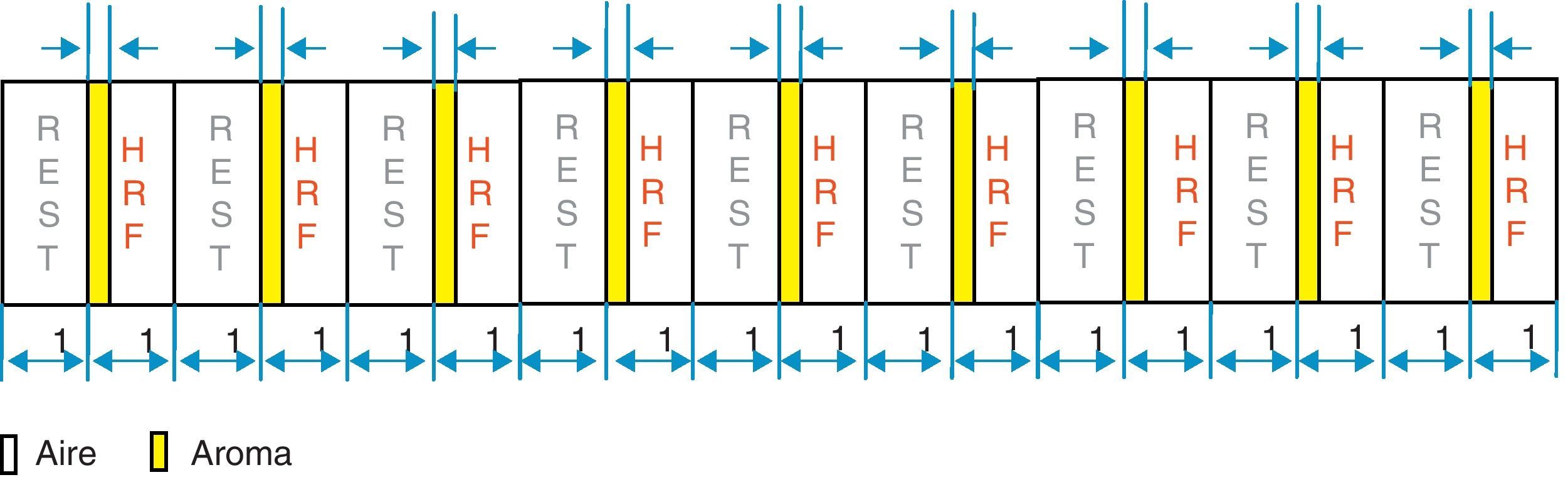
Material y métodosEstudiamos 10 sujetos normales: 5 varones y 5 mujeres. El olfatómetro está diseñado para que el estímulo que produce se sincronice con el equipo de fMRI mediante la señal desencadenante que suministra el propio equipo. El olfatómetro es capaz de: seleccionar el olor, secuenciar los distintos olores, programar la frecuencia y duración de los olores y controlar la intensidad del olor. El paradigma utilizado responde a un diseño de activación asociada a eventos, en el que la duración del bloque de activación y de reposo es de 15s. La duración del estímulo olfativo (butanol, menta o café) es de 2 segundos, durante toda la serie que consta de 9 ciclos.
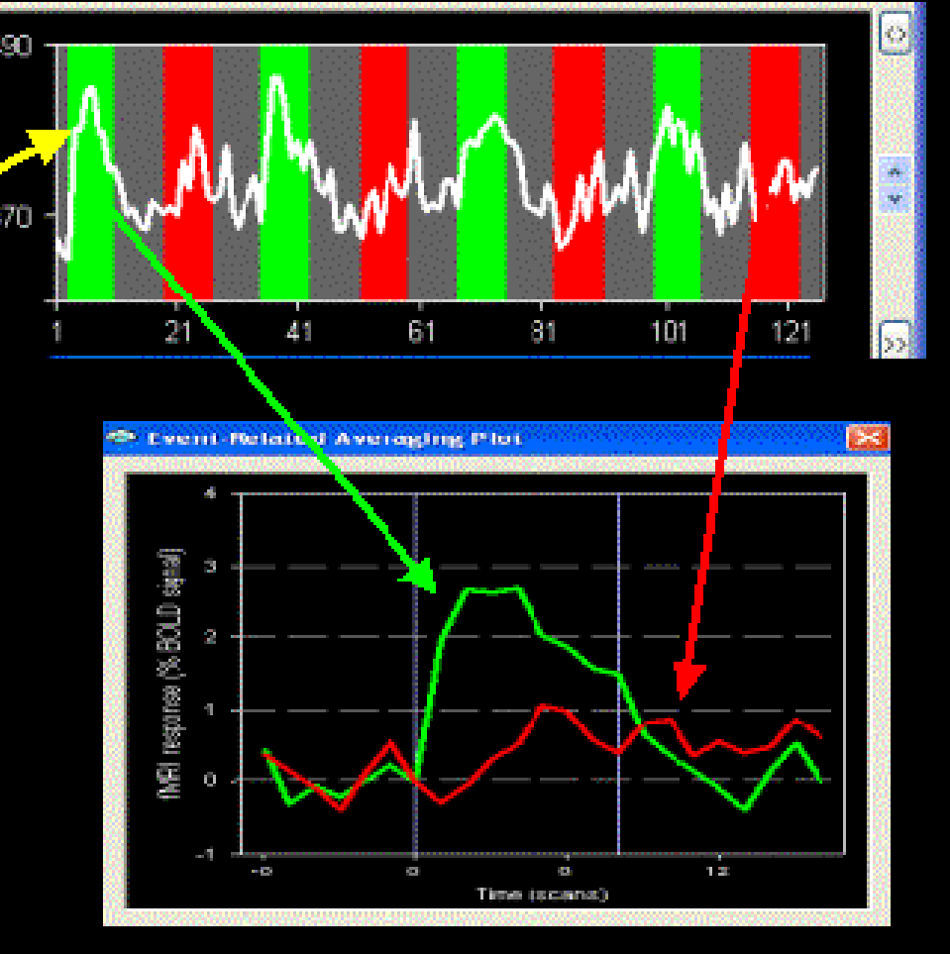
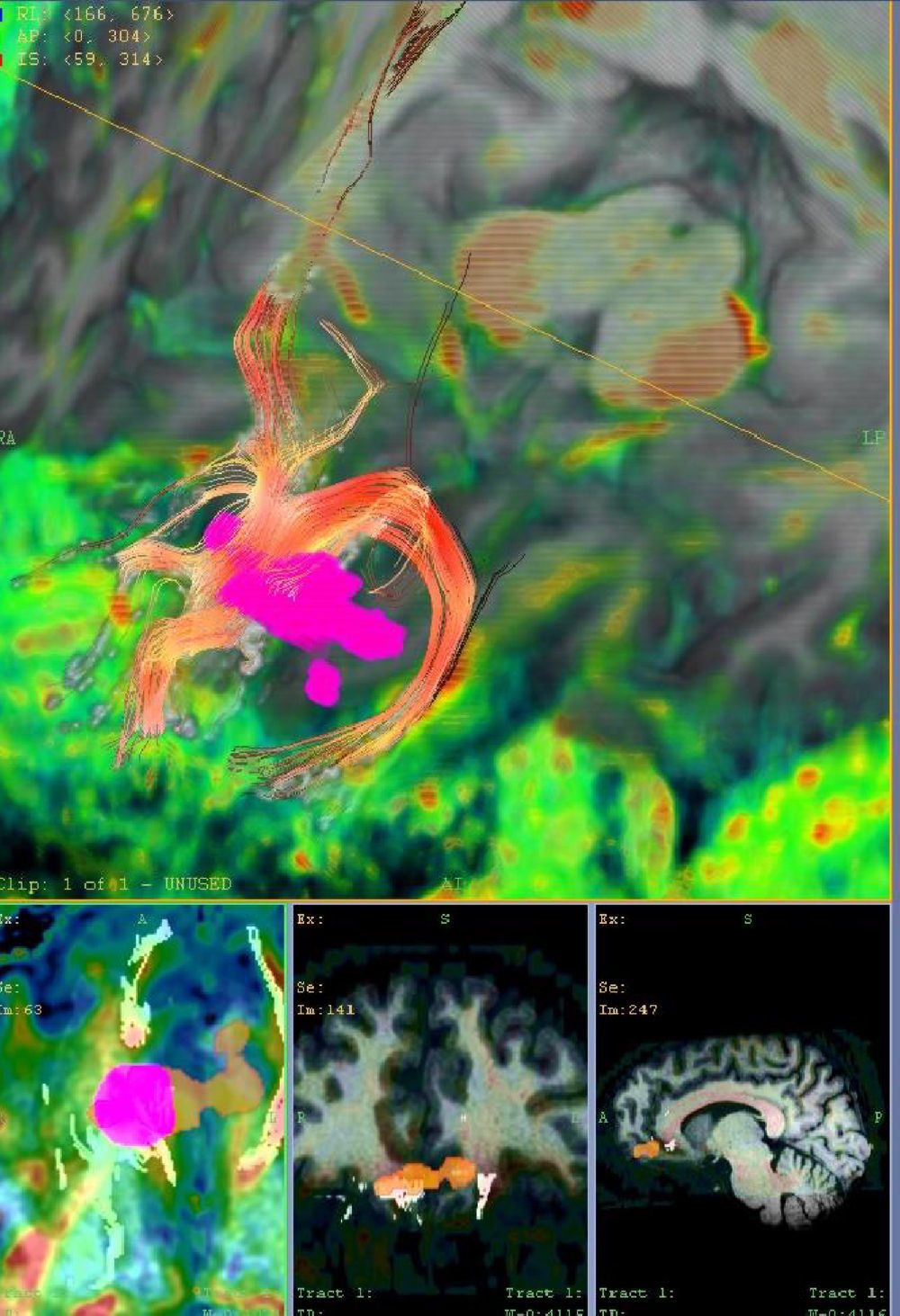
ResultadosSe ha observado reactividad (contraste BOLD) en las diferentes áreas cerebrales involucradas en las tareas olfativas: bulbo olfatorio, córtex entorrinal (4%), amigdala (2,5%) y córtex temporoparietal. Las áreas relacionadas con integración de las emociones tienen una reactividad mayor.
ConclusionesEl dispositivo propuesto nos permite controlar de forma automática y sincronizada los olores necesarios para estudiar la actividad de las áreas olfatorias cerebrales mediante fMRI.
To show the results of a device that generates automated olfactory stimuli suitable for functional magnetic resonance imaging (fMRI) experiments.
Material and methodsTen normal volunteers, 5 women and 5 men, were studied. The system allows the programming of several sequences, providing the capability to synchronise the onset of odour presentation with acquisition by a trigger signal of the MRI scanner. The olfactometer is a device that allows selection of the odour, the event paradigm, the time of stimuli and the odour concentration. The paradigm used during fMRI scanning consisted of 15-s blocks. The odorant event took 2s with butanol, mint and coffee.
ResultsWe observed olfactory activity in the olfactory bulb, entorhinal cortex (4%), amygdala (2.5%) and temporo-parietal cortex, especially in the areas related to emotional integration.
ConclusionsThe device has demonstrated its effectiveness in stimulating olfactory areas and its capacity to adapt to fMRI equipment.