Revisión narrativa sobre el azul de metileno en choque vasopléjico en posoperatorio de cirugía cardíaca en pacientes de cuidado intensivo de adultos. Se realizó búsqueda de la literatura en bases de datos Pubmed, Embase, Ovid y literatura gris.
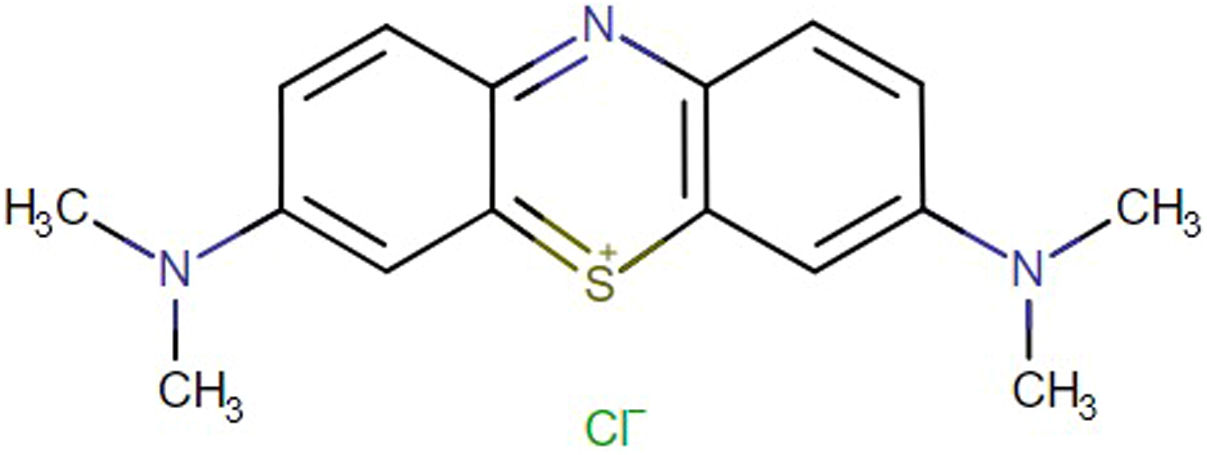
El choque vasopléjico es una complicación posoperatoria de cirugía cardíaca que se caracteriza por hipotensión arterial, baja resistencia vascular sistémica, presiones de llenado ventricular bajas, índice cardíaco normal o elevado y requerimiento de medicamentos vasopresores. El tratamiento convencional se basa en la administración de líquidos y terapia vasopresora con catecolaminas y vasopresina. Cuando este manejo no es eficaz, como alternativa terapéutica se encuentra el azul de metileno, fenotiazina tricíclica que actúa inhibiendo la óxido nítrico sintasa, la guanilato ciclasa y la relajación inducida por acetilcolina, y mejora el tono vascular y la hipotensión refractaria asociada con la disfunción endotelial.
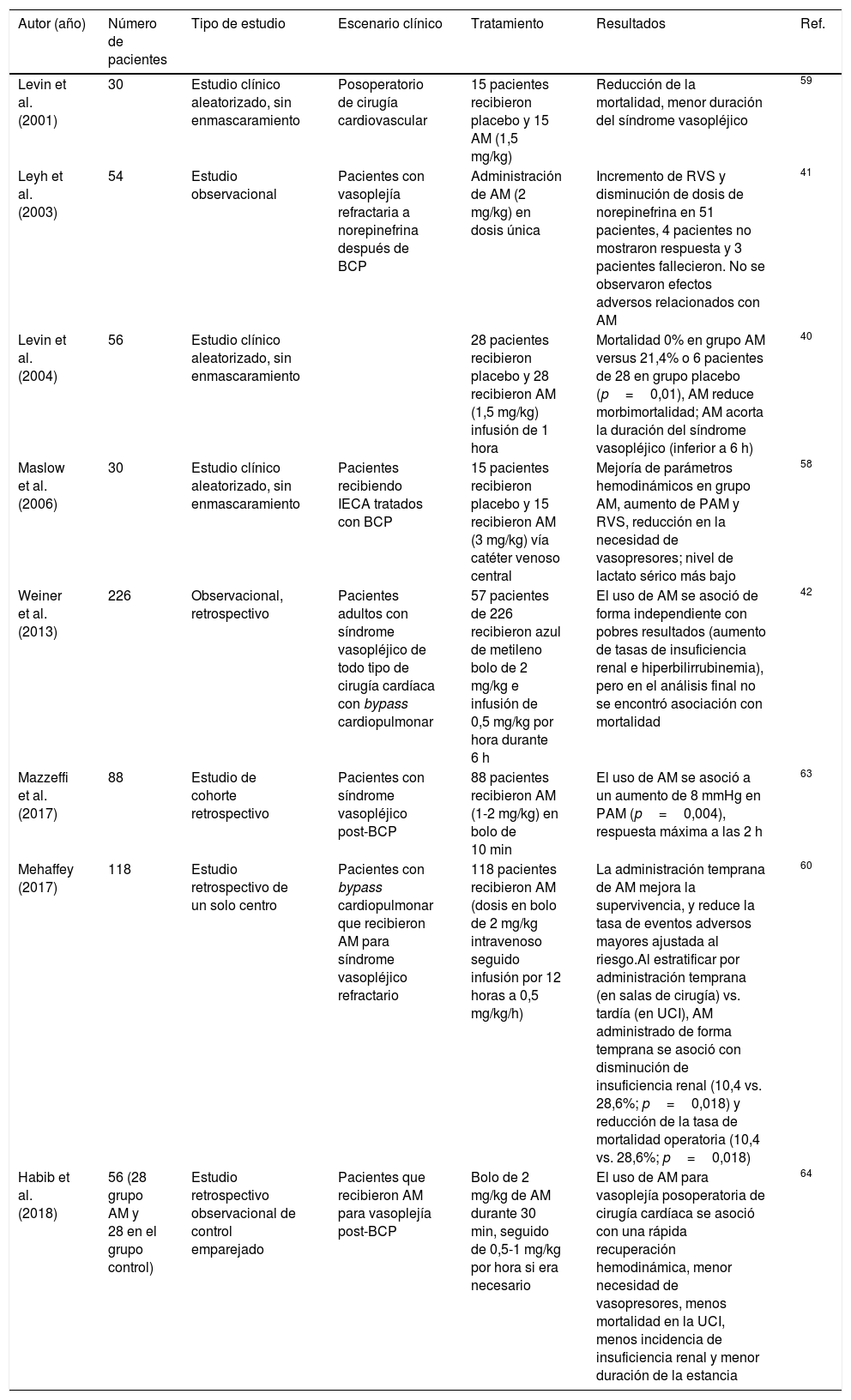
Se concluye que la evidencia apoya el uso de azul de metileno en el choque vasopléjico en posoperatorio de cirugía cardíaca como terapia de rescate cuando el manejo con catecolaminas y vasopresina no es eficaz. El uso de azul de metileno permite el destete de vasopresores convencionales, reduce la duración de la vasoplejía en cirugía cardíaca en comparación con el tratamiento convencional y reduce la mortalidad. Se recomiendan medidas de gestión del riesgo en farmacología clínica, como vigilancia y prevención de eventos adversos: anemia hemolítica, elevación de transaminasas, síndrome serotoninérgico, interacciones medicamentosas con fármacos de estrecho margen terapéutico, debido al potencial del azul de metileno de inhibir el citocromo P450.
Narrative review of methylene blue in vasoplegic shock after cardiac surgery in adult intensive care patients. A literature search was made in PubMed, Embase, Ovid, and the grey literature databases.
Vasoplegic shock is a postoperative complication of cardiac surgery. It is characterised by arterial hypotension, low systemic vascular resistance, low ventricular filling pressures, a normal or elevated cardiac index, and vasopressor medication requirement. The conventional treatment is based on the administration of fluids and vasopressor therapy with catecholamines and vasopressin. When this management is not effective, methylene blue, tricyclic phenothiazine, is used as a therapeutic alternative. This acts by inhibiting nitric oxide synthase, guanylate cyclase, and relaxation induced by acetylcholine, thus improving the tone vascular and refractory hypotension associated with endothelial dysfunction.
It is concluded that the evidence supports the use of methylene blue in vasoplegic shock in the postoperative period of cardiac surgery as rescue therapy when the management with catecholamines and vasopressin is not effective. The use of methylene blue allows the weaning of conventional vasopressors, a reduction in the duration of vasoplegia in cardiac surgery compared to conventional treatment, and a reduction in mortality. Risk management measures in clinical pharmacology are recommended, including monitoring and prevention of adverse events such as haemolytic anaemia, transaminase elevation, and serotonin syndrome, as well as drug interactions with drugs with a narrow therapeutic margin due to the potential of methylene blue to inhibit cytochrome P450.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí