La tuberculosis sigue siendo una causa importante de morbimortalidad, especialmente en los pacientes críticamente enfermos. Identificar los factores asociados con mayor riesgo de muerte en la unidad de cuidados intensivos podría guiar intervenciones terapéuticas más oportunas y eficaces. Este estudio evalúa la asociación entre múltiples variables clínicas y la mortalidad a 30 días.
Materiales y métodosCohorte retrospectiva de un solo centro, que incluyó a los adultos con diagnóstico confirmado de tuberculosis grave, ingresados a cuidados intensivos entre 2015 y 2022. Se excluyeron los casos de COVID-19, ausencia de confirmación microbiológica o registros clínicos incompletos. Se analizaron 99 pacientes mediante estadística descriptiva, análisis bivariado y regresión logística multivariada. El estudio fue aprobado por el comité de ética y cumplió con la Declaración de Helsinki.
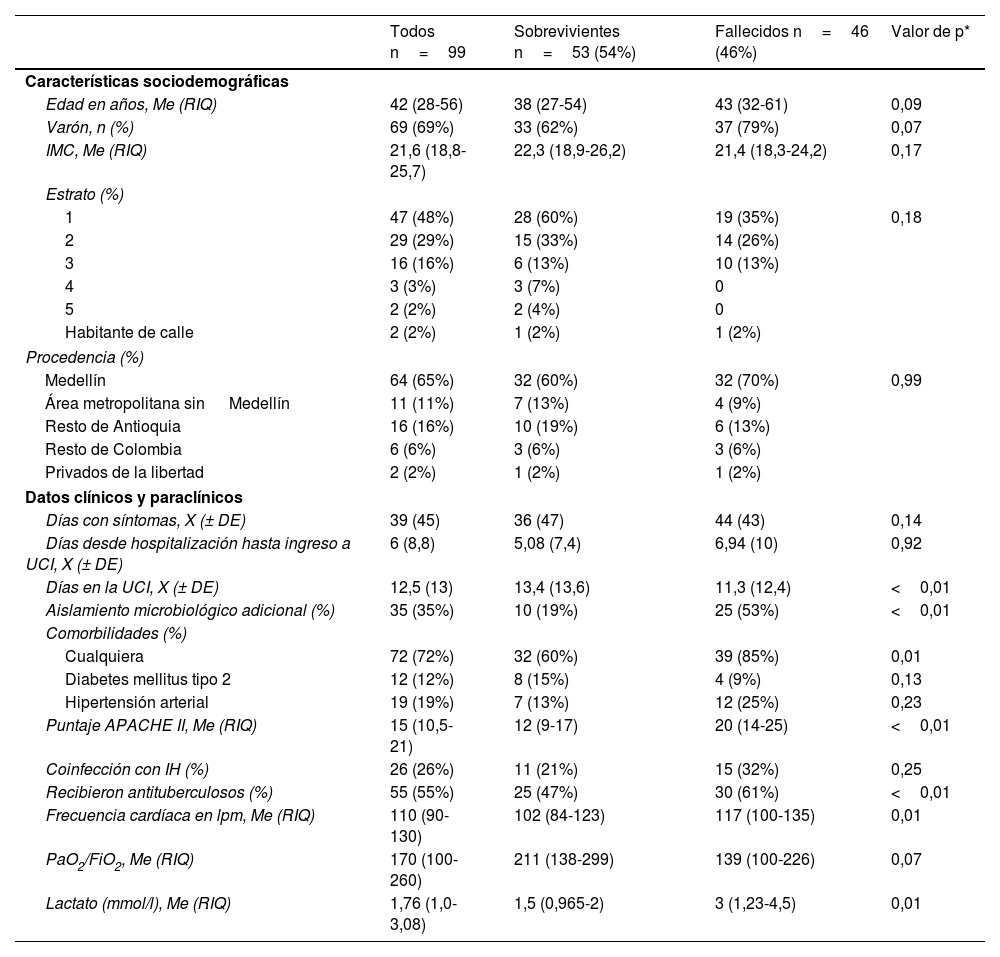
ResultadosDe 1.663 pacientes con tuberculosis, el 15% requirió ingreso a cuidados intensivos. Se incluyeron 99 participantes, con una mortalidad del 47% a 30 días. Los fallecidos presentaron con mayor frecuencia comorbilidades (85 vs. 60%; p<0,01), choque séptico (91 vs. 28%; p<0,01), ventilación mecánica, diálisis, SDRA, mayor puntaje APACHE II, taquicardia y elevación del lactato. En el análisis bivariado, todas las variables excepto neumonía multilobar y PaO2/FiO2 se asociaron significativamente con la mortalidad. En el modelo multivariado, solo el choque séptico (OR: 18,92; IC 95%: 4,9-72,9), la presencia de comorbilidades (OR: 4,73; IC 95%: 1,26-17,7) y el puntaje APACHE II (OR: 1,14; IC 95%: 1,03-1,24) se mantuvieron como predictores independientes de muerte.
ConclusiónLa tuberculosis grave en los pacientes críticos se asocia con una alta mortalidad. Comorbilidades, puntuaciones elevadas de APACHE II y choque séptico fueron los principales predictores independientes. Un abordaje individualizado y el reconocimiento temprano de estos factores podrían mejorar los desenlaces clínicos.
Tuberculosis (TB) remains a major contributor to morbidity and mortality, particularly among critically ill patients. Identifying clinical predictors of mortality in the intensive care unit (ICU) may guide early interventions and improve outcomes. This study aimed to assess the association between multiple clinical variables and 30-day mortality in patients with severe TB admitted to the ICU.
Materials and MethodsThis was a single-center retrospective cohort study including adult patients with microbiologically confirmed severe TB admitted to the ICU between 2015 and 2022. Patients with COVID-19, unconfirmed TB diagnosis, or incomplete clinical records were excluded by the investigators. A total of 99 participants were included for analysis. Sociodemographic and clinical variables, ICU complications, and 30-day mortality were assessed using descriptive statistics, bivariate comparisons, and multivariable logistic regression. The study protocol was approved by the institutional ethics committee and conducted in accordance with the Declaration of Helsinki.
ResultsAmong 1,663 TB patients, 15% required ICU admission. Ninety-nine patients met the inclusion criteria, with a 30-day mortality rate of 47%. Compared to survivors, non-survivors had higher rates of comorbidities (85 vs. 60%; P<.01), septic shock (91 vs. 28%; P<.001), mechanical ventilation, renal replacement therapy, acute respiratory distress syndrome (ARDS), elevated APACHE II scores (median 20 vs. 12; P<.01), higher heart rate, and increased lactate levels. In bivariate analysis, all variables except multilobar pneumonia and PaO2/FiO2 ratio were significantly associated with mortality. In the multivariable model, only septic shock (adjusted OR: 18.92; 95% CI: 4.9-72.9), comorbidities (adjusted OR: 4.73; 95% CI: 1.26-17.7), and APACHE II score (adjusted OR: 1.14; 95% CI: 1.03-1.24) remained independent predictors of death.
ConclusionSevere TB in critically ill patients is associated with high 30-day mortality. Septic shock, the presence of comorbidities, and elevated APACHE II scores were identified as independent risk factors. Early recognition and individualized management of these factors may improve clinical outcomes in this high-risk population.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí